Services on Demand
Journal
Article
Indicators
Related links
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.77 suppl.1 Ciudad de México Jan./Mar. 2007
7. Insuficiencia cardíaca derecha
7. Right heart failure
Edgar Gildardo Bautista Bautista, María Luisa Eugenia Martínez Guerra, Tomás Pulido Zamudio, Julio Sandoval Zárate, Luis Efrén Santos Martínez, Mario Seoane García de León
Definiciones
Cor pulmonale (CP). En 1963, la Organización Mundial de la Salud lo definió como: <<La hipertrofia del ventrículo derecho (VD) que resulta de enfermedades que afectan la estructura y/o la función del pulmón; excepto cuando estas alteraciones sean el resultado de enfermedades que afecten primariamente el lado izquierdo del corazón (enfermedad cardíaca congénita, valvular, etc.)>>.1–9 Recientemente,10 se ha propuesto la siguiente: <<La hipertrofia del VD, dilatación, o ambas, debido a hipertensión arterial pulmonar (HAP) como resultado de enfermedades que involucran al parénquima pulmonar, la circulación pulmonar o al control ventilatorio>>.
Como puede verse, los términos utilizados para referirse al CP favorecen confusión; lo mismo se le ha designado estructuralmente (hipertrofia, dilatación) o funcionalmente, como disfunción VD (DVD), falla del VD (FVD) o insuficiencia cardíaca congestivo venosa (ICCV) y hacen difícil comparar estudios al respecto. En estas Guías, el término CP se refiere a disfunción o falla del VD con manifestaciones clínicas de insuficiencia cardíaca derecha (bajo gasto cardíaco y/o congestión venosa sistémica) en un cardiópata cuyo problema causal principal se localiza en el parénquima o en la circulación pulmonar
Formas clínicas de presentación
Existen dos formas de CP: 6–10 1) El agudo, que se refiere a la dilatación y falla del VD por un incremento súbito de la presión pulmonar, habitualmente durante un evento de tromboembolia pulmonar (TEP) masiva, y 2) el crónico, que ocurre en el contexto de HAP crónicamente establecida que lleva a la hipertrofia y eventual dilatación y falla del VD y es complicación de diversas condiciones clínicas.
Cor pulmonale agudo (CPA)
Ocurre principalmente en el contexto de la tromboembolia pulmonar masiva (TEPM) aguda, en donde la obstrucción súbita de una gran parte del lecho vascular pulmonar (mayor al 50%) es la responsable.11
Otras formas de insuficiencia respiratoria aguda pueden condicionar HP (SIRPA, ascenso a la altitud en sujetos predispuestos, crisis asmática) que por regla general es moderada, transitoria y por ello de poca influencia para remodelar al VD.
Reconocimiento clínico del problema
La sospecha de TEPM debe contemplarse siempre que existan anormalidades graves e inexplicables en los parámetros hemodinámicos y de oxigenación.11,13,24
Algunas manifestaciones merecen gran atención, ya que su presencia sugiere no sólo una oclusión masiva sino que pueden ofrecer información para un abordaje de manejo fisiopatológicamente orientado.11,13,24 Tal es el caso del síncope (bajo gasto cardíaco), de disnea y taquipnea súbitas de gran magnitud (oclusión vascular mayor) y de dolor torácico compatible con angina más que pleurítico. Con unaoclusión vascular mayor el enfermo está aprensivo,con pulso rápido, débil y filiforme (bajo gasto), posiblemente cianótico e hipotenso (hipoxemia y bajo gasto). Puede haber palidez, hipotermia de extremidades y diaforesis fría (manifestaciones de descarga adrenérgica asociada); es posible que esta descarga adrenérgica esté manteniendo la presión arterialsistémica. El hallazgo de signos como 2º ruidopulmonar (2P) incrementado, impulso paraesternaly soplo de insuficiencia tricuspídea traducen HAP, lo mismo que el ritmo de galope traduce cor agudo. Un grado importantede ingurgitación yugular traduce aumento importante en las presiones de llenado de cavidades derechas. Estos hallazgos, junto conla sintomatología descrita, refuerzan la sospechaque el enfermo tiene un evento embólicomayor y hay que actuar con prontitud 11,20 (Tablas I y II).
Tratamiento del Cor pulmonale agudo
INC 1. Oxígeno
INC 1 La hipoxemia debe ser corregida Siempre que se documente la hipoxemia y se conozca o no que el evento precipitante es una TEPM, debe administrarse oxígeno con el método y la fracción inspirada necesarios.11,18,20,40,43 Si se requiere, el enfermo debe ser intubado y asistido con ventilación mecánica, sin olvidar los cambios hemodinámicos que pueden ocurrir, como disminución del retorno venoso.
INC 1. Anticoagulación
Debe ser inmediata ya que uno de los objetivos inmediatos del tratamiento es interrumpir el proceso trombótico. Basta la sospecha clínica fundada, aun sin contar con el resultado de los estudios diagnósticos confirmatorios, para iniciar de inmediato el tratamiento con heparina, si no existe contraindicación formal para su uso. La administración de un bolo de heparina de 5,000 a 10,000 U, seguido de una infusión continua de 1,000 U por hora cumple, en la mayoría de los casos, con el objetivo de interrumpir el proceso trombótico y puede hacer la diferencia.11,18,20,40 El uso de las heparinas de bajo peso molecular (HBPM) en el contexto de la TEPM no está aún claramente definido.11,18,20,40
Tratándose de TEPM, sin embargo, lo anterior no resuelve el problema. La hipotensión sistémica o el estado de choque secundarios a la falla ventricular (FVD) aguda, como resultado de la obstrucción masiva de la circulación pulmonar, obligan a un manejo diferente. El enfermo debe ser trasladado a la UCI o al área en donde se pueda hacer una vigilancia cercana con monitoreo hemodinámica que ayuden a resolver la emergencia.11,14,20,26
Soporte hemodinámico es una medida fundamental para disminuir la mortalidad inmediata en TEPM y ésta se debe al resultado de las alteraciones hemodinámicas. En sujetos previamente sin daño cardiopulmonar, más que por el grado de HAP establecido, el deterioro hemodinámico en TEPM está condicionado por FVD aguda.
Así, el apoyo al VD incluye tres lineamientos fundamentales que deben ser aplicados de manera inmediata y simultánea y orientados por un monitoreo preciso.11,12,14,18,20,40
• Disminuir la poscarga del VD
• Manejo óptimo del volumen intravascular
• Mantener, a toda costa, la presión arterial sistémica (PAS)
Disminuir la poscarga ventricular derecha
INC1
Existen intervenciones universalmente aceptadas como son: 1) la corrección de la hipoxemia, para revertir la potencial vasoconstricción hipóxica existente y, 2) el uso de trombolíticos. Si los trombolíticos tienen un lugar en el tratamiento de la TEP, es precisamente en el enfermo con TEPM, en donde su indicación resulta inobjetable. 11,18,20,40,44,46
INC 2
Por razones diversas, no todos los pacientes son candidatos para TF o, a pesar de su uso, puede no resolverse la condición clínica. Por ello existen otras estrategias orientadas a disminuir la poscarga ventricular derecha; tal es el caso de la embolectomía quirúrgica o no quirúrgica. Aunque existen estudios clínicos en favor de estos procedimientos,20,47,48 la evidencia es incompleta y, en todo caso, su aplicación está limitada a pocos centros.
INC 3 Manejo óptimo del volumen intravascular
La administración de volumen al aumentar la presión circulatoria media sistémica (PCMS) puede ser un recurso inicial útil en un enfermo con TEP y compromiso hemodinámico (hipotensión). Sin embargo, dicha intervención debe ser cautelosa, ya que, ante un VD desfalleciente y dilatado, los márgenes de seguridad son muy estrechos y se corre fácilmente el riesgo de sobrecarga de volumen, hecho que agravaría la dilatación y con ello, sin duda, la FVD.11,20,51
Es difícil establecer una regla en cuanto a la cantidad y la velocidad del volumen a infundir; cada caso debe ser individualizado y la respuesta monitorizada, idealmente con presión venosa central (PVC), la presión capilar pulmonar (PCP) y el GC, y cautelosamente analizada.11,20,62 La PVC debe ser mantenida entre 15–20 cm H2O. Recordar que con un VI restringido por un VD dilatado, fenómeno de interdependencia, la PCP puede estar elevada aun cuando la precarga de dicho ventrículo esté disminuida. En este sentido, puede tenerse una idea de la PCP transmural si restamos de la PCP obtenida la PVC (PCP–PVC).
Mantener a toda costa la presión arterial sistémica
INC 2 Norepinefrina – Arterenol
Existe también suficiente evidencia experimental que señala la importancia de la presión arterial sistémica (PAS) para mantener la función ventricular, en el contexto del incremento agudo de la poscarga del VD.11,128,64,69 Desde 1956 se reconoció que la supervivencia de un enfermo con TEPM dependía del mantenimiento de la presión aórtica para proveer un flujo coronario adecuado al VD bajo estrés.70
La norepinefrina (NE) parece ser la droga vasopresora de elección para quienes tienen TEPM y estado de choque.11,120,70,71 La NE es un estimulante de receptores alfa–adrenérgicos que induce vasoconstricción sistémica (arterial y venosa). La vasoconstricción arterial aumenta la PAS y favorece el gradiente de perfusión coronaria y con ello mejora la isquemia del VD,71,72 la venoconstricción aumenta la PCMS y favorece el gradiente para retorno venoso. Además, la NE aumenta la contractilidad cardíaca por efecto sobre los receptores beta–1;71,73 La función del VD mejora como resultado del aumento de la presión de perfusión coronaria, del aumento en el retorno venoso y así como del aumento de la contractilidad cardíaca.71,73 En modelos de TEPM, la NE mejora la PAS, el GC, la RVP y la presión de VD comparada con grupos controles.51,71 En el modelo de choque producido por la embolización de coágulos autólogos, 61 sobrevivieron todos los animales tratados con norepinefrina, mientras que fallecieron los controles y los tratados con volumen e isoproterenol. La norepinefrina ha producido el beneficio hemodinámico más consistente51,61,71,73 de todas las drogas vasoactivas empleadas en TEPM experimental. La epinefrina ha mostrado también ser efectiva en el tratamiento de choque, complicando una TEPM.71 Su estudio, aún en el ámbito experimental, no ha sido muy extenso.
También se ha estudiado, aunque menos, la dopamina que posee efectos beta a dosis moderadas y alfa a dosis altas; parece ofrecer un beneficio similar al de norepinefrina .11,51 La taquicardia que produce es un factor limitante.
INC 4 Isoproterenol
El uso del isoproterenol en TEPM tiene efectos predominantemente beta–adrenérgicos que resultan en un aumento de la contractilidad cardíaca y pueden promover vasodilatación. Con este fármaco, sin embargo, se ha descrito la aparición de falla ventricular como resultado de un incremento desmedido en la demanda miocárdica de oxígeno y de la reducción de la PAS, que resulta en hipoperfusión coronaria y cerebro–vascular.51
En conjunto, los datos experimentales señalan que el uso del isoproterenol no es apropiado ni recomendado para el tratamiento de TEPM con inestabilidad hemodinámica severa.
INC 2 Dobutamina
La dobutamina vasodilata la circulación sistémica (efecto beta–2) y la pulmonar, aumenta la contractilidad cardíaca y disminuye las presiones de llenado en cavidades derechas, la dobutamina aumenta el GC y disminuye la RVP sin modificar significativamente la PAS.11 Comparado con norepinefrina, la dobutamina ha sido asociada con un aumento en el consumo de oxígeno por el miocardio y un aumento en el flujo sanguíneo coronario. Tiene además el riesgo de disminuir la oxigenación al alterar la relación V/Q.11 Como corolario podemos señalar que la dobutamina estaría indicada en pacientes con TEP normotensos o con mínima hipotensión moderada, mientras que la NE debe ser utilizada en pacientes con choque.11,74,75 La combinación de dobutamina y de norepinefrina puede estar indicada en algunas situaciones y merece mayor evaluación.
INC 4 Amrinona
La amrinona actúa a través de dos mecanismos capaces de afectar la circulación pulmonar, la inhibición de fosfodiesterasa III y la alteración del transporte de calcio, lo que resulta en efectos inotrópicos negativos y predominante y casi exclusivamente vasodilatadoras.11,75 Nuevamente, al igual que con el isoproterenol, la administración de un solo agente sin propiedades vasoconstrictoras, a un enfermo con profunda hipotensión causada por una TEPM es potencialmente peligrosa.
INC 3 La colocación de un filtro en vena cava inferior (VCI) interrupción de VCI en TEPM
Si fracasa el tratamiento anticoagulante para prevenir recurrencia, al igual que la existencia de complicaciones o contraindicaciones para la anticoagulación, son indicaciones inobjetables para la colocación de un filtro que interrumpa la circulación de trombos a través de la vena cava inferior hacia los pulmones.11,18–20,40
Aunque no existen estudios prospectivos, la sola existencia de TEPM pudiera ser indicación para la interrupción de VCI; en estas condiciones la situación hemodinámica es tan precaria que una nueva embolia, por pequeña que sea, pudiera terminar con una vida. La colocación profiláctica de un filtro se ha recomendado también en los operados de embolectomía pulmonar. De la misma manera, la colocación profiláctica del filtro puede estar indicada en pacientes con factores de riesgo persistentes o con extensa trombosis venosa profunda residual.11,18,20,40
Los filtros disponibles actualmente cumplen satisfactoriamente con el requisito de no interferir de manera importante con el retorno venoso (Tabla III).
El problema de la TEP submasiva
Identificar al enfermo con TEP masiva y colapso circulatorio y confirmarlo no es difícil si se toman en cuenta los factores de riesgo, las manifestaciones clínicas descritas y se cuenta con el ecocardiograma y algún otro método confirmatorio de trombosis venosa profunda (TVP) y de TEP. Este enfermo está en FVD y de no establecer el tratamiento adecuado casi seguramente fallecerá en las siguientes horas. Un mayor problema es identificar y manejar al enfermo con TEP submasiva; definida ésta, como aquella situación en donde existe aún estabilidad hemo dinámica pero hay datos de DVD.11,19,20 Conforme al planteamiento fisiopatológico de FVD, el enfermo con TEP submasiva tiene riesgo elevado de evolucionar de DVD a FVD en las siguientes horas o días, con lo que incrementa su riesgo de muerte. El problema es cómo identificar DVD de manera cierta y temprana. El método más estudiado es el ecocardiograma. Los resultados de varios estudios, entre ellos el ICOPER,35 han señalado que los enfermos con DVD ecocardiográfica, a pesar de una aparente estabilidad hemodinámica inicial, pueden desarrollar choque cardiogénico y están en riesgo de muerte durante su estancia hospitalaria.11,18,35.36,40,76,77 Los signos ecocardiográficos de DVD son la dilatación de cavidades derechas y de la arteria pulmonar, la hipocinesia de VD, el aumento de la relación de diámetro VD/VI, el movimiento septal paradójico con desplazamiento del tabique interventricular a la izquierda y la insuficiencia tricuspídea. Un signo ecocardiográfico temprano de DVD es la disfunción regional en la pared libre del VD.78 Recientemente se ha señalado la potencial utilidad del uso de marcadores de daño miocárdico como las troponinas T o I,79,80 o de marcadores humorales de DVD como el péptido cerebral natriurético (BNP).81
La estratificación de esta situación de DVD sería bajo el supuesto de que este tipo de enfermos de riesgo alto pueden beneficiarse con la trombólisis, o la embolectomía, además de la anticoagulación intensiva. Mientras la indicación de terapia trombolítica para el grupo con TEPM e inestabilidad hemodinámica (choque o hipotensión) es un hecho aceptado11,18,20,40,45 la indicación de esta opción terapéutica para el grupo con DVD y estabilidad hemodinámica es motivo de controversia.40,45,46
Cor pulmonale crónico (CPC)
El CPC es resultado de: 1) Enfermedades que cursan con hipoxemia y 2) Enfermedades que cursan con obstrucción arterial vascular pulmonar.9,10,82,83
Dentro de las enfermedades que cursan con hipoxemia el ejemplo típico es la enfermedad pulmonar obstructiva crónica (EPOC), mientras que en aquellas que cursan con obstrucción vascular el ejemplo típico es la hipertensión arterial pulmonar primaria o idiomática (HAPI)1,9,10,83 (Tabla IV y V).

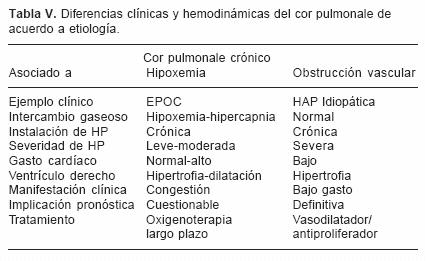
Tratamiento del CPC en las enfermedades asociadas a hipoxemia
INC 1 Oxigenoterapia
La corrección del CPC del EPOC con la oxigenoterapia continua y la mejoría de la ventilación con broncodilatadores señala la importancia de la necesidad de corrección del trastorno del intercambio gaseoso en la génesis de esta forma de CP.
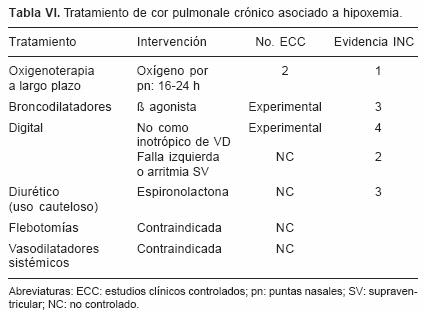
INC 3 Broncodilatadores
Si bien a algunos broncodilatadores beta–adrenérgicos (terbutalina) se les ha atribuido efecto benéfico sobre la función ventricular, su efecto final es difícil de separar del ocasionado por la mejoría en la ventilación.9,10,83
INC 2 Digital
La digital puede estar indicada si existe evidencia de falla izquierda o alteraciones del ritmo cardíaco susceptibles a este fármaco.
INC 4 Digital
Como inotrópico positivo para ventrículo derecho.
INC 4 Vasodilatadores
El uso de vasodilatadores tradicionales no está justificado.
INC 3 Diuréticos
Uso cauteloso, espironolactona.
Tratamiento del CP en las condiciones asociadas a obstrucción vascular (Tabla VII)

El tratamiento de la falla ventricular derecha asociada a condiciones que conllevan sobrecarga de presión por obstrucción o daño vascular predominante difiere y depende del contexto clínico.
HAP idiopática y formas asociadas
Las intervenciones farmacológicas disponibles intentan aliviar la obstrucción vascular pulmonar y disminuir la poscarga del VD aumentada y con ello atenuar la FVD como un objetivo secundario. En la HAP se ha demostrado tanto la deficiencia de mediadores vasodilatadores y antiproliferadores y un aumento de mediadores que son vasoconstrictores y proliferadores. El concepto terapéutico ha evolucionado del anterior empleo de sólo vasodilatadores, al uso actual de vasodilatadores que al mismo tiempo son antiproliferadores. 87
Prostanoides
El llegar a saber que los enfermos con HAP idiomática tenían déficit de prostaciclina,87,99,100 condujo al intento de administrar este compuesto en forma crónica.
INC 1 Epoprostenol
El primer fármaco empleado fue el epoprostenol, un análogo de prostaciclina de administración IV continua. Los resultados fueron muy buenos y fue el primero en ser aprobado por la Food and Drugs Administration (FDA) para el tratamiento de la HAP al demostrar un impacto no sólo en la mejoría de la calidad de vida sino también en la supervivencia de los enfermos.101,102
INC 2 Treporstenil
Para uso subcutáneo (treprostinil).
INC 2 Iloprost inhalado
INC3 Iloprost intravenoso
INC 3 beroprost oral.105
Tanto el treprostinil como el iloprost han mostrado beneficio en la capacidad para realizar esfuerzo físico de los enfermos (caminata de los 6 minutos) en estudios controlados. Los prostanoides ejercen su acción vasodilatadora y antiproliferadora a través de su segundo mensajero, el AMP–c.
Antagonistas de receptores de endotelina
El conocimiento de que los enfermos de HAP tenían exceso de endotelina,87,106 llevó al empleo de sus antagonistas.
INC1 Bosentan
El bosentan, es un antagonista dual de los receptores (A y B) en la célula de músculo liso valvular (CMLV).87,98,107 Administrado por vía oral, es el más empleado en el tratamiento sobre la base de los buenos resultados obtenidos en los estudios controlados.87,107
INC 2 sitaxsentan, INC 3 ambrisentan98,108
Ambos bloqueadores selectivos de los receptores tipo A de la endotelina; estudios muy avanzados sobre el bloqueo selectivo de receptores A pretende en breve dejar libre al receptor tipo B, bajo el concepto de que la activación de este receptor al nivel de la célula endotelial promueve vasodilatación. Los resultados preliminares son satisfactorios y son cuando menos similares a los obtenidos con el bloqueo dual.98,108
Inhibidores de fosfodiesterasa. Los enfermos con HAP tienen déficit relativo de óxido nítrico (ON).87,109 Más aún el ON ejerce su efecto vasodilatador a través de su segundo mensajero, el GMP–c y éste es constantemente degradado por la fosfodiesterasa–5 (FD–5).87
INC 1 Sildenafil
El sildenafil es un inhibidor efectivo de la FD–5.87,98,110 En el estudio más reciente,110 tres diferentes dosis de sildenafil fueron utilizadas (20, 40, y 80 mg tres veces al día) y los resultados, al menos en la caminata de los 6 minutos, mostraron que las 3 dosis ofrecen mejoría en la capacidad física, igualmente efectivas y superiores al placebo.
Otras intervenciones
INC 3 Trasplante pulmonar
El trasplante pulmonar revierte también de manera efectiva la FVD en la HAP.98,111,112 Además de la relativa dificultad técnica y la evidente poca disponibilidad de órganos, la utilidad del trasplante pulmonar está limitada por el rechazo crónico del órgano injertado que eventual y frecuentemente se presenta en la forma de bronquiolitis obliterante y que disminuye de manera considerable la supervivencia a largo plazo.
INC 2 Septostomía interatrial
La septostomía interatrial es un procedimiento específicamente enfocado al alivio inmediato de la falla ventricular de estos enfermos.92,98 El beneficio funcional y de sobrevida92,112–114 puede ser resultado de la demostrada descompresión del VD y de la mejoría de la función ventricular derecha.92,115 Mejora el gasto cardíaco sistémico al aumentar el cortocircuito venoarterial y con ello, la precarga del VI (Tabla VII).
Otros fármacos empleados en el manejo de la FVD en HAP
INC 3 Anticoagulación
Todos los enfermos con HAP idiopática o asociada deben recibir anticoagulantes en ausencia de contraindicación formal. Su indicación está basada en la evidencia histológica de la disminución de la trombosis in situ que juega un papel en la fisiopatología y en el mantenimiento de la HAP. La evidencia de su potencial utilidad clínica, sin embargo, está basada en análisis retrospectivos. La meta con estos fármacos es mantenerun INR alrededor de 1.5 a 2.0.98
INC 3 Diuréticos
En fases avanzadas de FVD con síntomas de congestión venosa severa, el empleo de diuréticos se justifica en la reducción de los fenómenos de interdependencia ventricular que incrementan las presiones de llenado del VI y favorecen la hipertensión venocapilar (HVCP) (disnea y ortopnea) y por su capacidad para mejorar la tensión parietal del VD en cardiópatas con insuficiencia tricuspídea concomitante y sobrecarga de volumen. En casos de congestión venosa grave pueden requerirse dosis altas de diuréticos de asa de Henle solos o en combinación. Siempre debe vigilarse muy de cerca la posibilidad de depleción de volumen (caída de precarga) y de alteraciones del equilibrio electrolíticos que serían deletéreos.68,92,98
INC 3 Digoxina
La digoxina puede producir un incremento levedel gasto cardíaco en reposo (aproximadamentedel 10%) con una reducción significativa denorepinefrina circulante, lo que puede atenuarla activación neurohumoral y retrasar la progresiónde la falla ventricular derecha. Así, más quecomo inotrópico positivo, su indicación es comomodulador del equilibrio simpático–vagal. Lasarritmias supraventriculares que tienen un profundoefecto deletéreo en la función cardíacaglobal de estos cardiópatas, constituyen tambiénuna indicación precisa para el uso del medicamento.68,92,98 Cabe señalar que para ninguna delas intervenciones farmacológicas antes señaladasexiste evidencia sustentada en estudios clínicoscontrolados.
El tratamiento en otras formas de CP por sobrecarga de presión
Los enfermos con HAP y síndrome de Eisenmenger tienen ya de suyo el beneficio del cortocircuito de derecha a izquierda y no es frecuente que desarrollen FVD a pesar de la sobrecarga de presión. 97 En nuestra opinión, el beneficio de los nuevos fármacos para el tratamiento de la HAP en esta población no está aún completamente demostrado. Otras intervenciones terapéuticas frecuentemente usadas en este grupo de enfermos como el uso de anticoagulantes o de flebotomías son controvertidas y no deben emplearse de manera indiscriminada.123 Del mismo modo, el beneficio potencial de la oxigenoterapia a largo plazo en esta condición ha sido cuestionado recientemente por nuestro grupo.124,125
El tratamiento de la HP y de la FVD secundaria a tromboembolia pulmonar crónica es completamente diferente.126,127 El tratamiento de esta entidad es obligadamente quirúrgico a través de la endarterectomía pulmonar, un procedimiento que es aún de riesgo elevado para mortalidad perioperatoria pero que en los sobrevivientes revierte la FVD y mejora de manera impresionante la calidad de vida y la supervivencia de los pacientes.126,127 Aunque no existen estudios prospectivos y controlados, la endarterectomía tiene evidencia I.
Referencias
1. Barnard D, Alpert JS: Right ventricular function in health and disease. Curr Probl Cardiol 1987; 12: 417–449. [ Links ]
2. Bristow M, Zizman L, Lances BD, Abraham WT, Badesch DB, Groves B, et al: The pressure–overloaded right ventricle in pulmonary hypertension. Chest 1998; 114: 101S–106S. [ Links ]
3. Grignola JC, Ginés F: Mecánica del ventrículo derecho. Actas de Fisiología 2000; 6:131–163. [ Links ]
4. Lee F: Hemodynamics of the right ventricle in normal and disease states. Clin Chest Med 1992;10: 59–67. [ Links ]
5. Redington AN: Right ventricular function. Cardiol Clin 2002; 20: 23–30. [ Links ]
6. McNeil K, Dunning J, Morrell NW: The pulmonary physician in critical care: The pulmonary circulation and right ventricular failure in the ITU. Thorax 2003; 58: 157–162. [ Links ]
7. Oldershaw P, Bishop A: The difficulties of assessing right ventricular function. Brit Heart J 1995; 74: 99–106. [ Links ]
8. Sandoval J: Imagen del ventrículo derecho. Una pregunta por contestar. En: Roldán FJ Y Vallejo EP: (ed) Actualidades en imagen cardiovascular. PLAC Cardio–4. Intersistemas SA de CV, México, 2004: 144–149. [ Links ]
9. MacNee W: Pathophysiology of cor pulmonale in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1994; 150: 833–852 (Part I); 1158–1168 (Part II). [ Links ]
10. Budev MM, Arroliga AC, Wiedemann HP, Matthay RA: Cor pulmonale: An overview. Seminars in Resp and Crit Care Med 2003; 24: 233–243. [ Links ]
11. Wood KE: Major pulmonary embolism: Review of a pathophysiologic approach to the golden hour of hemodynamically significant pulmonary embolism. Chest 2002; 121: 877–905. [ Links ]
12. Vlahakes GJ, Turley K, Hoffman JIE: The pathophysiology of failure in acute right ventricular hypertension: Hemodynamic and biochemical correlations. Circulation 1981; 63: 87–95. [ Links ]
13. Dalen JE: What have we learned since virchow? Natural history, pathophysiology and diagnosis. Chest 2002: 122 (4). [ Links ]
14. McNeil K, Dunning J, Morrell NW: The pulmonary physician in critical care: 13: The pulmonary circulation and right ventricular failure in the ITU. Thorax 2003; 58: 157–162. [ Links ]
15. Miller GA, Sutton GC: Acute massive pulmonary embolism: Clinical and haemodynamic findings in 23 patients studied by cardiac catheterization and pulmonary angiography. Br Heart J 1970; 32: 518–523. [ Links ]
16. Kasper W, Konstantinides S, Geibel A, Olschewski M, Heinrich F, Grosser KD, et al: Management strategies and determinants of outcome in acute major pulmonary embolism:results of a multicenter registry. J Am Coll Cardiol 1997; 30: 1165–1171. [ Links ]
17. Stein PD, Henty JW: Clinical characteristics of patients with acute pulmonary embolism stratified according to their presenting syndromes. Chest 1997; 112: 974–979. [ Links ]
18. Jerjes–Sánchez C, Elizalde GJ, Sandoval J, Gutiérrez–Fajardo P, Seoane GLM, Ramírez–Rivera A, et al: Guías de la Sociedad Mexicana de Cardiología para la estratificación, diagnóstico y tratamiento de la tromboembolia pulmonar aguda. Arch Cardiol Mex 2004; Arch Cardiol Mex 2004; 74 (Supl): S548–S555. [ Links ]
19. Task Force on Pulmonary Embolism, European Society Cardiology. Guidelines on diagnosis and management of acute pulmonary embolism. Eur Heart J 2000; 1301: 1336. [ Links ]
20. Sandoval J, Pulido T, Bautista E, et al: Cuidados intensivos en el paciente con tromboembolia pulmonar aguda. En: González A y Conde JM: (Ed) Tópicos selectos en medicina crítica 2006. Editorial Prado SA de CV, México DF. ISBN 9968–6899–89–8. [ Links ]
21. Rocha AT, Tapson VF: Venous thromboembolism in intensive care patients. Clin Chest Med 2003; 24:102–122. [ Links ]
22. Goldhaber SZ: Pulmonary embolism. Lancet 2004; 363: 1295–305. [ Links ]
23. Perrier A, Bounameaux H: Acute pulmonary embolism; diagnosis. In: Peacock A, Rubin LJ:(Eds) Pulmonary Circulation 2nd edition. Arnold. London 2004: 414–428. [ Links ]
24. Thames MD, Alpert JS, Dalen JE: Syncope in patients with pulmonary embolism. JAMA 1977; 238: 2509–11. [ Links ]
25. Elliott CG, Goldhaber SZ, Visani L, et al: Chest radiographs in acute pulmonary embolism. Results from the International Cooperative Pulmonary Embolism Registry. Chest 2000; 118: 33–8. [ Links ]
26. Rattes M, Calvin JE: Acute Pulmonary Hypertension. In: Pinsky M, Dhainaut JF: Pathophysiologic foundations of critical care. 1993: 312–336. [ Links ]
27. Anderson JT, Owings JT, Goodnight JE: Bedside non–invasive detection of acute pulmonary embolism in critically ill surgical patients. Arch Surg 1999; 134: 869–874. [ Links ]
28. McGinn S, White PD: Acute cor pulmonale resulting from pulmonary embolism. JAMA 1935; 104: 1473–1480. [ Links ]
29. Stein PD, Terrin ML, Hales CA: Clinical, laboratory, roentgenographic and electrocardiographic findings in patients with acute pulmonary embolism and no pre–existing cardiac or pulmonary disease. Chest 1991; 100: 598–603. [ Links ]
30. Kucher N, Walpoth N, Wustmann K, Noveanu M, Gertsch M: QR in V1 – an ECC sign associated with right ventricular strain and adverse clinical outcome in pulmonary embolism. Eur Heart J 2003; 24: 113–119. [ Links ]
31. Sreeram N, Cheriex EC, Smeets JLR, et al: Value of the 12–lead electrocardiogram at hospital admission in the diagnosis of pulmonary embolism. Am J Cardiol 1994; 73: 298–303. [ Links ]
32. A collaborative study by the PIOPED Investigators. Value of the ventilation–perfusion scan in acute pulmonary embolism: Results of the Prospective Investigation of Pulmonary Embolism Diagnosis (PIOPED). JAMA 1990; 263: 2753–2759. [ Links ]
33. Schoepf UJ, Goldhaber SZ, Costello P: Spiral computed tomography for acute pulmonary embolism. Circulation 2004; 109: 2160–2167. [ Links ]
34. Goldhaber SZ: Echocardiography in the management of pulmonary embolism. Ann Intern Med 2002; 136: 691–700. [ Links ]
35. Grifoni S, Olivitto I, Cecchini P, et al: Short–term clinical outcome of patients with acute pulmonary embolism, normal pressure, and echocardiographic right ventricular dysfunction. Circulation 2000; 101: 2817–2822. [ Links ]
36. Goldhaber SZ, Visani L, De Rosa M: Acute pulmonary embolism: Clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999; 353: 1386–1389. [ Links ]
37. Kucher N, Printzen G, Doernhoefer T, Windecker S, Meier B, Hess OM: Low pro–brain natriuretic peptide levels predict benign clinical outcome in acute pulmonary embolism. Circulation 2003; 107: 1576–1578. [ Links ]
38. Kucher N, Printzen G, Golghaber SZ: Prognostic role of brain natriuretic peptide in acute pulmonary embolism. Circulation 2003; 107:2545–2547. [ Links ]
39. Prusky P, Bochowicz A, Torbicki A, Szulc M, Kurzyna M, Fijalkowska A, et al: Cardiac troponin t monitoring identifies high–risk group of normotensive patients with acute pulmonary embolism. Chest 2003; 123: 1947–1957. [ Links ]
40. Goldhaber SZ: Acute pulmonary embolism; treatment. In: Peacock A, Rubin LJ: (Eds) Pulmonary circulation. 2nd Edition. Arnold. London 2004: 429–437. [ Links ]
41. Caldini P: Pulmonary hemodynamics and arterial oxygen saturation in pulmonary embolism. J Appl Physiol 1965; 20: 184–190. [ Links ]
42. Murray IV, Mikhail M, Banner MJ, et al: Pulmonary embolism: high frequency jet ventilation offers advantages over conventional mechanical ventilation. Crit Care Med 1987; 15: 114–117. [ Links ]
43. Badr MS, Grossman JE: Positional changes in gas exchange after unilateral pulmonary embolism. Chest 1990; 98: 1514–1516. [ Links ]
44. Sánchez–Díaz CJ, Ramírez–Rivera A, De Lourdes GM, et al: Streptokinase and heparin versus heparin alone in massive pulmonary embolism: A randomized controlled trial. J Thromb Thrombolysis 1995; 2: 227–229. [ Links ]
45. Wan S, et al: Thrombolysis compared with heparin for the initial treatment of pulmonary embolism. A meta–analysis of the randomized controlled trials. Circulation 2004; 110: 744–750. [ Links ]
46. Konstantinides S, et al: Heparin plus alteplase compared with heparin alone in patients with submassive pulmonary embolism. N Engl J Med 2002; 347: 1143–1150. [ Links ]
47. De Gregorio MA, Gimeno MJ, Alfonso R: Fragmentación mecánica y fibrinólisis intrapulmonar en el tratamiento del tromboembolismo pulmonar masivo con repercusión hemodinámica. Arch Bronconeumol 2001; 37: 16–22. [ Links ]
48. Uflacker R: Treat the Clot! Endovascular Today, 2004; 23: 32–39. [ Links ]
49. Capellier G, Jacques T, Balvay P, et al: Inhaled nitric oxide in patients with pulmonary embolism. Intensive Care Med 1997; 23: 1089–1092. [ Links ]
50. Webb SA, Stott S, Van Heerden PV: The use of inhaled aerosolized prostacyclin (IAP) in the treatment of pulmonary hypertension secondary to pulmonary embolism. Intensive Care Med 1996; 22: 353–355. [ Links ]
51. Prewitt RM: Hemodynamic management in pulmonary embolism and acute hypoxemic respiratory failure. Crit Care Med 1990; 18 (Suppl); S61–S69. [ Links ]
52. Starling E: Some points in the pathology of heart disease. Lancet 1897; 1: 652–655. [ Links ]
53. Starr I: Role of the <<static blood pressure>> in abnormal increments of venous pressure, especially in heart failure. II Clinical and experimental studies. Am J Med Sci 1940; 199:40–55. [ Links ]
54. Guyton AC: Determination of cardiac output by equating venous return curves with cardiac response curves. Physiol Rev 1955; 35: 123–129. [ Links ]
55. Guyton AC, Lindsey AW, Abernathy B, et al: Venous return at various right atrial pressures and the normal venous return curve. Am J Physiol 1957; 189: 609–615. [ Links ]
56. Guyton AC, Jones C, Coleman T: Circulatory physiology. Cardiac output and its regulation. Philadelphia, WB Saunders Company, 1973. [ Links ]
57. Goldberg HS, Rabson J: Control of cardiac output by systemic vessels: circulatory adjustments of acute and chronic respiratory failure and the effects of therapeutic interventions. Am J Cardiol 1981; 47: 696–702. [ Links ]
58. Sylvester JT, Goldberg HS, Permutt S: The role of the vasculature in the regulation of cardiac output. Clin Chest Med 1983; 4: 111–125. [ Links ]
59. Pinsky MR: Instantaneous venous return curves in an intact canine preparation. J Appl Physiol 1984; 56: 765–771. [ Links ]
60. Mathru M, Venus B, Smith RA, et al: Treatment of low cardiac output complicating acute pulmonary hypertension in normovolemic goats. Crit Care Med 1986; 14: 120–124. [ Links ]
61. Molloy WD, Lee KY, Girling L, et al: Treatment of shock in a canine model of pulmonary embolism. Am Rev Respir Dis 1984; 130: 870–974. [ Links ]
62. Magder SA, Georgiadis G, Tuck C: Respiratory variations in right atrial pressure predict response to fluid challenge. J Crit Care 1992; 7: 76–85. [ Links ]
63. Mercat A, Diehl JL, Meyer G, et al: Hemodynamic effects of fluid loading in acute massive pulmonary embolism. Crit Care Med 1999; 27:540–544. [ Links ]
64. Guyton AC, Lindsey AW, Gilluly JJ: The limits of right ventricular compensation following acute increase in pulmonary circulatory resistance. Circ Res 1954; 2: 326–332. [ Links ]
65. Vlahakes GJ, Turley K, Hoffman JIE: The pathophysiology of failure in acute right ventricular hypertension: hemodynamic and biochemical correlations. Circulation 1981; 63: 87–95. [ Links ]
66. Calvin JE JR: Acute right heart failure: Pathophysiology, recognition, and pharmacological management. J Cardiothorac Vasc Anesth 1991;4: 251–265. [ Links ]
67. Lualdi JC, Goldhaber AZ: Right ventricular dysfunction after acute pulmonary embolism: Pathophysiologic factors, detection, and therapeutic implications. Am Heart J 1995; 130: 1–8. [ Links ]
68. Bristow M, Zizman L, Lances BD, Abraham WT, Badesch DB, Groves B, et al: The pressure–overloaded right ventricle in pulmonary hypertension. Chest 1998; 114: 101S–106S. [ Links ]
69. Brooks H, Kirk ES, Vokonas PS, Urschel CW, Sonnenblick EH: Performance of the right ventricle under stress: Relation to right coronary flow. J Clin Invest 1971; 50: 2176–2183. [ Links ]
70. State D, Salisbury PR: The experimental production of pulmonary embolism syndrome and the effects of variations of systemic arterial pressure on its course. Surg Gynecol Obstet 1956;103: 202–208. [ Links ]
71. Hirsch LJ, Rooney MW, Wat SS, Kleinmann B, Mathru M: Norepinefrine and phenylephrine effects on right ventricular function in experiment alcanine pulmonary embolism. Chest 1991; 100: 796–801. [ Links ]
72. Mathru M, Dries DJ: Is levophed lethal? Chest 1989; 95: 1177–1178. [ Links ]
73. Angle MR, Molloy DW, Penner B, et al. The cardiopulmonary and renal hemodynamic effects of norepinephrine in canine pulmonary embolism. Chest 1989; 95: 1333–1337. [ Links ]
74. Jardin F, Genevray B, Brun–Ney D, et al: Dobutamine: a hemodynamic in PE Shock. Crit Care Med 1985; 13: 1009–1012. [ Links ]
75. Jean–Louis Vincent: Pharmacological management of the pulmonary circulation in critically ill patients. In: Peacock A, Rubin LJ: (Eds) Pulmonary circulation. 2nd Edition. Arnold. London 2004. Pág. 532–537. [ Links ]
76. Grifoni S, Olivitto I, Cecchini P, et al: Short–term clinical outcome of patients with acute pulmonary embolism, normal pressure, and echocardiographic right ventricular dysfunction. Circulation 2000; 101: 2817–2822. [ Links ]
77. Gutiérrez–Fajardo P, Jerjes–Sánchez DC: El papel del ecocardiograma en las urgencias cardiovasculares. En: Sánchez–Díaz CJ: Aspectos selectos en urgencias cardiovasculares 2001. 2ª Edición actualizada. México DF. Editorial Vesalio Difusión, 2001: 357–387. [ Links ]
78. McConnel MV, Solomon SD, Rayan ME: Regional right ventricular dysfunction detected by echocardiography in acute pulmonary embolism. Am J Cardiol 1996; 78: 469–473. [ Links ]
79. Konstantinides S, Geibel A, Olschewski M, et al: Importance of cardiac troponins I and T inrisk stratification of patients with acute pulmonary embolism. Circulation 2002; 106:1263–1268. [ Links ]
80. Prusky P, Bochowicz A, Torbicki A, Szulc M, Kurzyna M, Fijalkowska A, et al: Cardiactroponin t monitoring identifies high–risk group of normotensive patients with acute pulmonary embolism. Chest 2003; 123: 1947–1954. [ Links ]
81. Kucher N, Printzen G, Goldhaber SZ: Prognostic role of brain natriuretic peptide in acute pulmonary embolism. Circulation 2003; 107:2545–2547. [ Links ]
82. Santos LE: Fisiopatología de la falla ventricular derecha. Arch Cardiol Méx 2004; 74: S53–S357. [ Links ]
83. Weitzenblum E: Chronic cor pulmonale. Heart 2003; 89: 225–230. [ Links ]
84. Cargill RI, Kiely DG, Lipworth BJ: Hypoxemia and the renin–angiotensin system: New answers for old questions. Pulm Pharmacol 1994; 7: 279–284. [ Links ]
85. Morrell NW, Danilov SM, Saryyan KB, et al: Right ventricular angiotensin converting enzyme activity and expression is increased during hypoxic pulmonary hypertension. Cardiovasc Res 1997; 34: 393–403. [ Links ]
86. Tutar E, Kaya A A, Gülec S, Ertas F, Erol C, Özdemir Ö et al: Echocardiographic evaluation of left ventricular diastolic function in chronic corpulmonale. Am J Cardiol 1999; 83: 1414–1417. [ Links ]
87. Farber HW, Lloscalzo J: Pulmonary arterial hypertension. N Engl J Med 2004; 351: 1655–65. [ Links ]
88. Piene H: Pulmonary impedance and right ventricular function. Physiol Rev 1986; 66: 606–651. [ Links ]
89. Santos E, Aranda A, Pulido T, et al: Right ventricular remodeling in chronic pressure overload depends on the type of pulmonary hypertension. Am J Respir Crit Care Med 2003;167: A276. [ Links ]
90. Sandoval J, Bauerle O, Palomar A, et al: Survival in primary pulmonary hypertension: validation of a prognostic equation. Circulation 1994; 89: 1733–44. [ Links ]
91. D'Alonzo GB, Barst RJ, Ayres SM, et al: Survival in patients with primary pulmonary hypertension. Ann Intern Med 1991; 115: 343–49. [ Links ]
92. Sandoval J, Gaspar J: Atrial Septostomy. In: Peacock A, Rubin LJ: (Eds) Pulmonary Circulation. 2nd Edition. Arnold. London 2004: 319–333. [ Links ]
93. Gómez A, Bialostozky D, Zajarias A, Santos LE, Palomar A, Sandoval J: Right ventricular ischemia in patients with primary pulmonary hypertension. J Am Coll Cardiol 2001; 38: 1137–1142. [ Links ]
94. Abraham WT, Raynolds MV, Gottschall B: Importance of angiotensin converting enzymein pulmonary hypertension. Cardiology 1995; 86 (Suppl 1): 9–15. [ Links ]
95. Rosas M, Kuri J, Sandoval J, et al: Circadian regulation of heart rate variability in primary pulmonary hypertension: An Unappreciated risk Marker? JACC 1999: 33 (Suppl 120 A). [ Links ]
96. Beltrán ME, Díaz E, Santos E, et al: The role of tricuspid regurgitation in the pathophysiology of right ventricular failure from severe primary pulmonary hypertension. 3rd World Symposium on PAH, Venice, Italy, 2003 (abstract). [ Links ]
97. Hopkins WE: The remarkable right ventricle of patients with Eisenmenger syndrome. Coronary artery disease 2005; 16: 19–23. [ Links ]
98. Galie N, Seeger W, Naeije R, et al: Comparative analysis of clinical trials and evidence–based treatment algorithm in pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43: 81S–88S. [ Links ]
99. Christman BW, McPherson CD, Newman JH, et al: An imbalance between excretion of thromboxane and prostacyclin metabolites in pulmonary hypertension (see comments). N Eng J Med 1992; 327: 70–75. [ Links ]
100. Tuder RM, Cool CD, Geraci MW, et al: Prostacyclin synthase expression is decreased in lungs from patients with severe pulmonary hypertension. Am J Respir Crit Care Med 1999; 159: 1925–1932. [ Links ]
101. Barst RJ, Rubin LJ, Long W, et al: A comparison of continuous intravenous epoprostenol (prostacyclin) with conventional therapy for primary pulmonary hypertension. N Engl J Med 1996; 334: 296–301. [ Links ]
102. McLaughlin VV, Shillington A, Rich S: Survival in primary pulmonary hypertension. The impact of epoprostenol therapy. Circulation 2002; 106: 1477–1482. [ Links ]
103. Simonneau G, Barst RJ, Galié N, et al: Continuous subcutaneous infusion of Treprostinil, a prostacyclin analogue, in patients with pulmonary arterial hypertension. Am J Respir Crit Care Med 2002; 165: 800–804. [ Links ]
104. Olschewski H, Simonneau G, Galié N, et al: Inhaled iloprost for severe pulmonary hypertension. N Engl J Med 2002; 347: 322–329. [ Links ]
105. Galié N, Humbert M, Vachiery JL, et al: Effects of beraprost sodium, an oral prostacyclin analogue, in patients with pulmonary arterial hypertension: a randomized double–blind, placebo– controlled trial. J Am Coll Cardiol 2002; 39: 1496–1502. [ Links ]
106. Giaid A, Yanagisawa M, Langleben D, et al: Expression of endothelin–1 in the lungs of patients with pulmonary hypertension. N Engl J Med 1993; 328: 1732–9. [ Links ]
107. Rubin LJ, Badesch DB, Barst RJ, et al: Bosentan therapy for pulmonary arterial hypertension. N Engl J Med 2002; 346: 896–903. [ Links ]
108. Barst RJ, Langleben D, Frost A, et al: Sitaxsentan therapy for pulmonary arterial hypertension. Am J Respir Crit Care Med 2004; 169:441–447. [ Links ]
109. Giaid A, Saleh D: Reduced expression of endothelial nitric oxide synthase in the lungs of patients with pulmonary hypertension. N Engl J Med 1995; 333: 214–221. [ Links ]
110. Galie N, Ghofrani HA, Torbicki A, et al: Sildenafil citrate therapy for pulmonary arterial hypertension. N Engl J Med 2005; 353: 2148–57. [ Links ]
111. Trulock EP: Lung transplantation for primary pulmonary hypertension. Clin Chest Med 2001; 22: 583–94. [ Links ]
112. Klepetko W, Mayers E, Sandoval J, et al: Interventional and surgical modalities of treatment for pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43: 73S–80S. [ Links ]
113. Sandoval J, Gaspar J, Pulido T, et al: Graded balloon dilation atrial septostomy in severe primary pulmonary hypertension. A therapeutic alternative for patients non–responsive to vasodilator treatment. J Am Coll Cardiol 1998; 32: 297–304. [ Links ]
114. Sandoval J, Rothman A, Pulido T: Atrial septostomy for pulmonary hypertension. Clin Chest Med 2001; 22: 547–60. [ Links ]
115. Espínola–Zavaleta N, Vargas J, Tazar JI, et al: Echocardiographic evaluation of patients with primary pulmonary hypertension before and after atrial septostomy. Echocardiography 1999; 7: 625–634. [ Links ]
116. McGoon MD: The assessment of pulmonary hypertension. In: Rich S, McLauglin V: (Eds) Pulmonary hypertension. [ Links ] Clin Chest Med 2001;22: 493–508. [ Links ]
117. Sitbon O, Humbert M, Ioos V, et al: Who benefits from long–term calcium–channel blocker therapy in primary pulmonary hypertension (Abstract). Am J Respir Crit Care Med 2003; 167: A440. [ Links ]
118. Rubin LJ: Pulmonary arterial hypertension. Proc Am Thorac Soc 2006; 3: 111–5. [ Links ]
119. Ghofrani HA, Rose F, Schermuly RT, et al: Oral sildenafil as long–term adjunct therapy to inhaled Iloprost in severe pulmonary arterial hypertension. J Am Coll Cardiol 2003; 42: 153–64. [ Links ]
120. Humbert M, Barst RJ, Robbins IM, et al: Combination of bosentan with epoprostenol in pulmonary arterial hypertension: Breathe–2. Eur respir J 2004; 24: 353–359. [ Links ]
121. Petkov V, Mosgoeller W, Ziesche R, et al: Vasoactive intestinal peptide as a new drug for treatment of primary pulmonary hypertension. J Clin Invest 2003; 111: 1339–1346. [ Links ]
122. Ghofrani HA, Seeger W, Grimminger F, et al: Imatinib for the treatment of pulmonary arterial hypertension. N Engl J Med 2005; 353: 1412–3. [ Links ]
123. Sandoval J, Bautista BE, Pulido Z, Santos M, Martínez Guerra, Aguirre SJ: Síndrome de Eisenmenger en Cardiopatías congénitas del adulto. Dr. Fause Attié. 2003. Elsevier Science, España. [ Links ]
124. Sandoval J, Aguirre, et al: Nocturnal oxygen therapy in patients with the Eisenmenger's syndrome. Am J Respir Crit Care Med 2001; 164:1682–1687. [ Links ]
125. Bowyer JJ, Busst CM, Denison DM, et al: Effect of long–term oxygen treatment at home in children with pulmonary vascular disease. Br Heart J 1986; 55: 385–390. [ Links ]
126. Auger WR, Fedullo PF, Jamieson SW: Chronic thromboembolic pulmonary hypertension. In: Peacock A, Rubin LJ: (eds) Pulmonary Circulation 2nd Edition. Arnold. London 2004: 440–457. [ Links ]
127. Fedullo PF, Auger WR, Kerr KM, et al: Chronic thromboembolic pulmonary hypertension. N Engl J Med 2001; 345: 1465–72. [ Links ]














