Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.76 suppl.4 Ciudad de México Oct./Dec. 2006
Investigación Clínica
Exclusión del ventrículo venoso.
Evolución y retos.
A propósito de los primeros cien casos del procedimiento de Fontan en el Instituto Nacional de Cardiología "Ignacio Chávez"
Exclusion of venous ventricle.
Evolution and challenges
Juan Calderón–Colmenero,* Jorge L Cervantes S,** Samuel Ramírez Marroquín,*** Fause Attie****
* Subjefe del Servicio de Cardiología Pediátrica, INCICH.
** Médico adscrito Servicio de Cirugía de Cardiopatías Congénitas, INCICH.
*** Jefe del Servicio de Cirugía de Cardiopatías Congénitas, INCICH.
**** Director General, INCICH.
Correspondencia:
Juan Calderón Colmenero.
Instituto Nacional de Cardiología Ignacio Chávez
(INCICH Juan Badiano Num.1.Col. Sección XVI,
Tlalpan, 14080 México D.F.)
E–mail: juanecalderon@yahoo.com.mx
Resumen
La historia y evolución de la cirugía cardiovascular y la cardiología pediátrica resulta fascinante. Durante muchos siglos se mantuvieron conceptos erróneos como los galénicos en cuanto a la anatomía y la fisiología del sistema cardiovascular. A finales del siglo XIX y durante el XX se dieron una serie de avances que condujeron a un entendimiento más apropiado de la anatomofisiología del sistema cardiovascular, lo que incluso llevó a la idea audaz de poder prescindir de la mitad del corazón. Este concepto de prescindibilidad del ventrículo derecho ha perdurado, enseñándonos lecciones que nos hacen comprender mejor el comportamiento hemodinámico de muchas malformaciones congénitas cardíacas. La derivación cavopulmonar total o procedimiento de Fontan y sus modificaciones, son una muestra del resultado de esta serie de conocimientos adquiridos. En el presente artículo hacemos una breve reseña histórica de la evolución de este concepto de prescindibilidad del ventrículo derecho, con un breve análisis de las lecciones aprendidas gracias a los conocimientos aportados por muchos otros autores y por nuestra propia experiencia sin dejar de reconocer que aún es largo el camino que tenemos por recorrer para lograr un pleno entendimiento del comportamiento de la vasculatura pulmonar y de la fisiología univentricular.
Palabras clave: Fontan. Conexiones cavopulmonares. Cardiopatías congénitas.
Summary
The history and evolution of the cardiovascular surgery and pediatric cardiology is fascinating. For centuries many erroneous galenic concepts about cardiovascular anatomy and physiology were sustained by physicians. At the end of the XIX century and during the XX century, the progress in science allowed for a more appropriate understanding of the anatomophysiology of the cardiovascular system, promoting the concept of dispensability of half of the heart. This concept of right ventricle dispensability has subsisted, teaching us lessons that have led to a bear understanding of the hemodinamic behavior of many cardiac congenital malformations. The cavopulmonar total bypass or Fontan procedure with its modifications is an example of this knowledge. In the present article we make a brief historical review of the concept of right ventricle dispensability, and a brief analysis of the learned lessons provided by many authors and our own experience, without forgetting that we still have a long way to fully understand the pulmonary vasculature behavior and the univentricular physiology.
Key words: Fontan. Cavopulmonary conection. Congenital heart–disease.
Introducción
Los pacientes portadores de cardiopatías con anatomía y/o fisiología univentricular representan un reto para todo el grupo multidisciplinario encargado de su atención. Antes del advenimiento de la derivación cavopulmonar total popularizada por el Dr. Francis Fontan y las modificaciones subsecuentes al procedimiento, el pronóstico de estos pacientes era muy pobre con una mala calidad de vida. El procedimiento de Fontan vino a ofrecer una alternativa viable para estos pacientes, mejorando tanto la supervivencia como la calidad de vida en aquellos enfermos que cumplen con ciertos requisitos anatómicos y hemodinámicos de los cuales es responsabilidad del grupo multidisciplinario su determinación para garantizar, en lo que sea posible, ese resultado óptimo que se espera del procedimiento. Recientemente, en el Instituto Nacional de Cardiología "Ignacio Chávez" hemos alcanzado la centena de este procedimiento y reportado nuestra experiencia inicial de los primeros 81 casos. Ha sido un camino largo el recorrido, en ocasiones con dolorosas enseñanzas que nos han servido para iniciar un largo proceso de aprendizaje de estas patologías que representan un verdadero reto clínico–quirúrgico. A propósito de esta experiencia inicial, presentamos una breve reseña histórica de la evolución del abordaje de estos pacientes y hacemos un planteamiento de las lecciones aprendidas tratando de encarar los retos que aún nos impondrán nuestros pacientes y con los cuales nos comprometemos con el fin de brindarles lo mejor de esta experiencia.
Exclusión del ventrículo venoso. Evolución y retos
Hubieron de pasar nueve siglos para que se cuestionaran los conceptos Galénicos referentes a la estructura y el funcionamiento del corazón. Todavía en el siglo XVI, se enseñaba que la sangre se producía en el hígado, de donde fluía hacia la aurícula derecha y luego pasaba al lado izquierdo del corazón por un orificio. La función del corazón no era de bombear la sangre sino calentarla. En ese siglo diversos estudiosos empezaron a cuestionar dichos conceptos, destacamos a Miguel Servet (1511–1553) quien sostuvo que la principal vía de comunicación existente entre los dos sistemas de Galeno, el sanguíneo y el aéreo, no era la formada por los poros del tabique interventricular, sino por otros orificios existentes en el pulmón, que dejaban que parte de la sangre contenida en la vena arteriosa (arteria pulmonar) se filtrara hacia las ahora llamadas venas pulmonares.1,2
En el año de 1628 es publicada la obra Exercitatio anatómica de motu coráis et sanguinis in animalibus (Ejercicios anatómicos sobre el movimiento del corazón y de la sangre en los animales) de William Harvey, donde se demuestra la circulación de la sangre. Es de resaltar la disculpa que realiza en el prólogo, de sus hallazgos: "Hasta tal punto es nuevo e inaudito lo que voy ha decir que no sólo temo el mal que me pueda venir de la envidia de algunos, sino hasta granjearme la hostilidad de todos los hombres".3 La tesis fundamental que sostenía Harvey fue que la sangre es transportada de las venas a las arterias por el corazón, al llegar la sangre al ventrículo izquierdo, éste la envía a la aorta y a las arterias que laten bajo su impulso y luego la distribuyen por los diferentes miembros y partes. Desde allí regresa por las venas hacia la aurícula derecha, y de ahí reinicia el ciclo, pues su movimiento es continuo, incesante y simultáneo en cada uno de los segmentos del sistema vascular. Es conocido que el Dr. Harvey no llegó a saber cómo se llevaba a cabo el paso entre arterias y venas, conocimiento que se logró cuatro años después de su muerte, cuando Marcello Malpighi estableció, en el pulmón y en las paredes de la vejiga de la rana, que dicho paso se realiza a través de vasos capilares.3
El papel del ventrículo derecho en la dinámica circulatoria a su vez no fue cuestionado sino hasta el siglo XX. Estudios experimentales realizados por Isaac Star y colaboradores en 1943, demostraron que la destrucción del ventrículo derecho en perros, ya sea por ligadura o cauterización del sistema coronario, no producía hipertensión venosa sistémica.4 Bakos lo explicaba aduciendo que el ventrículo izquierdo trasmitía su energía a través de bandas musculares que se extendían a la pared libre del ventrículo derecho y que le permitían una función pasiva de bomba.5 En 1948 se publica el trabajo de Rodbar y Wagner quienes demostraron la posibilidad de excluir, desde un punto de vista circulatorio, al ventrículo derecho mediante la anastomosis de la orejuela derecha con la arteria pulmonar que ligaron de manera proximal.6
En 1950 tres cirujanos italianos Carlon, Mondini y de Marchi reportaron la primera aplicación experimental de la conexión cavopulmonar. Ellos anastomosaron la vena ácigos a la rama derecha de la arteria pulmonar y ligaron la vena cava superior en su unión con el atrio derecho logrando supervivencias prolongadas en animales.7
En 1954 Glenn y Patino en Yale presentaron su primer reporte de una derivación cavopulmonar experimental y en 1956 publicaron una serie de 59 perros operados con éxito con esta técnica.8 Aunque este procedimiento se popularizó en todo el mundo como derivación o procedimiento de Glenn, otros autores en otros países (Robicsek9 en Budapest, Galankin10 y Meshalkin11 en Rusia, Shumacker12 en Estados Unidos y Car Ion en Italia6) desarrollaron procedimientos semejantes basados en los mismos principios. De hecho la primera aplicación clínica del procedimiento se debe a Shumacker en 1954, ya que Glenn lo aplicó en forma clínica hasta 1958.13 Lamentablemente, Shumacker realiza el procedimiento en dos niños, uno con diagnóstico de tronco común y otro con transposición de grandes arterias que aunque sobrevivieron 8 y 15 horas al postoperatorio, fallecieron por hipertensión pulmonar. Sin embargo, sirvió para demostrar que, al menos por unas horas, el corazón era capaz de funcionar "sin el lado derecho del corazón".
Simultáneamente, Warden, de Wall y Vareo, en 1954, llevaron a cabo el cierre quirúrgico de la válvula tricúspide con el propósito de contar con un modelo experimental que simulara una atresia tricuspídea y la complementaron con una anastomosis atriopulmonar, considerando que el atrio derecho suplía, parcialmente, la función de bomba del ventrículo derecho.12
Haller en 1966 reportó sus trabajos experimentales consistentes en realizar anastomosis cavopulmonar sin ligar la porción proximal de la arteria pulmonar y es en 1972 cuando Azzolina, Eufrate y Pensa reportan los primeros resultados de esta técnica donde se mantiene la continuidad del árbol pulmonar y se logra un flujo similar en ambas ramas de la arteria pulmonar. De ahí el origen del nombre derivación cavopulmonar bidireccional. Esta cirugía tiene como ventajas, con respecto a la fístula sistémico–pulmonar, evitar la distorsión de los vasos pulmonares, disminuir el riesgo de desarrollar hipertensión pulmonar y de sobrecargar al ventrículo sistémico.14,15 Además, evita la hipotensión diastólica como ocurre en fístula sistémico–pulmonar y no altera la perfusión coronaria.
La derivación cavopulmonar bidireccional se ha utilizado como un paso quirúrgico importante para alcanzar la circulación tipo Fontan, sobre todo en pacientes que tienen factores de riesgo. Esta cirugía se realiza en pacientes entre los 6 y 12 meses pero se puede realizar, con una adecuada selección, en niños más pequeños.16
En 1968 los Doctores Fontan y Baudet reportaron a tres pacientes con atresia tricuspídea sometidos a una nueva técnica quirúrgica donde se pretendía que el atrio derecho asumiera la función de bomba. La operación consistía en la realización de sección de la rama derecha de la arteria pulmonar, ligadura del tronco de la arteria pulmonar, cierre de la comunicación interauricular, anastomosis de la orejuela derecha con el cabo proximal de la rama derecha de la arteria pulmonar con colocación de un homoinjerto valvulado y de una válvula en la entrada de la cava inferior a la aurícula17 (Fig. 1).
En 1971 Kreutzer y colaboradores, en Argentina, realizaron por primera vez un bypass del ventrículo derecho teniendo como fundamento fisiológico, el que la circulación pulmonar se llevaba a cabo siempre y cuando existiera un gradiente adecuado entre el atrio derecho e izquierdo. La cirugía consistía en la anastomosis entre la orejuela derecha y la arteria pulmonar, ya sea mediante la colocación de un homoinjerto o desinsertando la arteria pulmonar y uniéndola a la orejuela derecha. La complicación que se presentó fue la compresión esternal de la anastomosis atriopulmonar, situación resuelta posteriormente mediante la realización de anastomosis atriopulmonar posterior amplia, pasando el tronco de la arteria pulmonar por detrás y hacia la derecha de la aorta.18,19
En Suecia en 1975, el Dr. Bjork describió un procedimiento quirúrgico consistente en realizar anastomosis entre la aurícula derecha y el ventrículo derecho rudimentario en atresia tricuspídea, con el fin de aprovechar, en alguna medida, la función de bomba ventricular.20 Yacoub en 1976 extiende estos conceptos a otro tipo de cardiopatías como la doble entrada a ventrículo único, pero preserva el fundamente fisiológico en el cual el atrio asume la función contráctil ventricular, colocando dos válvulas tanto a la entrada como a la salida de la aurícula.21
Los resultados iniciales de la derivación cavopulmonar total trajeron consigo una alta mortalidad y morbilidad relacionada en mucho con las características poco óptimas de muchos de los pacientes. Por esta razón, Choussat, Fontan y colaboradores en 1977, establecen los criterios para la selección de candidatos para la cirugía de Fontan. Se consideraron 10 criterios: Un mínimo de edad de 4 años; ritmo sinusal; drenaje normal de venas cavas; volumen normal del atrio derecho; presión media de la arteria pulmonar menor de 16 mm Hg; resistencia pulmonar menor de 41U•W; relación de diámetros pulmonar y aórtico mayor de 0.75; función ventricular normal (fracción de eyección mayor de 60%); sin insuficiencia mitral y sin secuelas secundarias a los procedimientos paliativos previos.22 Teóricamente, el apego estricto a estos criterios haría que tanto la mortalidad como la morbilidad del procedimiento fueran menores. Con el paso del tiempo, se ha visto que algunos de estos requisitos no son estrictamente indispensables o pueden ser manejados con otras alternativas (como por ejemplo la insuficiencia mitral que puede tratarse con plastia o sustitución protésica) y otros que siguen siendo inamovibles (como las resistencias vasculares pulmonares, por ejemplo).
En relación a la cirugía de Fontan original, se observó una elevada tasa de obstrucción de la conexión atriopulmonar, 40% de los pacientes a los 15 años, así como con las variantes propuestas por Kreutzer y Bjork presentaban dilatación severa del atrio derecho con compresión progresiva de las venas pulmonares derechas, tromboembolia pulmonar, alta incidencia de arritmias supraventriculares así como enteropatía perdedora de proteínas. Por estas alteraciones la eficacia de este tipo de cirugía fue cuestionada, motivo por el cual se buscaron nuevas alternativas quirúrgicas.19,23,24
En 1989, de Leval y colaboradores consideraron que las diferentes variantes de la cirugía de Fontan–Kreutzer tenían como inconveniente que el atrio derecho no ejercía una función de bomba, las pulsaciones en un circuito valvado generaban turbulencia y disminuían el flujo efectivo con la consecuente pérdida de energía a nivel de las cámaras no pulsátiles. Con base a lo anterior propusieron la denominada derivación cavopulmonar total consistente en la unión término–lateral de la vena cava superior con la rama derecha de la arteria pulmonar y la derivación del flujo de la vena cava inferior a través de un túnel lateral utilizando la pared posterior del atrio derecho y la conexión del extremo proximal a la rama por su borde inferior. Las ventajas de esta cirugía son: facilidad técnica, el que se logra mantener presiones bajas tanto en el atrio derecho como en el seno coronario, menor riesgo de desarrollo de trombos y de arritmias. Esta cirugía se propuso para pacientes con cardiopatías asociadas a anomalías del retorno venoso sistémico y pulmonar como ocurre en los isomeris–mos y donde la posibilidad de realizar alguna variante de la cirugía de Fontan–Kreutzer no era posible. En la actualidad se considera como una alternativa quirúrgica a seguir en pacientes en quienes se ha practicado como primer tiempo quirúrgico una derivación cavopulmonar bidirectional. En pacientes con una gran dilatación del atrio derecho complicado con arritmias supraventriculares refractarias o trombos en dicho atrio, se ha propuesto la conversión de las variantes tradicionales del Fontan a la derivación cavopulmonar total.25,26
El "Fontan fenestrado" fue propuesto por el Dr. Aldo Castañeda en 1987 como una alternativa para candidatos de alto riesgo, con el fin de reducir la morbilidad, tiempo de drenajes pleurales y de hospitalización, así como la mortalidad. Los factores de riesgo que se consideran para utilizar esta alternativa son la presencia de insuficiencia de la válvula atrioventricular, compromiso de la función cardíaca, llámese presión diastólica final del ventrículo sistémico elevada o fracción de eyección baja, resistencia vascular pulmonar elevada, distorsión de las ramas pulmonares, así como niños menores de 2 años. El tamaño de la fenestración se establece de acuerdo a la superficie corporal pero en promedio se utilizan en diámetros que van de 3 a 6 mm, aunque se desconoce el tamaño "ideal" de la fenestración27,28 (Fig. 2).

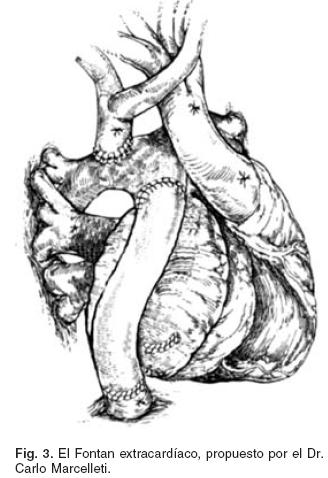
El Dr. Carlo Marcelleti en 1990 publica una nueva técnica quirúrgica con énfasis en la prevención de arritmias supraventriculares, las cuales seguían siendo una complicación importante a pesar de procedimientos quirúrgicos como la derivación cavopulmonar total con túnel lateral. La técnica quirúrgica está encaminada en llevar a cabo una anastomosis cavopulmonar utilizando un conducto protésico para derivar el retorno de la vena cava inferior hacia el piso de la rama derecha de la arteria pulmonar y el flujo de la vena cava superior derivarlo al techo de esa misma rama, con el fin mantener a las aurículas como un sistema de baja presión y evitar colocar suturas auriculares que son sustrato para el desarrollo de arritmias supraventriculares. Esta cirugía se ha considerado como la idónea en la actualidad, ya que ha demostrado tener una mejor hemodinamia con respecto a otras propuestas quirúrgicas, y en consecuencia un menor riesgo de trombosis y de arritmias29,30 (Fig. 3).
La mortalidad en los años setenta con las diversas variantes de Fontan oscilaba entre 20% y 25%. En la década de los 80 con una mejor selección de los pacientes y modificaciones en la técnica quirúrgica el riesgo de muerte descendió a un 10 a 15%. En los años noventa diversas estrategias como la realización de una derivación cavopulmonar bidireccional como técnica paliativa previa o variantes como la derivación cavopulmonar total con túnel lateral o con tubo extracardíaco así como la fenestración han permitido que la mortalidad se encuentre en rangos que van de 4 a 9%.31–33 En nuestra serie34 aunque sin presentar un valor estadísticamente significativo, sí se observó una menor mortalidad en aquellos pacientes portadores de un procedimiento de derivación cavopulmonar bidireccional previo a completar el Fontan, lo que está muy en relación con evitar una descompresión brusca del ventrículo único.
En esta experiencia inicial nuestra,34 no se encontró diferencias en las variables analizadas: edad, presión media de arteria pulmonar, resistencias pulmonares, presión diastólica final del ventrículo izquierdo, fracción de eyección del ventrículo sistémico, tiempo de circulación extracorpórea entre los pacientes sobrevivientes y fallecidos sometidos a cirugía de Fontan–Kreutzer, pero se observó 2.8 veces más de riesgo de morir en los pacientes en quienes no se realizó fenestración. La presión en atrio izquierdo > 10 mm Hg mostró ser una variable postoperatoria estadísticamente significativa en cuanto a riesgo de mortalidad, fuera en forma aislada como asociada a elevación de la presión media de la arteria pulmonar >20 mm Hg.
En muchas ocasiones a pesar de parámetros adecuados para ser llevados a una cirugía univentricular, los pacientes tienen una mala respuesta con elevación de la presión pulmonar y disfunción del ventrículo sistémico. Se ha reportado la asistencia ventricular para permitir su paulatina adaptación y en caso necesario entrar en lista de trasplante cardíaco o proceder al desmantelamiento, ya sea dejando la derivación cavopulmonar bidireccional o colocando una fístula sistémico–pulmonar. En ambos escenarios la mortalidad es alta, entre un 60 y 70%. Por lo señalado es necesario encontrar otros factores que puedan incidir y nos permitan predecir el comportamiento de los pacientes, por lo que se requiere conocer aún más la fisiología del corazón univentricular, haciendo hincapié en la función diastólica y cuya alteración puede estar dada por diversos grados de fibrosis, alteración que pudiera determinarse por estudios como la resonancia magnética nuclear.34–36
Los aspectos a considerar en cuanto a morbilidad en las variantes de cirugía de Fontan–Kreutzer, se pueden concentrar en tres rubros: arritmias, derrame pleural y trombosis. La incidencia de arritmias atriales reportada va de 10 hasta un 40%, y se incluye la disfunción del nodo sinusal, ocasionada por lesión directa del nodo sinusal o por alteración en el aporte sanguíneo del mismo, y las taquicardias supraventriculares (taquicardia de la unión, taquicardia atrial ectópica y el flutter auricular). Las arritmias se han atribuido a la presencia de abundante material de sutura, dilatación atrial y elevación de la presión intra–atrial. Gandhi y colaboradores,37 en un modelo animal, demostraron que la cercanía de la línea de sutura, en este tipo de cirugía, a la crista terminalis predispone a la aparición de flúter auricular.
Algunas técnicas de exclusión del ventrículo venoso se consideran menos arritmogénicas como la derivación cavopulmonar total con túnel lateral o con tubo extracardíaco, sin embargo se debe tener en cuenta que las arritmias pueden deberse también a alteraciones electrofisiológicas primarias o secundarias a falla cardíaca. Cohen y colaboradores38 reportaron un estudio prospectivo para evaluar la incidencia de disfunción del nodo sinusal en pacientes sometidos a derivación cavopulmonar bidireccional, derivación cavopulmonar total con túnel lateral o mediante tubo extracardíaco, siendo de 14% en el grupo de túnel lateral comparada a un 10% cuando se llevó a cabo derivación cavopulmonar bidireccional o colocación de tubo extracardíaco, diferencia sin significancia estadística. La necesidad de marcapaso temporal varía entre un 5 a 30% y un número significativo de ellos requieren de marcapaso definitivo.
El derrame pleural contribuye a la morbilidad y a una hospitalización prolongada en los pacientes sometidos a alguna variante de cirugía de Fontan–Kreutzer. Se piensa que la circulación extracorpórea resulta en un síndrome de fuga capilar que se manifiesta como: edema intersticial, derrames y depresión de la función miocárdica. Hay factores inflamatorios, hormonales (sistema renina–angiotensina, péptido auricular natriurético y vasopresina) e hidrostáticos involucrados en el origen de los derrames pleurales persistentes. Gupta y colaboradores reportan una duración promedio de tubos de drenaje de 10 días con una media de volumen de 14.7 mL/kg/ día encontrando como factores de riesgo significativos: SaO2 baja preoperatoria, tiempos prolongados de circulación extracorpórea, parálisis diafragmática y la presencia de infecciones postoperatorias.39 En nuestra experiencia los pacientes presentaron un volumen de drenaje muy elevado con un promedio de 522 mL/m2/ día y estancia promedio de los drenajes de 16 días. No encontramos algún factor que pudiera predecir el mayor volumen o la duración de los drenajes pleurales. Aunque se ha considerado que la altitud de la ciudad de México pueda ser un factor que explique esta diferencia, se requiere la realización de un protocolo de investigación en pacientes con atresia tricuspídea con variables demográficas y hemodinámicas similares y sometidos a una sola técnica quirúrgica y en los cuales la única diferencia fuera la altitud, para definir si esta variable incide en la morbilidad de los pacientes.
En nuestra serie34 si bien no se presentó ninguna diferencia estadísticamente significativa entre los grupos estudiados en relación a la duración y cantidad de los drenajes, sí es marcada la mayor incidencia de ambos factores en aquellos pacientes que se realizó la derivación cavopulmonar total sin fenestración, por lo que creemos que la presencia de fenestración puede tener un efecto positivo en estos pacientes que ayuda a disminuir tanto la morbilidad como la mortalidad, al igual que otros estudios lo señalan.
La incidencia de eventos tromboembólicos en pacientes con fisiología de Fontan no está bien establecida pero se ha reportado entre 20 y 30%. Diversos estudios sugieren que las alteraciones en los factores de coagulación encontrados en algunos pacientes sometidos a este tipo de cirugía son consecuencia de la naturaleza de esta circulación caracterizada por hipertensión venosa sistémica, flujo lento y estasis ya sea en el túnel lateral, tubo extracardíaco o en la circulación pulmonar, por arritmias supraventriculares, disfunción hepática, entre otros. Se han determinado niveles séricos de factores II, V, VII, X, proteína C y plasminógeno encontrándolos bajos y en otro grupo de pacientes se ha demostrado elevación del Factor VIII, situación que condicionó mayor riesgo de eventos tromboembólicos. La causa por el que se encuentre incrementando este factor se desconoce, se ha especulado que la hipertensión venosa sistémica y consecuentemente la elevación en la presión venosa a nivel hepático sea el factor que induzca a una mayor producción a nivel del endotelio hepático, apoyando esta hipótesis en pacientes con derivación cavopulmonar bidireccional, los cuales tienen una presión atrial y venosa hepáticas bajas, los niveles séricos del Factor VIII se han encontrando bajos. El poder establecer factores de riesgo de tromboembolismo en cada paciente, puede hacer posible que se puede sustentar de una manera objetiva la necesidad de usar ya sea antiagregantes plaquetarios, anticoagulación con cumarínicos o heparina de bajo peso molecular o bien una terapia combinada.40–42
La exclusión del ventrículo venoso ha revolucionado el tratamiento de los pacientes con cardiopatías complejas con fisiología univentricular. Los resultados a largo plazo demuestran superioridad en relación a la paliación tipo fístula sistémico–pulmonar. La calidad de vida de los pacientes es adecuada, lo que permite su integración a la vida productiva. Una de las complicaciones postoperatorias que presentan con mayor frecuencia como son las arritmias es probable que puedan ser disminuidas con la utilización de técnicas como la derivación cavopulmonar total con tubo extracardíaco, que tiene como virtudes: no producir sobrecarga de presión o de volumen de las cavidades cardíacas, no requerir de suturas en el atrio derecho, situación propicia para la generación de arritmias, lograr un flujo laminar manteniendo una distribución homogénea en ambos lechos pulmonares y finalmente, esta cirugía permite lograr una presión venosa sistémica inferior a 15 mm Hg y también un retorno venoso coronario con presiones bajas. Sin embargo es de esperar todavía una serie de problemas que más que por la variante quirúrgica estén dadas por el estado fisiológico de la circulación Fontan per se.43,44
Aún en la posibilidad de que en el futuro se cuenten con tubos con posibilidad de crecimiento o se dispongan de bombas que permitan reemplazar la función contráctil del ventrículo venoso, los conceptos aprendidos en la separación de ambas circulaciones, pulmonar y sistémica, difícilmente serán abandonados. Continúa habiendo una serie de interrogantes que una vez resueltas influirán en el manejo de pacientes con otro tipo de patología cardiovascular.
En base a nuestra experiencia, el paciente idóneo para someterlo a derivación cavopulmonar total es aquél portador de cardiopatía del tipo de la ausencia de conexión atrioventricular derecha, sin factores de riesgo, es decir con resistencias pulmonares bajas, buena función del ventrículo sistémico y con anatomía y tamaños adecuados de ramas pulmonares, con el antecedente de derivación cavopulmonar bidireccional como paliación previa, siendo la técnica ideal la derivación cavopulmonar total con tubo extracardíaco fenestrado.34
Con estas lecciones aprendidas hemos logrado disminuir nuestra morbilidad y estancias hospitalarias así como la mortalidad del procedimiento. Hasta el año 2002 nuestra mortalidad era del 17%34 y a partir del 2003, hemos operado más de 20 pacientes con una mortalidad menor al 5%. La exclusión del ventrículo venoso continúa representando un reto, tanto en la selección de pacientes como en su manejo. Para su realización, se requiere de una infraestructura hospitalaria sólida y de un equipo médico altamente especializado y comprometido. Para explicar la incidencia y severidad de los derrames pleurales en nuestra población, deben ser analizados diversos factores, incluido la altitud de la ciudad de México. En relación a los trastornos del ritmo y/o conducción, es posible que técnicas quirúrgicas como la de la derivación cavopulmonar total con colocación de tubo extracardíaco disminuya su incidencia. Los eventos tromboembólicos son un factor de riesgo a considerar en los pacientes sometidos a una variante de cirugía de Fontan–Kreutzer, es necesario poder determinar aquellos pacientes de mayor riesgo y la terapia más adecuada para su prevención.
La experiencia adquirida no sólo ha repercutido en un mejor manejo de pacientes con cardiopatías con fisiología univentricular, sino en el de pacientes con otro tipo de malformaciones cardíacas. Se requiere de investigaciones multidisciplinarias para profundizar en el conocimiento de la fisiopatología del corazón univentricular.
Referencias
1. Izquierdo JJ: Harvey en México, hacia el tercer centenario de su muerte. Gac Med Mex 1959; 89: 49–62. [ Links ]
2. Attie F: Pasado, Presente y Futuro de la Cardiología Pediátrica. Gac Med Mex, 2006; 3: 263–69. [ Links ]
3. Harvey W: Del movimiento del corazón y de la sangre en los animales. Ediciones Ciencia. Universidad Nacional Autónoma de México. 3a edición. México DF. 1994. [ Links ]
4. Starr I, Jeffers WA, Meade RH: The absence of conspicuous increments of venous pressure after severe damage to the right ventricle of the dog, with a discussion of the relation between clinical congestive heart failure an heart disease. Am Heart J 1943; 26–291–301. [ Links ]
5. Bakos AC: The question of the function of the right ventricular myocardium: An experimental study. Circulation 1950; 1: 724–732. [ Links ]
6. Rodbard S, Wagner D: By–passing the right ventricle. Proc Soc Exp Biol Med 1949; 71: 69–70. [ Links ]
7. Carlon CA, Mondini PG, De Marchi R: Su una nuova anastomosi vasaleper la terapia chirurgica di alcuni vizi cardiovasculari. (A new vascular anastomosis for surgical treatment of some cardiovascular anomalies). Ital Chir 1950; 6(11): 760–74. [ Links ]
8. Fenn JE, Glenn WWL, Guilfoil PH, Hume M, Patiño JF: Circulatory by–pass of the right heart II. Further observation on caval–pulmonary artery shunts. Surg Forum (1955). 1956; 6: 189–93. [ Links ]
9. Robicsek F, Temesvari A, Kadar RL: A new method for the treatment of congenital heart disease associated with impaired pulmonary circulation. Experimental study. Acta Med Scand 1956; 154(2): 151–61. [ Links ]
10. Darbinian TM, Galankin NK: Anastomosis between the superior vena cava and the right pulmonary artery: experiment. Eksp Khir 1956; 1(3): 54–57. [ Links ]
11. Meshalkin EN: Anastomosis of the superior vena cava with the pulmonary artery in patients with congenital heart disease with blood flow insufficiency in the lesser circulation. Eksp Khir 1956; 1(6): 3–12. [ Links ]
12. Warden HE, DeWall RA, Varco RL: Use of the right auricle as a pump for the pulmonary circuit. Surg Forum (1954). 1955; 5: 16–22. [ Links ]
13. Glenn WW: Circulatory bypass of the right side of the heart. IV. Shunt between the superior vena cava and distal right pulmonary artery: report of clinical application. N Engl J Med 1958; 259(3): 117–20. [ Links ]
14. Haller JA, Adkins JC, Wothington M, Raven horst J: Experimental studies of permanent bypass of the right heart. Surgery 1966; 59: 1128–1132. [ Links ]
15. Azzolina G, Eufrate AS, Pensa P: Experience in surgical management with a modified cavopulmonary anastomosis. Thorax 1972; 27: 11–15. [ Links ]
16. Calderón–Colmenero J, Ramírez S, Rijlaarsdam M, Buendía A, Zabal C, Zarco–Martinez E, et al: Use of the bidirectional cavopulmonary shunt in patients under one year. Cardiol Young 1995; 5: 28–30. [ Links ]
17. Fontan F, Baudet E: Surgical repair of tricuspid atresia. Thorax 1971; 26: 240–8. [ Links ]
18. Kreutzer G, Galindez E, Bono H, De Palma C, Laura JP: An operation for the correction of tricuspid atresia. J Thorac Cardiovasc Surg 1973; 66:613–21. [ Links ]
19. Kreutzer G, Vargas FJ, Schlinchter AJ, Laura JP, Suárez JC, Coronel AR, Kreutzer EA: Atrio pulmonary anastomosis. J Thorac Cardiovasc Surg 1982; 83: 427–36 [ Links ]
20. Bjork VO, Olin CL, Bjarke BB, Thoren CA: Right atrial–right ventricular anastomosis for correction of tricuspid atresia. J Thorac Cardiovasc Surg. 1979; 77: 452–58. [ Links ]
21. Yacoub M, Ahmed M, Radley–Smith R: Proceedings: use of right atrium to pulmonary artery valved conduit for correction of single ventricle of hypoplastic right heart syndrome. Br Heart J 1975; 37: 782. [ Links ]
22. Choussat A, Fontan F, Besse P, Vallot F, Chauve A, Bricand H: Selection criteria for Fontan's procedure. En RH Anderson, EA Shinebourn: Pediatric Cardiology 1977; Edinburgh: Churchil Livinsgtone, 1978. Cap. 64. [ Links ]
23. Calderón–Colmenero J, Ramírez Marroquin S, Lince R, Zabal C, Rijlaarsdam M, Buendía A, et al: Cirugía de Fontan en atresia tricuspídea. Experiencia del Instituto Nacional de Cardiología "Ignacio Chavez". Arch Inst Cardiol Méx 1997; 67: 210–16. [ Links ]
24. Ramírez Marroquín S, Calderón–Colmenero J, Lince R, Zabal C, Rijlaarsdam M, Buendía A, et al: Cirugía de Fontan en pacientes de alto riesgo. Arch Inst Cardiol Méx 1998; 68: 377–82. [ Links ]
25. De Leval MR, Kilner P, Gewillig M, Bull C: Total cavopulmonary connection: a logical alternative to atriopulmonary connection for complex Fontan operations. Experimental studies and early clinical experience. J Thorac Cardiovasc Surg. 1988; 96: 682–95. [ Links ]
26. Mavroudis C, Backer CL, Deal BJ, Johnsrude CL: Fontan conversion to cavopulmonary connection and arrhythmia circuit cryoblation. J Thorac Cardiovasc Surg. 1998; 14: 7–13. [ Links ]
27. Castañeda A: From Glenn to Fontan. A continuing evolution. Circulation 1992: 86(Suppl II): II 80–11 84. [ Links ]
28. Goff D, Bloom E, Gauvreau K, Mayer J, Lock J, Jenkins C: Clinical outcome of fenestrated Fontan patients after closure: the first 10 years. Circulation 2000; 102: 2094–9. [ Links ]
29. Marcelleti CF, Corno A, Giannico S, Marino B: Inferior vena cava–pulmonary artery extracardiac conduit: a new form of right heart bypass. J Thorac Cardiovasc Surg 1990; 100: 228–32. [ Links ]
30. Marcelleti CF, Hanley FL, Mavroudis C, McElhinney DB, Abella RF, Marianeschi SM, et al: Revision of previous Fontan connections to total extracardiac cavopulmonary anastomosis: A multicenter experience. J Thorac Cardiovasc Surg. 2000; 119:340–6. [ Links ]
31. Fontan F, Kirklin JW, Fernandez G, Costa F, Naftel DC Tritto F, Blackstone EH: Outcome after a "Perfect" Fontan operation. Circulation 1990; 81; 1520–36. [ Links ]
32. Franklin RCG, Spiegelhalter DJ, Sullivan ID, Anderson R, Thoele DG, Shinebourne EA, Deanfield JE: Tricuspid atresia presenting in Infancy. Survival and suitability for the Fontan operation. Circulation 1993; 87: 427–39. [ Links ]
33. Mott AR, Spray TL, Gaynor JW, Godinez RI, Nicolson SC, Steven JM, et al: Improved early results with cavopulmonary connections. Cardiol Young 2001; 11:3–11. [ Links ]
34. Calderón–Colmenero J, Ramírez S, Viesca R, Ramírez L, Casanova M, García–Montes JA, Patino E, et al: Cirugía de Fontan. Factores de riesgo a corto y mediano plazo. Arch Cardiol Méx 2005; 75: 425–34. [ Links ]
35. Booth K, Roth S, Thiagarajan R, Almodóvar M, Del Nido P, Laussen P: Extracorporeal membrane oxygenation support of the Fontan and bidirectional Glenn circulations. Ann Thorac Surg 2004; 77: 1341–8. [ Links ]
36. Border WL, Syed AU, Michelfelder EC, Khoury P, Uzark KC; Manning PB, Pearl JM: Impaired systemic ventricular relaxation affects postoperative short–term outcome in Fontan patients. J Thorac Cardiovasc Surg 2003; 126: 1760–64. [ Links ]
37. Gandhi SK, Bromberg BI, Rodelfeld MD, Schuessler RB, Boineau JP, Cox JL, et al: Lateral tunnel suture line variation reduces atrial flutter alter modified Fontan operation. Ann Thorac Surg 1996; 61:1299–309. [ Links ]
38. Cohen MI, Bridgews ND; Gaynor JW, Hoffman TM, Wernovsky G, Vetter VL, et al: Modifications to the cavopulmonary anastomosis do not eliminate early sinus node dysfunction. J Thorac Cardiovasc Surg. 2000; 120: 891–900. [ Links ]
39. Gupta A, Daggett C, Behera S, Ferraro M, Wells W, Starnes V: Risk factors for persistent pleural effusions after the extracardiac Fontan procedure. J Thorac Cardiovasc Surg 2004; 127:1664–9. [ Links ]
40. Rosenthal DN, Friedman AH, Kleinman CS, Kopf GS, Rosenfeld LE, Hellenbrand WE: Thromboembolic complications after Fontan operations. Circulation 1995; 92(Suppl II): 287–93. [ Links ]
41. Jahangiri M, Ross DB, Redington AN, Lincoln C, Shinebourne EA: Thromboembolism after the Fontan procedure and its modifications. Ann Thorac Surg. 1994; 58: 1409–14. [ Links ]
42. Odegard KC, McGown FX, Zurakowski D, Di Nardo JA, Castro RA, del Nido P, Laussen PC: Procoagulant and anticoagulant factor abnormalities following the Fontan procedure: increased factor VIII may predispose trombosis. J Thorac Cardiovasc Surg. 2003; 125: 1260–1267. [ Links ]
43. Lardo AC, Webber SA; Friehs I, del Nido PJ, Cape EG: Fluid dynamic comparison of intra–atrial and extracardiac total cavopulmonary connections. J Thorac Cardiovasc Surg 1999; 117: 688–96. [ Links ]
44. Azakie A, McCrindle BW, Van Arsdell G, Benson LN, Coles J, Hamilton R, et al: Extracardiac conduit versus lateral tunnel cavopulmonary connections at a single institution: Impact on outcomes. J Thorac Cardiovasc Surg. 2001; 122(6): 1219–28. [ Links ]














