Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de cardiología de México
On-line version ISSN 1665-1731Print version ISSN 1405-9940
Arch. Cardiol. Méx. vol.73 n.2 Ciudad de México Apr./Jun. 2003
Investigación básica
Participación del óxido nítrico y los metabolitos del ácido araquidónico vía citocromo P450 en la regulación de la presión arterial
Participation of nitric oxide and arachidonic acid metabolites via cytochrome-p450 in the regulation of arterial blood pressure
M Alicia Sánchez-Mendoza,* Sonia O Martínez-Ayala,** José A Hernández-Hernández,*** Leonor Zúñiga-Sosa,** Gustavo Pastelín-Hernández* y Bruno A Escalante-Acosta**
* Departamento de Farmacología. Instituto Nacional de Cardiología "Ignacio Chávez".
** Departamento de Biomedicina Molecular. Centro de Investigación y de Estudios Avanzados del IPN.
*** Sección Externa de Farmacología.
Correspondencia:
Dra. Ma. Alicia Sánchez-Mendoza.
Departamento de Farmacología.
Instituto Nacional de Cardiología "Ignacio Chávez".
(INCICH, Juan Badiano No. 1, Col. Sección XVI, Tlalpan 14080 México, D.F.).
Teléfono (55) 5573-2911 ext 1317.
E-mail: alicia_sanchez_incich@yahoo.com
Recibido: 8 de julio de 2002
Aceptado: 15 de octubre de 2002
Resumen
El óxido nítrico y los metabolitos del ácido araquidónico vía citocromo P450 contribuyen a la regulación de la presión arterial. La modificación en la síntesis de estos autacoides conduce a hipertensión arterial, sin embargo, se desconoce si existe interacción. Por ello, decidimos estudiar el papel modulador del óxido nítrico y los metabolitos del ácido araquidónico vía citocromo P450, y su interacción, sobre la presión arterial y el contenido renal de citocromo P450. Ratas Wistar macho fueron divididas por grupos: 1) Control, 2) L-NAME (100mg/kg/d v.o.), 3) L-NAME + SnCl2 (10mg/kg/d i.p.) y 4) L-NAME + dexametasona (1mg/kg/d s.c.). Se determinó la presión arterial sistólica y la concentración de nitritos por HPLC en orina y sangre. Los valores de presión arterial sistólica fueron: control 97 ± 7 mmHg, L-NAME 151 ± 4.6 mmHg, L-NAME + SnCl2 133 ± 3 mmHg, y L-NAME + dexametasona 152 ± 4.5 mmHg. Los nitritos en orina fueron: 1) 1.832 ± 0.32, 2) 1.031 ± 0.23, 3) 1.616 ± 0.33 y 4) 1.244 ± 0.33 μmol/mL y en sangre: 1) 0.293 ± 0.06, 2) 0.150 ± 0.05, 3) 0.373 ± 0.13 y 4) 0.373 ± 0.07 μmol/mL. El contenido renal de citocromo P450 fue abatido con el tratamiento de L-NAME + SnCl2, y una respuesta semejante se observó con L-NAME + dexametasona. Tanto óxido nítrico como los metabolitos del ácido araquidónico vía CYP participan en la regulación de la presión arterial. Además, el óxido nítrico contribuye regulando parcialmente el contenido renal del citocromo P450.
Palabras clave: CYP. Óxido nítrico. Presión arterial.
Abstract
Nitric oxide and cytochrome P450 arachidonic acid metabolites participate in blood pressure regulation. The synthesis of these autacoids leads to arterial hypertension. However, it is not known whether there is an interaction between them. Therefore, we studied the modulatory effect of nitric oxide and cytochrome P450-arachidonic acid metabolites, their interaction on blood pressure, and the renal content of cytochrome P450. Male Wistar rats were divided: 1) control, 2) L-NAME (100 mg/kg/d p.o.), 3) L-NAME + SnCl2 (10 mg/kg/d i.p.), and 4) L-NAME + dexamethasone (1 mg/kg/d s.c.). We measured blood pressure and collected urine and blood for nitric oxide measurement. NO2 was quantified by HPLC. Blood pressure was: control, 97 ± 7 mmHg; L-NAME, 151 ± 4.6 mmHg; L-NAME + SnCl2, 133 ± 3 mmHg, and L-NAME + dexamethasone 152 ± 4.5 mmHg. Urine nitrite concentration was: 1) 1.832 ± 0.32, 2) 1.031 ± 0.23, 3) 1.616 ± 0.33, and 4) 1.244 ± 0.33 μmol/mL, while the concentration in blood was: 1) 0.293 ± 0.06, 2) 0.150 ± 0.05, 3) 0.373 ± 0.13, and 4) 0.373 ± 0.07 μmol/ mL. L-NAME + SnCl2 decreased cytochrome P450 renal content, and L-NAME + dexamethasone showed a similar response. In conclusion, both, nitric oxide and CYP-arachidonic acid metabolites play a role in the regulation of blood pressure. Nitric oxide also partially regulates renal cytochrome P450 content.
(Arch Cardiol Mex 2003; 73:98-104).
Key words: CYP. Nitric oxide. Blood pressure.
Introducción
El metabolismo del ácido araquidónico (AA) vía ciclooxigenasa produce prostaglandins (PGs) y tromboxano, mientras que la vía de la lipooxigenasa produce leucotrienos; los efectos de estos metabolitos sobre la presión arterial han sido ampliamente documentados.1-3 La vía metabólica del citocromo P450 (CYP) produce metabolitos tales como ácidos: hidroxieicosatetraenoicos (HETEs), epoxieicosatrienoicos (EETs) y los dihidroepoxieicosatrienoicos (DHTs). Se ha demostrado que estos metabolitos tienen propiedades vasoactivas además de afectar en forma directa el transporte iónico renal.4 El 20-HETE ha sido descrito como un potente vasoconstrictor en los lechos vasculares renales,5,6 además ha sido implicado como modulador del proceso de autorregulación del flujo sanguíneo renal,7 sugiriendo su participación en el proceso de retroa-limentación tubuloglomerular.8
La liberación de óxido nítrico (NO) desencadena respuestas celulares que contribuyen a regular la función renal y la presión arterial. El principal mecanismo por el cual el NO regula la presión arterial es por estimulación de la guanilato ciclasa soluble (GCs), la cual, convierte al GTP en GMPc, promoviendo de este modo la relajación vascular.9 También se ha mostrado, que el NO puede regular la presión por otros mecanismos, uno de éstos es la inhibición que puede ejercer sobre el CYP. Wink et al. han reportado que el NO inhibe a las familias 1A y 2B1 del CYP.10
Adicionalmente, Alonso-Galicia et al. han observado que al exponer microsomas renales a donadores de NO, como el nitroprusiato de sodio (SNP) y el 1-propanamina, 3 (2-hidroxi-2-nitroso-1-propilhidrazino) (PAPANONOATO), la síntesis de 20-HETE es inhibida,11 sugiriendo que el NO regula el metabolismo del AA vía CYP. Los estudios realizados no hancaracterizadoen su totalidad los efectos producidos por el NO sobre el metabolismo del AA vía CYP, ni la repercusión de esta interacción sobre la regulación de la presión arterial, por lo que en el presente estudio nos planteamos como objetivo evaluar el papel modulador del NO y los metabolitos del AA vía CYP, así como la mutua interacción entre estas vías de señalización, sobre la presión arterial, además evaluamos el efecto del NO sobre el contenido de CYP renal.
Material y métodos
Grupos experimentales
Ratas Wistar macho con un peso de 250-320 g fueron divididas en cuatro grupos experimentales: Las ratas del primer grupo constituyeron el grupo control y sólo recibieron vehículo (control), a las ratas del segundo grupo se les administró: metil ester de nitro L-arginina (L-NAME, 100 mg/kg/d) en el agua de bebida. El tercer grupo estuvo constituido por ratas a las que se les administró L-NAME (100 mg/kg/d, v.o.) + cloruro de estaño (SnCl2, 10 mg/kg/d, 4 días, i.p.) y el cuarto grupo recibió L-NAME (100 mg/kg/d, v.o.) + dexametasona (1 mg/kg/d s.c, 4 días). Las ratas de todos los grupos experimentales fueron colocadas en jaulas metabólicas con agua y alimento ad libitum, bajo condiciones de temperatura y humedad controladas y ciclos luz-oscuridad (12-12 h). Se colectó la orina de 24 h y se midió el volumen urinario excretado en 24 horas y la cantidad de agua bebida diariamente.
Medición de la presión arterial
Al concluir el tratamiento, las ratas fueron anestesiadas con pentobarbital sódico (63 mg/kg i.p.), se cateterizó la arteria carótida con una cánula PE90 conteniendo solución salina heparinizada (10 UI/mL) y ésta se conectó a un transductor de presión arterial (modelo BP1, de World Precision Instruments), acoplado a un sistema computarizado para la adquisición de los datos.12
Cuantificación de NO por HPLC
La cuantificación del NO se realizó por un método indirecto, determinando la concentración de nitritos por Cromatografía Líquida de Alta Resolución (HPLC). Las muestras de orina y sangre obtenidas de los animales, después de los tratamientos farmacológicos, fueron centrifugadas a 13,000 rpm durante 5 min. Se colectó el sobrenadante y se diluyó 1:100, inyectándose 50 μL en un HPLC (modelo M45 de Waters). La separación se realizó usando una columna Waters IC Pack de intercambio aniónico de alta resolución (dimensiones: 4.6 x 75 mm, tamaño de partícula 6 μm y capacidad: 30 ± 3 μeq/mL), así como una fase móvil preparada con solución amortiguadora de gluconato/borato de litio pH 7.4. La detección de NO2 se realizó con un detector UV/ visible Beckman System Gold 166 a una longitud de onda de 214 nm y acoplado a un graficador Kipp and Zonnen modelo BD41. Bajo estas condiciones el tiempo de retención fue de 1.4 min. La concentración de NO2 en las muestras, se determinó por extrapolación de los valores respecto de una curva estándar de nitritos y se tomó como índice de la cantidad de NO contenido en las muestras.13
|
Bajo anestesia profunda a los animales se les extrajeron ambos riñones, uno de ellos fue usado para obtener la corteza y el otro fue usado en su totalidad. La corteza y el riñón completo fueron homogenizados por separado en una solución amortiguadora de Tris-HCl-sacarosa a pH 7.6. El homogenado fue centrifugado a 2500 rpm/4°C/10 min, colectándose el sobrenadante, mismo que fue sometido a centrifugaciones secuenciadas: primero se centrifugó a 10,000 rpm/4°C/15 min, y después a 25,000 rpm durante 90 min, posteriormente los microsomas aislados fueron resuspendidos en solución amortiguadora de fosfato de potasio 0.1 M a pH 7.6, divididos y congelados a -80°C, hasta la realización del inmunoblot.14 Las proteínas fueron cuantificadas por el método de Bradford15 y separadas por electroforesis en un gel de poliacrilamida al 7.5% por 1.5 hrs a 150 V. Posteriormente, se transfirieron a una membrana de polivinil dieno difluoruro (PVDF) durante 2 hrs a 150 V y 4°C. Esta membrana fue incubada en solución amortiguadora de fosfatos en Tween y leche (TBST-leche 1%) durante 12 hrs a 4°C; previo lavado la membrana se incubó con un anticuerpo policlonal de conejo contra CYP4A (1:250) por 24h a 4°C. Transcurrido el tiempo, la membrana fue lavada varias veces con TBST y se incubó 1 h con el segundo anticuerpo anticonejo marcado con peroxidasa de rábano (1:2000). La membrana se lavó nuevamente con TBST y fue revelada por quimioluminiscencia (ECL Amersham).
Estadística
La concentración de nitritos en orina y sangre, así como los datos de presión arterial fueron sometidos a un análisis de varianza de una sola vía, seguidos de una prueba de Tukey, para buscar diferencias significativas entre los grupos. Se consideró que había diferencias significativas cuando p < 0.05. Los resultados se presentan como la media ± el error estándar de 5 experimentos.
Resultados
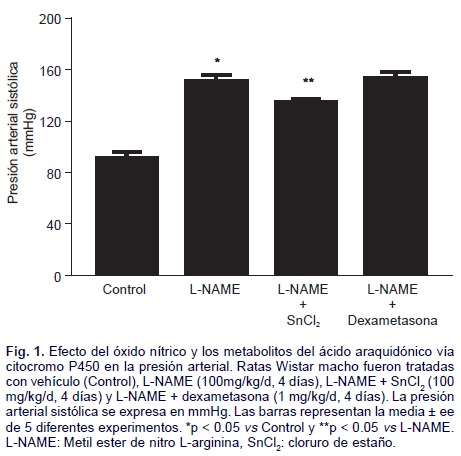
Efecto de la inhibición de la síntesis de NO sobre el metabolismo del AA vía CYP y la presión arterial. La administración oral de L-NAME incrementó la presión arterial con respecto al grupo control de 97 ± 7 mmHg a 151 ± 4.6 mmHg. La administración conjunta de L-NAME + SnCl2, previno parcialmente el aumento de la presión arterial (133 ± 3 mmHg) en comparación con el grupo que sólo recibió L-NAME (150 ± 4 mmHg, p < 0.05). Mientras que, la administración de L-NAME + dexametasona no modificó los valores de presión arterial (152 ± 4.5 mmHg) con respecto del grupo tratado únicamente con L-NAME (151 ± 4.6 mmHg) (Fig. 1).
Efecto de la dexametasona y el cloruro de estaño en la síntesis y excreción de NO.
La concentración de NO en la orina de las ratas del grupo control fue de 1.832 ± 0.325 μmol/mL, en ratas tratadas con L-NAME se observó una disminución significativa de la excreción urinaria de NO (1.031 ± 0.233 μmol/mL). En el grupo de ratas tratadas con L-NAME + SnCl2, no disminuyó la excreción urinaria de NO (1.616 ± 0.334 μmol/mL).
Por otro lado, la administración de L-NAME + dexametasona, no modificó la excreción urinaria de NO con respecto al grupo tratado con L-NAME (1.244 ± 0.334 μmol/mL) (Fig. 2).

La inhibición de la síntesis de NO producida por el tratamiento con L-NAME disminuyó significativamente la concentración de NO en suero de 0.293 ± 0.066 y 0.150 ± 0.049 μmol/mL para los grupos control y L-NAME, respectivamente. El co-tratamiento con L-NAME + SnCl2 y L-NAME + dexametasona previno la reducción de la concentración de nitritos en suero con respecto al grupo tratado únicamente con L-NAME (0.373 ± 0.131 mmol/mL, 0.373 ± 0.070 mmol/mL vs 0.150 ± 0.049 μM/mL, respectivamente) (Fig. 3).

Western Blot
El análisis del contenido renal de CYP4A en el homogenado de riñón total de rata, por western blot, mostró que existe expresión proteica basal del contenido de las isoformas CYP4A1, A2 y A3. El tratamiento con L-NAME no modificó la expresión proteica de las tres isoformas, mientras que los co-tratamientos: L-NAME + SnCl2 y L-NAME + dexametasona disminuyeron la expresión de las tres isoformas del CYP (Fig. 4). Cuando se realizó el western blot en microsomas provenientes de la corteza renal de animales que recibieron los mismos cotratamientos, se observó que con L-NAME el contenido de las tres isoformas aumentó, mientras que con L-NAME + SnCl2 se presenta un comportamiento similar al del homogenado total. En el grupo tratado con L-NAME + dexametasona, se observó disminución del contenido de las isoformas CYP4A2 y 4A3 y un ligero aumento de la isoforma 4A1, con respecto al grupo tratado con L-NAME (Fig. 5).
Discusión
En el presente trabajo se demuestra que tanto el NO como los metabolitos del AA vía CYP tienen participación en la regulación de la presión arterial, que los productos del AA vía CYP contribuyen a la regulación de la síntesis de NO y que tanto el NO como los AA-CYP contribuyen a la regulación del contenido de CYP.
La presión arterial es un parámetro que presenta regulación multifactorial. En este sentido se ha demostrado que factores autocrinos entre los que se incluyen al NO y los metabolitos del AA-CYP, (particularmente 19- y 20 HETE), regulan el establecimiento de procesos hipertensivos en modelos animales.16,17 El NO contribuye importantemente a la regulación de la presión arterial y aunque no es el único factor, posee una participación preponderante en este proceso. En nuestro modelo, la inhibición de la síntesis de NO produjo aumento de la presión arterial de manera similar a estudios previos.12 Adicionalmente, cuando disminuyó la cantidad de CYP por tratamiento con SnCl2, se observó disminución de la presión arterial, esto demuestra que en condiciones normales el CYP contribuye a la regulación de la presión arterial mediante la acción de metabolitos vasoconstrictores. Y el NO actúa como agente que se oponealaumento de la presión arterial y al establecimiento de la hipertensión. Al inhibir la producción de NO por administración de L-NAME e inhibir la expresión de CYP por acción del cloruro de estaño, se hizo evidente el papel hipertensor de los metabolitos del AA-CYP.16
La actividad metabólica del CYP puede ser modificada farmacológicamente por agentes tales como el SnCl2 y la dexametasona, herramientas que permiten evaluar la participación de los metabolitos del CYP en procesos fisiológicos.18,19 Estudios llevados a cabo por Lin et al. han mostrado que el tratamiento con clofibrato o dexametasona induce la expresión del gen correspondiente a la familia CYP4A, lo cual se acompaña de un incremento en la síntesis de 20-HETE.20 Sin embargo, en nuestro modelo, el tratamiento conjunto (L-NAME + dexametasona) no potenció el aumento en la presión arterial respecto al tratamiento con L-NAME. Este resultado en primera instancia resulta sorprendente ya que al aumentar la monooxigenasa del CYP, la producción de metabolitos hipertensores (19- y 20-HETE) debería estar incrementada, y al faltar NO que se oponga a la acción vasoconstrictora de estos metabolitos, se esperaba potenciación del efecto hipertensor. Existen varios factores que pudieron haber influido para que no se presentara la potenciación: 1) El factor preponderante en la regulación del tono vascular y la resistencia vascular periférica es el NO, por lo que la presencia de agentes vasoconstrictores no modificó significativamente la respuesta vascular;21 2) Durante el tratamiento in vivo con L-NAME y dexametasona se haya ejercido regulación de la presión arterial por factores humorales (PGs, Bradicinina, Ach, etc.) o factores renales de regulación de volumen y excreción de sodio;22,23 3) Dexametasona indujo al CYP y con ello la producción de sus metabolitos incrementó. Si bien estudios previamente realizados en nuestro laboratorio mostraron que los únicos metabolitos que aumentaron su producción por el tratamiento con dexametasona son los ω-1 y ω-hidroxilados, no podemos descartar la posibilidad de que en ausencia de NO, la actividad epoxigenasa del CYP se haya favorecido y con ello la producción de EETs, los cuales, se ha reportado, poseen propiedades vasorrelajantes, considerándoseles como el factor hiperpolarizante derivado del endotelio.24 4) Otra posibilidad es que una isoforma de la NOS resistente a L-NAME haya producido al vasorrelajante (NO), y haya contrarrestado las acciones vasoconstrictoras de los metabolitos del CYP. La presencia de una enzima de tales características ha sido reportada por Singh et al. Este grupo reportó en 1997 la actividad productora de L-citrulina y NO por una NOS en homogenado de riñón de rata. Esta actividad fue medida en presencia de L-NAME (incluso a 1 mM) y los investigadores no observaron disminución de la actividad enzimática en más del 10%, concluyendo que en el riñón de rata existen isoformas de la NOS con características diferentes a las presentes en otros sitios, insensibles a análogos de la L-arginina y que contribuyen con alrededor del 90% de la producción de NO renal.25 Esta posibilidad podría explicar parcialmente la elevada concentración de nitritos observada en el suero de las ratas a pesar de la administración de L-NAME y los cotratamientos. Por lo que podemos sugerir que el factor preponderante en la regulación de la presión arterial es el NO. Esta regulación puede ser en forma directa al modular el tono vascular o en forma indirecta regulando la acción vasoconstrictora de metabolitos con propiedades hipertensivas como los del AA vía CYP y su relación con la regulación de la presión arterial. En este sentido los resultados sugieren una regulación dual entre ambos sistemas, ya que la reducción de la síntesis de NO en animales tratados con L-NAME + SnCl2, originó incrementos menores de la presión arterial respecto de los animales a los que sólo se les inhibió la síntesis de NO. El análisis del contenido de CYP de la corteza de riñón mostró que en el grupo tratado con L-NAME + dexametasona la isoforma CYP4A1 se encuentra aumentada con respecto al control. Si bien se esperaba un aumento en la expresión de todas las isoformas del CYP renal con el co-tratamiento L-NAME + dexametasona, éste sólo favoreció a la isoforma 4A1.
Conclusiones
En conclusión, tanto el óxido nítrico como los AA-CYP tienen participación en la regulación de la presión arterial, sin embargo, el NO contribuye en mayor proporción regulando, además, la expresión de la familia 4A del CYP renal.
Referencias
1. Needleman P, Turk J, Jakschick BA, Morrison AR, Lefkowith JB: Arachidonic acid metabolism. Annu Rev Biochem 1986; 55: 69-102. [ Links ]
2. Smith WL: Prostanoid biosynthesis and mechanism of action. Am J Physiol 1992; 263: F181-F191. [ Links ]
3. Jackson EK, Herzer WA: Angiotensin II/Prostaglandin I2 interactions in spontaneously hypertensive rats. Hypertension 1993; 22: 688-698. [ Links ]
4. Straudinger R, Escalante BA, Schwartzman ML, Abraham NG: Effects of EETs on 86Rb uptake in renal epithelial cells. J Cell Physiol 1994;160: 69-74. [ Links ]
5. Schwartzman M, Falck JR, Yadagiri P, Escalante BA: Metabolism of 20-HETE by cyclooxygenase, formation and identification of novel endothelium dependent vasoconstrictor metabolites. J Biol Chem 1989; 264: 1165-1172. [ Links ]
6. Rosolowski M, Falck JR, Willerson JT, Campbell WB: Synthesis of lypooxigenase and epoxygenase products of arachidonic acid by normal and stenosed canine coronary arteries. Circ Res 1990; 66: 608-621. [ Links ]
7. Zou AP, Imig JD, Kaldunski M, Ortiz de Montellano PR, Sui Z, Roman RJ: Inhibition of renal vascular 20-HETE production impairs autoregulation of renal blood flow. Am J Physiol 1994; 266(2Pt2): F275-F282. [ Links ]
8. Zou AP, Imig JD, Ortiz de Montellano PR, Sui Z, Falck JR, Roman RJ: Effect of P450 omegahydroxylase metabolites of arachidonic acid on tubuloglomerular feedback. Am J Physiol 1994; 266(6pt2): F934-F941. [ Links ]
9. Palmer RM, Ferrige AG, Moncada S: Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature 1987; 327(6122): 524-526. [ Links ]
10. Wink DA, Osawa Y, Darbyshire JF, Jones CR, Eshenaur SC, Nims RW: Inhibition of cytochromes P450 by nitric oxide and a nitric oxide-releasing agent. Arch Biochem Biophys 1993; 300: 115-123. [ Links ]
11. Alonso-Galicia M, Drummond HA, Reddy KK, Falck JR, Roman RJ: Inhibition of 20-HETE production contributes to the vascular responses to nitric oxide. Hypertension 1997; 29(2): 320-325. [ Links ]
12. Sánchez-Mendoza A, Hong E, Escalante B: The role of nitric oxide in angiotensin II-induced renal vasoconstriction in renovascular hypertension. J Hypertension 1998; 16(5): 697-703. [ Links ]
13. El Menyawi I, Looareesuwan S, Knapp S, Thalhammer F, Stoiser B, Burgmann H: Measurement of serum nitrite/nitrate concentrations using high-performance liquid chromatography. J Chromatography B Biomed Sci App 1998; 706(2): 347-351. [ Links ]
14. Ito O, Alonso-Galicia M, Hoop KA, Roman R: Localization of cytochrome P-450 4A isoformas along the rat nephron. Am J Physiol 1998; 274: F395-F404. [ Links ]
15. Bradford MM: A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Analyt Biochem 1976; 72: 248-254. [ Links ]
16. Laniado-Schwartzman M, Abraham NG, Sacerdoti D, Escalante B, McGiff JC: Effect of acute and chronic treatment of tin on blood pressure in spontaneously hypertensive rats. Tonoku J Exp Med 1992; 166(1): 85-91. [ Links ]
17. Laniado-Schwartzman M, Abraham NG: The renal cytochrome P-450 arachidonic acid system. Pediatr Nephrol 1992; 6(5): 490-498. [ Links ]
18. Da Silva JL, Tiefenthaler M, Park E, Escalante B, Schwartzman ML, Levere RD, Abraham NG: Tin-mediated heme oxygenase gene activation and cytochrome P450 arachidonate hydroxylase inhibition in spontaneously hypertensive rats. Am J Med Sci 1994; 307(3): 173-181. [ Links ]
19. Erman A, Hassid A, Baer PG, Nasjletti A: Treatment with dexamethasone Increases glomerular prostaglandin synthesis in rats. J Pharmacol Exper Ther 1994; 739: 296-301. [ Links ]
20. Lin F, Abraham NG, Schwartzman ML: Cytochrome P450 arachidonic acid omega hydroxylation in the proximal tubule of the rat kidney. Ann NY Acad Sci 1994; 744: 11-24. [ Links ]
21. Mannig RH, Hu L: Nitric oxide regulates renal hemodynamics and urinary sodium excretion in dogs. Hypertension 1994; 23: 619-625. [ Links ]
22. Nakamoto H, Suzuki H, Kageyama Y, Murakami M Ohishi A, Naitoh M, et al: Depressor systems contribute to hypertension induced by glucocorticoid excess in dogs. J Hypertension 1992; 10(6): 561-569. [ Links ]
23. Falardeau P, Martineau A: Prostaglandin I2 and glucocorticoid-induced rise in arterial pressure in the rat. J Hypertension 1989; 7(8): 625-632. [ Links ]
24. Li P-L, Campbell WB: Epoxyeicosatrienoic acids activate K+ channels in coronary smooth muscle through a guanine nucleotide binding protein. Circ Res 1997; 80: 877-884. [ Links ]
25. Singh R, Pervin S, Rogers NE, Ignarro LJ, Chaudhuri G: Evidence for the presence of an unusual nitric oxide- and citrulline-producing enzyme in rat kidney. Biochem Biophys Res Commun 1997; 232: 672-677. [ Links ]














