Introducción
La contaminación del agua por cromo hexavalente [Cr (VI)] es un problema que afecta a los ecosistemas de manera directa, generalmente la principal fuente de contaminación proviene de industrias como: metalúrgica, galvanoplastia, curtiembres, de fabricación de acero inoxidable, producción de pinturas y preservación de la madera (Aghababai B. & Esmaeili, 2020). La agencia de protección ambiental de los estados unidos (USEPA) ha identificado al Cr (VI) como una sustancia química tóxica que representa una amenaza para los seres humanos (USEPA, 2007) al provocar diarrea, úlceras, irritación de la piel y ojos, disfunción renal, cáncer del tracto digestivo y de pulmón (Mohanty, Jha, Meikap & Biswas, 2005). Por su impacto ambiental y en la salud pública, la comunidad científica ha desarrollado métodos y procesos para el tratamiento del agua contaminada con esta sustancia, entre ellos, la electrodiálisis, la filtración con membranas, el intercambio iónico, la precipitación y la adsorción utilizando carbón activado (Jobby, Jha, Yadav Kumar & Desai, 2018). Estos tratamientos son simples y de purificación rápida, sin embargo, algunos tienen un alto costo de inversión, consumen gran cantidad de energía y generan contaminantes secundarios (Luiz da Rocha Ferreira, Vendruscolo & Antoniosi Filho, 2019;Al-Homaidan,Al-Qahtani,Al-Ghanayem,Ameen & Ibraheem, 2018; Enniya, Rghioui & Jourani, 2018), por esto, es necesario desarrollar nuevos procesos o aplicar otros como la biosorción.
La biosorción es un proceso alternativo para el tratamiento del agua contaminada con diversas sustancias químicas e. g. iones metálicos. Consiste en utilizar la biomasa de algas o subproductos agroindustriales como adsorbentes, los cuales, tanto en la superficie como en los poros, tienen grupos funcionales como: carboxilo, hidroxilo, fosfato, ésteres, amino, carbonilo y tiol, que tienen la capacidad de adsorber diversos iones metálicos de manera eficaz. Además, su aplicación es de bajo costo y sin daños al medio ambiente (Ghimire, Inoue, Yamaguchi, Makino & Miyajima, 2003; Aghababai B. & Esmaeili, 2020; Javanbakht, Alavi Amir & Zilouei, 2014). Los subproductos agroindustriales han generado interés como adsorbentes de iones metálicos en soluciones acuosas o efluentes industriales, también por su abundancia, resistencia mecánica y química, estabilidad térmica y alta capacidad de adsorción (Flores-Garnica, Morales-Barrera, Pineda-Camacho & Cristiani-Urbina, 2013; Lingamdinne, Yang, Chang & Koduru, 2016; Saha, Hoque, Miah, Holze, Chowdhury, Khandaker & Chowdhury, 2017; Gisi, Lofrano, Grassi & Notarnicola, 2016).
El fruto de nanche (Byrsonima crassifolia) es una drupa con una semilla cubierta por una testa delgada y oscura, de importancia económica y desarrollo comercial en los principales estados mexicanos, productores, de: Guerrero, Nayarit y Michoacán, por lo que el servicio de información agroindustrial y pesquera (SIAP) reportó en 2019 a nivel nacional una producción de 8,028 toneladas, donde el 11 % del fruto corresponde al endocarpio (semilla-testa), es decir, que se generaron ~ 883.08 toneladas de subproducto agroindustrial (SIAP, 2019). Por esto y al no encontrar información bibliográfica relacionada con el objetivo de este trabajo, fue que se evaluó la biosorción del Cr (VI) utilizando el subproducto del nanche como adsorbente mediante el ajuste de modelos cinéticos, así como el efecto del pH de la solución, dosis y tamaño del adsorbente.
Materiales y métodos
Preparación del adsorbente
El subproducto del nanche fue adquirido en el mercado local (21°30’39.3”N 104°53’42.8”W), la semilla y la testa se lavaron con agua desionizada, se secaron a 80 °C durante 5 horas en un horno del laboratorio (NovaTech, NOT-HS35-AID), posteriormente se trituraron en un molino de muelas para granos (Lion Tools, 6360) y cribadas en tamices estándar Montinox de malla 4 hasta 45, el rango del tamaño de la partícula utilizado en este estudio fue de 0.595 a 2.38 mm. Los grupos superficiales del subproducto se identificaron con espectroscopía infrarroja (FT-IR) (Thermo Scientific, Nicolet iS20).
Soluciones de cromo hexavalente
Las soluciones de Cr (VI) para los experimentos de biosorción se obtuvieron a partir de una solución primaria de 1 g/L de Cr (VI) disolviendo una cantidad exacta de dicromato de potasio (K2Cr2O7, J.T. Baker; pureza ≥ 99.0 %) en agua desionizada. Las soluciones obtenidas se ajustaron al valor del pH deseado mediante un potenciómetro (Hach sensION+) y con soluciones de 0.1 N de HCl (J.T. Baker, 36.5%) y 0.1 N de NaOH (J.T. Baker, 95%)
Biosorción y método analítico
La biosorción se realizó con el método batch al agregar 1 gramo de adsorbente y 30 mL de solución de Cr (VI) en un vaso de precipitado, el pH constante a temperatura ambiente y agitación permanente durante una hora; en este proceso se modificó la concentración inicial del Cr (VI), el tamaño de la partícula, el pH de la solución y la dosis del adsorbente; los valores evaluados se muestran en la Tabla I.
Tabla I Valores de los parámetros evaluados.
| Parámetros | Valores |
|---|---|
| [Cr (VI)]0 (mg/L) | < 50, 50, 100, 150, 200, 250, 300 y 400 |
| pH | 2,3,5 y 7 |
| Tamaño de la partícula (mm) | 0.595-0.991, 0.991-2.00, 2.00-2.38 |
| Dosis de adsorbente (g/30mL) | 0.5,1,2,3 y 4 |
El Cr (VI) se determinó con la metodología de la difenilcarbazida descrita en los métodos normalizados para análisis de agua potable y residual (APHA-AWWA-WEF, 2012); la absorbancia del complejo cromo-difenilcarbazida de coloración púrpura fue leída a 540 nm en un espectrofotómetro Uv-Vis (Agilent Technologies, Cary 50). El porcentaje de remoción del Cr (VI) se representa mediante la Ecuación 1. Donde C o: es la concentración del Cr (VI) inicial (mg/L), Ct: es la concentración del Cr (VI) (mg/L) en el tiempo t.
Mediante dos réplicas independientes se demostró que los experimentos de remoción del Cr (VI) son reproducibles con un error del 5%. Los datos de la biosorción del Cr (VI) se analizaron estadísticamente mediante un análisis de varianza para cada parámetro evaluado (Método Tukey; nivel de confianza del 95%) utilizando el software Minitab 18 (Minitab Statistical Software).
Modelos cinéticos
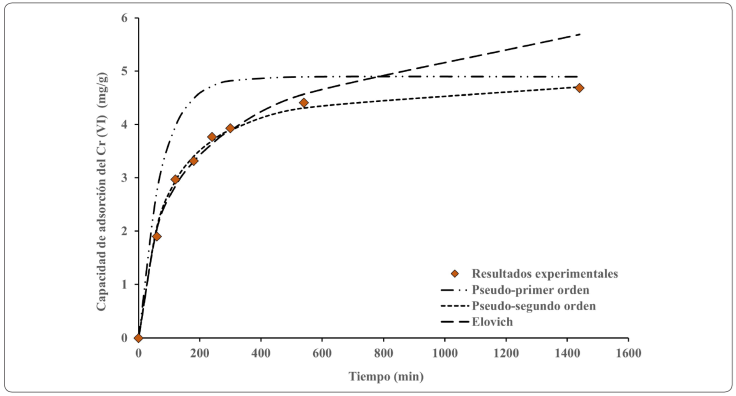
Los datos cinéticos experimentales se analizaron utilizando tres modelos cinéticos: Elovich, Pseudo-primer orden y Pseudo-segundo orden mostrados en la Tabla II. El ajuste de los datos experimentales y los diversos modelos se obtuvieron por regresión lineal de los modelos cinéticos linealizados utilizando el Software Minitab 18 (Minitab Statistical Software). A partir del coeficiente de correlación (R2) y el porcentaje de desviación (%D) se determinó el modelo cinético que mejor se ajusta a los datos experimentales.
Resultados y discusión
Capacidad de adsorción del subproducto de nanche
Desde los inicios de la biosorción se han utilizado gran variedad de adsorbentes sintéticos o naturales, estos últimos a partir de subproductos agroindustriales que presentan la capacidad de remover iones metálicos de soluciones acuosas. Existen estudios de adsorción mediante el subproducto de nanche Monroy-Figueroa, Mendoza-Castillo, Bonilla-Petriciolet & Pérez-Cruz (2014) quienes realizaron la adsorción de los iones metálicos del cadmio (Cd+2) y del níquel (Ni+2), a una temperatura de 30 °C y con un pH de la solución de 5 obtuvieron una q máx de 1.71 mg/g y 0.95 mg/g respectivamente. Bernal-Jácome, Olvera-Izaguirre, Gallegos-García, Delgado-Delgado & Espinosa- Rodríguez (2020) utilizaron plomo (Pb +2) como adsorbato a una temperatura de 25 °C y un pH de la solución de 4, la q máx fue de 8.53 mg/g. Los resultados experimentales al modificar la concentración inicial del Cr (VI) se muestran en la Tabla III. Donde q máx es el Cr (VI) máximo adsorbido y se representa mediante la capacidad de adsorción (q, mg/g), que se obtiene de acuerdo con un balance de materia (Ecuación 2).
Donde V: es el volumen de la solución (L) y W la masa del adsorbente seco (g) que demuestran tener una capacidad máxima de adsorción del Cr (VI) experimental de 3.596 mg/g en una hora de contacto y una remoción cercana al 100% utilizando una concentración inicial de 50 mg/L de Cr (VI).
Tabla III Efecto de la concentración inicial del Cr (VI) (dosis del adsorbente: 1 g; tiempo de contacto: 60 min; tamaño de la partícula: 2.38-2.0 mm).
| C inicial (mg/L) | C 60 min (mg/L) | q 60 min (mg/g) | % Remoción |
|---|---|---|---|
| 400 | 280.139 | 3.596 | 29.965 |
| 300 | 181.614 | 3.552 | 39.462 |
| 250 | 148.253 | 3.052 | 40.699 |
| 200 | 110.409 | 2.688 | 44.796 |
| 150 | 73.528 | 2.294 | 50.982 |
| 100 | 30.344 | 2.090 | 69.656 |
| 50 | 1.204 | 1.464 | 97.593 |
| < 50 | nd | nd | 100 |
nd: No detectado.
Efecto del pH de la solución
El pH afecta directamente a la carga superficial del adsorbente (Naja & Volesky, 2011) y a la especiación del ion metálico (Greene, Henzl, Hosea & Darnall, 1986). Los resultados se presentan en la Figura 1.a, donde se aprecia una mejor remoción del Cr (VI) de hasta 45% con un pH de 2. Esto se debe, a que cuando el pH de la solución es de carácter ácido (1 - 6) predominan iones como HCrO4 -, y dado que, el punto de carga cero (PCC) del nanche de forma natural es 6.0 la carga superficial del subproducto del nanche a pH de 2 es positiva (Bernal-Jácome et al., 2020; Leyva-Ramos, Díaz-Flores, Guerrero Coronado, Mendiza Barrón & Aragón Piña, 2004), por lo que, la adsorción se ve favorecida mediante atracción electrostática, este efecto se da al utilizar carbón activado de aserrín de madera (Ramirez, Ocampo, Giraldo, Padilla, Flórez & Aceltas, 2020) y carbón de lignito (Beksissa, Tekola, Ayala & Dame, 2021) como adsorbentes. Los experimentos posteriores se realizaron con un pH de 2.0.
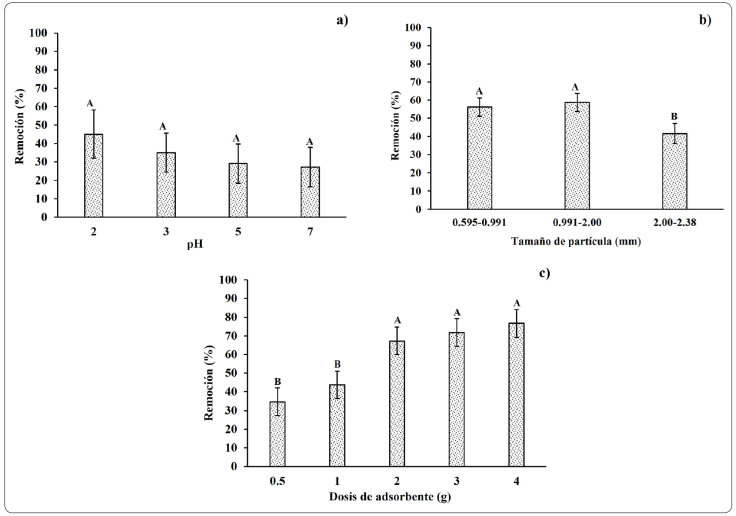
Figura 1 a) Efecto del pH (dosis del adsorbente: 1 g; tamaño de la partícula: 2.00-2.38 mm; concentración inicial: 150 mg/L; tiempo de contacto: 60 min), b) Tamaño de partícula (pH: 2.0; dosis del adsorbente 1 g; concentración inicial: 150 mg/L; tiempo de contacto: 60 min) y c) Dosis del adsorbente (tamaño de la partícula: 2.00-2.38 mm; pH: 2.0; concentración inicial: 150 mg/L; tiempo de contacto: 60 min).
Efecto del tamaño de la partícula
En la Figura 1.b la mayor remoción (58.54 %) se da para un tamaño de partícula de 0.991 - 2.00 mm y esto se atribuye a que una partícula pequeña tiene mayor área superficial por unidad de masa (Enniya et al., 2018), sin embargo, al disminuir el tamaño de las partículas < 0.991 mm estas se aglomeran y se adhieren unas a otras, por lo que disminuye no solo la superficie expuesta a la solución, sino también la remoción del Cr (VI). Este fenómeno igual fue observado por Al-Qahtani (2016), al utilizar cáscaras de kiwi, mandarina y plátano como adsorbentes.
Efecto de la dosis del adsorbente
La remoción del Cr (VI) se elevó de 34.7 % a 76.44 % al incrementar la dosis del adsorbente de 0.5 a 4.0 g respectivamente como se observa en la Figura 1.c, este aumento en la remoción se puede atribuir a la aparición de más sitios activos para la biosorción, sin embargo, no existe diferencia visible entre las dosis de 2.0, 3.0 y 4.0 g, y puede deberse a la formación de bloques y puntos de estancamiento, dado que la velocidad de agitación se mantuvo constante. Este comportamiento también se observó utilizando cáscara de cacahuate en la remoción del Cr (VI) (Owalude & Tella, 2016).
Modelos cinéticos de adsorción
Los resultados obtenidos de la cinética de adsorción se muestran en la Figura 2, donde la remoción es del 100 % durante un tiempo de contacto de 24 horas y una concentración inicial de 150 mg/L, definida a partir de la caracterización de un efluente de galvanoplastia (Liu. Fiol, Poch & Villaescusa, 2016). Estos resultados se utilizaron para estimar las constantes de los tres modelos cinéticos linealizados que se muestran en la Tabla IV.
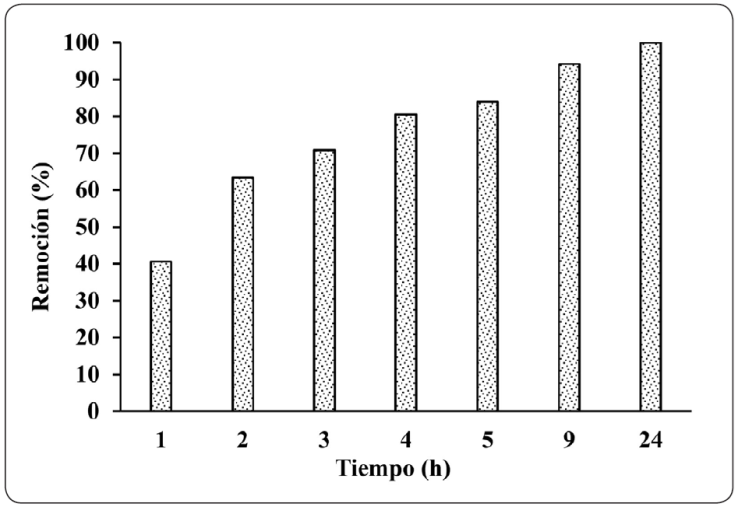
Figura 2 Cinética de adsorción; (pH: 2.0; dosis del adsorbente: 1 g; concentración inicial: 150 mg/L).
Tabla IV Resultados del ajuste de los modelos cinéticos.
| Modelo cinético | Parámetros del modelo, coeficiente de correlación y porcentaje de desviación | |||
|---|---|---|---|---|
| Pseudo- primer orden | k 1 (1/min) | q e1 (mg/g) | R 2 | %D |
| 0.014 | 4.893 | 0.984 | 25.284 | |
| Pseudo- segundo orden | k 2 (g/(mg min) | q e2 (mg/g) | R 2 | %D |
| 0.002 | 4.973 | 0.999 | 2.725 | |
| Elovich | α | β | R 2 | %D |
| 0.114 | 0.873 | 0.979 | 5.991 | |
Una vez calculados los parámetros de cada modelo cinético, se sustituyen en el modelo original y se grafica la cinética de adsorción experimental y de los tres modelos cinéticos que se ilustran en la Figura 3, el que mejor describe los datos experimentales es el de pseudo-segundo orden. Al igual que en el presente estudio, se han encontrado diversos adsorbentes con el mismo ajuste para el modelo pseudo-segundo orden en la biosorción del Cr (VI) empleando: cáscara de pistache (Moussavi & Barikbin, 2010), piña (Pinus sylvestris), (Ucun, Bayhan, Kaya, Cakici & Algur, 2002) y salvado de trigo (Nameni, Moghadam & Arami, 2008).
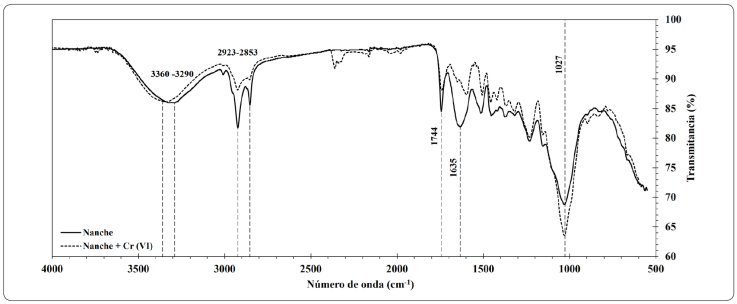
Espectro infrarrojo del adsorbente
Los espectros FT-IR del subproducto de nanche antes y después de la cinética de adsorción mostrados en la Figura 4, se emplearon para determinar los cambios en los grupos funcionales presentes en la biomasa. La banda entre 3,290-3,360 cm- 1 indica la existencia de grupos hidroxilos en la estructura del adsorbente; la banda entre 2,853-2,923 cm-1 se asocia a la vibración de estiramiento del grupo C- H de los grupos metilo alifáticos; el pico ubicado a 1,744 cm-1 corresponde a los grupos carbonilo (C=O) pertenecientes a los ácidos carboxílicos o grupos ésteres de la biomasa; el pico ubicado a 1,635 cm-1 está relacionado al estiramiento C=C que se atribuye generalmente a los grupos aromáticos de la lignina; y finalmente la banda ubicada a 1,027 cm-1 asociada al grupo -OCH3 confirma la presencia de la estructura de la lignina y grupos éteres (Hospodarova, Singovszka & Stevulova, 2018). Podemos observar cambios visibles, cuando se adsorbe Cr (VI) en el adsorbente, e. g. existe un desplazamiento en las bandas y aumento en la amplitud de los picos, que están asociados a grupos oxigenados, como hidroxilos, carbonilos y éteres, que pueden estar involucrados en la adsorción del Cr (VI), corroborando así, que existen interacciones entre el Cr (VI) y la superficie del subproducto de nanche. Estos cambios también se han observado utilizando bagazo de caña y mazorca de maíz (Garg, Kaur, Garg & Sud, 2007).
Comparación de la capacidad de adsorción del Nanche con otros adsorbentes
La comparación del subproducto del nanche con otros materiales adsorbentes para la remoción del Cr (VI) se realizó en función de su capacidad máxima de adsorción (Tabla V). Se muestra que la capacidad de adsorción es similar a la obtenida con carbón activado de aserrín de coco y mayor al bagazo de caña de azúcar, por lo que, el subproducto del nanche se considera un adsorbente viable para la remoción del Cr (VI) en solución acuosa.
Tabla V Comparación de la capacidad de adsorción del Cr (VI) con otros adsorbentes.
| Adsorbentes | Capacidad de adsorción (mg/g) | Referencias |
|---|---|---|
| Subproducto de Nanche | 3.596 | Este estudio |
| Carbón activado de aserrín de coco | 3.46 | (Selvi, Pattabhi & Kadirvelu, 2001) |
| Cáscara de almendra | 3.40 | (Pehlivan & Altun, 2008) |
| Cáscara de arroz | 0.6 | (Sumathi, Mahimairaja & Naidu, 2005) |
| Aserrín | 1.482 | |
| Semilla de granada | 3.31 | (Ghaneian, Bhatnagar, Ehrampoush, Amrollahi, Jamshidi, Dehvari & Tagavhi, 2017) |
| Bagazo de caña de azúcar | 0.63 | (Garg et al., 2007) |
Conclusiones
Los resultados obtenidos en el presente estudio demostraron que el subproducto del nanche (Byrsonima crassifolia) tiene la capacidad de remover el Cr (VI) de soluciones acuosas, esta afirmación es sustentada en el ajuste del modelo cinético Pseudo-segundo orden y en los parámetros de la biosorción que influyen en un aumento de la remoción del Cr (VI) al disminuir el tamaño de la partícula y el pH de la solución, así como al incrementar la dosis del adsorbente. Finalmente, se obtuvo una capacidad máxima de adsorción de 3.596 mg/g en una hora de contacto. Si bien los subproductos agroindustriales solo son utilizados para composteo, emplearlos como adsorbentes representa una nueva ruta para su aplicación.











 text new page (beta)
text new page (beta)