Introducción
El algodón (Gossypium hirsutum L.) es el cultivo de mayor importancia económica utilizado en la industria textil y constituye más de la mitad del consumo de esta fibra en todo el mundo (Karademir, Karademir & Gencer, 2011). El algodón transgénico fue usado de manera comercial en 1996 en países como Argentina, Australia, China, y México (Terán-Vargas et al., 2009). En México, el algodón transgénico “Bollgard I y II” fue introducido por la empresa Monsanto® y se caracteriza por tener la toxina Cry 1Ac, derivada de Bacillus thuringiensis (Bt), var kurstaki Berliner, que es altamente efectiva contra las larvas del gusano rosado, Pectinophora gossypiella (Saunders), el gusano bellotero, Heliothis zea (Boddie), el gusano tabacalero, Heliothis virescens (Fabricius) y la conchuela del algodonero, Chlorochroa ligata (Say). En la actualidad, el uso de plantas transgénicas ha sido un factor determinante en el incremento del área de siembra del cultivo y en la reducción del uso de plaguicidas en las zonas productoras de México (Vargas-Bejarano et al., 2012). No obstante, el crecimiento del algodón transgénico puede verse afectado severamente por varios tipos de estrés bióticos (Ahsan et al., 2011). Dentro de estos factores la presencia marchita del tallo causada por hongos, es una enfermedad generalizada en el cultivo del algodón que se produce durante la etapa inicial de su crecimiento, o sea, cuando prevalecen condiciones de alta humedad (Lutfunnessa & Shamsi, 2011). Por otra parte, estudios recientes reportan que las plantas de algodón transgénicas que contienen la toxina Cry 1Ac, han mostrado ser más susceptibles a las enfermedades fúngicas en comparación con las líneas convencionales (Li et al., 2009). Esto como resultado de un efecto promotor de la germinación de las esporas y el crecimiento micelial de hongos fitopatógenos como Fusarium oxysporum (Li, Wei, Liu & Alam, 2013).
Entre los hongos que han sido reportados en el valle de Mexicali en Baja California, una de las principales zonas productoras de algodón en México, está Fusarium solani del que se tienen diferentes aislados (Gonzalez-Soto et al., 2015). Sin embargo, estudios sobre la interacción de estos aislados con plántulas de algodón transgénico “Bollgard II” que se siembran en el mismo valle, no habían sido realizados. Por esto los objetivos del presente trabajo fueron los siguientes: evaluar los cambios a nivel fisiológico de las plántulas y morfológico en las plantas de algodón transgénico “Bollgard II” al ser inoculadas con cepas nativas de F. solani, estudiar el efecto del crecimiento del hongo mencionado en la necrosis, número de lesiones en la raíz, actividad fotosintética e índice de clorofila en plántulas de algodón transgénico “Bollgard II.
Materiales y métodos
Preparación del inóculo de las cepas de Fusarium solani
Los cultivos de cuatro aislados de F. solani (T-ICA01, T-ICA03, T-ICA04 y T-ICA08), separados previamente de las plantas de algodón fueron cultivados en agar papa dextrosa (PDA, por sus siglas en inglés), e incubados a 27 °C. Las cepas fueron previamente identificadas molecularmente y registradas en Genbank por Gonzalez-Soto et al., (2015) con las siguientes claves: KJ620374 (T-ICA01), KJ620372 (T-ICA03), KJ620371 (T-ICA04) y KJ620375 (T-ICA08). Los subcultivos de cada aislado de F. solani en PDA se realizaron de acuerdo con lo propuesto por Tsror, Barak & Sneh (2001) para mantener viables las cuatro cepas de patógenos utilizadas en el estudio.
Inoculación de las plántulas de algodón con los aislados de Fusarium solani
Las semillas de algodón transgénico Bollgard con 20 días de germinación fueron retiradas del suelo de los terrarios del laboratorio y el sistema radicular lavado con agua destilada estéril para eliminar los residuos de tierra (Figura 1A). Posteriormente, el sistema radicular de las plantas se inoculó con cada una de las cepas de F solani (T-ICA01, T-ICA03, T-ICA04 y T-ICA08) y sometidas a inmersión con 1x107 esporas·mL-1 por un tiempo de 30 min., (Figura 1B). Las plantas inoculadas fueron colocadas en un microcosmos tipo sandwich de 100x15 cm de acuerdo con lo descrito por Espinoza-Victoria, Gonzalez, Plascencia & García (2004). Las plántulas inoculadas y sin inocular (testigos), se mantuvieron bajo un fotoperiodo de 12 h luz: oscuridad a 30 °C y con una humedad del 60%. Se realizaron cinco muestreos destructivos a los 0, 3, 6, 9 y 12 días después de la inoculación del patógeno, evaluando cuatro repeticiones por tratamiento. Las variables medidas fueron incidencia y severidad de la enfermedad en las plántulas de algodón transgénico Bollgard, usando la escala propuesta por Adorada et al. (2000) y también con base en estos autores la severidad de la enfermedad (SE) se expresó en porcentajes con la fórmula:
Eficiencia fotosintética e índice de clorofila en las plántulas inoculadas con F. solani.
Una vez que las plántulas de algodón fueron inoculadas con el patógeno se procedió a medir el valor de la clorofila empleando un medidor de clorofila SPAD 502 plus (Minolta) y la eficiencia fotosintética mediante un fluorómetro portátil OS-30p (OPTI-SCIENCE, USA), respectivamente. Se realizaron 4 mediciones por planta y cepa del patógeno empleado, registrándose lecturas a los días 0, 3, 6, 9 y 12 posteriores a la inoculación con las cepas de F. solani.
Puntos de infección de F. solani en las plántulas
Los cambios detectados en el sistema radicular de las plántulas de algodón previamente inoculadas con las diferentes cepas de F. solani, se evaluaron contabilizando los puntos de infección provocados por el hongo usando un estereoscopio Stemi 305 (Carl Zeiss). Las lecturas se realizaron los días 0, 3, 6, 9 y 12 posteriores a la inoculación.
Análisis estadísticos
Se utilizó un diseño completamente al azar para los datos de eficiencia fotosintética e índice de verdor con 4 repeticiones para cada medición, se llevó a cabo un análisis de varianza (ANOVA) y los datos fueron comparados con una prueba de Tukey (P ≤ 0.05) en el paquete estadístico NCSS versión 2007. Las gráficas fueron elaboradas en el paquete Sigma Plot 10.0.
Resultados y discusión
Porcentaje de severidad del daño en las plántulas inoculadas con F. solani
Diversos estudios han reportado la acción patogénica del hongo Fusarium solani en diferentes cultivos de importancia agrícola (Herrera-Parra et al., 2017). El hongo causa necrosis en el sistema radicular y en el tallo (Figueroa-Rivera et al., 2010). Afectando, el flujo de nutrientes y agua vía xilema por el daño hidráulico que ocasiona el crecimiento hifal del hongo en los haces vasculares, marchitando la planta. En México, se ha informado de la presencia de F. solani en plantas de Guanajuato, Aguascalientes y Morelos (Delgado-Ortiz et al., 2016). También se ha reportado en plantas de importancia forestal como Pinus patula y P. pseudostrobus en el estado de Guerrero, México (Robles-Yerena et al., 2016).
En el presente estudio los resultados mostraron que las cepas T-ICA03 y T-ICA08 de F. solani, tuvieron un efecto significativamente mayor en la reducción del número de raíces de las plantas de algodón con respecto a las otras cepas de F. solani, T-ICA01 y T-ICA04, (Figura 2). Lo anterior, podría ocasionar un sistema radicular poco profuso, menor área de contacto con las partículas del suelo, afectando la capacidad de absorción de agua y nutrimentos de la planta (Leslie, Zeller, Lamprecht, Rheeder & Marasas, 2005).
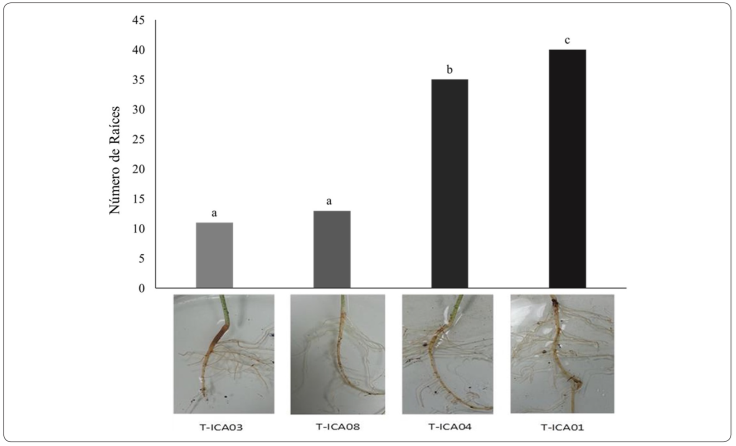
Figura 2 Sintomatología presente en plántulas de algodón transgénico Bollgard 12 días después de la inoculación con las cepas de F. solani. Para cada variable, las barras con la misma letra son estadísticamente iguales.
Con respecto al porcentaje de severidad de los daños causados por el hongo se observaron diferencias significativas (P ≤ 0.05) entre las medias de los tratamientos correspondientes a los 3, 6, 9 y 12 días (Figura 3). Los valores más altos de severidad fueron de un 90% en las cepas T-ICA03 y T-ICA01. Siendo la cepa T-ICA08, la que presentó el menor porcentaje de severidad con un 40% a los 12 días posteriores a la inoculación. Lo anterior, nos confirma la presencia de variaciones genotípicas en el grado de patogenicidad entre las cepas, asociadas a procesos de coevolución y adaptación con la planta hospedera y el área geográfica (Abd-Murad, Mohamed-Nor, Shohaimi, & Mohd-Zainudin, 2017).
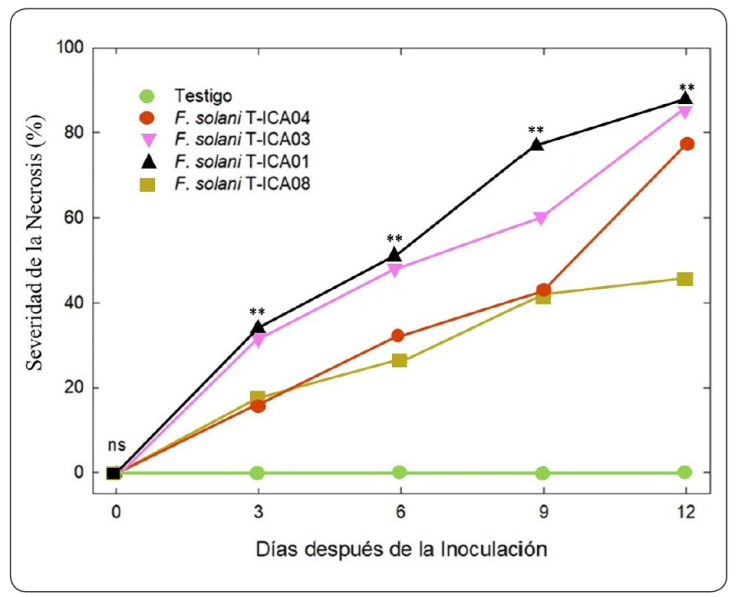
Figura 3 Porcentaje de severidad en plántulas de algodón transgénico Bollgard a los 3, 6, 9 y 12 días de inoculado el patógeno. Cada símbolo es la media de cuatro repeticiones ± el error estándar (ns, no significativo; *, significativo; **, altamente significativo).
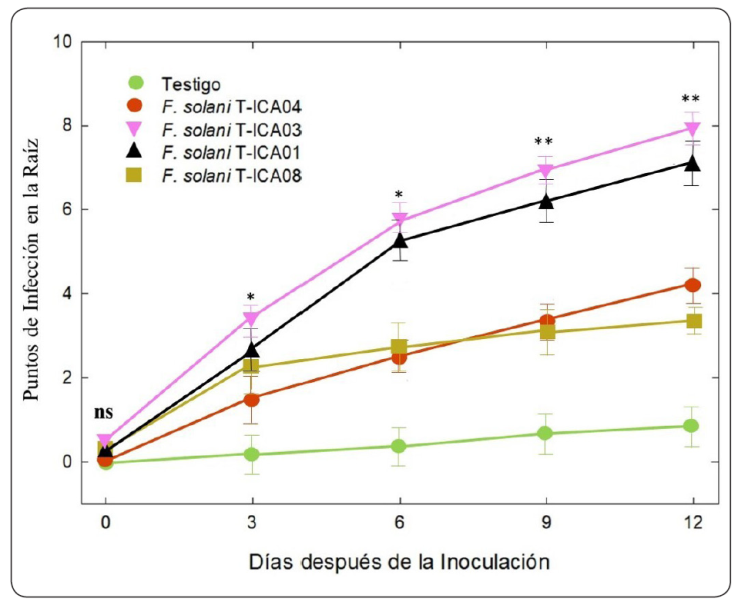
Por otra parte, el sistema radicular de las plantas inoculadas con la cepa de F. solani T-ICA03 y T-ICA01 mostraron un mayor número de puntos de infección y necrosis en las raíces con un promedio de 9 puntos en comparación con las demás cepas que fueron de entre 4 y 5 puntos (Figura 4). Todas las cepas mostraron diferencias significativas con respecto al testigo y conforme pasaban los días las plántulas de algodón tuvieron un incremento en el número de puntos de infección. Resultados similares se han observado en el frijol (Phaseolus vulgaris L.) en donde los síntomas iniciales de pudrición de las raíces por F. solani, en este caso F. phaseoli, son la presencia de estrías longitudinales rojizas en el hipocótilo y en la raíz primaria de las plántulas que a medida que la infección avanza, el sistema radicular puede cubrirse de lesiones café rojizas (Naseri, 2008). Similares resultados fueron reportados por Truter & Wehner (2004) en lisianthus (Eustoma grandiflorum (Raf.) Shinn.), una especie ornamental que se cultiva para producir flores de corte o plantas en maceta y que tiene una gran demanda comercial por la variedad de sus colores. Por otra parte, las diferencias observadas en los sitios de infección causadas por cada una de las cepas de F. solani en las plántulas de algodón transgénico Bollgard, nos indica también la presencia de una posible variación en su grado de patogenicidad influenciada por la tolerancia de la planta de algodón a las diferentes cepas del hongo. Lo anterior ha sido sugerido por Snapp, Kirk & Roman-Aviles (2021), quienes observaron la relación entre un menor sitio de daño en el sistema radicular y la tolerancia de las plantas de frijol y tabaco a la infección de F. solani, respectivamente.
Eficiencia fotosintética e índice de verdor en plántulas inoculadas con F. solani
Existen diversos reportes que indican que los procesos fotosintéticos pueden verse alterados de forma significativa cuando las plantas son sometidas a diferentes tipos de estrés bióticos o abióticos (Gonzalez-Mendoza, Espadas y Gil, Escoboza-García, Santamaria & Zapata-Perez, 2013; Michel-López, Espadas-Gil, Fuentes-Ortiz, Santamaria & Gonzalez-Mendoza, 2016). En este sentido, los resultados mostraron que la eficiencia fotosintética (Fv/Fm) de las plantas inoculadas con las diferentes cepas de F. solani fueron significativamente (P ≤ 0.05), menores con respecto al testigo (Figura 5). En el experimento las plantas inoculadas con la cepa T-ICA03 y T- ICA01, presentaron lo siguiente: (a) una clara reducción en la eficiencia fotosintética, la disminución fue de 0.78 hasta 0.64 desde el primer día hasta el último día del experimento. Esto puede deberse a la acción del hongo sobre el sistema vascular de la planta, donde la infección produce una disminución en las tasas de asimilación fotosintética como resultado de un descenso en el contenido de agua foliar y como consecuencia de la baja absorción de agua producida por la presencia del hongo dentro del sistema vascular (Chekali et al., 2011). Este déficit de agua en la planta puede afectar el proceso de fotolisis generando una disminución en el transporte de electrones del fotosistema I (PSI) al fotosistema II (PSII), lo cual también es otro factor que se refleja en un decremento de la capacidad fotosintética de la planta (Yan et al., 2018). Resultados que confirman la sensibilidad del parámetro (Fv/Fm) como un indicador no destructivo para evaluar el daño a nivel de transporte del agua y eficiencia fotosintética (Chang-Hyo, Suk-Min, Seokchan, Young-Joo & Hyeun-Jong, 2012); (b) en cuanto al índice de clorofila en unidades SPAD, los datos mostraron diferencia significativa (P≤0.05) con respecto al testigo desde el tercer día de la evaluación (Figura 6), con valores más bajos cercanos a las 10 unidades SPAD, y también con diferencias significativas respecto a todos los demás tratamientos. Lo anterior puede ser un efecto del patógeno sobre el transporte adecuado de nutrientes que altera la síntesis de clorofila, y un correcto balance NADPH/ATP (Arbona Hossain, López-Climent, Pérez-Clemente & Gómez-Cadenas, 2008). Esto podría afectar la formación de especies reactivas de oxígeno debido al proceso de infección, lo que favorece un estrés oxidativo que daña la capacidad antioxidante y de fotoprotección de la planta (Arbona, Iglesias, Talón & Gómez-Cadenas, 2009). Finalmente, el empleo de ambos parámetros fisiológicos, eficiencia fotosintética y clorofila, son de gran utilidad para el seguimiento del proceso de infección del hongo en las plantas. No obstante, el uso del parámetro de eficiencia fotosintética es más sensible que el parámetro de clorofila al proporcionar una mayor información a nivel de fotosistemas y bioenergético (López-Cuén et al., 2020).
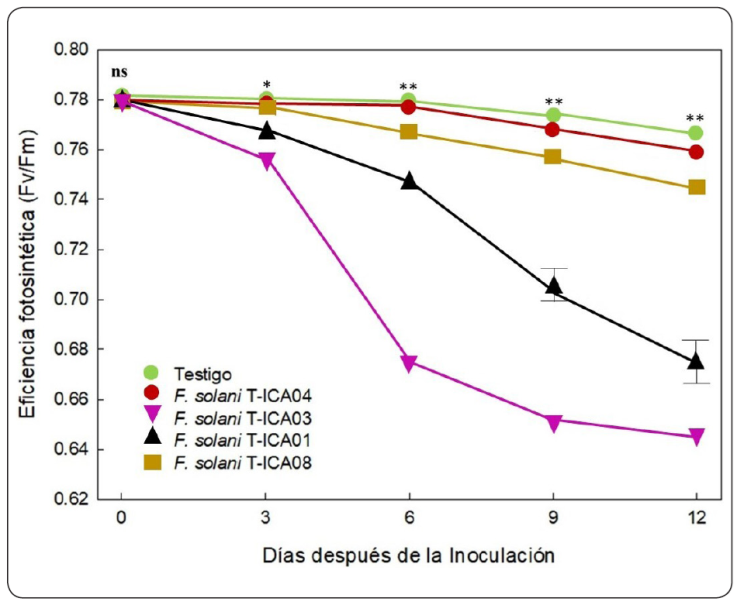
Figura 5 Eficiencia fotoquímica del Fotosistema II en plántulas de algodón transgénico Bollgard inoculadas con cuatro cepas de F. solani durante 12 días después de la inoculación muestreo y un testigo. Cada uno de los símbolos es la media de cuatro repeticiones ± el error estándar (ns, no significativo; *, significativo; **, altamente significativo).
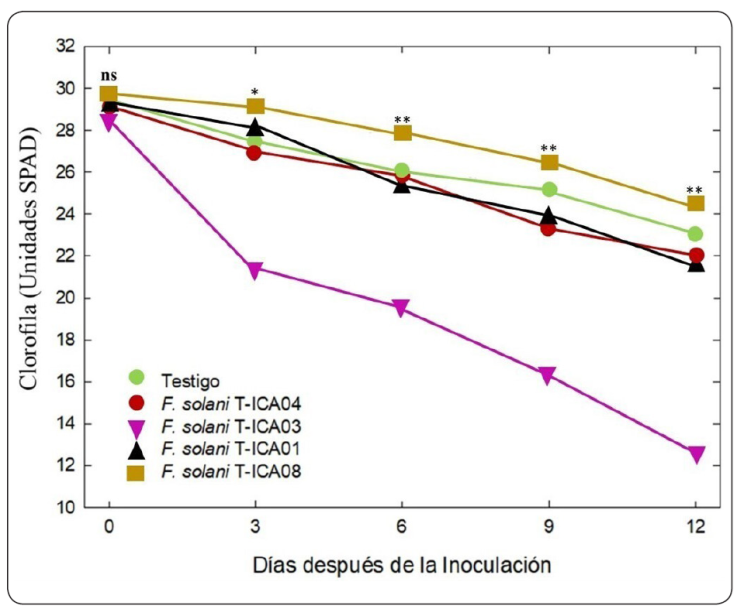
Figura 6 Comportamiento del índice de clorofila para plántulas de algodón transgénico Bollgard inoculadas con cuatro cepas de F. solani para cada día de muestreo y un testigo. Cada uno de los símbolos es la media de 4 repeticiones ± el error estándar (ns, no significativo; *, significativo; **, altamente significativo).
Conclusiones
Los resultados indican que las cepas de Fusarium solani aisladas del cultivo de algodón transgénico del valle de Mexicali en Baja California, presentan una respuesta diferencial al ataque del patógeno. En donde, la cepa de F. solani T-ICA03, fue causante de un mayor daño en las raíces del algodón en comparación con las otras cepas evaluadas. El uso de parámetros fisiológicos como la eficiencia fotosintética y clorofílica, permitieron explicar los posibles efectos de la infección a nivel del transporte de nutrientes y agua que impacta negativamente el sistema fotosintético de la planta. No obstante, debido a su especificidad, se recomienda principalmente el uso de la eficiencia fotosintética como un parámetro no destructivo para evaluar el daño a nivel del fotosistema causado por la infección de F. solani en las plantas de algodón transgénico. Finalmente, futuros estudios deberán encaminarse a determinar a nivel molecular los posibles mecanismos presentes en el proceso de interacción planta-patógeno, del algodón transgénico que se cultiva en México, específicamente en la región noroeste del país.











 text new page (beta)
text new page (beta)