Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
TIP. Revista especializada en ciencias químico-biológicas
Print version ISSN 1405-888X
TIP vol.13 n.1 Ciudad de México 2010
Artículo original
Efecto protector de los polifenoles ante el daño provocado por especies reactivas de oxígeno en maíz (Zea mays L.)
Protective effect of polyphenols against damage from reactive oxygen species in maize (Zea mays L.)
Héctor Urueta-Cuéllar1, Martha Albores2, Raúl Aguilar1 y Estela Sánchez de Jiménez1*
1 Depto. de Bioquímica, Facultad de Química, Edificio E, UNAM. Paseo de la Investigación Científica, Ciudad Universitaria, Coyoacán, C.P. 04510, México, D.F. *E-mail: estelas@servidor.unam.mx
2 Depto. de Química Orgánica, Facultad de Química, Edificio E, UNAM. Paseo de la Investigación Científica, Ciudad Universitaria, Coyoacán, C.P. 04510, México, D.F.
Artículo recibido el 24 de mayo de 2010.
Aceptado el 23 de junio de 2010.
Resumen
Todos los organismos vivos están expuestos a oxidación debida a radicales libres (ROS), producidos por las células a partir de estímulos de agentes ambientales. En el presente trabajo se identifica, mediante estudios de genómica comparativa, la secuencia de bases de la enzima PTEN (Phosphatase and Tensin homolog) ortóloga de maíz (Zea mays L.) conocida por su función relevante en el mantenimiento del estado reducido de las células.
Se encontró que esta enzima contiene las secuencias características del sitio activo de la enzima PTEN de otros eucariontes. Para corroborar la función de PTEN y su sensibilidad a los ROS, se analizó el efecto del agua oxigenada en el proceso de germinación del maíz y el efecto protector de la adición del extracto metanólico de semillas de tamarindo (EMT), con una concentración conocida de antioxidantes polifenólicos. Se demostró la participación de PTEN de maíz en la vía de transducción de señales PI3K-TOR, la cual es activada por la aplicación de insulina analizando su respuesta a esta hormona. Se encontró que tanto la insulina como el peróxido de hidrógeno estimulan en el maíz la síntesis de novo de las proteínas ribosomales, medida por la cantidad de [35S]-metionina incorporada a estas proteínas, además de tener un efecto mitogénico, como se constató midiendo la incorporación de [3H]-timidina en el ADN.
Estos efectos fueron neutralizados por el extracto de tamarindo, dada su capacidad de restaurar la actividad de la fosfatasa PTEN, como se demuestra al determinar la incorporación de [32P]-ortofosfato en los fosfatidilinosítidos PIP3 y PIP2 (fosfoinosítido 3,4,5 trifosfato y fosfoinosítido 4,5 bifosfato).
Los resultados indican que la inhibición de la enzima PTEN por agentes oxidantes puede ser revertida por compuestos polifenólicos como los identificados en extractos de tamarindo (EMT). Así mismo, resaltan la posibilidad de identificar por medio de bioensayos en el maíz, compuestos con alto contenido de polifenoles que permitan ser usados para mantener el estado reducido de los organismos.
Palabras Clave: antioxidante, especies reactivas de oxígeno, proteína cinasa, PTEN, transducción de señales.
Abstract
All living organisms are exposed to lethal oxidative effects from free radicals (ROS) produced in their cells from environmental or internal agents. The present research is concerned with the identification, by data base comparative genomic studies, of the maize (Zea mays L.) orthologue PTEN (Phosphatase and Tensin homolog), a relevant enzyme in maintaining the reduced state of living organisms.
The maize enzyme showed to contain the characteristic PTEN active site nucleotide sequences of other eukaryotes. To corroborate PTEN sensitivity to ROS, the effect of H2O2 was determined on seed germination. The protective antioxidant effect of a methanolic extract from tamarind seeds (EMT), due to its polyphenol concentration, was also determined.
The participation of PTEN in the PI3K-TOR maize pathway, was shown by analysis of its response to insulin, as well as to H2O2. Both compounds stimulated cell growth of germinating seeds, increasing [35S]-methionine incorporation into de novo ribosomal protein synthesis. Furthermore, a mitogenic effect, induced by either of these compounds was made evident by the increment of [3H]-thymidine incorporation into DNA. These effects were avoided by the presence of polyphenolic antioxidants, that restored PTEN activity, as demostrated by measuring [35P]-incorporation into the phosphoinositides PIP3/PIP2 (Phosphatidylinositol 3,4,5-trisphosphate/phosphatidylinositol 4,5-biphosphate) in the analyzed tissues. These results indicate that enzyme PTEN inhibition by ROS might be reversed by polyphenol compounds as those present in EMT. These results strengthen the possibility of identifying, through bioassays in plants, compounds with high polyphenol content that might be used to help on the maintenance of living organisms into a reduced state.
Key Words: antioxidant, ROS, protein kinase, PTEN, signal transduction.
Introducción
La enzima PTEN es una fosfatasa cuyo principal sustrato es el fosfoinosítido PIP3 al que hidroliza para formar PIP2. Su nombre se deriva de su función como supresor _de tumores (phosphatase and tensin, homolog deleted on chromosome 10), ya que es uno de los genes humanos más frecuentemente mutados en varios tipos de cáncer[1,2].
Esta enzima juega un papel central en la ruta de señalización PI3K-TOR en eucariontes[3], donde PIP3 funciona como segundo mensajero para ciertos factores del crecimiento como la insulina, el IGF (factor de crecimiento tipo insulina) y el EGF (factor de crecimiento epidermal). La activación de esta vía genera corriente abajo, efectos antiapoptóticos y de regulación del crecimiento[4,5] (ver diagrama en la Fig. 1).
La proteína PTEN presenta dos dominios en su molécula, el de fosfatasa en la región N-terminal y el dominio C2 en la región C-terminal, ambos son necesarios para la actividad enzimática[3]. Dentro del dominio fosfatasa se encuentra el "p-loop" o sitio catalítico (122-HCKXGKXR-131) característico de la gran familia de las proteínas fosfatasas de residuos de tirosina (PTP's) a la cual pertenece PTEN, siendo los residuos Cys124 y Arg130 claves para su actividad catalítica[4,6,7].
Recientemente se ha demostrado que la exposición de células de diferentes orígenes al H2O2 da como resultado la oxidación de PTEN, ocasionada por la formación de un puente disulfuro entre los residuos Cys124 y Cys71, lo que inhibe temporalmente su actividad, generando un incremento en la concentración de PIP3 y la activación de la vía de transducción de señales PI3K-TOR. Así, aun a bajas concentraciones el H2O2, promueve procesos relacionados con la formación de radicales reactivos de oxígeno (ROS); lo cual provoca un incremento en el crecimiento y la proliferación celular no controlados, que conllevan a la formación de tumores y al cáncer[8].
Esta señal puede ser revertida por antioxidantes[9-13]. En plantas, la enzima PTEN ha sido muy poco estudiada, así como también la vía de transducción de señales PI3K-TOR en la que participa. En el maíz se ha reportado un factor proteico (ZmIGF) de la familia de los "Insulin-like" growth factors (IGFs), el cual favorece la germinación y el crecimiento de ejes embrionarios del maíz, incrementando significativamente la síntesis de proteínas ribosomales[14] y la del ADN[15]. Este proceso depende también de la vía de transducción de señales PI3K-TOR, la cual antagoniza con la acción de PTEN a nivel de los pozos de los fosfolípidos PIP3/PIP2 (ver diagrama en la Fig. 1) en forma similar, a la vía equivalente de mamíferos[16,17].
Los antioxidantes son sustancias que evitan la formación de radicales libres, retardan el inicio o bien disminuyen la velocidad de oxidación en los organismos, evitando por consiguiente la formación de los ROS[18]. Existen diversos antioxidantes que provienen de productos vegetales, entre ellos los polifenoles, que se definen químicamente como sustancias que tienen un anillo aromático con uno o más sustituyentes hidroxilo, incluyendo sus derivados funcionales como ésteres, éteres, glucósidos, etc. Entre los compuestos fenólicos que existen en los materiales vegetales se pueden mencionar la hidroquinona, la vainillina y el ácido gálico, que pueden clasificarse como fenoles simples, o los derivados del ácido hidroxicinámico de los cuales el ácido clorogénico y los flavonoides forman el grupo más importante[18]. En particular, el tamarindo ( Tamarindus indica L.), de la familia Leguminosae, que crece en amplias regiones subtropicales, se ha descrito que contiene abundantes antioxidantes fenólicos, como los polifenoles, en extractos metanólicos del pericarpio, entre los que se ha determinado la presencia de trímeros, tetrámeros, pentámeros y hexámeros de procianidina junto con otros derivados fenólicos[19].
Dada la importancia de estos compuestos antioxidantes en la prevención de la oxidación y el daño a los organismos vivos, se han propuesto probar la bioactividad de dichos antioxidantes en cultivos celulares. Éste es un instrumento que está emergiendo rápidamente en muchos campos de investigación[20], específicamente con el objeto de determinar el efecto antioxidante en tipos particulares de células y su capacidad de absorción de los radicales.
El presente trabajo de investigación tiene como objetivo demostrar la presencia de PTEN en el maíz y su función en relación a mantener bajos los niveles de PIP3 a fin de regular la vía PI3K-TOR. Así mismo, se pretende demostrar el efecto antioxidante de una mezcla polifenólica que permita recuperar in vivo la actividad de PTEN al estar inhibida por ROS.
Material y métodos
Medición del contenido fenólico de extractos de tamarindo: Preparación de extractos de semilla de tamarindo
Ochenta gramos de semillas de tamarindo limpias y secas, obtenidas de 280 g de vainas de tamarindo, se molieron en una licuadora. En un aparato de Soxhlet se desengrasaron las semillas molidas con hexano durante 3 hrs y posteriormente con acetato de etilo hasta que no hubo coloración en el disolvente. A continuación se extrajo el polvo con metanol para obtener los compuestos más polares. Se evaporó el disolvente de los extractos y se determinó el residuo seco de cada uno de ellos.
Se seleccionaron dos métodos para evaluar la capacidad antioxidante de extractos de semilla de tamarindo que son los recomendados actualmente por la AOAC (Association of Official Agricultural Chemists): el método de Folin-Ciocalteu modificado por Singleton y Rosi (1965)[21], y el método de reducción con DPPH[22].
Porcentaje de inhibición del DPPH (2,2-difenil-l-picrilhidracilo) y determinación de la capacidad antioxidante
Se usó la cinética de la reacción de la inhibición de DPPH por el método de Sánchez-Moreno y colaboradores (1998)[23] como sigue: Se preparó una solución molar de 6X10-5 de DPPH (Sigma Aldrich).
Se determinó la absorbancia de la solución a 515 nm, y se siguió por espectrofotometría la desaparición del radical cuando se adicionaron 75 μl de solución de fenoles estándar y/o de extractos de tamarindo.
Las concentraciones de estándares (ácido gálico, ácido ferúlico y BHT (t-2,6-diterbutoxi-4-metilfenol) y los extractos de tamarindo fueron los siguientes: 0.240 mg/ml (que corresponde a una solución de 1.07 mM de BHT), 0.120 mg/ml (0.5 mM de BHT). Las determinaciones se hicieron cada 12 segundos al principio de la reacción y cada minuto al final. Se obtuvo el porcentaje de inhibición usando ácido gálico como patrón como lo recomienda Katalinic (2006)[24]:
% de inhibición = Abst=0 - Abst=13 min / Abst=0 x 100.
Se calculó también la concentración de fenoles que disminuye la concentración inicial de DPPH al 50%, denominada por Sánchez-Moreno como EC50 y el tiempo necesario para llegar a un estado estacionario conocido como TEC50. También se calculó la capacidad antioxidante denominada AE que se define como AE=1/EC50 TEC50.
Medición del contenido fenólico de extractos de tamarindo con el reactivo de Folin-Ciocalteu
Se construyó una curva estándar con diluciones de los estándares BHT, ácido gálico y ácido ferúlico. Se utilizaron diluciones de 0.120 mg, 0.060 mg y 0.012 mg del extracto seco de tamarindo. Se añadieron 2.5 ml de reactivo de Folin-Ciocalteu y 30 ml de agua destilada. Después de 3 minutos se agregó 7.5 ml de carbonato de sodio al 10% y se aforó cada muestra a 50 ml. Se midió la absorbancia a 765 nm, después de 2 hrs de reacción a temperatura ambiente.
Con el método de Singleton y Rosi[21] se midió la actividad de extractos de semilla de tamarindo con diferentes disolventes y se obtuvieron los resultados que se muestran en la Tabla I, comparando la reducción del reactivo con 1 mg de residuos sólidos de extractos de tamarindo con 1 mg de BHT y de ácido ferúlico. Se calculó la actividad reductora de 1 mg de los extractos metanólico (EMT) y de acetato de etilo secos. Se observó que el extracto metanólico tiene una actividad similar a la del ácido ferúlico, pero del orden 10 veces mayor que la del antioxidante comercial.

Los resultados de esta determinación pueden verse en la Tabla I, que muestra la mayor actividad en el extracto metanólico que la del extracto de acetato de etilo, equivalente a la del ácido gálico.
Para esta investigación, se decidió usar el EMT que corresponde a una mezcla de polifenoles para evaluar su efecto como antioxidante en la función de PTEN de maíz, calculando los miliequivalentes de extracto que reaccionarían con un equivalente de H2O2.
Material Biológico
En los experimentos realizados en este trabajo, se utilizaron tanto semillas como ejes embrionarios de maíz (Zea mays L.) cv. Chalqueño. Las semillas se colocaron en agua corriente y en agitación por un par de minutos, posteriormente en un matraz se les adicionó etanol al 70 % durante 5 minutos, se eliminó y enseguida se desinfectaron con hipoclorito de sodio al 5 % durante 5 minutos. Finalmente, se enjuagaron de 3 a 4 veces con agua estéril.
Efecto fisiológico del peróxido de hidrógeno (H2O2) y del EMT
Lotes de 50 semillas desinfectadas se colocaron en charolas de plástico en medio de dos capas de algodón y se embebieron: el lote control únicamente en agua y los demás lotes en peróxido de hidrógeno a diferentes concentraciones. Esto se realizó en presencia y ausencia de EMT 1 mg/ml. El tiempo de incubación fue de 72 hrs a 24 °C ± 2 °C en oscuridad constante. Al final del experimento se determinó la longitud de la raíz y del coleóptilo de las plántulas obtenidas en cada lote.
Incorporación de [35S]-metionina en proteínas de ejes embrionarios de maíz
Semillas desinfectadas de maíz se hicieron germinar y después de 24 hrs los ejes embrionarios se disectaron y se incubaron durante 2 hrs en medio líquido de Murashige-Skoog (MS)[25] (1.5 ml/g de ejes) en oscuridad a 25 ° C ± 2 ° C en presencia de 200 μCi de [35S]-metionina (sp. Act. 43.5 TBq/mmol).
Los ejes se homogenizaron con N2 líquido en cuatro volúmenes de regulador de extracción (50 mM tris-ácido acético, 50 mM KCl, 5 mM acetato de magnesio, 5 mM 2 b-mercaptoetanol, 250 mM sacarosa, todo a pH 8.2) por gramo de muestra. Después de centrifugar a 15 000 rpm (rotor SS-34 de Sorvall) durante 30 minutos a 4 °C, el sobrenadante se colocó sobre un colchón de sacarosa 0.5 M y 0.5 M de KCl en regulador de extracción y se centrifugó a 53 000 rpm (rotor 75 Ti de Beckman) durante 3 hrs.
El botón de ribosomas se resuspendió en un volumen mínimo de regulador A3 (Hepes 20 mM, KOH 20 mM, acetato de magnesio 5 mM, acetato de potasio 125 mM, 2-mercaptoetanol 6 mM a pH=7.6), se añadió acetato de magnesio 1M (décima parte del volumen), dos volúmenes de ácido acético glacial y se dejó con agitación ocasional por lo menos 1 hora en hielo[26].
Posteriormente se centrifugó a 8 000 rpm (rotor SS-34 de Sorvall) durante 15 minutos. El sobrenadante se precipitó con 5 volúmenes de acetona fría durante toda la noche a -20°C y luego se centrifugó a 5 000 rpm, como se realizó anteriormente. Se evaporó la acetona para obtener las proteínas ribosomales.
A partir del sobrenadante obtenido con el gradiente de sacarosa se precipitaron las proteínas citoplásmicas con TCA a una concentración final de 10 %, dejándose toda la noche a 4 °C. Se centrifugaron a 5 000 rpm (rotor SS-34 de Sorvall) durante 15 minutos y se resuspendieron en un volumen mínimo de agua desionizada alcalinizada con KOH.
La marca radioactiva se cuantificó utilizando un contador de centelleo líquido (LS6000IC de Beckman) tanto para las proteínas ribosomales como para las citoplásmicas.
Efecto del H2O2 y del EMT en la síntesis de ADN Incorporación de [3H]-timidina en ejes embrionarios de maíz
Se disectaron los ejes embrionarios de semillas de maíz con 36 hrs de germinación, los cuales después se incubaron durante 18 horas en medio MS (1.5 ml de medio por gramo de tejido) con [3H]-timidina (5 μCi/ml), a 25°C±2°C en oscuridad constante.
Posteriormente se aplicaron los siguientes tratamientos: control (agua), insulina 200 μυ/ml o H2O2 20 nM final. Los ejes embrionarios correspondientes se trataron 30 minutos antes de los tratamientos indicados con EMT 1 mg/ml, y se incubaron a tres diferentes tiempos (15, 30 y 60 min) bajo las mismas condiciones. A continuación se lavaron dos veces con agua desionizada estéril y se prosiguió a la extracción de ADN.
Extracción de ADN a partir de ejes embrionarios
Los ejes embrionarios fueron pulverizados en N2 líquido y tratados con las siguientes soluciones a 65°C: 4 ml/ g de tejido de CTAB /g (CTAB 2% (p/v), Tris-HCl 100mM, pH 8, EDTA 20 mM, pH 8, NaCl 1.4 M) y 0.5 mg/ g de tejido de CTAB/NaCl (2.05g de NaCl en 40 ml de agua y lentamente añadir 5 g de CTAB agitando y calentando, aforar a 50 ml). La muestra se mezcló fuertemente y se incubó a 65°C por una hora con agitación ocasional[27]. Las muestras se extrajeron 2 veces (1:1) con cloroformo/alcohol isoamílico (24:1) centrifugando a 7500 rpm (rotor SS-34 de Sorvall) a 24°C, se recuperó la fase acuosa y se le adicionó 1/10 de volumen de la solución CTAB/ NaCl a 65 °C mezclando por inversión. A la fase acuosa se adicionó 1:1 (v/v) CTAB (CTAB 1% (p/v), Tris-HCL 50mM, pH 8, EDTA 10mM, pH 8) y se mezcló por inversión. Se centrifugó (500 g a 4°C durante 5 min).
Posteriormente se removió el sobrenadante y el ácido nucleico se precipitó añadiendo 0.6 volúmenes de isopropanol. Por último el botón se lavó con etanol al 80 % (centrifugando a 7500 g por 15 min). Se resuspendió el producto en un volumen mínimo de TE (Tris-HCl 10 mM, EDTA 1 mM, a pH:8.0)(0.1-0.5 ml/g de tejido inicial).
Una vez obtenido el ADN, se cuantificó espectrofoto-métricamente a260nm y se determinó la [3H]-timidina incorporada utilizando un contador de centelleo líquido (Beckman).
Efecto del H2O2 y del EMT en la actividad de la ortóloga PTEN en maíz
Incorporación de [32P]-ortofosfato en fosfolípidos de ejes embrionarios de maíz
Se colocaron semillas de maíz y a las 24 hrs de germinación se disectaron los ejes embrionarios, después se incubaron durante 10, 20 y 40 minutos en medio MS (1.5 ml/g) en oscuridad a 25 °C ± 2 °C en presencia de 100 μCi de [32P]-ortofosfato y se aplicaron los siguientes tratamientos: control (agua), H2O2 20 nM, o insulina 200 μU/ml y en presencia o ausencia de EMT 1 mg/ml. Al final se dieron dos lavados con agua desionizada estéril y se prosiguió con la extracción de fosfolípidos los cuales se cuantificaron por medio de un líquido de centelleo a base de tolueno para obtener la radioactividad incorporada.
Obtención de membranas microsomales y extracción de los derivados fosforilados de fosfatidilinositol[28]
Se homogenizaron los ejes embrionarios con regulador (sacarosa 250 mM, EDTA 3 mM, EGTA 2 mM, 2-mercaptoetanol 14 mM, DTT 2 mM, TRIS-HCl 30 mM pH 7.4) en una proporción de 3 volúmenes por gramo de tejido (3 ml/g), agregando 0.1 g de polivinilpirrolidona. El tejido se centrifugó a 5000 g (rotor SS-34 de Sorvall) por 10 min a 4 °C, se desechó la pastilla y el sobrenadante se centrifugó nuevamente a 40 000 g (rotor 60 Ti de Sorvall, Centrífuga Ultra Pro 80 de Sorvall) por 1 hora a 4 °C, para obtener la pastilla de microsomas, la cual se pesó y se resuspendió en el regulador anterior (3 volúmenes/gramo de microsomas).
Se tomaron 100 μ! de microsomas resuspendidos a los cuales se les agregaron 1500 μ de una mezcla fría de cloroformo/metanol (1:2 v/v), se agitó en el vórtex, se colocó en hielo por 30 min aproximadamente y después a 25 °C. Se adicionaron 500 μl de EDTA 100 mM pH 4.4, 500 μl de HCl 2.4 Ny 500 μl de cloroformo, agitando en vórtex después de cada adición. La mezcla se centrifugó a2000 g (rotor SS-34 de Sorvall) por 6 min a 4 °C, la fase inferior fue separada y la fase superior se extrajo dos veces más con 500 μl de cloroformo, separándola por centrifugación. Todas las fases inferiores colectadas se combinaron y se lavaron dos veces con 2 ml de metanol/HCl 1 N (1:1 v/v), centrifugándose a 2000 g (rotor SS-34 de Sorvall) por 6 minutos a 4 °C, el producto se secó y almacenó a -70 °C hasta su utilización.
Cromatografía en capa fina de fosfolípidos[29]
Los fosfolípidos obtenidos de las membranas se solubilizaron en una mezcla de cloroformo/metanol (2:1 v/v). Las muestras se colocaron sobre cromatoplacas de gel de sílice (sílica gel 60 de MERCK) con un espesor de 0.25 mm, pretratadas con una solución de oxalato de potasio al 1% y secadas a 100 °C durante 60 min justo antes de usarlas. La separación se llevó a cabo con una solución de cloroformo/metanol/acetona/ácido acético/ agua (40:14:15:12:7,v/v/v/v/v), durante 2.5 hrs. Los fosfolípidos se revelaron utilizando dos procedimientos: A) La placa se sumergió en ácido fosfomolíbdico (14 ml de H2SO4, 1.25 g de sulfato cérico de amonio y 20 g de ácido fosfomolíbdico aforados a 500 ml, con agua desionizada) durante un minuto y se secó con aire caliente hasta su visualización. B) La placa se expuso a vapores de yodo en una cámara, previamente saturada con vapores de yodo, hasta la visualización de los fosfolípidos.
Resultados
Identificación de PTEN de maíz por homología de bases con la correspondiente enzima de otros organismos
En primer lugar este trabajo se orientó a la búsqueda en maíz de la proteína homóloga de la fosfatasa PTEN y su caracterización. Para lograr este objetivo, y debido a que el genoma de maíz no está totalmente resuelto, se hicieron estudios comparativos de las secuencias de bases de maíz con las secuencias ya existentes de PTEN en arroz (Oryza sativa), ya que el arroz es una especie muy cercana al maíz y su genoma está completamente secuenciado. Con la secuencia de nucleótidos de maíz así obtenida, se hicieron alineamientos tipo "blast" con el genoma de Arabidopsis y de otros organismos eucariontes no fotosintéticos (Fig. 2).
Se encontró una región de 234 aminoácidos en maíz que correspondió a la región N-terminal de la proteína PTEN. Es importante señalar que esta región es característica de todos los miembros de la familia de cinasas PTP, a la que pertenece PTEN[2]. En ella destacan así mismo las dos lisinas críticas para la función de PTEN dentro del asa "P-loop", que corresponden en maíz a la K101 y K104 (Fig. 2A). La comparación en el árbol evolutivo de estos resultados indica que en el maíz existe una proteína PTEN muy semejante a la reportada para otros eucariontes (Fig. 2B).
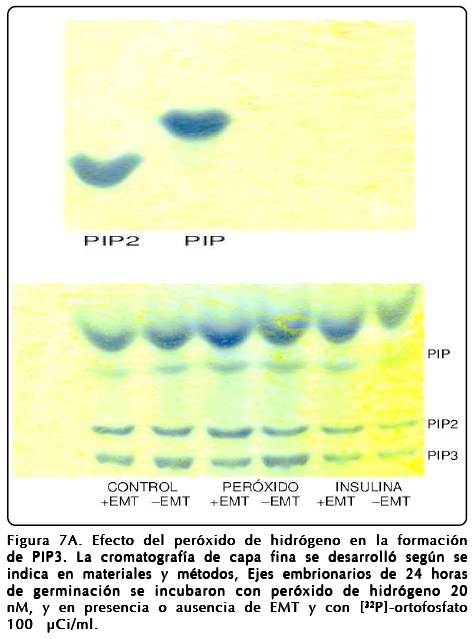
Con el objeto de corroborar la funcionalidad de PTEN y su sensibilidad a los radicales ROS, se diseñaron experimentos a nivel fisiológico y bioquímico que permitieran conocer el efecto que tiene el peróxido de hidrógeno sobre la ruta de transducción de señales PI3K-TOR, ya que el sitio blanco del peróxido de hidrógeno es la fosfatasa PTEN[9]. Para ello se analizaron los compuestos antioxidantes del extracto metanólico de cáscara de tamarindo (EMT)[19] (Fig.3) y se probó posteriormente su capacidad de inhibir los efectos de ROS inducidos por H2O2 en maíz a través de analizar la regulación de la vía PI3K-TOR (ver diagrama en la Fig. 7).

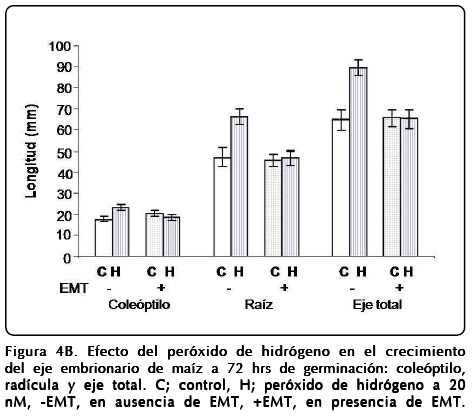
Efecto de H2O2 en el proceso de germinación
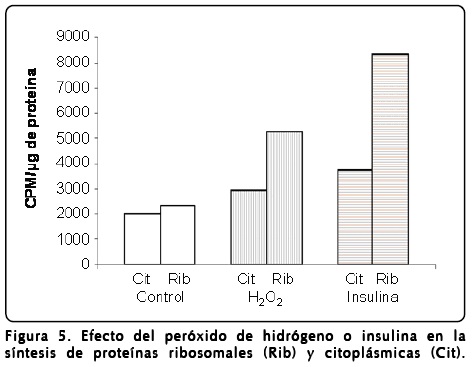
Semillas de maíz germinadas en presencia de H2O2 mostraron diferencias en la velocidad de germinación y crecimiento de los ejes embrionarios, ya que la longitud obtenida de las estructuras, la radícula y el coleóptilo se incrementaron por la presencia del peróxido de hidrógeno (Fig. 4A). En otro grupo de semillas, además de H2O2 se agregó EMT durante la germinación, y se observó inhibición del proceso de crecimiento comparado con la presencia de H2O2 o crecimiento similar al control sin H2O2 y sin EMT (Fig. 4B). Se ha reportado que el crecimiento de los tejidos en germinación va acompañado normalmente por aumento en la biogénesis de los ribosomas[14]. Este proceso es acelerado por factores de crecimiento tipo insulina a través de estimular la vía de transducción de señales llamada PI3K-TOR[15]. Por tanto, a fin de corroborar si el efecto del H2O2 observado en los ejes embrionarios, se correlaciona con la síntesis de proteínas ribosomales, se realizaron experimentos en los que se aplicó [35S]-metionina como precursor de proteínas a los tejidos estimulados por H2O2 o por insulina (Fig. 5).
Los resultados muestran que el peróxido de hidrógeno o la insulina incrementan la incorporación de [35S]-metionina en las proteínas ribosomales, indicando que ambos estímulos generan crecimiento, y a su vez inducen la síntesis de novo de las proteínas ribosomales (Fig. 5). Estos resultados son consistentes en mostrar que el peróxido de hidrógeno estimula procesos que conllevan a incrementar el efecto de la vía de PI3K-TOR.
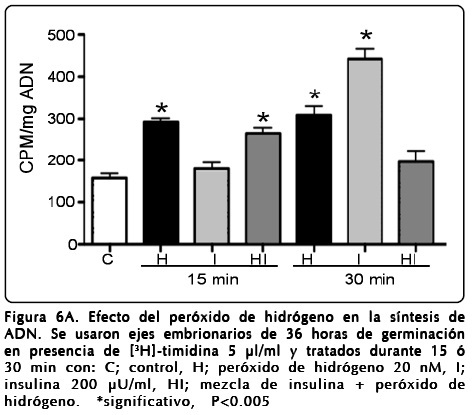
Efecto de H2O2 y EMT en la síntesis de ADN
Es sabido que la insulina e IGFs (insulina-like growth factors), tienen también un efecto mitogénico en células eucariontes[30] y particularmente en maíz[15]. En el presente caso se analizó si el H2O2 también mostraba ese efecto sobre los ejes embrionarios de maíz germinado. En la figura 6A se muestran los resultados de estos experimentos, en donde se aplicó como precursor [3H]-timidina para marcar el ADN sintetizado de novo. Como puede observarse, en ambos casos tanto con insulina como con H2O2, hubo incrementos significativos sobre todo a 30 minutos (P<0.0005) en la incorporación de [3H]-timidina al ADN, por arriba del control (2 y 2.6 veces para H2O2 e insulina, respectivamente). Estos resultados sugieren que la acción del H2O2 genera inhibición de la actividad de PTEN[31], por la formación ROS, generando así un efecto mitogénico en los tejidos.
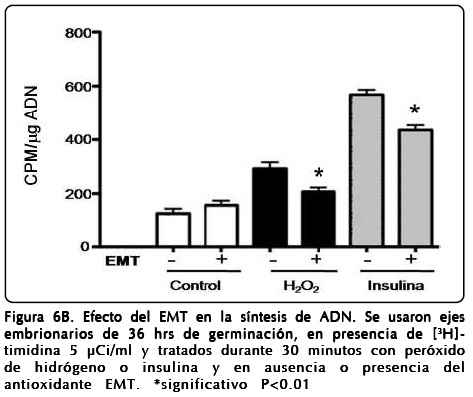
Para confirmar esta sugerencia se consideró de importancia probar la capacidad antioxidante del extracto de EMT para revertir estos efectos por acción antioxidante, con base en la mezcla de polifenoles que contiene[32]. Así, se realizaron experimentos en presencia de EMT y se encontró que los polifenoles contenidos en EMT inhiben significativamente el efecto mitogénico inducido por el H2O2 o por insulina en los ejes embrionarios de maíz (Fig. 6B).
Inhibición de la fosfatasa PTEN
Para comprobar que los efectos observados por el H2O2 se deben realmente a la inhibición de la actividad de la fosfatasa PTEN, se midió directamente el efecto del H2O2 en la actividad de la enzima PTEN. Dado que la función de PTEN corresponde a la defosforilación de PIP3 para convertirlo en PIP2, se midió la incorporación de [32P]-ortofosfato tanto en el sustrato como en el producto de PTEN en condiciones de estimulación con H2O2 o insulina. Los resultados de estos experimentos, después de llevar a cabo la separación de los compuestos producidos por cromatografía en capa fina (Fig. 7A) y la medida de la radiactividad incorporada en ellos (Fig. 7B), muestran la inhibición de la actividad de PTEN y como consecuencia la acumulación de PIP3 al tratar los ejes con peróxido de hidrógeno. En el caso de la insulina, su estímulo provoca un incremento en la PI3-Kinasa generando también una acumulación de PIP3. Por otra parte el tratamiento de los ejes con el antioxidante EMT anuló el efecto del H2O2 regresando los valores de PIP3 a los de nivel del control (Fig. 7B).

Discusión
Como ya se ha comprobado, la generación de ROS en células vegetales tiene efectos diferenciales[33]: con altas concentraciones de estas moléculas se pueden ocasionar daños oxidativos extensos, pero a bajos niveles, funcionan como moléculas de señalización en rutas de transducción de señales. Sin embargo, la señalización prolongada de alguna de estas vías puede desregular procesos celulares básicos como la división celular, lo cual genera trastornos tan importantes y peligrosos como el cáncer[34].
Los resultados obtenidos en esta investigación indican que el peróxido de hidrógeno a baja concentración tiene un efecto activador de la ruta de transducción de señales PI3K-TOR (Fig. 1). Esto lo observamos tanto a nivel fisiológico como bioquímico; medido como el incremento en el crecimiento de los ejes y en la síntesis de proteínas ribosomales y de ADN (Figs.4-6). Goldstein y colaboradores[31], mencionan que el peróxido de hidrógeno puede facilitar o mimetizar la acción mitogénica de la insulina en mamíferos. En efecto, en este modelo de maíz se ha demostrado que la insulina induce la síntesis de novo de ADN (Fig. 6), así como la división celular[15]. Más aún, otros reportes indican que el peróxido de hidrógeno se genera en respuesta a la estimulación con insulina sirviendo como un segundo mensajero en la cascada de señalización de ésta (Fig. 1)[35]. El blanco mejor caracterizado de ROS son las proteínas fosfatasas de tirosina (PTP's), entre ellas PTEN[9,11]. Es así que las PTP's, normalmente sirven como reguladores negativos de la acción de la insulina puesto que las ROS pueden rápidamente oxidar el residuo de cisteína del sitio catalítico de las PTP bloqueando efectivamente su actividad enzimática y estimulando el efecto por la señalización de la insulina[6].
Los resultados comprueban que los efectos del H2O2 observados, tanto a nivel fisiológico como bioquímico (Figs. 4 y 7), son ocasionados por la inactivación momentánea de la enzima PTEN cuyo sustrato es PIP3 el cual se incrementa y desencadena los efectos de la vía PI3K-TOR. Esta inactivación es temporal, ya que las células presentan un sistema para revertir este proceso o también para destruir el H2O2, por medio de una serie de enzimas como las catalasas, peroxidasas, dismutasas de superóxido y S-transferasas de glutatión (GST)[35]. De aquí la relevancia de mantener el estado reducido de las células.
Para que haya actividad de PTEN, es importante localizar antioxidantes que puedan coadyuvar a la protección celular manteniendo el estado reducido. En este trabajo se usó EMT (extracto metanólico de tamarindo) como agente reductor, ya que se conoce que el extracto de tamarindo presenta una gran cantidad de polifenoles (Fig. 3A), los cuales tienen gran actividad antioxidante[19,36].
Más aún, se demostró que la acción de EMT revierte la velocidad de la síntesis de ADN (Fig. 5B) muy probablemente empleando el mecanismo de protección de la oxidación de PTEN. Esto es apoyado por los resultados que muestran la reversión en la concentración de PIP3 por acción de EMT (Fig. 7).
Estos resultados resaltan la importancia de compuestos como el EMT, capaces de proteger a las células de la producción de radicales ROS, y con ello evitar anomalías en la regulación del ciclo de división celular, por las nefastas consecuencias que esto conlleva para los organismos, particularmente para el ser humano.
Conclusiones
Se demuestra que en plantas, particularmente en maíz, existe una proteína homóloga a la PTEN de otros organismos no-fotosintéticos (Fig. 2). Esta enzima desarrolla la misma función de fosfatasa convirtiendo PIP3 a PIP2 (Fig. 7) y protegiendo a las células de ROS.
El H2O2 así como la insulina inducen la acción mitogénica en las células de maíz a través de producir ROS, por lo que elevan la síntesis de novo de ADN (Fig. 6).
La producción de ROS por exposición de las células de maíz al H2O2, genera efectos inductores del crecimiento y la división celular, como en organismos eucariontes animales[31]. El apagamiento de esta activación por oxidación es logrado por EMT, una mezcla de compuestos polifenólicos que mantiene el estado reducido de las células a través de un mecanismo que involucra la restitución de la actividad de PTEN.
Agradecimientos
Este proyecto fue apoyado por los proyectos DGAPA IN206207-2008 y Facultad de Química PAIP 6290-10, ambos de la Universidad Nacional Autónoma de México.
Referencias
1. Di Cristofano, A. & Pandolfi, P.P. The multiple roles of PTEN in tumor suppression. Cell 100, 387-390 (2000). [ Links ]
2. Chagpar, R.B. et al. Direct positive regulation of PTEN by the p85 subunit of phosphatidylinositol 3-kinase. PNAS 107, 5471-5476 (2010). [ Links ]
3. Courtney, K.D., Corcoran, R.B. & Engelman, J.A. The P13K Pathway As Drug Target in Human Cancer. Journal of Clinical Oncology 28, 1075-1083 (2010). [ Links ]
4. Pagliarini, D.J., Worby, C.A. & Dixon, J.E. A PTEN-like phosphatase with a novel substrate specificity. J. Biol. Chem. 279(37), 38590-38596 (2004). [ Links ]
5. Waite, K.A. & Eng, C. Protean PTEN: form and function. Am. J. Hum. Genet. 70, 829-844 (2002). [ Links ]
6. Downes, C.P. et al. Acute regulation of the tumour suppressor phosphatase, PTEN, by anionic lipids and reactive oxygen species. Biochem. Soc. Trans. 32, 338-342 (2004). [ Links ]
7. Yin, Y. & Shen, W.H. PTEN: a new guardian of the genome. Oncogene 27(41), 5443-5453(2008). [ Links ]
8. Veal, E.A., Day, A.M. & Morgan, B.A. Hydrogen peroxide sensing and signaling. Mol. Cell 26, 1-14 (2007). [ Links ]
9. Lee, S.R. et al. Reversible inactivation of the tumor suppressor PTEN by H2O2. J. Biol. Chem. 277, 20336-20342 (2002). [ Links ]
10. Cho, S. H. et al. Redox regulation of PTEN and protein tyrosine phosphatases in H(2)O(2) mediated cell signaling. FEBS Lett. 560, 7-13 (2004). [ Links ]
11. Kwon, J. et al. Reversible oxidation and inactivation of the tumor suppressor PTEN in cells stimulated with peptide growth factors. Proc. Natl. Acad. Sci. USA 101, 16419-16424 (2004). [ Links ]
12. Hay, N. The Akt-mTOR tango its relevance to cancer. Cancer Cell 83, 179-183 Review (2005). [ Links ]
13. Tonks, N.K. Redox redux: revisiting PTPs and the control of cell signaling. Cell 121(5), 667-670 (2005). [ Links ]
14. García Flores, C. et al. A maize insulin-like growth factor signals to a transduction pathway that regulates protein synthesis in maize. Biochem. J. 358, 95-100 (2001). [ Links ]
15. Dinkova, T.D. et al. Dissecting the TOR-S6K signal transduction pathway in maize seedlings: relevante on cell growth regulation. Physiologia Plantarum 130, 1-10 (2007). [ Links ]
16. Reyes de la Cruz, H., Aguilar, R. & Sánchez de Jiménez, E. Functional characterization of a maize ribosomal S6 protein kinase (ZmS6K), plant ortholog of metazoan p70S6K. Biochemistry 43(2), 533-539 (2004). [ Links ]
17. Agredano Moreno, L.T., Reyes de la Cruz, H., Martínez Castilla, L.P. & Sánchez de Jiménez, E. Distinctive expression and functional regulation of the maize (Zea mays L.). TOR Kinase Ortholog. Mol. Biosyst. 3(11), 794-802 (2007). [ Links ]
18. Ho, C.T. & Lee, C.Y. Phenolic Compounds in Food and their effects on Healt II (ACS Symposium Series 507) 2-7 (American Chemical Society, Washington, DC, 1992). [ Links ]
19. Sudjaroen, Y.Y. et al. Isolation and structure elucidation of phenolic antioxidants from Tamarind ( Tamarindus indica L.) seeds and pericarp. Food Chem. Toxicol. 43, 1673-1682 (2005). [ Links ]
20. Finley, J.W. Introduction: White papers from the "First International Congress on Antioxidant Methods". Journal of Agricultural and Food Chemistry 53(10), 4288-4289 (2005). [ Links ]
21. Singleton, V.L. & Rosi, J.A. Colorimetry of total phenolics with phosphomolibdic phosphotungstic acid reagents. Am. J. Enol. Vitic. 16, 144-158 (1965). [ Links ]
22. Brand Williams, W., Cuvelier, M.E. & Berset, C. LWT. Use of a free radical method to evaluate antioxidant activity. Food Science and Technology 28(1), 25-30 (1995). [ Links ]
23. Sánchez-Moreno, C., Larrauri, J.A. & Saura-Calixto, F. A procedure to measure the antirradical efficiency ofpolyphenols. J. Science of Food and Agriculture 76, 270-276(1998). [ Links ]
24. Katalinic, V., Milos, M., Kulisic, M. & Jukic, M. Screening of 70 medicinal plant extract for antioxidant capacity and total phenols. Food Chemistry 94, 550-557 (2006). [ Links ]
25. Murashige, T. & Skoog, C. A revised medium for rapid growth and bio assag with tobacco cultures. Physiol. Plant 15, 473-497 (1962). [ Links ]
26. Fehling, E. & Weidner, M. Adaptative Potential of Wheat Ribosomes toward Heat Depends on the Large Ribosomal Subunit and ribosomal Protein Phosphorylation. Plant Physiol. 87(3), 562-565 (1988). [ Links ]
27. Murray, M.G. & Thompson, W.F. Rapid isolation of high-molecular weight plant DNA. Noc. Acids. Res. 8, 4321-4325 (1980). [ Links ]
28. Cho, M.H. & Boss, W.F. Transmembrane signaling and phosphoinositides. Methods Cell Biol. 49, 43-54 (1995). [ Links ]
29. Racagni-Di Palma, G. & Brito-Argaez, L. Phosphorylation of signaling phospholipids in Coffea arabica cell. Plant Physiol. Biochem. 40, 899-906 (2002). [ Links ]
30. Coolican, S.A., Samuel, D.S., Ewton, D.Z., McWade, F.J. & Florini, J.R. The mitogenic and myogenic actions of insulin-like growth factors utilize distinct signaling pathways. J. Biol. Chem. 272(10), 6653-6662 (1997). [ Links ]
31. Goldstein, B.J., Mahadev, K., Wu, X., Zhu, L. & Motoshima, H. Role of insulin-induced reactive oxygen species in the insulin signaling pathway. Antioxid Redox Signal 7, 1021-1031 (2005). [ Links ]
32. Tsuda, Y., Watanabe, M., Oshima, K., Yamamoto, A., Kawasishi, S. & Osawa, T. Antioxidative components osilated from the seed of Tamarind (Tamarindus indica L). J. A. and Rood Chem. 42, 2671-2674 (1994). [ Links ]
33. del Río, L.A., Sandalio, L.M., Corpas, F.J., Palma, J.M. & Barroso J.B. Reactive oxygen species and reactive nitrogen species in peroxisomes. Production, scavenging, and role in cell signaling. Plant Physiol. 141(2), 330-335 (2006). [ Links ]
34. Valco, M., Rhodes, C., Moncol, J., Izakovic, M. & Manzur, M. Free radicals, metals and antioxidants in oxidative stress-induced cancer. Chem. Biol. 160, 1-40 (2006). [ Links ]
35. May, J.M. & de Haën C. Insulin-stimulated intracellular hydrogen peroxide production in rat epididymal fat cells. J. Biol. Chem. 254, 2214-2220 (1979). [ Links ]
36. Scandalios, J.G. Oxidative stress: molecular perception and transduction of signals triggering antioxidant gene defenses. Braz. J. Med. Res. 38(7), 995-1014 (2005). [ Links ]
Información sobre los autores
Héctor Urueta-Cuéllar
Héctor Urueta-Cuéllar estudió la Licenciatura en Biología en la Escuela Nacional de Ciencias Biológicas del IPN, la Maestría en Ciencias Bioquímicas en la UNAM y actualmente es Candidato a Doctor en Ciencias Bioquímicas por la UNAM.
Como docente ha impartido cursos en la Asociación Mexicana de Genética Humana. A.C. y en la Facultad de Química, UNAM. Ha participado como ponente en varios congresos y asistido a varias reuniones científicas.
Su área de interés es la relacionada con ciencias biológicas y de la salud. Ha sido becado por el CONACyT y el IPN.
Martha Albores
Martha Albores estudió la Licenciatura en Química en la Escuela Nacional de Ciencias Químicas, UNAM, el Doctorado en Ciencias Químicas (Química Orgánica) en la Facultad de Química. UNAM y 3 Posdoctorados en: Wye College, London University; Institut fur Organische Chemie. Universität Eiiangen-Nürmberg y Borstel Research Institut.
Ha sido distinguida con el premio Catedrático UNAM 2000. Ha dirigido 29 tesis de licenciatura, 5 tesis de maestría y una de doctorado. Ha publicado 39 artículos en revistas indexadas y en la Polymerie Materials Encyclopedia.
Actualmente es Profesora de Tiempo Completo Titular "C" en la Facultad de Química. UNAM.
Raúl Aguilar
Raúl Aguilar estudió la Licenciatura en Ingeniería Bioquímica en la Escuela Nacional de Ciencias Biológicas, IPN y la Maestría en Ciencias Químicas (Orientación Bioquímica) en la Facultad de Química. UNAM.
Fue Investigador Nacional Nivel I en el 2001.
Es docente en las carreras de Químico Farmacéutico Biólogo y Químico de Alimentos en la Facultad de Química de la UNAM. Ha sido asesor y supervisor de tesis de licenciatura. Ha participado como ponente en diversos congresos. Cuenta con 22 publicaciones internacionales arbitradas y 2 nacionales. Ha sido jurado de exámenes profesionales y evaluador de proyectos del CONACyT.
Estela Sánchez de Jiménez
Estela Sánchez de Jiménez estudió la Licenciatura de Químico Farmacéutico Biólogo en la Facultad de Química, UNAM; la Maestría en Bioquímica en el Instituto Nacional de la Nutrición; el Doctorado en Bioquímica en la Universidad de Wisconsin, Madison, USA y el Posdoctorado en Biología Molecular también en la Universidad de Wisconsin.
Su área de investigación es la regulación de la expresión genética en plantas superiores, el mecanismo de control traduccional y los parámetros bioquímicos de productividad.
Es Profesora Emérita, UNAM; Profesor-Investigador Titular "C" de tiempo completo, con categoría "D" en el PRIDE, Investigador Nacional Nivel III, área 2 en el SNI e Investigador Nacional Emérito.
Es docente a nivel licenciatura y posgrado.
Ha dirigido 68 tesis de licenciatura, 31 de maestría y 20 de doctorado. Ha realizado varias estancias sabáticas a nivel nacional e internacional como profesora visitante.
Ha publicado 97 artículos en revistas internacionales arbitradas, 18 en revistas nacionales arbitradas, 32 artículos de divulgación y 2 patentes.
Ha recibido varios premios, entre ellos el Rockefeller Fellowship; NIH Fellowship; ASPP Corresponding Member Award, The American Society of Plant Physiologists y a nivel nacional ha sido distinguida con el Premio Nacional de Química "Andrés del Río"; el de la Academia Nacional de la Investigación Científica: Profesor Emérito, UNAM e Investigador Nacional Emérito, SNI.














