Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Agrociencia
On-line version ISSN 2521-9766Print version ISSN 1405-3195
Agrociencia vol.52 n.4 Texcoco May./Jun. 2018
Ciencia de los Alimentos
Calidad nutricional de los tipos de faseolinas y morfotipos del frijol ejotero (Phaseolus vulgaris L.)
1 University of Zagreb, Faculty of Agriculture, Department of Seed Science and Technology, Svetošimunska cesta 25, HR-10000 Zagreb, Croatia; (kcarovic@agr.hr)
2 Centre of Excellence for Biodiversity and Molecular Plant Breeding, Svetošimunska 25, HR-10000 Zagreb, Croatia
3 University of Zagreb, Faculty of Agriculture, Department of Animal Nutrition, University of Zagreb, Svetošimunska cesta 25, HR-10000 Zagreb, Croatia; (jpintar@agr.hr); (dbedekovic@agr.hr)
4 University of Zagreb, Faculty of Science, Department of Botany, Marulićev Trg 20/II, HR-10000 Zagreb, Croatia; (zliber@botanic.hr); (ivanrad@biol.pmf.hr)
5 Josip Juraj Strossmayer University of Osijek, Faculty of Agriculture in Osijek, Kralja Petra Svačića 1d, HR-31000 Osijek, Croatia; (suncica.guberac@pfos.hr)
6 University of Zagreb, Faculty of Agriculture, Department of Management and Rural Entrepreneurship, Svetošimunska cesta 25, HR-10000 Zagreb, Croatia; (vocic@agr.hr)
7 University of Zagreb, Faculty of Agriculture, Department of Plant Nutrition, Svetošimunska cesta 25, HR-10000 Zagreb, Croatia, (blazarevic@agr.hr)
La larga tradición del cultivo del frijol ejotero (Phaseolus vulgaris L.) en Croacia ha tenido como resultado el desarrollo de variedades locales adaptadas a áreas específicas y elegidas para satisfacer diferentes hábitos alimenticios. La hipótesis de nuestro estudio fue que la calidad nutricional (contenido de proteínas, azúcares, fibras, calcio, potasio y fósforo en vainas frescas) de 14 muestras de frijol ejotero croata cultivadas ampliamente se vieron afectadas por el origen y el morfotipo. Las muestras analizadas se cultivaron en parcelas de campo no replicadas, donde se clasificaron los morfotipos. El conjunto de genes de adscripción (andino vs. mesoamericano) de cada muestra se determinó con el marcador de faseolina, mientras que los rasgos de calidad nutricional se analizaron de acuerdo con los métodos analíticos estándares. Las relaciones entre las características de calidad nutricional de las vainas frescas se evaluaron mediante el coeficiente de correlación de Pearson. El ANDEVA univariante y una prueba Tukey post hoc (p ≤ 0.05) se llevaron a cabo para cada característica con el objeto de comparar los valores entre las muestras. Las muestras se agruparon según el tipo de faseolina (I, II ó III) y las características morfológicas (hábito de crecimiento, color y ancho de la vaina). Hubo cuatro muestras que tuvieron la faseolina tipo I ("S") predominante en Mesoamérica, mientras que las demás muestras pertenecen al conjunto de genes andinos caracterizado por la faseolina tipo II ("H" o "C") o III ("T"). Entre las muestras agrupadas por el tipo de faseolina se encontraron diferencias significativas en todas las características de calidad nutricional. Las muestras de la reserva genética mesoamericana tuvieron mayor contenido de materia seca y de proteína cruda de las vainas frescas, mientras que las del grupo de genes andinos tuvieron un contenido total de azúcares más alto. Las muestras de hábito de crecimiento indeterminado tuvieron mayor materia seca y contenido de proteína cruda, así como también contenido de fósforo y potasio que las determinadas, pero registraron un contenido total de azúcar y calcio más bajo. Las muestras excepcionales: S538, S541, S506 y S545 podrían utilizarse como valiosas fuentes de nutrientes bioactivos en futuros programas de mejoramiento.
Palabras clave: proteína cruda; grupo genético; hábito de crecimiento; alimento funcional; fósforo; potasio
The long tradition of green bean (Phaseolus vulgaris L.) cultivation in Croatia has resulted in the development of a landraces adapted to specific areas and chosen to suit different dietary habits. The hypothesis of our study was that nutritional quality (content of proteins, sugars, fibres, calcium, potassium and phosphorus in fresh pods) of 14 widely grown Croatian green bean accessions is affected by origin and morphotype. The analysed accessions were grown in non-replicated field plots where morphotypes were classified. The gene pool of adscription (Andean vs. Mesoamerican) of each accession was determined with the phaseolin marker, whereas nutritional quality traits were analysed according to standard analytical methods. The relationships among nutritional quality traits of fresh pods were assessed by Pearson's correlation coefficient. The univariate ANOVA and a post hoc Tukey test (p ( 0.05) were carried out for each trait to compare the values among accessions. Accessions were grouped according to phaseolin type (I, II or III) and morphological traits (growth habit, pod colour and width). Four accessions had phaseolin type I ("S") predominant in the Mesoamerican while the rest of accessions belong to the Andean gene pool characterized by the phaseolin type II ("H" or "C") or III ("T"). Significant differences among accessions grouped by phaseolin type were found in all nutritional quality traits. The accessions of the Mesoamerican gene pool had higher dry matter content and crude protein content of fresh pods, while those of the Andean gene pool had higher total sugars content. Accessions of indeterminate growth habit had higher dry matter and crude protein content as well as phosphorus and potassium content than determinate ones, but display lower total sugar and calcium content. Outstanding accessions: S538, S541, S506 and S545 could be used as valuable sources of bioactive nutrients in future breeding programs.
Key words: crude protein; gene pool; growth habit; functional food; phosphorus; potassium
Introducción
Los consumidores están cada vez más interesados en los beneficios para la salud de los alimentos que van más allá de las necesidades nutricionales básicas. El valor nutricional de las legumbres gana interés en los países desarrollados debido a la creciente demanda de alimentos funcionales. Los frijoles ejoteros (Phaseolus vulgaris L.) se cultivan, distribuyen y utilizan en dietas en todo el mundo (Khatun et al., 2007).
Los frijoles ejoteros tienen dos hábitos de crecimiento: frijoles indeterminados (trepadores o de postes) y frijoles determinados (enanos o arbustos). El color de la vaina es verde, amarillo o morado (Singh y Singh, 2015), mientras que su forma varía desde el delgado "filete" hasta el ancho "romano". Las vainas son ricas en proteínas, carbohidratos, fibra dietética, minerales, vitaminas y fitoquímicos antioxidantes (Lim, 2012). Los frijoles ejoteros se pueden preparar al vapor, hervidos, salteados u horneados, y a diferencia de la mayoría de los vegetales, retienen la actividad antioxidante después de pasar por casi todas las recetas de cocina (Jiménez-Monreal et al., 2009). Las vainas se cosechan inmaduras, generalmente de 12 a 14 d después de que se abren las primeras flores (Lim, 2012). Las vainas inmaduras se comercializan frescas, congeladas o enlatadas, enteras o cortadas a la francesa (Duke, 1981).
La domesticación del frijol común se produjo de forma independiente en Mesoamérica y la región andina de América del Sur (Kaplan y Lynch, 1999) y dio lugar a dos grupos principales de genes dentro de las formas cultivadas (Gepts, 1988); luego, los cultivares mesoamericanos y andinos se difundieron en todo el mundo. La distribución relativa de cada grupo genético varía de una región a otra (Gepts, 1988). La larga tradición del cultivo del frijol ejotero en Croacia ha significado el desarrollo de un gran número de variedades locales adaptadas a áreas específicas, y elegidas para satisfacer diferentes hábitos alimenticios (Čupić et al., 2012). Las variedades criollas tradicionales son una fuente importante de germoplasma para los fitomejoradores; tienen una variación genética considerable y muestran una gran adaptabilidad a diferentes condiciones ambientales (Informe de la FAO, 2008).
La composición de nutrientes varía entre los frijoles ejoteros y se debe al genotipo, las condiciones de crecimiento y la etapa de madurez en la cosecha (Kelly y Scott, 1992; Jakopic et al., 2013; Selan et al., 2014). Por lo tanto, la hipótesis de nuestro estudio es que hay diferencias significativas en la calidad nutricional entre las variedades locales tradicionales de frijol ejotero en Croacia y esas diferencias podrían estar relacionadas con el conjunto de genes y/o las diferencias de los morfotipos. Además, el objetivo fue evaluar el valor nutricional de las variedades locales más importantes del frijol ejotero croata, como también el efecto del origen y el morfotipo en el contenido de proteínas, azúcares, fibras, calcio, potasio y fósforo en las vainas de frijoles ejoteros frescos.
Materiales y Métodos
Materia vegetal y determinación del morfotipo
Nuestra investigación abarcó 14 muestras de variedades locales de frijol ejotero procedentes de diversas regiones geográficas de Croacia (Cuadro 1). Las muestras se cultivaron en parcelas de campo no replicadas, en un campo experimental en Maksimir, Zagreb. Las semillas se plantaron el 6 de mayo de 2014. Antes de la siembra se sembraron 350 kg ha-1 de N:P:K (7:20:30). Durante el proceso de cultivo, hicimos desmalezamiento con máquinas. El período de cultivo se caracterizó por una distribución suficiente y adecuada de precipitaciones (145 mm, 145.4 mm, 157.8 mm y 115.2 mm en mayo, junio, julio y agosto, respectivamente); por lo tanto, no hubo necesidad de riego. Las temperaturas medias mensuales durante el período de crecimiento, mayo, junio, julio y agosto, fueron de 16.2, 20.3, 22.4 y 19.2ᵒ C, respectivamente.
Cuadro 1 Accesiones utilizadas en el estudio con su correspondiente tipo de faseolina y morfotipo.
| Number | Accession | Origin (County) |
Phaseolin type† |
Morphotype | ||
| Habit | Pod colour | Pod width | ||||
| 1 | S501 | Dubrovnik | I | Indeterminate | Green | Wide |
| 2 | S506 | Varaždin | I | Indeterminate | Yellow | Thin |
| 3 | S507 | Varaždin | II | Indeterminate | Green | Wide |
| 4 | S508 | Dubrovnik | III | Determinate | Green | Wide |
| 5 | S509 | Varaždin | II | Indeterminate | Yellow | Thin |
| 6 | S518 | Krapina | I | Determinate | Yellow | Thin |
| 7 | S525 | Krapina | II | Indeterminate | Yellow | Wide |
| 8 | S526 | Gorski Kotar | III | Determinate | Yellow | Thin |
| 9 | S538 | Koprivnica | I | Indeterminate | Green | Wide |
| 10 | S541 | Zagreb | II | Indeterminate | Yellow | Wide |
| 11 | S542 | Zagreb | III | Determinate | Yellow | Thin |
| 12 | S543 | Karlovac | III | Determinate | Yellow | Wide |
| 13 | S544 | Zadar | III | Determinate | Green | Thin |
| 14 | S545 | Zadar | III | Indeterminate | Green | Thin |
Tipos de Faseolina: I - Tipo “S” mesoamericano, II - tipo “H” o “C” andino, III - tipo “T” andino.
Los morfotipos de 14 muestras se clasificaron según tres características morfológicas (hábito de crecimiento, color de la vaina y ancho de la vaina), lo que requirió que se puntuaran según la lista de descriptores del frijol común utilizada en la base de datos de Phaseolus (http://www.genbank.at/en/ecpgr-phaseolus.html).
Tipos de faseolina
Se extrajeron los ADN genómicos totales de 25 mg de hojas secas de gel de sílice de cada muestra utilizando el mini kit DNeasy Plant (Qiagen, Valencia, California, EE. UU.). La amplificación de faseolina por PCR combinó los iniciadores de PCR desarrollados por Kami et al. (1995) y un enfoque de cebador PCR de cola (Schuelke, 2000). Los 20 μL de la mezcla de PCR contenían el cebador M13 inverso (5'-GCTCAGTTCCTCAATCTGTTC-3') y FAM etiquetado como iniciador M13 (5'-TGTAAAACGACGGCCAGT-3), cada uno de 8 pmol, 2 pmol del iniciador directo de cola (5'-TGTAAAACGACGGCCAGTAGCATATTCTAGAGGCCTCC- 3'), 1 x amortiguador de PCR, dNTP 0.2 mM, 1 U ADN polimerasa Hot Start TaKaRa Taq ™ (Takara Bio Inc., Otsu, Japón) y 5 ng de ADN de molde. Un protocolo de PCR de dos pasos se utilizó con un ciclo de toma de contacto inicial (94 ° C durante 5 min, 5 ciclos de 45 s a 94 ° C, 30 s a 60 ° C, que se redujo en 1 ° C en cada ciclo, y 90 s a 72 ° C, 25 ciclos de 45 s a 94 ° C, 30 s a 55 ° C, y 90 s a 72 ° C, y el siguiente paso de 8 min a 72 ° C) (Radosavljević et al., 2011). Los productos de PCR se detectaron en un analizador de ADN ABI 3730xL (Applied Biosystems, Foster City, CA, EUA) por el servicio Macrogen DNA (Seúl, Corea del Sur) y se analizaron utilizando el programa informático GeneMapper 4.0 (Applied Biosystems, Foster City, CA, EUA)
Calidad nutricional
Siete características de calidad nutricional se determinaron en muestras de vainas cosechadas antes de que estuvieran completamente maduras, de 12 a 14 d después de que las flores se abrieran según el genotipo y las condiciones climáticas (Lim, 2012). El contenido de materia seca se determinó secando las muestras de la vaina en un horno con aire a 70 ° C hasta obtener una masa constante. Las muestras secas se trituraron y homogeneizaron usando un molinillo de muestra (IKA® Werke M 20). El contenido total de N se determinó usando el procedimiento de Kjeldahl después de la descomposición del material vegetal a 420 °C en presencia de ácido sulfúrico (AOAC, 1995). El contenido de proteína cruda se estimó multiplicando el valor del contenido total de N por un factor de conversión de 6,25 (Merrill y Watt, 1973).
Después de la digestión del material vegetal en un horno de microondas con ácido nítrico y perclórico (6:1), el contenido de fósforo (P2O5) se determinó usando un espectrofotómetro; el contenido de potasio (K2O) se determinó utilizando un fotómetro de llama (AOAC, 1995) y el de calcio se detectó por medio de la titrimetría (AOAC, 1995). El contenido de azúcares totales (reductores + no reductores) se cuantificó según el método de Nelson-Somogyi (Somogyi, 1945; Maness, 2010). El contenido de fibra cruda se determinó usando el método con filtración intermedia (HRN EN ISO 6865, 2001).
La muestra se trató con ácido sulfúrico diluido hirviendo, el residuo se separó por filtración, se lavó y luego se trató con una solución de hidróxido de potasio hirviendo. El residuo se separó por filtración, se lavó, se secó, se pesó y se convirtió en cenizas. La pérdida de masa resultante de este proceso corresponde a la masa de fibra cruda en la muestra. El contenido de materia seca se expresó como porcentaje del peso fresco y todas las demás características como porcentaje de materia seca.
Análisis de datos
Las relaciones entre las siete características cuantitativas que describen la composición química de las vainas frescas se evaluaron mediante el coeficiente de correlación de Pearson utilizando PROC CORR (SAS Institute Inc., 2011). El ANOVA univariado usando PROC GLM (SAS) y una prueba Tukey post hoc (p ≤ 0.05) se realizaron para cada característica con el fin de comparar los valores entre las muestras. Después, las muestras se agruparon según el tipo de faseolina (I, II ó III) y las tres características morfológicas: hábito de crecimiento (determinado versus indeterminado), color de la vaina (verde vs. amarillo) y ancho de la vaina (delgado vs. ancho), y las medias del grupo se compararon, como ya se describió.
Además, se hizo un análisis de correspondencia canónica (CCA) para dilucidar las relaciones entre cuatro características cualitativas (tipo de faseolina y tres morfológicas) y siete características cuantitativas que describen la composición química de las vainas frescas. El análisis se realizó utilizando PAST ver. 3.07 (Hammer et al., 2001).
Resultados y Discusión
El contenido de proteína cruda tuvo correlación positiva con el contenido de fósforo (r = 0.85) y potasio (r = 0.78), pero la correlación fue negativa con el contenido total de azúcares (r = -0.74). Además, se determinó una correlación positiva entre el contenido de fósforo y de potasio (r = 0.82) (Cuadro 2). Ferreira et al. (2006) estudiaron las correlaciones entre las características de calidad de la vaina durante las diferentes etapas de su desarrollo y encontraron correlaciones entre la materia seca (de la vaina), los sólidos insolubles en alcohol y el contenido de fibra, que también se vieron fuertemente afectados por el proceso de maduración. Además, la composición mineral, el color y el contenido de lípidos fueron estables para todos los cultivares estudiados durante las diferentes etapas de desarrollo de la vaina.
Cuadro 2 Coeficientes de correlación de Pearson (r; debajo de la diagonal) y su importancia (arriba de la diagonal) entre siete características de calidad nutricional de las vainas frescas de frijol ejotero.
| No. | Trait | Trait | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
| 1 | Dry matter | * | ns | *** | ns | ns | ns | |
| 2 | Crude protein | 0.38 | ns | *** | ns | *** | *** | |
| 3 | Crude fibre | -0.10 | 0.26 | ns | ns | ns | ns | |
| 4 | Total sugars | -0.60 | -0.74 | -0.29 | ns | *** | ** | |
| 5 | Calcium | -0.25 | -0.31 | 0.21 | 0.16 | ** | ** | |
| 6 | Phosphorus | 0.29 | 0.85 | 0.05 | -0.53 | -0.44 | *** | |
| 7 | Potassium | 0.15 | 0.78 | -0.07 | -0.47 | -0.44 | 0.82 | |
*** p≤0.001; ** 0.001<p<0.01; * 0.01<p<0.05; ns p>0.05.
Existe evidencia indirecta de que la síntesis de proteínas requiere potasio (Hawkesford et al., 2012) y su función probable es la síntesis de polipéptidos en los ribosomas, la cual requiere una alta concentración de potasio (Wyn Jones y Pollard, 1983). Además, el potasio tiene un efecto favorable en el transporte de asimilados a órganos de plantas en crecimiento (Engels et al., 2012); mientras que los fosfatos tienen una función irremplazable en los procesos de transferencia de energía, sirven de enlace importante en los grupos y proporcionan ligandos esenciales en los procesos enzimáticos (Taiz y Zeiger, 2002). Todos estos hechos, junto con la alta movilidad del potasio y el fósforo en las plantas y el contenido de proteína cruda de las vainas frescas, explican la correlación positiva entre dichos contenidos.
El contenido de fibras crudas en las vainas frescas varió entre 7.7 % y 11.1 % (datos no mostrados) y se observaron diferencias no significativas entre las muestras de frijol ejotero. El contenido de materia seca de las vainas frescas varió de 72.3 % (S544) a 98 % (S501) y solo se encontraron diferencias significativas entre la muestra S501 y las muestras S544, S543, S518, S507, S542, S509, S526, S545 y S508 (Figura 1A).

Las barras verticales representan los medios ± errores estándar de la media (SEM) (n=3); *** p ≤ 0.001 ANDEVA; las medias (barras) con letras diferentes son estadísticamente significativas (Tukey; p ≤ 0.05).
Figura 1 Contenido de materia seca (A), proteínas crudas (B), azúcares totales (C), calcio (D), potasio (E) y fósforo (F) en la materia seca de las vainas de 14 muestras de frijol ejotero cultivadas en el campo.
El contenido de proteína cruda en las vainas frescas varió de 18.2 % (S526) a 31.7% (S538) y el contenido de la muestra superior S538 fue similar al de las muestras S501 (26.5%) y S541 (28.2%) (Figura 1b). Estos resultados concuerdan con los reportados por Salinas et al. (2012) que registraron 22.3 % de contenido de proteína en las vainas de cv 'Hav-14' de raza indeterminada. Además, Kazydub et al. (2017) mostraron un contenido de proteína cruda de 17.8 - 23.6 % como valores promedio en cinco cultivares de frijol ejotero en Siberia.
El contenido total de azúcares en las vainas frescas de frijol ejotero varió de 11.3 % (S541) a 28.6 % (S507); sin embargo, sólo se encontraron diferencias significativas entre la muestra S507 y las muestras S518, S509, S543, S507 (Figura 1C). Estos resultados son similares a los reportados por Sánchez-Mata et al. (2002) de 21.1-21.5 % del total de azúcares solubles en las vainas de cv. 'Perona'. El contenido de calcio en las vainas frescas varió entre 4.9 g kg-1 (S541) y 8.1 g kg-1 (S545); sin embargo, se encontraron diferencias significativas sólo al comparar las muestras S545 (8.1 g kg-1) y S506 (7.4 g kg-1) con muestras S501 (5.3 g kg-1), S509 (5.1 g kg-1), S525 (5.3 g kg-1) y S541 (4.9 g kg-1) (Figura 1D). El contenido de potasio en las vainas frescas varió entre 24.3 g kg-1 y 34.6 g kg-1 (Figura 1E), y el contenido de fósforo varió de 4.4 a 6.4 g kg-1. Se encontraron Los contenidos de potasio y fósforo fueron altos en las vainas frescas de las muestras S525, S538 y S541, con 34.6, 32.4 y 33.3 g kg-1 de potasio, y 6.1, 6.4 y 6.4 g kg-1 de fósforo, respectivamente. Además, hubo contenidos bajos de estos nutrientes en las vainas frescas de las muestras S518, S526 y S542, 25.2, 24.4 y 24.3 g kg-1 de potasio y 4.4, 4.4 y 4.4 g kg-1 de fósforo, respectivamente (Figuras 1E y 1F). Los resultados del contenido de nutrientes minerales son comparables a los obtenidos en las vainas de cinco cultivares portugueses de frijol ejotero por Ferreira et al. (2012), quienes reportaron 6.3, 30.6 y 5.9 g kg-1 como valores promedio de contenidos de fósforo, potasio y calcio, respectivamente.
Las muestras se agruparon según el tipo de faseolina (I, II ó III) y de acuerdo con cada una de las tres características morfológicas [hábito de crecimiento (determinado versus indeterminado), color de la vaina (verde vs. amarillo), ancho de la vaina (delgado vs. amplio)]. En cuanto al análisis de la faseolina, cuatro muestras tenían faseolina tipo I ("S"), que es predominante en el conjunto de genes mesoamericanos, mientras que las otras muestras pertenecen al conjunto de genes andinos caracterizado por los tipos II de faseolina ("H" o "C") y III ("T") (Cuadro 1).
El análisis de varianza reveló diferencias significativas entre los tipos de faseolina en todas las características de calidad nutricional (Cuadro 3). Las muestras del grupo de genes mesoamericano (faseolina tipo I) tuvieron significativamente mayor contenido de materia seca y proteína cruda en las vainas frescas en comparación con las muestras del conjunto de genes andinos (faseolina tipos II y III). Por el contrario, las muestras andinas tenían un contenido total de azúcares significativamente mayor que las de Mesoamérica y las que tenían faseolina tipo II tenían los contenidos más altos de fósforo y potasio. Islam et al. (2002) también encontraron diferencias en las características de calidad de la vaina entre el grupo genético mesoamericano y el andino. Estos autores informaron de mayores contenidos de calcio, fósforo, azufre y zinc, y menor contenido de hierro y faseolina en Mesoamérica en comparación con el grupo de gen andino.
Cuadro 3 Efecto del tipo de faseolina, hábito de crecimiento, color de la vaina y ancho de la vaina en siete características de calidad nutricional de las vainas frescas de frijol ejotero.
| Trait | Phaseolin type† | Growth habit ¶ | Pod colour | Pod width | |||||
| I | II | III | D | I | Green | Yellow | Thin | Wide | |
| Dry matter (%) | 88.6a | 80.2b | 76.6b | 76.7b | 84.7a | 82.8a | 79.8a | 78.6b | 83.5a |
| Crude protein (%) | 25.7a | 25.0b | 21.0c | 20.9b | 25.5a | 24.6a | 22.7b | 21.5b | 25.6a |
| Crude fibre (%) | 9.4ab | 8.3b | 9.8a | 9.6a | 9.0a | 10.0a | 8.8b | 9.1a | 9.4a |
| Total sugars (%) | 17.1b | 20.9a | 23.4a | 24.4a | 18.2b | 19.2b | 22.2a | 23.4a | 18.3b |
| Calcium (g kg-1) | 6.4a | 5.2b | 6.9a | 6.7a | 6.0b | 6.4a | 6.2a | 6.8a | 5.8b |
| Phosphorus (g kg-1) | 5.4b | 6.0a | 4.8c | 4.7b | 5.8a | 5.4a | 5.2b | 4.8b | 5.8a |
| Potassium (g kg-1) | 28.9b | 32.3a | 27.3c | 26.8b | 31.0a | 30.0a | 28.6b | 27.2b | 31.2a |
† Tipos de Faseolina: I - Tipo "S" Mesoamericano, II - tipo "H" o "C" andino, tipo III - "T" andino.
Hábito de crecimiento: D - determinado, I - indeterminado; las medias con letras diferentes son estadísticamente significativas (prueba de Tukey: p≤0.05).
También se encontraron diferencias significativas en casi todas las características de calidad nutricional en los diferentes morfotipos. El contenido de fibras crudas fue similar, independiente del hábito de crecimiento y el ancho de la vaina. Las muestras de hábito de crecimiento indeterminado tuvieron mayores contenidos de materia seca y proteína cruda, como también contenido de fósforo y potasio en comparación con los determinados, pero mostraron menores contenidos totales de azúcar y calcio. Las muestras de vainas de color amarillo tenían un contenido de azúcar total más alto, pero menor contenido de fósforo y potasio en comparación con las muestras de vainas verdes.
Las muestras con vainas verdes tuvieron mayor contenido de proteína cruda, fibra cruda, fósforo y potasio y menor contenido de azúcares totales en comparación con los morfotipos con vainas amarillas. Las muestras con vainas anchas tenían un mayor contenido de materia seca, proteína cruda, contenidos de fósforo y potasio y menos azúcares totales y contenido de calcio, que las muestras de vainas delgadas.
Los resultados de nuestra investigación indican una variación considerable en las características nutricionales de las vainas frescas en las muestras de frijol ejotero. Además, aunque nuestro estudio de las vainas señala características cuantitativas afectadas por las condiciones ambientales, las condiciones climáticas favorables durante nuestro experimento, junto con resultados comparables reportados por otros autores, indican la existencia de diferentes patrones de acumulación de nutrientes en relación con diferentes morfotipos de frijol ejotero y diferentes tipos de faseolina.
Las relaciones entre pares de cuatro características cualitativas (tipos de faseolina y tres características morfológicas) y siete características cuantitativas que describen la composición química de vainas frescas (mostradas como vectores) se muestran como un biplot construido por los dos primeros ejes de análisis de correspondencia canónica (CCA) (Figura 2). El primer eje explicó más de 60% de la variación total que muestra que los mayores niveles de fósforo, potasio y proteínas crudas en las vainas están relacionados con el hábito de crecimiento indeterminado (Hab_I), el amplio morfotipo de las vainas (PW_W) y la faseolina tipo II (Ph_II) . Igualmente, las muestras que tienen faseolina tipo III (Ph_III), hábito de crecimiento determinado (Hab_D) y vainas delgadas (PW_T) tienden a mostrar valores más altos de azúcares totales y calcio.
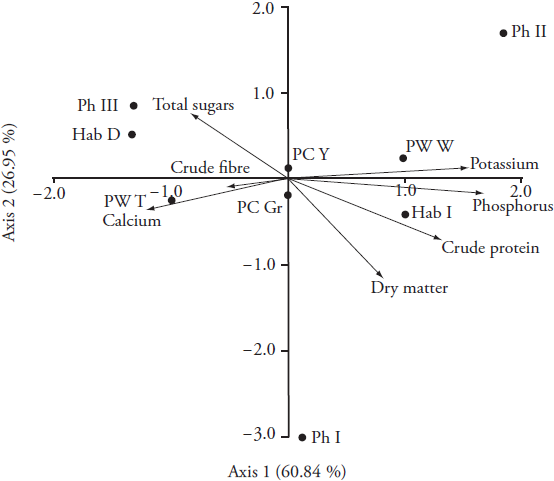
Ph_I - faseolina tipo I; Ph_II - faseolina tipo II; Ph_III - faseolina tipo III; Hab_D - hábito determinado; Hab_I - hábito indeterminado, PC_Gr - color verde de la vaina; PC_Y - color amarillo de la vaina; PW_T: ancho de vaina delgada; PW_W: ancho de vaina amplio.
Figura 2 Biplot del análisis de correspondencia canónica (CCA) que muestra las relaciones entre cuatro características cualitativas (tipo de faseolina y tres características morfológicas) y siete características cuantitativas que describen la composición química de las vainas frescas (mostradas como vectores).
Sin embargo, es más probable que el tipo de hábito de crecimiento y el ancho de la vaina, más que el tipo de faseolina, tengan un mayor efecto en las características nutricionales de las vainas frescas debido al número limitado de morfotipos diferentes dentro de cada tipo de faseolina. A saber, la mayoría de las muestras dentro del tipo III de faseolina tenía un tipo de hábito determinado (cuatro de cinco muestras), mientras que las muestras de los tipos I y II tenían un tipo de hábito indeterminado (ocho de nueve muestras) (Cuadro 1). Además, Singh et al. (1991) informaron que el hábito de crecimiento determinado en el frijol común está controlado por el locus de aleta y que la mayoría de las variedades de la raza Nueva Granada del grupo genético andino (faseolina tipo III) poseen este locus. Por lo tanto, parece que las plantas con un hábito de crecimiento diferente tienden a tener diferentes patrones bioquímicos y metabólicos de removilización y acumulación de nutrientes en las vainas.
Estos resultados concuerdan con los reportados por Koinange et al. (1996) y Rosales-Serna et al. (2004), quienes detectaron diferencias en las plantas de frijol común con diferentes hábitos de crecimiento. Además, Singh y Singh (2015) afirmaron que el hábito de crecimiento es responsable de la geometría de dosel, y características como el número de hojas, el tamaño de la hoja, el número de entrenudos y la longitud del entrenudo tienen un impacto significativo en el rendimiento y calidad de la vaina.
Los cultivares determinados exhiben menos acumulación de biomasa debido al hábito de crecimiento compacto y al rápido período de floración y maduración, mientras que los cultivares de hábito de crecimiento indeterminado exhiben senescencia secuencial de hojas, que ocurre simultáneamente con la floración. Además, los tejidos en crecimiento en plantas indeterminadas son sumideros de compuestos transportados en el floema, y así los nutrientes móviles como el potasio y el fósforo podrían volver de las hojas en senescencia a los tejidos en crecimiento (Thomas, 2013). Nuestros resultados están en línea con estas afirmaciones. A saber, se encontraron mayores contenidos de nutrientes móviles, es decir, nutrientes que se movilizaron mediante floema (P2O5 and K2O) (Hawkesford et al., 2012) en las vainas de las plantas con hábito de crecimiento indeterminado, mientras que el calcio como un nutriente inmóvil, transportado principalmente por la corriente de transpiración en el xilema (Hawkesford et al., 2012), se encontró en vainas de plantas de hábito de crecimiento determinado.
Una explicación viable para el alto contenido total de azúcar y calcio en los morfotipos con vainas delgadas, en comparación con los morfotipos con vainas anchas, está en su tendencia a acumular un alto contenido de fibra (Figura 2). La ausencia de diferencias significativas en el contenido de fibra entre morfotipos con vainas delgadas y anchas (Cuadro 3) puede ser el resultado de una cosecha temprana que evitó la acumulación de fibras en las vainas, así como el hecho de que el frijol ejotero se caracteriza por un bajo contenido de fibra (Singh y Singh, 2015). Las fibras son células largas con paredes celulares secundarias que sirven como elementos de soporte en partes de la planta que ya no se alargan (Evert y Esau, 2006); por lo tanto, la cantidad de la pared celular secundaria aumenta con el envejecimiento de las vainas. La principal diferencia en la composición de las paredes celulares primarias y secundarias es que la celulosa es más abundante en las secundarias, mientras que las sustancias pécticas son el principal sitio de unión de los iones de calcio (Willats et al., 2001) y carecen de paredes secundarias (Evert y Esaau, 2006). Por lo tanto, durante el período inicial de crecimiento, las vainas contienen un mayor contenido de calcio y azúcares y menos fibra; mientras que, posteriormente, el contenido de azúcares y calcio disminuye y el de las fibras aumenta.
Los frijoles ejoteros, también conocidos como judías verdes, son un componente importante de una dieta bien balanceada. Además, en los países europeos, se observa un mayor consumo de leguminosas en todo el Mediterráneo (Bouchenak y Lamri-Senhadji, 2013). La dieta mediterránea se considera un patrón dietético saludable que protege contra algunas enfermedades crónicas y el consumo de frijoles ejoteros ha sido objeto de un creciente interés por parte de los investigadores. Los frijoles ejoteros también juegan un papel importante en la dieta, pues implica cumplir con el requisito de consumir un producto que contiene proteína, fibra y minerales. Según Shanmugacelue (1989), 100 g de porción comestible de las vainas contienen en promedio 1.7 g de proteína, 4.5 g de carbohidratos, 1.8 g de fibra, 50 mg de Ca, 29 mg de Mg, 28 mg de P, y 1.7 mg de Fe. Sin embargo, la apariencia de las verduras, el sabor y el valor nutricional tienen una influencia cada vez mayor en la elección de los alimentos que hace el consumidor. De acuerdo con Očić et al. (2015), los consumidores en Croacia prefieren las vainas delgadas/amarillas y delgadas/verdes; además, las características relacionadas con la calidad de las vainas de frijoles ejoteros son más importantes que el rendimiento en sí (Singh y Singh, 2015)).
Conclusiones
Existen diferentes patrones de acumulación de nutrientes en el frijol ejotero debido al morfotipo y el conjunto de genes de las muestras. Las muestras analizadas podrían usarse como valiosas fuentes de nutrientes bioactivos en futuros programas de mejoramiento. Además, las muestras sobresalientes S538 y S541 tuvieron contenidos de proteínas crudas, fósforo y potasio significativamente mayores, mientras que las muestras S506 y S545 registraron un mayor contenido de calcio
Literatura Citada
AOAC (Association of Official Analytical Chemistry International). 1995. Official Methods of Analysis of AOAC International (16th ed.) Volume 1. Association of Analytical Communities, Arlington, USA. [ Links ]
Bouchenak, M., and M. Lamri-Senhadji. 2013. Nutritional quality of legumes, and their role in cardio metabolic risk prevention: a review. J. Med. Food. 16: 185-198. [ Links ]
Čupić, T., R. Gantner, S. Popović, M. Tucak, R. Sudar, and M. Stjepanović. 2012. “Rasprostranjenost jednogodišnjih mahunarki u Hrvatskoj”. In: Proceedings & abstracts of the 5th international scientific/professional conference Agriculture in nature and environment protection, Stipešević, B., and R. Sorić (eds). Glas Slavonije d.d., Osijek (Pub.). pp: 220-225. [ Links ]
Duke, J. A. 1981. Handbook of Legumes of World Economic Importance. Plenum Press, New York. 345 p. [ Links ]
Engels, C., E. Kirkby, and P. White. 2012. Mineral nutrition, yield and source-sink relationships. In: Marschner, P. (ed). Marschner's Mineral Nutrition of Higher Plants (Third Edition) Academic Press; London, UK. pp: 85-133. [ Links ]
Evert, R. F. and K. Esau. 2006. Esau's Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body - Their Structure, Function and Development., John Wiley & Sons, Inc, Hoboken, New Jersey. 601 p. [ Links ]
FAO (Food and Agriculture Organisation). 2008. Country Report on the State of Plant Genetic Resources for Food and Agriculture, Croatia. http://www.fao.org/docrep/013/i1500e/Croatia.pdf [ Links ]
Ferreira M. E., de Varennes A., de Melo-Abreu J. P., and Vieira M. I. 2006. Predicting pod quality of green beans for processing. Sci. Hortic. 109: 207-211. [ Links ]
Gepts, P. 1988. Phaseolin as an evolutionary marker. In: Gepts, P. (ed). Genetic Resources of Phaseolus Beans: Their Maintenance, Domestication, Evolution and Utilization. Springer Netherlands, Dordrecht. pp: 215-241. [ Links ]
Hammer Ø., D. A. T. Harper, and P. D. Ryan. 2001. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontol. Electron. 4: 1-9. [ Links ]
Hawkesford M., W. Horst, T. Kichey, H. Lambers, J. Schjoerring, I. Skrumsager Møller, and P. White. 2012. Functions of macronutrients. In: Marschner, P. (ed). Marschner's Mineral Nutrition of Higher Plants (Third Edition). Academic Press; London, UK. pp: 135-189. [ Links ]
HRN EN ISO 6865:2001. Animal feeding stuffs - Determination of crude fibre content - Method with intermediate filtration (ISO 6865:2000; EN ISO 6865:2000). [ Links ]
Islam F. M. A., K. E. Basford, C. Jara, R. L. Redden, and S. Beebe. 2002. Seed compositional and disease resistance differences among gene pools in cultivated common bean. Genetic Resour. Crop Evol. 49: 285-293. [ Links ]
Jakopic J., A. Slatnar, M. Mikulic-Petkovsek, R. Veberic, F. Stampar, F. Bavec, and M. Bavec. 2013. Effect of different production systems on chemical profiles of dwarf French bean (Phaseolus vulgaris L. cv. Top Crop) pods. J. Agr. Food. Chem. 61: 2392-2399. [ Links ]
Jimenez-Monreal, A. M., L. Garcia-Diz, M. Martinez-Tome, M. Mariscal, and M. A. Murcia. 2009. Influence of cooking methods on antioxidant activity of vegetables. J. Food. Sci. 74: 97-103. [ Links ]
Kami, J., V. B. Velasquez, D. G. Debouck, and P. Gepts. 1995. Identification of presumed ancestral DNA sequences of phaseolin in Phaseolus vulgaris. Proc. Natl. Acad. Sci. USA. 92: 1101-1104. [ Links ]
Kaplan, L., and T. F. Lynch. 1999. Phaseolus (Fabaceae) in archaeology: AMS radiocarbon dates and their significance for pre-Colombian agriculture. Econ. Bot. 53: 261-272. [ Links ]
Kazydub, N., A. Pinkal, T. Marakayeva, S. Kuzmina, M. Korobeinikova, and Kotsybinskaya. 2017. Chemical composition of seeds and green beans of common bean varieties, breeded in Omsk State Agrarian University under conditions of southern forest-steppe zone of Western Siberia. Agron. Res. 15. 1918-1927. [ Links ]
Khatun, M. M., N. Sultana, M. H. Rahman, M. A. A Mamun, and M. M. Hossain. 2007. Effect of freezing on nutritional quality of Bush Bean at different pod age stages. Int. J. Sustain. Crop Prod. 2: 10-15 [ Links ]
Kelly, J. F., and M. K. Scott. 1992. The nutritional value of Snap Beans versus other Vegetables. In: Henry G., and W. G. Janseen (ed). Snap Beans in the Developing World: Proceedings of an international conference. Cali, Colombia. pp: 23-46. [ Links ]
Koinange, E. M. K., S. P. Singh, and P. Gepts. 1996. Genetic control of the domestication syndrome in common bean. Crop Sci. 36: 1037-1045. [ Links ]
Lim, T. K. 2012. Phaseolus vulgaris. In: Lim, T. K. (ed). Edible Medicinal and Non-Medicinal Plants: Volume 2, Fruits. Springer Netherlands, Dordrecht. pp: 815-848. [ Links ]
Maness, N. 2010. Extraction and analysis of soluble carbohydrates. In: Sunkar, R. (ed). Plant Stress Tolerance: Methods and Protocols. Humana Press, Totowa, NJ. pp: 341-370. [ Links ]
Merrill, A. L., and B. K. Watt. 1973. Energy Value of Foods: Basis and Derivation. Agriculture Handbook. US Department of Agriculture, Agricultural Research Service, Washington DC. [ Links ]
Očić, V., B. Šakić Bobić, Z. Grgić, K. Carović-Stanko, M. Grdiša, and Z. Šatović. 2015. Izbor tipa mahuna prema stavovima proizvođača o zahtjevima tržišta. In: Pospišil, M. (ed). Zbornik radova 50. Hrvatskog i 10. Međunarodnog Simpozija Agronoma. Zagreb, Cro. pp: 159-163. [ Links ]
Radosavljević, I., Z. Satovic, J. Jakse, B. Javornik, D. Greguraš, M. Jug-Dujaković, and Z. Liber. 2012. Development of new microsatellite markers for Salvia officinalis L. and its potential use in conservation-genetic studies of narrow endemic Salvia brachyodon Vandas. Int. J. Mol. Sci. 13: 12082-12093. [ Links ]
Rosales-Serna, R., J. Kohashi-Shibata, J. A. Acosta-Gallegos, C. Trejo-López, J. Ortiz-Cereceres, and J. D. Kelly. 2004. Biomass distribution, maturity acceleration and yield in drought-stressed common bean cultivars. Field Crop. Res. 85: 203-211. [ Links ]
Salinas, R. N., E. J. A. Escalante, G. M. T. Rodríguez, y M. E. Sosa. 2012. Rendimiento y calidad nutrimental de frijol ejotero en dos ambientes. Rev. Fitotec. Mex. 35: 317-323. [ Links ]
Sánchez-Mata, M. C., M Cámara-Hurtado, and C. Diez-Marqués. 2002. Identification and quantification of soluble sugars in green beans by HPLC. Eur. Food. Res. Technol. 214: 254-258. [ Links ]
SAS Institute Inc. 2011. Base SAS® 9.3 Procedures Guide. SAS Institute Inc., Cary, NC. [ Links ]
Schuelke M. 2000. An economic method for the fluorescent labeling of PCR fragments. Nat. Biotechnol. 18: 233-234. [ Links ]
Selan, M., D. Kastelec, J. Jakopič, R. Veberič, M. Mikulič-Petkovšek, and N. Kacjan-Maršić. 2014. Hail net cover, cultivar and pod size influence the chemical composition of dwarf French bean. Sci. Hortic-Amsterdam. 175: 95-104. [ Links ]
Shanmugacelue, K. G. 1989. Production Technology of Vegetable Crops. Oxford & IBH Publishing Co, New Delhi. pp: 446-461. [ Links ]
Singh, S. P., P. Gepts, and D. G. Debouck. 1991. Races of common bean (Phaseolus vulgaris, Fabaceae). Econ. Bot. 45: 379-396. [ Links ]
Singh, B. K., and B. Singh. 2015. Breeding perspectives of Snap bean (Phaseolus vulgaris L.). Vegetable Sci. 42: 1-17. [ Links ]
Somogyi, M. 1945. A new reagent for the determination of sugars. J. Biol. Chem. 160: 61-68. [ Links ]
Taiz, L., and E. Zeiger. 2002. Plant Physiology (3th ed). Sinauer Associates, Inc. Publishers Sunderland, Massachusetts. 623 p. [ Links ]
Thomas, H. 2013. Senescence, ageing and death of the whole plant. New Phytol. 197: 696-711. [ Links ]
Willats, W. G., C. Orfila, G. Limberg, H. C. Buchholt, G. J. van Alebeek, A. G. Voragen, S. E. Marcus, T. M. Christensen, J. D. Mikkelsen, B. S. Murray, and J. P. Knox. 2001. Modulation of the degree and pattern of methyl-esterification of pectic homogalacturonan in plant cell walls. Implications for pectin methyl esterase action, matrix properties, and cell adhesion. J. Biol. Chem. 276: 19404-19413. [ Links ]
Wyn Jones, R. G., and A. Pollard. 1983. Proteins, enzymes and inorganic ions. In: Läuchli, A., and R. L. Bieleski (eds). Inorganic Plant Nutrition Springer, New York. pp: 528-562. [ Links ]
Recibido: Marzo de 2017; Aprobado: Enero de 2018











 text in
text in 


