Introducción
La lignina es uno de los biopolímeros más abundantes en las plantas, es una macromolécula fenólica, está unida covalentemente a la celulosa y otros polisacáridos de la pared celular, como hemicelulosas y pectinas (Johansson et al., 2014). La estructura química de la lignina (Figura 1) consiste principalmente de tres unidades fenilpropanoides: alcohol coniferílico, cumárico y sinapílico (Bai et al., 2014; Jin et al., 2014). Por su naturaleza polimérica es una fuente potencial de compuestos aromáticos, con valor agregado, que pueden emplearse en la industria alimenticia para la producción de vainillina y ácido vainillínico (Nagar et al., 2010; Menon y Rao, 2011; Eudes et al., 2014; Volokitina et al., 2015) y la industria farmacéutica para la síntesis química de guayacol y catecol (Collinson y Thielemans, 2010; Menon y Rao, 2011).
Para transformar la lignina se han desarrollado procedimientos químicos y biológicos que la despolimerizan de forma selectiva y gradual. Entre ellos está el uso de catalizadores inorgánicos, como MnO2, Zr (CH3CO2), Co (CH3CO2) y Mn (CH3CO2) (Collinson y Thielemans, 2010; Doherty y Mousavioun, 2010; Zhang et al., 2014); no obstante, la catálisis heterogénea tiende a generar otros productos que deben purificarse para su uso. La degradación de lignina también se ha realizado con Trametes versicolor, Ceriporiopsis subvermispora, Cyanthus stercoreus y Phlebia radiata (Dávila y Vázquez-Duhalt, 2006), que producen enzimas, principalmente lacasas y peroxidasas, que catalizan la separación de los enlaces entre las subunidades de la lignina y causan su despolimerización gradual (Collinson y Thielemans, 2010).
Las lacasas (benzenediol:oxígeno oxidoreductasas E.C. 1.10.3.2) catalizan la oxidación de compuestos fenólicos y aminas aromáticas, utilizan oxígeno molecular como aceptor de electrones, y también oxidan ácidos metoxifenólicos (Forte et al., 2010; Kim et al., 2011; Jin et al., 2014), descarboxilan y degradan sus grupos metoxilo por desmetilación o desmetoxilación (Solomon et al., 1996; Dávila y Vázquez-Duhalt, 2006; Moilanen et al., 2011; Polak y Jarosz, 2012; Rodrigues et al., 2012; Pang et al., 2015). Algunas lacasas utilizan transportadores de electrones, para su acción catalítica, y otras no (Arana et al., 2002; Ganachaud et al., 2008; Forte et al., 2010; Kim et al., 2011; Lange et al., 2013). El objetivo de este estudio fue determinar si H2O2, como mediador en el transporte de electrones, favorece la capacidad catalítica de lacasa inmovilizada en la despolimerización de lignina. La hipótesis fue que H2O2, como aceptor secundario de electrones, incrementa el efecto oxidante de lacasa inmovilizada en alginato, en compuestos fenólicos y no fenólicos de lignina.
Materiales y Métodos
Materiales
Los compuestos como ácido benzoico, ácido vainillínico, ácido ρ-cumárico, ácido ferúlico, hidroquinona y vainillina (Sigma-Aldrich), lacasa de Trametes versicolor (EC 1.10.3.2, 1.25 mIU, CAS 80498-15-3) y lignina (CAS 8068-05-1), y los demás, utilizados en el estudio fueron grado analítico o grado cromatográfico.
Preparación y activación de las perlas de alginato
Las perlas de alginato de sodio, con diámetro de 3 mm, se prepararon con el método de Pal y Khanum (2011). Dos gramos del compuesto se disolvieron en 100 mL de agua desionizada caliente y para formar las perlas la solución se vertió por goteo en 0.2 M CaCl2 a 4 °C. Para endurecerlas, las perlas se almacenaron 24 h en 0.02 M CaCl2 a 4 °C. Luego, las perlas se separaron al filtrar la solución de CaCl2 y se lavaron con agua desionizada, en proporción de 10 veces el volumen de CaCl2. Para asegurar su activación las perlas se transfirieron a una solución de glutaraldehído al 9 % (v/v) y amortiguador de citrato (pH 5.0) y se mantuvieron en agitación por 90 min. Las perlas se almacenaron en glutaraldehído al 9 % (v/v) con amortiguador de citrato, a 4 °C por 24 h.
Determinación de actividad enzimática
La actividad de la lacasa se determinó por oxidación de ABTS 2,2´-azinobis (3-etilbenzotiazolina)-6-sulfonato en amortiguador de acetato (0.1 M y pH 5) a 50 °C. En un tubo de ensaye se mezclaron 2.85 mL de la solución 0.5 mM de ABTS, solubilizado en amortiguador de acetato y 0.15 mL de enzima, se mantuvo 1 h a 30 °C. La reacción se detuvo en baño de hielo y la absorbancia se leyó a 420 nm en espectrofotómetro UV-Vis (Jenway, model 6715). Una unidad de lacasa (mIU mL-1) se definió como 1 lmol de ABTS oxidado por minuto (Childs y Bardsley, 1975).
Inmovilización de lacasa
Las perlas se separaron por filtración de la solución de glutaraldehído con amortiguador de citrato y se lavaron con agua desionizada. Luego, se colocaron en una solución de lacasa (1.25 mIU mL-1), con agitación vigorosa por 1.5 h a temperatura ambiente. Las perlas de alginato con la enzima inmovilizada se almacenaron a 4 °C hasta su utilización (She et al., 2010).
Activación biocatalítica de la enzima
Las perlas de alginato con enzima inmovilizada se transfirieron a amortiguador de fosfatos, al pH deseado (5.8, 6.5 y 8.6) y se adicionó solución de lignina (80 g), solubilizada previamente, a temperatura ambiente, en 100 mL de agua desionizada, a cada tratamiento. Inmediatamente se agregó la solución de H2O2, en las concentraciones establecidas, se inició la reacción enzimática a 25 °C y agitación (150 rpm) en un agitador orbital (ZHCHENE, ZHWY-200D model). La reacción se mantuvo por 24 h; cada 1.5 h se realizó un muestreo, y para cada muestra se determinó la absorbancia en el espectrofotómetro UV-Vis (Janshekar et al., 1981).
Controles de actividad catalítica
En cada proceso experimental se incluyeron dos testigos. Estos, de acuerdo a lo establecido en el diseño de experimentos, sin lacasa inmovilizada. El testigo sin H2O2 se mantuvo en las condiciones de reacción establecidas en el diseño de experimentos.
Cuantificación del consumo de H2O2
Solución 0.1 M de KMnO4 se calentó hasta ebullición. De forma simultánea, una alícuota de 0.25 mL de agua oxigenada se transfirió a un matraz volumétrico de 5 mL y se aforó con agua desionizada. Luego, una alícuota de 1.25 mL de la solución de agua oxigenada se transfirió a un vaso de precipitado, se adicionaron 0.15 mL de H2SO4 6 M y 1.25 mL de agua desionizada y se calentó a 60 °C. La titulación volumétrica de la solución de H2O2, con la solución estandarizada de permanganato, se mantuvo hasta la aparición de un color rosado permanente (Sant, 1956).
Cromatografía de capa fina
Para la separación preparativa por cromatografía de capa fina (CCF), de los productos de reacción, se utilizaron placas con gel de sílice (0.25 mm de espesor y 5 × 10 cm) como fase estacionaria e indicador de fluorescencia UV254 (Merck AG, Darmstadt, Alemania); antes de usarse se calentaron (activaron) a 40 °C, por 1 h. La fase móvil fue agua: metanol (50 / 50, v / v) grado cromatográfico. Cincuenta (L de muestras y soluciones estándar de ácido benzoico, ácido vainillínico, ácido ρ-cumárico, ácido ferúlico, hidroquinona y vainillina se aplicaron en diferentes carriles individuales de la placa. Antes de eluír, la cámara se saturó por 15 min, al finalizar la elución las placas se mantuvieron a 25 - 30 °C hasta la evaporación completa del disolvente, luego se observaron bajo luz ultravioleta, y la trayectoria de las muestras se detectó por fluorescencia. El factor de retención se calculó con la relación:
Factor de retención (Fr) = distancia recorrida por el estándar o la muestra / distancia recorrida por el disolvente.
Cuantificación de productos de reacción
Los productos de la reacción de despolimerización de lignina se cuantificaron con curvas de calibración de estándares de ácidos benzoico, vainillínico, ρ-cumárico y ferúlico, e hidroquinona y vainillina, en soluciones de hasta 2.5 mM. La absorbancia máxima de cada compuesto se determinó previamente en espectrofotómetro UV-Vis (Jenway, 6715), entre 250 y 350 nm.
Diseño experimental y análisis estadístico
El diseño experimental fue un factorial 3 x 4: tres niveles de pH (5.8, 6.5 y 8.6) y cuatro niveles de concentración de H2O2 (25, 50, 75 y 100 mM), las pruebas se realizaron por triplicado. Los resultados se analizaron con ANDEVA y la prueba de comparación de medias de Tukey (p≤0.05), con MINITAB 16 (Minitab Inc. State College, Pennsylvania).
Resultados y Discusión
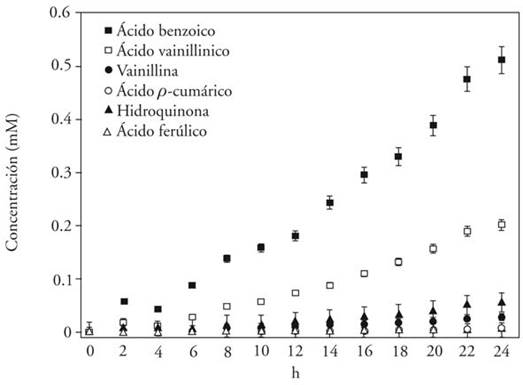
La despolimerización de la lignina aumentó de manera proporcional con el pH del medio (Figuras 2 a 4). Con pH superior a 7.0 el soporte de inmovilización se desintegró y esto permitió que la lacasa se solubilizara en el medio y aumentara su actividad (Figura 4); así, a pH de 8.6 la concentración de derivados de lignina fue mayor que a pH 5.8 y 6.5. En estos últimos la enzima permaneció inmovilizada. Los rendimientos mayores de conversión fueron ácido benzoico 63.5 %, ácido vainillínico 25 % y vainillina 11.5 % y se obtuvieron a pH 8.6. El rendimiento de vainillina es comparable al 8.5 y 11.5 % reportados por Crestini et al. (2006), con metiltrioxorenio (MeReO3) como catalizador y H2O2 como donador de oxígeno; pero, superó al 1.5 % reportado por Zheng et al. (2014), con zeolita como catalizador. Esto permite sugerir que la despolimerización de lignina con lacasa es factible.
En las reacciones testigo no se observó oxidación de lignina con ningún pH ni concentración de H2O2, por lo cual el poder oxidativo del H2O2 disminuyó en estas reacciones, probablemente por la concentración elevada de H2O2. De acuerdo con Rodríguez et al. (2008), este compuesto en exceso captura radicales hidroxilo, lo que disminuye su capacidad oxidativa; además, la velocidad de degradación del H2O2 también es baja respecto a algunas sustancias complejas, por lo cual se recomienda usar en combinación con otros oxidantes.
La desintegración del soporte de inmovilización permitió que la enzima se solubilizara y el efecto de la concentración de H2O2 fue poco significativo (Figura 5), ya que la concentración de ácido benzoico, derivado principal de lignina en las reacciones catalizadas con lacasa, prácticamente se mantuvo constante, independiente de la concentración de H2O2. En contraste, en las reacciones en las que la enzima permaneció inmovilizada la producción mayor de derivados de lignina dependió de la concentración de H2O2; así, a pH 5.8 la producción mayor se obtuvo con 75 mM de H2O2 (Figura 6) y a pH 6.5 con 50 mM (Figura 7). Esto se debió a que la capacidad oxidativa del H2O2 es dependiente de pH, temperatura, concentración y tiempo de reacción. Por esto, conviene establecer la dosis óptima de H2O2. Lo anterior confirmó que el pH del medio puede regular la deslignificación por oxidación. Al respecto, Ruuttunem y Vuorinen (2005) evaluaron catalizadores diferentes en la misma reacción y determinaron que la reactividad relativa de los catalizadores con los grupos fenólicos en la lignina incrementó al disminuir el pH.
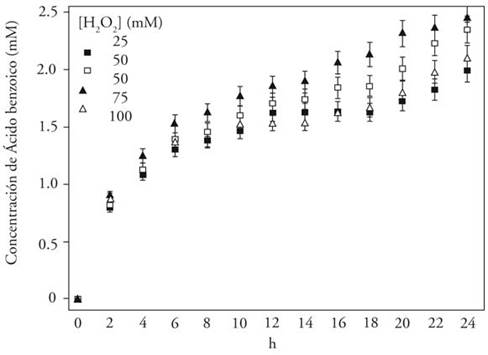
Figura 5 Efecto de la concentración de H2O2 en la producción de ácido benzoico a pH 8.6, con enzima soluble.
A pesar de que los rendimientos mayores de conversión de lignina se obtuvieron con la enzima solubilizada y que la concentración de H2O2 no afectó significantemente la actividad catalítica de la enzima, es posible inferir actividad sinérgica de la lacasa con el H2O2, ya que en las reacciones con la enzima inmovilizada se observó correlación directa entre el pH de la reacción y la concentración de H2O2 utilizada. Es decir, a mayor pH la concentración de H2O2 necesaria para mediar la catálisis de lignina será menor. Por lo tanto, la concentración de H2O2 necesaria para mediar la reacción a pH de 8.6 puede ser menor a 25 mM H2O2. También debe considerarse que las enzimas inmovilizadas muestran actividad catalítica menor que la enzima soluble y esto permite explicar parcialmente el hecho de que en las reacciones a pH 8.6 la producción de derivados de lignina fuera mayor.
El consumo de H2O2 indicó que a pH de 5.8 se consumió 89.4 % del H2O2 50 mM, en el medio líquido; y fue diferente al 93.5 % consumido cuando la concentración fue 75 mM (Cuadro 1). En las reacciones a pH 6.5 con H2O2 50 mM el consumo de H2O2 (95.2 %) fue mayor, que en las reacciones con 75 mM (82.3 %). Así, el consumo mayor de H2O2, en las reacciones catalizadas por lacasa inmovilizada en perlas de alginato, coincidió con la conversión mayor de lignina en cada pH. Esto concordó con lo reportado por Solomon et al. (1996) y Boukari et al. (2011), quienes determinaron que el H2O2 facilitó la extracción y conversión de lignina a partir de materiales lignocelulósicos. También se observó que el este agente oxidante no provocó inhibición enzimática y que en todas las reacciones el consumo de H2O2 fue significativo.
Cuadro 1 Diferencia entre el H2O2 empleado en la reacción de hidrólisis de lignina y el cuantificado por titulación con permanganato de potasio.
| pH | H2O2 (mM) | Moles añadidos de H2O2 | Moles finales de H2O2 |
| 5.8 | 50 | 8.12 x 10-5 | 8.63 x 10-6 |
| 75 | 1.62 x 10-4 | 1.06 x 10-5 | |
| 6.5 | 50 | 8.12 x 10-5 | 3.93 x 10-6 |
| 75 | 1.62 x 10-4 | 2.86 x 10-5 |
Los factores analizados y su interacción fueron significativos (p = 0.02) para el factor pH, 0.035 para factor concentración de H2O2 y 0.046 para la interacción pH x H2O2.
Conclusiones
La despolimerización de lignina, para obtener compuestos aromáticos, es posible con lacasa inmovilizada en perlas de alginato y H2O2, como aceptor secundario de electrones, pues los rendimientos son comparables con los de otros procesos de despolimerización oxidativa; además, tiene la ventaja de ser un proceso seguro y limpio. La concentración de H2O2 influye significativamente en el rendimiento de conversión y tiene relación directa con el pH de la reacción. La acción de H2O2 es sinérgica con la lacasa inmovilizada en la despolimerización de lignina. Aunque durante la reacción se reduce prácticamente todo el H2O2, la enzimática no se inhibe.











 text in
text in