Introducción
La pitaya (Stenocereus stellatus) se consume como producto fresco y no se encontraron estudios sobre la aplicación de este fruto en productos industrializados que permitan su explotación comercial. La obtención de extractos de pitaya con concentraciones altas de compuestos bioactivos puede ayudar a superar este inconveniente al permitir su aprovechamiento como fuente de pigmentos y antioxidantes para la industria de los alimentos.
Las investigaciones en frutos del género Stenocereus, o pitayas, son escasas. García-Cruz et al. (2012) y García-Cruz et al. (2013) evaluaron el contenido de compuestos fenólicos totales, capacidad antioxidante, betalaínas y minerales en pitayas S. griseus y S. pruinosus, respectivamente. Pérez-Loredo et al. (2016) clasificaron como pobres, buenas y excelentes fuentes de betalaínas a los frutos de 30 cactáceas de diversos géneros, e indican que los frutos rojos de S. stellatus de Puebla, México, son una buena fuente de pigmentos. Para extraer betalaínas de frutos de Opuntia se usa el fruto sin semillas, aunque éstas contienen mayor cantidad de compuestos fenólicos totales y capacidad antioxidante que la pulpa (Morales et al., 2012). Esto sugiere que sería más conveniente usar el fruto completo para obtener la mayor cantidad posible de compuestos bioactivos.
Las semillas del fruto de la pitaya son pequeñas y frágiles, durante la maceración de la fruta se rompen fácilmente y le confieren un color obscuro a la pulpa macerada, lo cual puede afectar la extracción de los pigmentos. Las semillas representan 31 % en peso de la fracción comestible de la pitaya y si son separadas de la pulpa podrían eliminarse del extracto algunos componentes bioactivos de la fruta. Por lo tanto, es necesario determinar el efecto de la presencia de semillas en los rendimientos de extracción de pigmentos y otros compuestos de interés.
Los frutos de cactáceas son fuente de diversos fitoquímicos, en especial pigmentos, por lo cual hay varios estudios sobre frutos de cactáceas para establecer las mejores condiciones para su extracción y aplicación. Los frutos más estudiados como fuente de compuestos bioactivos son del género Hylocereus (Naderi et al., 2010; Woo et al., 2011) y Opuntia (Prakash y Manikandan, 2012; Cejudo-Bastante et al., 2015).
Los métodos de extracción convencionales (maceración, reflujo o extracción Soxhlet) requieren tiempos largos de extracción, los rendimientos son bajos y el consumo energético es alto, pero son populares porque son fáciles de operar y el costo es bajo (Yang et al., 2011). Los métodos de extracción no convencionales son más amigables con el medio ambiente porque reducen el uso de químicos y el tiempo de extracción, además mejoran el rendimiento y la calidad del extracto. Los métodos de ultrasonido, pulsos eléctricos, digestión enzimática, extrusión, microondas y fluidos supercríticos se usan para mejorar el rendimiento y la selectividad de la extracción de compuestos bioactivos (Azmir et al., 2013).
El ultrasonido es un tipo especial de onda sonora, su frecuencia de 20-100 MHz está más allá de la audición humana, y al igual que otras ondas comprime y expande el material expuesto. Al aplicar ultrasonido se favorece la difusión a través de la pared celular y el lavado del contenido celular una vez que las células están rotas (Azmir et al., 2013). El ultrasonido se ha estudiado para extraer pigmentos naturales de betabel y otras fuentes vegetales (Sivakumar et al., 2009).
Las microondas son campos electromagnéticos en un rango de frecuencia de 300 Mhz a 300 GHz. Alupului et al. (2012) propusieron tres etapas secuenciales de la extracción asistida por microondas: 1) separación de los solutos de los sitios activos de la matriz debido al incremento de temperatura y presión, 2) difusión del disolvente a través de la matriz y, 3) liberación de solutos de la matriz al disolvente. La extracción con microondas se estudia para obtener polifenoles en cáscara de cítricos (Nayak et al., 2015), como pretratamiento en la extracción de astaxantina de Phaffia rhodozyma (Villalobos-Castillejos et al., 2013) y en la extracción de betalaínas de betabel (Cardoso-Ugarte et al., 2014).
La adición de celulasa, α-amilasa y pectinasa mejora la extracción de algunos compuestos bioactivos al romper las paredes celulares e hidrolizar estructuras de polisacáridos donde se encuentran enlazados (Puri et al., 2012). Además de la composición, concentración y tipo de enzima, otros factores como el tamaño de partícula de los materiales vegetales, la relación sólido-agua y el tiempo de hidrólisis afectan el proceso de extracción (Azmir et al., 2013). La hidrólisis enzimática se ha estudiado para extraer compuestos fenólicos desde desperdicios de uva (Gómez-García et al., 2012), residuos sólidos de frambuesa (Laroze et al., 2010) y betalaínas en frutos del género Hylocereus (Naderi et al., 2010).
La demanda de compuestos naturales ha aumentado por sus propiedades benéficas en la salud, pero los procesos de extracción con temperaturas altas o con ciertos disolventes pueden ser inadecuados. La extracción de esos compuestos debe realizarse en condiciones que no alteren sus propiedades bioactivas, y un método de extracción ideal debe ser rápido, cuantitativo y no destructivo (Yang et al., 2011).
Por lo anterior, el objetivo de este estudio fue aplicar los pretratamientos con microondas, ultrasonido y enzimas (proteasa, celulasa, pectinasa) para aumentar el rendimiento de extracción de los compuestos bioactivos de la pitaya roja (S. stellatus) y determinar el efecto de la presencia de semillas sobre la extracción de betacianinas, betaxantinas, betalaínas totales, compuestos fenólicos totales y capacidad antioxidante.
Materiales y Métodos
Reactivos
Todos los reactivos utilizados fueron de grado analítico. Ácido gálico, ABTS [2,2-azinobis-(3-ethilbenzothiazolina 6-ácido sulfonico)] y Trolox (6-hidroxi-2,5,7,8-tetrametilcroman-2-ácido carboxílico) se obtuvieron de Sigma-Aldrich (México). Para los tratamientos enzimáticos se usaron preparaciones comerciales de proteasa, celulasa y pectinasa de grado alimentario adquiridas en ENMEX (México).
Material vegetal
Los frutos de pitaya roja se recolectaron durante la temporada de cosecha de agosto a septiembre del 2013 en Santiago Tonahuixtla, Puebla (18° 12’ 5.35” N, 97° 53’ 50.75” O). Las características físicas de los frutos fueron: peso de 45.1 a 103.1 g, longitud de 4.6 a 5.6 cm y diámetro de 3.9 a 5.8 cm. Los frutos seleccionados eran sanos, sin daños o manchas. Para almacenar los frutos se retiraron las espinas y se empacaron en bolsas de polietileno al vacío y se almacenaron a -20 °C hasta su análisis.
Preparación de las muestras
Las muestras se retiraron del congelador y se colocaron 24 h en refrigeración (4-10 °C) antes de su análisis. Los estudios se realizaron en pulpa con o sin semillas, para lo cual se separó la piel de los frutos y la pulpa se separó en dos porciones. Una de ellas se tamizó con una malla del # 25 (710 µm) para eliminar las semillas y después se homogeneizó con un procesador de alimentos para obtener la muestra de pulpa sin semillas. La otra parte se homogeneizó completa y se tamizó para obtener la pulpa con semillas.
Contenido de agua
El contenido de agua se determinó en la pulpa con y sin semillas, con la pérdida de peso de las muestras después de secar en horno a 110 °C (método AOAC 942.05) (AOAC, 1990).
Determinación de pH
El pH se midió en una solución acuosa de pulpa macerada con y sin semillas al 10 % p v-1 usando un potenciómetro (Denver Instrument UB-10 Colorado, EE.UU.; método AOAC 981.12).
Pretratamientos de la muestra
Los tres tipos de pretratamientos evaluados fueron: microondas, ultrasonido e hidrólisis enzimática. Porciones de 6.2 g de muestra se colocaron en tubos de ensayo de 20 mL con tapa de rosca y se sometieron a los diversos pretratamientos. En todos los casos se analizó una muestra sin pretratamiento o muestra control (C), usada para evaluar el efecto del pretratamiento.
Microondas
La muestra se colocó en el centro de un horno de microondas de uso doméstico (Acros AM1007Q, China, 1050 W) y se aplicó el pretratamiento a 105 W (10 % de la potencia máxima) por 62 min (M1, M2). Después del tratamiento la temperatura fue 36±1 °C para M1 y 45±1 °C para M2.
Ultrasonido
Las muestras se mantuvieron dentro de un baño de ultrasonido con control de temperatura (Bransonic CPX5800H, EE. UU., 40 KHz) a 20 °C durante 5 (U1), 10 (U2), 15 (U3), 20 (U4), 25 (U5), 30 (U6) y 35 (U7) min.
Hidrólisis enzimática
Previo al pretratamiento, se midió el pH de las muestras y fue 4.0±0.5, el cual está dentro del intervalo recomendado por el proveedor de las enzimas. Las muestras de pulpa con y sin semillas se mezclaron por separado con las preparaciones enzimáticas de proteasa (PT), pectinasa (PC), celulasa (CL) y las tres enzimas juntas (PPC) en una proporción de 0.5% p p-1. Las mezclas se incubaron en un baño de calentamiento con agitación (Aquatherm G-86, New Brunswick Scientific, EE. UU.) por 2 h y 24 h a 150 rpm y 40±1 °C. Al terminar la incubación, la reacción enzimática se detuvo calentando la mezcla de reacción en un baño maría a 95 °C por 5 min y luego enfriamiento con baño de hielo a 2±2 °C por 10 min (Naderi et al., 2010).
Después de la aplicación de los pretratamientos, las muestras se extrajeron según el procedimiento descrito en la sección “Preparación de los extractos” y se midieron betacianinas, betaxantinas, betalaínas totales, compuestos fenólicos totales y capacidad antioxidante.
Preparación de los extractos
Muestras de 6.2 g de pulpa con o sin semillas, con o sin pretratamiento se colocaron por separado en un tubo de 50 mL con tapa de rosca y se adicionaron 10 mL de agua destilada. Las mezclas se agitaron en vortex (GEMMY VM-300 Taipei, Taiwan) por 1 min a velocidad máxima (3200 rpm) y después se centrifugaron a 10576 xg por 20 min (Dynamica Velocity 14R, Londres, Reino Unido). El sobrenadante se separó y los sólidos remanentes se usaron para una segunda extracción bajo las mismas condiciones, adicionando 5 mL de agua. Los extractos obtenidos de la primera y segunda extracción se colocaron en un matraz volumétrico de 25 mL, se aforó el volumen con agua y la solución se usó para determinar betacianinas, betaxantinas, betalaínas totales, compuestos fenólicos totales y capacidad antioxidante.
Cuantificación de los pigmentos
El contenido de betaxantinas (Bx) y betacianinas (Bc) se cuantificó midiendo la absorbancia a 483 y 538 nm, respectivamente (Castellanos-Santiago y Yahia, 2008) con un espectrofotómetro UV-Vis (HACH DR5000, México). Las concentraciones de cada pigmento se calcularon con la Ecuación 1. Las betalaínas totales se calcularon sumando Bc y Bx.
donde B: Bx o Bc se expresaron en términos de mg de indicaxantina o betanina, respectivamente, por 100 g de muestra en peso seco (ps); A: absorbancia a 483 nm para Bx y a 538 nm para Bc.; FD: factor de dilución; PM: peso molecular (indicaxantina 308 g mol-1 y betanina 550 g mol-1); V: volumen del extracto (mL); Ɛ: coeficiente de extinción molar (indicaxantina=48 000 L mol-1 cm-1 y betanina=60 000 L mol-1 cm-1;P: cantidad de muestra (g); L: la longitud de la celda (1 cm).
Cuantificación de los compuestos fenólicos totales
Para esta cuantificación 400 µL del extracto se mezclaron con 3 mL de agua destilada, 200 µL del reactivo de Folin-Ciocalteu y 400 µL de solución de carbonato de sodio al 20 % (Singleton et al., 1999). La mezcla se agitó en vortex por 30 s, se mantuvo en la obscuridad por 30 min a 20±2 °C y se midió la absorbancia a 765 nm. Los valores de absorbancia se interpolaron en una curva estándar de ácido gálico. Los valores de compuestos fenólicos totales se presentan como mg equivalentes de ácido gálico (EAG) 100 g-1 de muestra ps.
Determinación de la capacidad antioxidante mediante el ensayo del ABTS
El radical ABTS•+ se preparó mezclando la solución de ABTS (7 mM) con persulfato de potasio (2.45 mM) (Re et al., 1999), la mezcla con el radical se mantuvo en obscuridad por 16 h antes de usarlo. Un mililitro del radical ABTS•+ se diluyó con 100 mL de regulador fosfato de sodio (PBS) 0.01 M pH 7.4, hasta obtener una absorbancia aproximada de 0.7±0.02 a 734 nm. Del extracto se tomó una alícuota de 200 µL y se adicionó 3.8 mL de la solución del radical ABST, la mezcla se agitó en vortex por 10 s, se mantuvo en obscuridad por 7 min a 20±2 °C y se midió su absorbancia a 734 nm (Af). Para cada muestra se realizó un blanco con 200 µL de metanol (A0). El porcentaje de inhibición se calculó y se interpoló en la curva de calibración de 30-300 mg mL-1 Trolox. Los resultados se expresan como mg equivalentes de Trolox (ET) 100 g-1 de muestra ps.
Diseño experimental y análisis estadístico de los resultados
El diseño experimental fue completamente al azar para los pretratamientos y se evaluaron dos factores: 1) tipo de muestra (pulpa con o sin semillas) y 2) tipo de pretratamiento; la unidad experimental fue el extracto de 25 mL obtenido bajo cada condición experimental y todos los análisis se realizaron por triplicado. Los resultados se reportan como el promedio ± desviación estándar (DE), se realizó un ANDEVA y las medias se compararon con el método de Fisher (p≤0.05). Para comparar el efecto del tipo de muestra y de pretratamientos se realizó un análisis de dos vías, así como un análisis de componentes principales (ACP) para analizar la correlación entre las variables evaluadas y los pretratamientos. El procesamiento de datos se efectuó con el programa Minitab 16 (Minitab Inc., Pennsylvania EE. UU.) y GraphPad Prism 6 (GraphPad Software, California EE. UU.).
Resultados y Discusión
Efecto del pretratamiento en la extracción de los compuestos bioactivos en pulpa con y sin semillas de pitaya roja
Extracción de las betalaínas en pulpa con y sin semillas de pitaya roja
En todos los extractos obtenidos de pulpa con y sin semillas tratadas enzimáticamente, el contenido de betalaínas totales se redujo (p≤0.05) respecto al testigo sin pretratamiento (Figura 1). Al comparar los valores de pigmentos extraídos en los testigos sin tratamiento enzimático (CEA y CEB), se observa que al aumentar el tiempo de incubación de 2 h a 24 h, la cantidad de betalaínas totales disminuyen del 9-34 % en pulpa sin semillas y del 28-42 % en pulpa con semillas. Esta disminución se puede deber al calentamiento de las muestras durante el periodo de incubación con las diferentes enzimas, lo cual destruye pigmentos termosensibles presentes en la pulpa de pitaya.
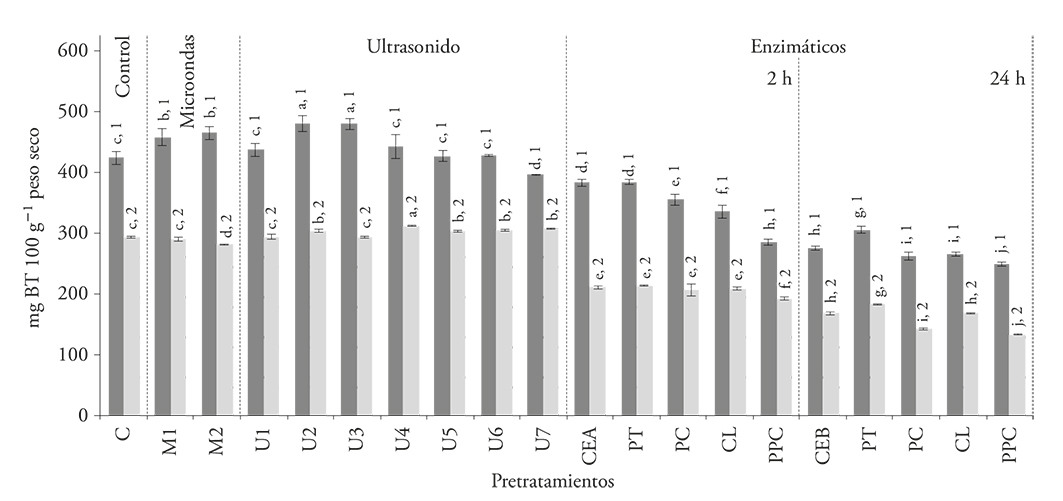
Figura 1 Contenido de betalaínas totales de los extractos de pulpa sin semillas ( ) y pulpa con semillas (
) y pulpa con semillas ( ) obtenidos después de la aplicación de los pretratamientos: microondas (M), ultrasonido (U), proteasa (PT), pectinasa (PC), celulasa (CL), mezcla de enzimas (PPC), comparados con los testigos sin tratamiento (C, CEA, CEB). Los números indican diferencia significativa entre las muestras; las letras indican diferencia significativa entre los pretratamientos (p≤0.05).
) obtenidos después de la aplicación de los pretratamientos: microondas (M), ultrasonido (U), proteasa (PT), pectinasa (PC), celulasa (CL), mezcla de enzimas (PPC), comparados con los testigos sin tratamiento (C, CEA, CEB). Los números indican diferencia significativa entre las muestras; las letras indican diferencia significativa entre los pretratamientos (p≤0.05).
Herbach et al. (2007) observaron una pérdida de betalaínas totales de 24 % al realizar una hidrólisis parcial del mucilago de pitahaya (Hylocereus polyrhizus) con una preparación enzimática a 40 °C por 2 h. El valor 9.4-32.7 % obtenido en nuestro estudio para la extracción de esos pigmentos en S. stellatus es similar al reportado por esos autores.
Respecto al pretratamiento con ultrasonido, el contenido de betalaínas totales aumentó 13.1% en los extractos de pulpa sin semillas a los 15 min, pero tiempos mayores de exposición al ultrasonido no aumentaron la eficiencia de extracción (Figura 1). Este efecto se puede deber a la alteración de las paredes celulares que facilita el proceso de extracción de los pigmentos (Panchev et al., 1988; Bagherian et al., 2011). El efecto en la pulpa con semillas fue prácticamente despreciable en todos los tiempos de exposición (Figura 1). El aumento obtenido para la pulpa sin semillas, fue mayor al observado por Sivakumar et al. (2009), quienes muestran que el rendimiento de la extracción de pigmentos del betabel aumentó sólo 8 % al aplicar el mismo pretratamiento.
La presencia de las semillas de pitaya tuvo un efecto negativo en la extracción de pigmentos: el contenido de betalaínas totales disminuyó 22.3-46.7 % en la pulpa con semillas, respecto a la pulpa sin semillas.
Extracción de compuestos fenólicos totales en pulpa con y sin semillas de pitaya roja
En contraste con los resultados para betalaínas, el contenido de compuestos fenólicos totales en los extractos de ambos tipos de pulpas aumentó (p≤0.05) al aplicar los pretratamientos enzimáticos a las 2 h, en especial con la aplicación de PC. Al igual que en la extracción de betalaínas, tiempos de 24 h de incubación tienen un efecto negativo sobre la extracción de fenoles totales (Figura 2), debido también a la acción del calentamiento (pretratamiento CEA vs CEB).
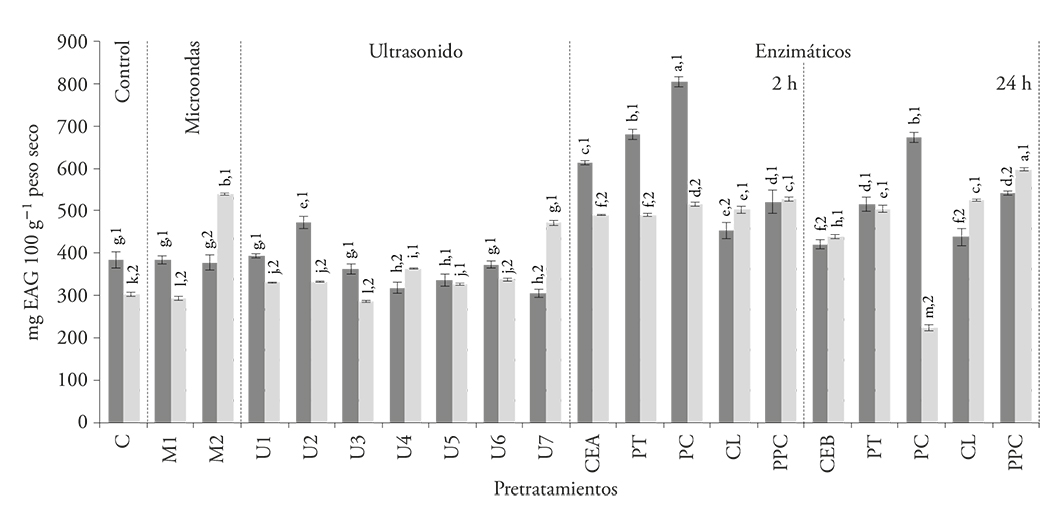
Figura 2 Compuestos fenólicos totales de los extractos de pulpa sin semillas ( ) y pulpa con semillas (
) y pulpa con semillas ( ) obtenidos después de la aplicación de los pretratamientos: microondas (M), ultrasonido (U), proteasa (PT), pectinasa (PC), celulasa (CL), mezcla de enzimas (PPC), comparados con los testigos sin tratamiento (C, CEA, CEB). Los números indican diferencia significativa entre las muestras; las letras indican diferencia significativa entre los pretratamientos (p≤0.05).
) obtenidos después de la aplicación de los pretratamientos: microondas (M), ultrasonido (U), proteasa (PT), pectinasa (PC), celulasa (CL), mezcla de enzimas (PPC), comparados con los testigos sin tratamiento (C, CEA, CEB). Los números indican diferencia significativa entre las muestras; las letras indican diferencia significativa entre los pretratamientos (p≤0.05).
La aplicación de enzimas hidrolíticas aumenta la extracción de compuestos fenólicos totales y en nuestro estudio el contenido de estos compuestos aumentó 109.8 y 70.4 % en los extractos de pulpa sin semillas y con semillas, respectivamente, cuando se utilizó el pretratamiento con pectinasa por 2 h (Figura 2). Gómez-García et al. (2012) reportan incrementos de compuestos fenólicos de 25 % en residuos de uva y de 28-35 % en desechos de frambuesa (Laroze et al., 2010), los cuales son valores inferiores a los de nuestro estudio.
Según Puri et al. (2012), al aplicar tratamientos enzimáticos, la hidrólisis parcial del mucílago permite extraer los compuestos ligados a la matriz polimérica lo cual facilita el procesamiento de muestras. El ácido galacturónico es un componente abundante del mucílago que puede ser liberado durante la hidrólisis enzimática y la exposición de los grupos funcionales (hidroxilo y carboxilo) puede aumentar el valor de fenoles totales (Combo et al., 2011).
Respecto a los pretratamientos con microondas, se observaron diferencias significativas en la extracción de compuestos fenólicos entre la pulpa con y sin semillas. La aplicación de microondas por 2 min (M2) aumentó 78.1 % (p≤0.05) la extracción de los compuestos fenólicos desde la pulpa con semillas, lo cual se puede deber a la ruptura de tejidos y mayor interacción entre el disolvente y la matriz (Bagherian et al., 2011). Sin embargo, en la pulpa sin semillas este pretratamiento no tuvo efecto (Figura 2).
Además, la exposición a ondas ultrasónicas no causó incrementos significativos (p≤0.05) en el contenido de compuestos fenólicos totales en la mayoría de las condiciones probadas para ambas muestras.
La extracción de compuestos fenólicos en pitayas usando microondas como pretratamiento es más eficiente que la obtenida por Nayak et al. (2015), quienes reportan un aumento de 20.5 % en cáscaras de cítricos, comparada con la extracción convencional por disolventes. Esto significa que el efecto de los pretratamientos sobre el rendimiento de compuestos fenólicos totales en los extractos depende del tipo de material vegetal sobre el cual se aplique. En la pitaya, la extracción de compuestos fenólicos es mayor con pectinasa, y mejor en la pulpa sin semillas.
Valores de capacidad antioxidante en los extractos de pulpa con y sin semillas de pitaya roja
Los tratamientos enzimáticos en pulpa con y sin semillas aumentaron los valores de capacidad antioxidante en los extractos obtenidos de ambas muestras (Figura 3), y el efecto fue mayor por la acción de la pectinasa (PC) por 2 h. De manera similar a lo observado en la extracción de compuesto fenólicos, el aumento de la temperatura tiene un efecto positivo ya que aumentó la capacidad antioxidante de los extractos, pero solo a tiempos cortos de incubación.
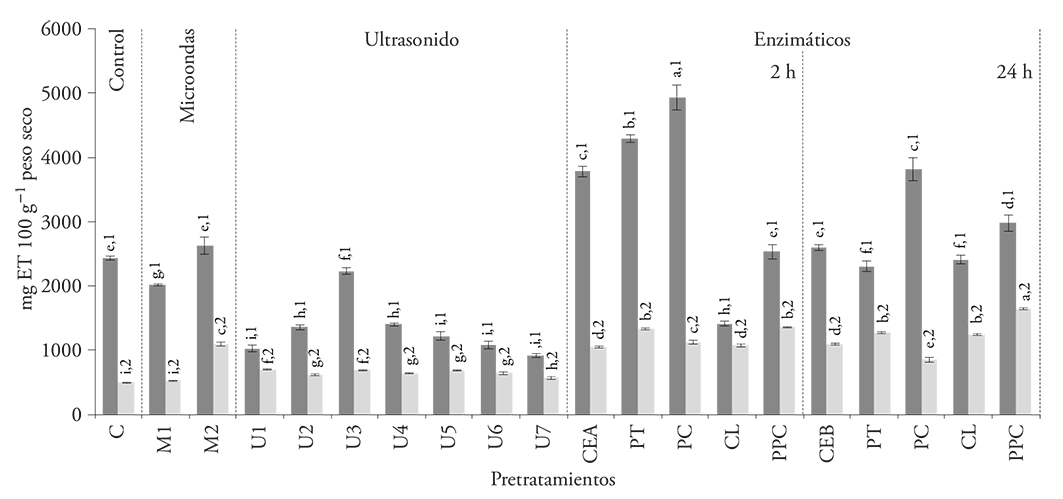
Figura 3 Capacidad antioxidante de los extractos de pulpa sin semillas ( ) y pulpa con semillas (
) y pulpa con semillas ( ) obtenidos después de la aplicación de los pretratamientos: microondas (M), ultrasonido (U), proteasa (PT), pectinasa (PC), celulasa (CL), mezcla de enzimas (PPC), comparados con los testigos sin tratamiento (C, CEA, CEB). Los números indican diferencia significativa entre las muestras; las letras indican diferencia significativa entre los pretratamientos (p≤0.05).
) obtenidos después de la aplicación de los pretratamientos: microondas (M), ultrasonido (U), proteasa (PT), pectinasa (PC), celulasa (CL), mezcla de enzimas (PPC), comparados con los testigos sin tratamiento (C, CEA, CEB). Los números indican diferencia significativa entre las muestras; las letras indican diferencia significativa entre los pretratamientos (p≤0.05).
La extracción de compuestos antioxidantes en la pitaya se mejora con los tratamientos de proteasa y pectinasa, pero se obtiene una mayor extracción al eliminar las semillas de la pulpa (Figura 3). El uso de pectinasa aumentó la capacidad antioxidante de los extractos de pulpa sin semillas hasta 74.8 % y 25.3 % en la pulpa con semillas. Estos valores son mayores a los obtenidos en los tratamientos por microondas o ultrasonido (Figura 3).
El aumento en la capacidad antioxidante en los extractos al aplicar el tratamiento con pectinasa puede ser causado por la hidrólisis de la pectina o el mucílago de la pulpa de la pitaya, lo cual puede liberar fragmentos con mayor capacidad antioxidante que los polímeros que les dieron origen (Chaouch et al., 2015), o bien a la ruptura de las redes poliméricas que libera compuestos antioxidantes, incluso compuestos fenólicos (Kunnika and Pranee, 2011).
Para determinar si las diferencias en las concentraciones de componentes bioactivos en los extractos se debían a la presencia de las semillas en la pulpa o a un efecto de dilución, se calcularon los valores corregidos de pigmentos, capacidad antioxidante y compuestos fenólicos totales por 100 g de pulpa, considerando la proporción de semillas en las muestras. Los resultados obtenidos para las muestras sin pretratamiento (testigo) y con los pretratamientos de ultrasonido por 15 min y pectinasa a 2 h, están en el Cuadro 1. Según los resultados habría un contenido mayor de pigmentos amarillos (Bx) que de pigmentos rojos (Bc) en las pulpas estudiadas, aunque según Pérez-Loredo et al. (2016) los parámetros cromáticos L*, a* y b* de los frutos S. stellatus confirman la coloración de la pulpa en las pitayas rojas. Esta discrepancia también se observa en estudios sobre betalaínas en tunas rojas de Opuntia ficus-indica (Fernández-López et al., 2010), y se puede deber a la sobreestimación de los valores de Bx por el traslape de las bandas del espectro de absorción de Bx y Bc, o el uso de coeficientes de extinción medios.
Cuadro 1 Valores de pigmentos (Bc, Bx, BT), fenoles (CFT) y capacidad antioxidante (CA) de los extractos acuosos de la pulpa sin semillas y con semillas obtenidos con los mejores pretratamientos.

Media ± la desviación estándar (DE), n=3. El contenido de humedad de las muestras fue 88.6 % en pulpa sin semillas y 87.5 % en pulpa con semillas. Valores expresados por 100 g de pulpa en peso seco (ps). Los superíndices indican diferencias significativas para cada variable (p≤0.05): los números indican diferencia significativa entre muestras; las letras indican diferencia significativa entre los pretratamientos. *Los valores corregidos fueron calculados considerando un contenido de semillas en la pulpa del fruto de 30.2 %.
Una investigación sobre el número y tipo de betalaínas presentes en las pitayas del género Stenocereus usando HPLC-DAD se realiza en nuestro grupo de trabajo. Los resultados preliminares indican que en el extracto de la pulpa hay cuatro tipos de betaxantinas y cinco de betacianinas (las últimas predominan). A pesar de la probabilidad de un sesgo en los resultados, es posible apreciar el nivel de betalaínas en los extractos de frutos de cactáceas con métodos espectrofotométricos (Fernández-López et al., 2002). En nuestro estudio, los valores de betalaínas totales permitieron evaluar y comparar el efecto de diversos pretratamientos en la extracción de pigmentos en la pitaya roja.
La comparación de los datos corregidos del Cuadro 1 confirma que la presencia de semillas tiene un impacto negativo en la extracción de los pigmentos y la capacidad antioxidante, y sólo se obtiene un ligero aumento en la extracción de compuestos fenólicos totales (<13 %), por lo cual es más recomendable usar la pulpa sin semillas. Además, se observó un obscurecimiento de los extractos de la pulpa con semillas que se puede deber a la oxidación o degradación de algunos compuestos en el extracto. La presencia de semillas podría favorecer el pardeamiento no enzimático o la oxidación del ácido ascórbico (Suh et al., 2003) que promueven el decaimiento de las betalaínas.
Para correlacionar la eficiencia de extracción de los pigmentos, los compuestos fenólicos y capacidad antioxidante con los pretratamientos usados, se aplicó un ACP. Este análisis estadístico permite obtener gráficos donde el agrupamiento de los datos en los cuadrantes ayuda a definir la relación entre las variables.
Análisis de componentes principales (ACP) de la extracción de los compuestos bioactivos en relación al pretratamiento utilizado
El ACP se usa en estudios de los alimentos para clasificar variables mediante la reducción estadística de los datos. Los grupos de datos originales se transforman en nuevos grupos de variables no correlacionadas llamados componentes principales (CP), con los cuales se elaboran gráficos que permiten evaluar visualmente similitudes entre las muestras, y determinar si esas muestras se pueden agrupar (Perez-Loredo et al., 2016).
El análisis de los resultados de betacianinas (Bc), betaxantinas (Bx), betalaínas totales (BT), compuestos fenólicos totales (CFT) y capacidad antioxidante (CA) mediante ACP, mostró que dos CP explican 96.3 % de la variación total de los resultados (CP1: 71.6 %; CP2: 24.7 %) en pulpa sin semillas (Figura 4), y 97.3 % (CP1: 82.1 %; CP2: 15.2 %) en pulpa con semillas (Figura 5).
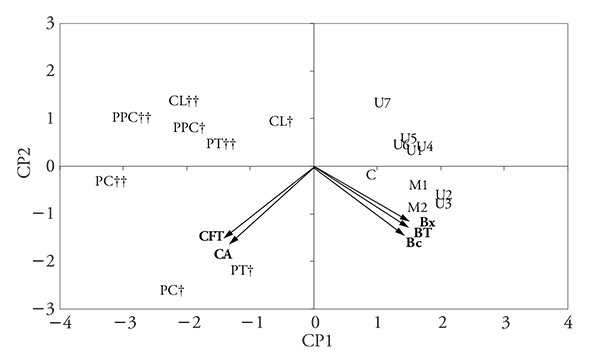
Figura 4 Gráfica de dos dimensiones de los componentes principales CP1 y CP2 para las cargas y puntuaciones del ACP de Bc, Bx, BT, CFT y CA obtenidos en pulpa sin semillas sin pretratamiento (C) y con pretratamiento de microondas (M), ultrasonido (U), y con las enzimas proteasa (PT), pectinasa (PC), celulasa (CL), proteasa, pectinasa y celulasa (PPC) a 2 (†) y 24 h (††) de incubación.
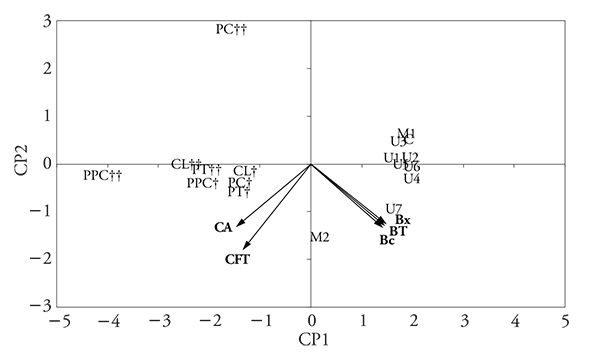
Figura 5 Gráfica de dos dimensiones de los componentes principales CP1 y CP2 para las cargas y puntuaciones del ACP de Bc, Bx, BT, CFT y CA obtenidos en pulpa con semillas sin pretratamiento (C) y con pretratamiento de microondas (M), ultrasonido (U), y con las enzimas proteasa (PT), pectinasa (PC), celulasa (CL), proteasa, pectinasa y celulasa (PPC) a 2 (†) y 24 h (††) de incubación.
Los gráficos de barras son útiles para análisis cuantitativos de las diferencias entre los tratamientos para cada muestra (Figura 1, 2 y 3). Pero el gráfico de CP permite analizar todos los resultados en conjunto y concluir en función de los agrupamientos (Figuras 4 y 5).
El análisis de los gráficos de ACP para la pulpa con y sin semillas (Figura 4, 5) permite observar que los tratamientos enzimáticos (PC y PT) ofrecen mayor rendimiento de extracción de CFT y CA, mientras que con el ultrasonido (U) y microondas (M) se obtiene mayor rendimiento para pigmentos. Para la pulpa sin semillas (Figura 4), los pretratamientos enzimáticos con periodos largos de incubación (24 h, ††) o los de ultrasonido con mayores tiempos de exposición (U4-U7), están alejados de las variables BT, CFT y CA (en los cuadrantes CP2 positivo); esto significa que mayores tiempos no favorecen la extracción. Este efecto no es tan notorio en la pulpa con semillas (Figura 5), porque los rendimientos de extracción de BT, CFT y CA son muy similares con los diferentes tratamientos y en la mayoría de ellos no hay diferencias significativas (p>0.05) (Figuras 1, 2 y 3).
Cabe resaltar que la capacidad antioxidante tiene mayor correlación con la cantidad de compuestos fenólicos (ambas en CP1 negativo), que con la cantidad de betalaínas (en CP1 positivo).
Con base en estos resultados, se sugiere que para usar la pitaya como fuente de compuestos bioactivos, la pulpa debe separarse de las semillas y para maximizar la extracción de pigmentos, compuestos fenólicos y capacidad antioxidante, aquella se debe tratar primero con ultrasonido por 15 min y pectinasa al 0.5 % p p-1 por 2 h.
Conclusiones
La aplicación de pretratamientos con microondas, ultrasonido y enzimas hidrolíticas afecta el rendimiento de extracción de betalaínas, fenoles y actividad antioxidante de la pitaya roja (S. stellatus). La selección del mejor pretratamiento de la muestra para la extracción de compuestos bioactivos específicos dependerá de la matriz y el objetivo del estudio. Los valores de betacianinas, betaxantinas y betalaínas totales máximos se obtuvieron al aplicar ultrasonido por 15 min. El contenido de fenoles totales y capacidad antioxidante máximos se obtuvieron al pretratar la pulpa con pectinasa.











 text in
text in 


