Introducción
Guarianthe skinneri (Bateman) Dressler & Higgins (antes Cattleya skinneri Bateman), llamada “La Candelaria” es una orquídea epífita silvestre, distribuida desde el sureste de México hasta Panamá (Cabrera, 2006). Actualmente se encuentra amenazada por la destrucción de su hábitat natural, y por la alta demanda en temporada de floración debido a la belleza de sus flores, que van de lilas a moradas; plantas completas son arrancadas de sus forófitos en remanentes de bosques, selvas y agroecosistemas de café (Damon, 2013; Solano-Gómez et al., 2016). Para su protección, en México está enlistada en la categoría de amenazada en la NOM-ECOL-059-SEMARNAT-2010, e internacionalmente se encuentra en la categoría II del CITES (Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestre).
Una de las estrategias de conservación, es el cultivo sostenible, el cual solo se permite con los permisos correspondientes (Damon, 2017). Las orquídeas se pueden reproducir por propagación asexual con la división de plantas, no obstante, este proceso es lento, demanda conocimiento de buenas prácticas de manejo para evitar enfermedades y, al ser plantas clonales, la diversidad genética es baja, lo cual representa una desventaja cuando se trata de rescatar y conservar la máxima variabilidad genética. Por el contrario, con la propagación sexual, a través de semillas, la variabilidad genética es mayor, y contribuye al mantenimiento de las poblaciones, y las plantas desarrolladas tienen mayor probabilidad de estar libres de enfermedades. Las semillas de las orquídeas son muy pequeñas (0.006 a 0.2 mm de longitud, de acuerdo con la especie), no tienen endospermo y carecen de reservas, o solo tienen un mínimo de lípidos para germinar (Arditti & Ghani., 2000; Koene et al., 2020; Yeung, 2017). Para la germinación de las semillas y otras funciones fisiológicas, las plantas de la familia Orchidaceae requieren de la asociación con hongos endófitos formadores de micorrizas o HEFM (López-Chávez et al., 2016; Rasmussen et al., 2015). Las orquídeas se caracterizan por la formación del protocormo, estructura embrionaria con incremento de volumen por división celular y diferenciación del meristemo apical, con expresión génica distinta a la del embrión inicial, que consiste en una masa de células aun no diferenciadas, y diseñadas para establecer la asociación con los HEFM (Fang et al., 2016). A partir de estudios in situ, se estima que, aun suponiendo la disponibilidad de los HEFM en el medio natural, solo el 1 % de semillas germinan, lo que implica bajas tasas de reclutamiento de nuevos individuos para el mantenimiento de las poblaciones naturales (Cruz-Higareda et al., 2015; Emeterio-Lara et al., 2018). Por ello, resulta útil enfocar esfuerzos para optimizar el aprovechamiento de las semillas producidas por las poblaciones naturales.
Desde hace varias décadas se ha implementado la germinación asimbiótica (sin la asociación de un HEFM) de semillas de orquídeas en laboratorio (in vitro), basándose en el uso de diferentes medios de cultivo adicionados con sacarosa para sustituir los recursos alimenticios provistos por los hongos (Arditti & Ghani, 2000). Se ha reportado el uso de medios como Murashige & Skoog (1962) (Coello et al., 2010) y otros medios de cultivo utilizados para la germinación de semillas de orquídeas como el medio Dalla Rosa & Laneri (1977), Yasuda et al. (1985) y Knudson (1946), los cuales han tenido respuestas favorables (Damon et al., 2014; Torres-González et al., 2011) y no han sido reportados para la germinación de semillas de G. skinneri. Los medios de cultivo pueden ser adicionados con reguladores de crecimiento, por ejemplo, con 6- bencilaminopurina (BAP), conocida por promover la diferenciación celular y proliferación de protocormos (David et al., 2008) o la adición de componentes orgánicos como el agua de coco (Cocos nucifera L.) que facilita la germinación por el contenido de varias hormonas como auxinas y citoquininas (Utami & Hariyanto, 2020). Una de las respuestas observadas en el cultivo in vitro es la oxidación u oscurecimiento de las células vegetales causado por diversos factores, como la composición del medio de cultivo o condiciones ambientales, entre otros. Los periodos de escotoperiodo (Vogel & Macedo, 2011) y la reducción de las concentraciones de los medios de cultivo (Cassells & Curry, 2001) son medidas propuestas para evitar la oxidación en el cultivo de tejidos vegetales in vitro.
Una de las ventajas de la germinación in vitro es que se pueden observar detalladamente las fases de germinación y la proporción de individuos en cada una de ellas, y de allí poder precisar tratamientos para optimizar el proceso. Se ha documentado, bajo condiciones de laboratorio, que los embriones pasan por diferentes fases, y de acuerdo al criterio aplicado puede ir desde la fase 0 hasta la 5, 6 o 7. Las fases contemplan desde semillas sin embrion (0), el hinchamiento o imbibición del embrión (1), ruptura de testa (cubierta delgada que protege al embrión) (1-2), incremento de tamaño del embrión (3), diferenciación de protocormos (3-4), desarrollo de ápices foliares y raicillas (5) y el desarrollo de hojas y raíces (6-7) (Damon et al., 2014; Johnson & Kane, 2007; Maldonado et al., 2020; Salazar-Mercado, 2012; Stewart & Kane, 2006; Vasudevan & Van Staden, 2010; Vogel & Macedo, 2011). Además, se ha observado variación en el tiempo de inicio de la germinación de las semillas, conocido como asincronía (Koene et al., 2020). Las fases de desarrollo y el grado de asincronía no han sido reportados aún en la germinación asimbiotica in vitro de G. skinneri.
Por lo antes mencionado, el objetivo de este estudio fue identificar el efecto de cuatro medios de cultivo, en combinación con dos condiciones de escotoperiodo, sobre las fases de germinación asimbiótica de G. skinneri, en condiciones de in vitro, para la producción de plántulas.
Materiales y métodos
Material biológico y desinfección de la cápsula
En abril del 2020, se colectaron cápsulas de semillas maduras, antes de la dehiscencia (aproximadamente 12 meses de desarrollo) de G. skinneri (5 cm de longitud x 1.5 cm de diámetro), disponibles en el Jardín Etnobiológico de las Selvas del Soconusco (JESS), de El Colegio de la Frontera Sur, ubicado en el municipio de Tuzantán, Chiapas (Coordenadas: 15º07'02.3'' N, 92º24'48.7'' W y altitud de 80 m). Se encontraron dos cápsulas que se trasladaron en una bolsa etiquetada hacia el Laboratorio de Biotecnología del Campo Experimental Rosario Izapa del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (CERI-INIFAP), en Tuxtla Chico, Chiapas. De estas dos capsulas solo una tenía la calidad adecuada y se trabajó con una cápsula.
La cápsula se desinfestó usando la metodología de (Torres-González et al., 2011), con las siguientes modificaciones: la superficie de la cápsula se limpió por un minuto con algodón humedecido con detergente líquido comercial y se enjuagó con abundante agua del grifo. Dentro de la campana de flujo laminar, la cápsula se colocó en una caja de Petri de vidrio esterilizada (de 90 x 15 mm) y se asperjó con alcohol etílico 96 % y se flameó por 30 s.
Siembra de semillas en medios de cultivo y escotoperiodo
Una vez que la cápsula estuvo a temperatura ambiente, se realizó un corte longitudinal (Fig. 1A); con una pinza se extrajeron las semillas y se depositaron en 50 mL de agua destilada esterilizada, después se agitó constantemente para formar una solución homogénea. Con una micropipeta, se tomaron 500 µL de la solución (aproximadamente 3,171 semillas), cantidad que se depositó en la superficie de cuatro medios de cultivo semisólidos (Fig. 1B). Al finalizar la siembra, las cajas Petri selladas y etiquetadas se incubaron a 26 ± 1 °C, en dos condiciones de escotoperiodo, de 12 h o 24 h. Para la primera condición de escotoperiodo, la fase luminosa se suministró con lámparas LED de color blanco frio (Smartlight, con 43 µmol m-2 s-1).

Fig. 1 A) Corte longitudinal de cápsula de semillas de Guarianthe skinneri, B) Siembra de semillas en medio de cultivo y C) Plántulas de G. skinneri en proceso de aclimatación.
Los cuatro medios semisólidos utilizados para la siembra de las semillas correspondieron a los siguientes: Medio Y10, con macro y micronutrimentos de Yasuda et al. (1985) al 10%, adicionado con 0.112 mg L-1 6-bencilaminopurina (BAP; Sigma-Aldrich©); medio Y100, constituido por las sales de Yasuda et al. (1985) al 100%, con 1.125 mg L-1 BAP, ambos medios con 30 g L-1 de sacarosa, 5.2 g L-1 de Phytagel (Sigma-Aldrich©) y pH de 6.3 de acuerdo con Torres et al. (2011). Medio DR (Dalla Rosa & Laneri, 1977), adicionado con 150 mL L-1 de agua de coco (A de cocoR), 20 g L-1 de sacarosa y 8 g L-1 de agar (Bacto Agar BD) y pH 5.5. Medio MS (Murashige & Skoog, 1962) con 30 g L-1 de sacarosa, 5.2 g L-1 de Phytagel y pH de 5.8. Todos los medios fueron esterilizados a 120 °C y 1.1 kg cm-2 de presión por 20 min y después se vertieron 10 mL en cajas Petri esterilizadas de 60 x 15 mm.
Prueba de viabilidad
De la solución utilizada en la siembra, se depositaron 500 µL en un criotubo de 2000 µL, dejando que las semillas se precipitaran. Con una micropipeta se retiró el agua del criotubo, enseguida se agregaron 1.5 mL de una solución de 1 g L-1 de tetrazolio (2,3,5-cloruro trifenil tetrazolio; Sigma-Aldrich©); la muestra se preservó en oscuridad por 24 h en 26 ± 1 °C. Posteriormente la viabilidad se evaluó, para lo cual, se realizó la observación y conteo de las semillas en tetrazolio por campo de visión en un microscopio estereoscopio Zeiss (1.0 x FWD 81 mm). Las semillas se consideraron viables cuando se observó el embrión teñido en rojo; semillas con el embrión de color blanco se consideraron no viables, y semillas vanas o vacías eran las que no tenían embrión. El porcentaje de viabilidad se obtuvo al multiplicar el número de semillas viables (embriones teñidos) por 100, dividido entre el total de semillas en la muestra. El conteo se realizó 10 veces en zonas diferentes de cada una de las cuatro placas y se obtuvo un promedio.
Diseño del experimento
Para la evaluación de la germinación de las semillas se estableció un diseño experimental completamente al azar con arreglo factorial 4 x 2 (AxB), del cual se obtuvieron ocho tratamientos, resultado de la combinación de cuatro medios de cultivo (Factor A) y dos condiciones de escotoperiodo (Factor B). Para las evaluaciones, se tomaron muestras de cada tratamiento, correspondiente a 1 cm2 de medio de cultivo con 155 semillas aproximadamente, y con cuatro repeticiones.
Variables
La evaluación de la pregerminación (Fases 2 y 3) y germinación (Fases 4 y 5) se realizó de acuerdo con las fases descritas por Damon et al., (2014), modificado de esta forma: Fase 1 = semilla con embrión. Para la etapa de pregerminación, se incluye la Fase 2 = hinchamiento o imbibición de embrión y Fase 3 = ruptura de testa y formación de protocormo. La etapa de germinación comprende la Fase 4 = protocormo con ápice (diferenciación) y la Fase 5 = protocormo con emergencia de rizoides o primordio foliar (Fig. 2). Con los datos obtenidos se calculó el porcentaje de cada fase al multiplicar el número de embriones y protocormos en la fase correspondiente por 100, y el resultado obtenido dividido entre el total de semillas.

Fig 2 Fases de germinación de semillas de Guarianthe skinneri. Fase 1 = semilla con embrión, Pregerminación: Fase 2 = hinchamiento o imbibición de embrión, Fase 3 = ruptura de testa y formación de protocormo, Germinación: Fase 4 = protocormo con ápice (diferenciación) y Fase 5 = protocormo con emergencia de rizoides o primordio foliar.
Se capturaron imágenes de los embriones y protocormos usando un microscopio estereoscópico y una escala, y posteriormente se realizaron las mediciones de longitud y ancho en milímetros con el programa de procesamiento de imagen digital ImageJ®.
Para evaluar el porcentaje de oxidación se consideraron dos variantes: para el caso de las muestras expuestas a escotoperiodo de 12 h, se consideró explante oxidado al cambio de coloración en los embriones y/o protocormos verdes (clorofílicos) a café en la totalidad del tejido, sin respuesta morfogénica, y para el caso del escotoperiodo de 24 h, correspondió al cambio de coloración de blanco (aclorofílicos) a café, sin respuesta morfogénica. El porcentaje de oxidación se obtuvo al multiplicar el número de embriones y /o protocormos oxidados en cada área de muestreo por 100, y el resultado dividido entre el total de semillas por área de muestreo.
Las evaluaciones se realizaron cada siete días por 14 semanas.
Obtención de plantas aclimatadas
Se realizó la aclimatación de plántulas, de acuerdo con la metodología de Ortiz et al., (2013). Una vez que las plántulas alcanzaron 1.5 a 2 cm de altura, con cinco a seis hojas expandidas y al menos una raíz desarrollada (Fig.1C), fueron trasplantadas en recipientes de unicel (19.5 cm de largo x 17.18 cm de ancho y 7 cm de altura) que contenían una mezcla de fibra de coco, agrolita y turba de Sphagnum (proporción 1:1:1) previamente esterilizado a 120 °C y 1.1 kg cm-2 por 40 min (humedecido con 100 mL de agua destilada). Para recrear una cámara de humedad, los recipientes se colocaron en el interior de charolas de germinación sobre una base de fibra de coco humedecida con 350 mL de agua. Para evitar la deshidratación durante la aclimatación temprana, se cubrieron con un domo (vinil transparente, 54 cm de largo x 28 cm de ancho y 11 cm de altura). Finalizado el trasplante, en la base de las plántulas se aplicaron 10 mL de MS al 25 % de concentración de sales.
Las charolas de germinación se trasladaron a un invernadero con malla sombra de color negro al 70 % de luz, cubierto con plástico blanco para evitar la precipitación pluvial. Las condiciones ambientales fueron registradas con un medidor ambiental (Enviro-meter®), a mediodía, una vez a la semana por 12 semanas. Se realizaron riegos con agua destilada sobre la base del sustrato de fibra de coco para alcanzar una humedad relativa (HR) del 90 %. En la semana dos después del trasplante, en los domos se realizaron ocho perforaciones (1 cm de diámetro), en la semana tres, los domos fueron levantadas parcialmente a una altura de 12 cm, y una semana después los domos fueron retirados. Durante las siguientes dos semanas se aplicaron riegos de agua por aspersión, hasta llevar a capacidad de campo.
Análisis de datos
Los análisis estadísticos fueron realizados en R versión 4.1.2. Los datos de las fases de desarrollo y la oxidación se compararon en un análisis de varianza (ANOVA); cuando hubo diferencias significativas se realizó la comparación de medias con la prueba de Tukey (p<0.05). Se aplicó una prueba de correlación de Spearman para poder comparar el efecto de los diferentes medios de cultivo y los patrones temporales observados en relación con los promedios de la longitud y el ancho de los embriones y protocormos.
Resultados
Viabilidad y pregerminación de semillas de Guarianthe skinneri
La prueba de tetrazolio mostró que, en promedio, el porcentaje de semillas viables fue del 80.3%, el 6.8% de las semillas fueron no viables y el 12.9% fueron semillas vanas (Fig. 3).

Fig 3 Semillas maduras de Guarianthe skinneri sometidas a la prueba de viabilidad con tetrazolio. sv= semilla viable snv= semilla no viable, sse= semilla sin embrión o vana. Barra: 1 mm.
En los ocho tratamientos, la pregerminación se observó a partir de la tercera semana después de la siembra (sds), con el inicio de la Fase 2 (imbibición) de los embriones de G. skinneri. No obstante, el mayor porcentaje de respuesta para esta fase se obtuvo a partir de las seis semanas. Los tratamientos con el mayor porcentaje de imbibición en esta fase fueron el Y10/24h, DR/12h y DR/24h con más del 80 % (Cuadro 1). Conforme los embriones de la Fase 2 continuaron su desarrollo, los porcentajes de imbibición disminuyeron gradualmente en las siguientes semanas. El inicio de la Fase 3 (ruptura de testa) se observó a las 5 sds, pero a partir de las 9 sds los porcentajes más altos (>50 %) se registraron en los tratamientos Y100/12h y Y10/12h, mientras que los tratamientos Y10/24h y DR/24h, expresaron el máximo porcentaje (>60 %) hasta las 12 sds y los porcentajes más bajos se obtuvieron en MS/12h y MS/24h (Cuadro 1).
Cuadro 1 Tiempo y porcentaje de respuesta máxima y mínima en cada fase de desarrollo de semillas de Guarianthe skinneri cultivadas in vitro en diferentes condiciones de medio de cultivo y escotoperiodo, evaluados durante 14 semanas después de la siembra.
| Tratamiento | Fase de desarrollo | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pregerminación | Germinación | ||||||||||||||||||
| Fase 1 | Fase 2 | Fase 3 | Fase 4 | Fase 5 | |||||||||||||||
| Semilla | Imbibición | Ruptura de testa | Protocormo ápice | PPF† y rizoides | |||||||||||||||
| Duración sds†† |
Mínima respuesta sds (%) |
Inicio sds |
Máxima respuesta sds (%) |
Mínima respuesta sds (%) |
Inicio (sds) |
Máxima respuesta sds (%) |
Mínima respuesta sds (%) |
Inicio (sds) |
Máxima respuesta sds (%) |
Respuesta sds (%)††† |
Inicio (sds) |
Respuesta sds (%)††† |
|||||||
| Y10-12 h | 2 | 7 (7) | 3 | 7 (64) | 10 (13) | 5 | 10 (55) | 12 (13) | 8 | 12 (46) | 14 (44) | 10 | 14 (7) | ||||||
| Y10-24 h | 2 | 8 (3) | 3 | 6 (86) | 12 (12) | 5 | 12 (65) | 14 (49) | 8 | 14 (16) | 14 (16) | 10 | 14 (10) | ||||||
| Y100-12 h | 2 | 8 (11) | 3 | 7 (65) | 12 (17) | 5 | 9 (56) | 14 (46) | 8 | 14 (12) | 14 (12) | 10 | 14 (0) | ||||||
| Y100-24 h | 2 | 6 (15) | 3 | 6 (66) | 14 (9) | 5 | 14 (32) | 14 (32) | 8 | 14 (29) | 14 (29) | 10 | 14 (4) | ||||||
| DR-12 h | 2 | 5 (8) | 3 | 6 (84) | 12 (14) | 5 | 12 (47) | 13 (43) | 8 | 13 (28) | 14 (28) | 10 | 14 (1) | ||||||
| DR-24 h | 2 | 7 (7) | 3 | 6 (81) | 13 (5) | 5 | 12 (62) | 13 (47) | 8 | 14 (28) | 14 (28) | 10 | 14 (3) | ||||||
| MS-12 h | 2 | 7 (32) | 3 | 9 (45) | 11 (37) | 5 | 12 (10) | 10 (8) | 8 | 10 (08) | 14 (08) | 10 | 14 (1) | ||||||
| MS-24 h | 2 | 7 (30) | 3 | 6 (61) | 11 (63) | 5 | 12 (11) | 10 (10) | 8 | 10 (01) | 14 (01) | 10 | 14 (0) | ||||||
| Promedio | (14) | (69) | (21) | (42) | (31) | (21) | (21) | (3) | |||||||||||
† PPF=Protocormos con primordios foliares. ††sds=semanas después de la siembra. ††† No categorizada como mínima al ser la respuesta registrada en la semana 14.
El inicio de la Fase 4 (protocormos con ápice) se observó a las 8 sds y los porcentajes más altos fueron observados hasta las 14 sds en Y10/12h (44 %), mientras que los tratamientos MS/12h y MS/24h tuvieron los porcentajes más bajos, con menos del 8 %. Por su parte, el inicio de la Fase 5 (protocormos con primordios foliares y rizoides) ocurrió a partir de las 10 sds en Y10/24h y Y10/12h (7 a 10%); los tratamientos con menor porcentaje de desarrollo de embriones fueron MS/12h y MS/24h, con nulo o 1% (Cuadro 1).
El promedio general de la máxima expresión de desarrollo, en cada una de las fases, fue disminuyendo, por lo que en la Fase 2 se consigna el promedio más alto, el cual disminuyó gradualmente en las siguientes fases (Cuadro 1). Esto demuestra que no todos los embriones que alcanzan una etapa específica pasan al mismo tiempo a la etapa que precede.
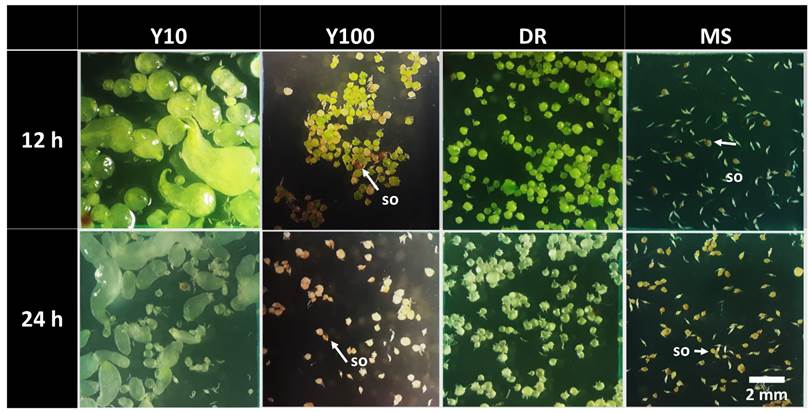
Las cinco fases de desarrollo de embriones y protocormos fueron observadas a partir de las 10 sds en Y10/12h y a las 13 sds en el resto de los tratamientos. Por lo que, a las 14 sds se pudieron observar todas las fases de desarrollo en todos los tratamientos (Fig. 4), esto evidencia la asincronía en el proceso de pregerminación y germinación de semillas de G. skinneri. No obstante, aun cuando la máxima expresión de cada una de las fases de desarrollo se presenta en diferentes periodos de tiempo, a los 14 sds se observó que, en la mayoría de los tratamientos, la Fase 3 se presenta en mayor porcentaje, a excepción de los tratamientos Y10/12h con mayor proporción de la Fase 4 y ambos medios MS, con mayor porcentaje de la Fase 2 (Fig. 4). Lo anterior indica que el tratamiento Y10/12h induce con mayor celeridad el desarrollo de los embriones hacia fases más complejas. Mientras que ambos tratamientos con sales de MS propician una menor diferenciación en los embriones, lo que retrasa la expresión de fases de desarrollo más complejas.

Fig. 4 Efecto de los tratamientos en el desarrollo de las fases de germinación de semillas de Guarianthe skinneri. Porcentaje promedio a las 14 semanas después de la siembra (sds). Los tratamientos con letras iguales no son estadísticamente diferentes, de acuerdo con la prueba de Tukey (p≤0.05). Barra indica desviación estándar.
Oxidación de embriones en las fases de desarrollo
La oxidación de los embriones se observó a partir de las 7 sds, dos semanas después de la máxima expresión de desarrollo de la Fase 2 (imbibición). A las 14 sds, el acumulado de los porcentajes de oxidación sobresalen en las Fases 2 y 3 (Fig. 5). De acuerdo con el análisis estadístico, hubo un efecto significativo del medio (p≤0.05), donde los medios MS y Y100 presentaron los porcentajes de oxidación más altos en la Fase 2, lo que implicó que la cantidad de semillas que pasaron a la Fase 3 disminuyó al no continuar con la sucesión de embriones, ya que fueron afectados por la oxidación.

Fig. 5 Efecto de los medios de cultivo en la oxidación de los embriones en las fases 2 y 3 de pregerminación de Guarianthe skinneri. Porcentaje promedio a las 14 sds. Los medios con letras iguales no son estadísticamente diferentes, de acuerdo con la prueba de Tukey (p≤0.05).
El factor escotoperiodo no indujo diferencias significativas para la variable oxidación de los embriones, en las diferentes fases de desarrollo evaluadas, por lo que la oxidación se presentó tanto en los embriones sin luz como en los que permanecieron en oscuridad (Fig.6).
Efecto del escotoperiodo sobre las fases de desarrollo
Se observaron diferencias significativas entre ambas condiciones de escotoperiodo en la Fase 3 de desarrollo de los embriones (Tukey P≤0.05); en dicho caso, la condición de 24 h de escotoperiodo propició mayor porcentaje de desarrollo de embriones (35%) que la condición de 12 h (28%). Sin embargo, en el resto de las fases no se presentaron diferencias significativas entre ambas condiciones de luz.
Los embriones expuestos a escotoperiodo de 12 h (Y10/12h, Y100/12h, DR/12h y MS/12h) adquirieron un cambio en su coloración de blanco a verde hialino (transparente), a partir de la tercera semana. El tratamiento Y10/12h generó un color verde tenue en los embriones, en comparación con Y100/12h y DR/12h donde se observó promovieron un color verde más intenso. Los embriones de los tratamientos con escotoperiodo de 24 h (Y10/24h, Y100/24h, DR/24h y MS/24h) mantuvieron un color blanquecino que no fue impedimento para continuar el proceso de germinación, aunque en la Fase 5 se observó etiolación de los primordios foliares (Fig. 6).
Efecto del medio de cultivo y escotoperiodo en el tamaño del embrión o protocormo
De acuerdo con el promedio general de la longitud y ancho de los embriones, en cada una de las fases, estas medidas fueron aumentando; por lo que en la Fase 1, los embriones elípticos presentaron una longitud de 0.24 mm (± 0.02) y ancho de 0.1 mm (± 0.02), y a partir del contacto con el medio de cultivo los embriones incrementaron el tamaño (Cuadro 2). La correlación indicó que la Fase 2 y longitud del embrión estuvieron ligeramente correlacionadas. La Fase 2, se caracterizó por el incremento del ancho de los embriones hasta expandir la testa en forma de red sin romperla, con una forma ligeramente esférica; en este caso los tratamientos Y100/12h y Y100/24h promovieron los embriones con mayor tamaño entre las 6 y 9 sds con un el máximo entre 0.25 a 0.30 mm x 0.18 a 25 mm, de longitud y ancho respectivamente. A medida que el embrión continuó aumentando de tamaño, ocasionó la ruptura de la testa (Fase 3) y en este momento el embrión fue llamado protocormo; para esta fase entre las 9 y 14 sds, Y10/12h promovió el mayor tamaño con medidas que oscilaban entre 0.26 a 0.56 x 0.21 a 0.52 mm de longitud y ancho, respectivamente (Fig.6). Entre las 10 y 14 sds, en uno de los polos longitudinales inició la formación del meristemo (Fase 4), donde el Y10/12h indujo el mayor tamaño de protocormos en esta fase, con medidas entre 0.46 a 0.79 mm x 0.45 a 1.03 mm. Conforme continua el crecimiento del protocormo (Fase 5), se desarrolla el primordio foliar, en esta fase las medidas observadas hasta la 14 sds oscilaron entre 2.2 a 2.84 mm x 0.7 a 1.35 mm de longitud y ancho, respectivamente.
Cuadro 2 Valores promedio de tamaño (longitud y ancho en milímetros) de los embriones o protocormos de Guarianthe skinneri en cada fase de desarrollo, observados durante la semana de mayor respuesta, por 14 semanas de evaluación.
| Tratamiento | Fase de desarrollo | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pregerminación | Germinación | |||||||||||||||||
| Fase 1 | Fase 2 | Fase 3 | Fase 4 | Fase 5 | ||||||||||||||
| Semilla | Imbibición | Ruptura de testa | Protocormo ápice | PPF† y rizoides | ||||||||||||||
| sds†† | Tamaño longitud x ancho (± DE) | Máxima respuesta sds | Tamaño longitud x ancho (± DE) | Máxima respuesta sds | Tamaño longitud x ancho (± DE) | Máxima respuesta sds | Tamaño longitud x ancho (± DE) | Respuesta sds | Tamaño longitud x ancho (± DE) | |||||||||
| Y10-12 h | 0 | 0.24 (± 0.02) x 0.1 (± 0.02) | 7 | 0.26 (± 0.02) x 0.19 (± 0.02) | 10 | 0.56 (± 0.03) x 0.52 (± 0.03) | 12 | 0.79 (± 0.21) x 1.03 (± 0.18) | ND | 2.84 (± 0.6) x 1.35 (± 0.33) | ||||||||
| Y10-24 h | 0 | 0.24 (± 0.02) x 0.1 (± 0.02) | 8 | 0.25 (± 0.02) x 0.19 (± 0.02) | 12 | 0.27 (± 0.05) x 0.21 (± 0.02) | 14 | 0.58 (± 0.01) x 0.90 (± 0.40) | ND | 2.76 (± 1.1) x 1.17 (± 0.16) | ||||||||
| Y100-12 h | 0 | 0.24 (± 0.02) x 0.1 (± 0.02) | 7 | 0.30 (± 0.04) x 0.21 (± 0.01) | 9 | 0.32 (± 0.02) x 0.29 (±0.01) | 14 | 0.46 (± 0.1) x 0.45 (± 0.05) | ND | 2.3 (± 0.5) x 0.9 (± 0.22) | ||||||||
| Y100-24 h | 0 | 0.24 (± 0.02) x 0.1 (± 0.02) | 6 | 0.29 (± 0.01) x 0.22 (± 0.01) | 14 | 0.35 (± 0.03) x 0.29 (± 0.04) | 14 | 0.46 (± 0.05) x 0.48 (± 0.05) | ND | 2.6 (± 0.3) x 0.9 (± 0.47) | ||||||||
| DR-12 h | 0 | 0.24 (± 0.02) x 0.1 (± 0.02) | 6 | 0.28 (± 0.04) x 0.25 (± 0.03) | 12 | 0.41 (± 0.03) x 0.39 (± 0.02) | 13 | 0.54 (± 0.05) x 0.59 (± 0.08) | ND | 2.5 (± 0.5) x 0.9 (± 0.1) | ||||||||
| DR-24 h | 0 | 0.24 (± 0.02) x 0.1 (± 0.02) | 6 | 0.26 (± 0.03) x 0.18 (± 0.03) | 12 | 0.45 (± 0.04) x 0.43 (±0.03) | 14 | 0.65 (± 0.07) x 0.67 (± 0.20) | ND | 2.4 (± 0.4) x 0.85 (± 0.2) | ||||||||
| MS-12 h | 0 | 0.24 (± 0.02) x 0.1 (± 0.02) | 9 | 0.29 (± 0.03) x 0.19 (± 0.02) | 11 | 0.31 (± 0.03) x 0.30 (±0.03) | 10 | 0.54 (± 0.1) x 0.47 (± 0.03) | ND | 2.2 (± 0.4) x 0.7 (± 0.2) | ||||||||
| MS-24 h | 0 | 0.24 (± 0.02) x 0.1 (± 0.02) | 6 | 0.28 (± 0.01) x 0.19 (± 0.02) | 11 | 0.36 (± 0.01) x 0.32 (± 0.03) | 10 | 0.56 (± 0.1) x 0.49 (± 0.03) | ND | ND | ||||||||
†PPF=Protocormos con primordios foliares. ††sds=Semanas después de la siembra. ND= No determinado.
Aclimatación de plántulas
El porcentaje de sobrevivencia en la aclimatación de plántulas de G. skinneri en promedio fue 80% a los 85 días a partir del trasplante. A los 60 días después del trasplante se obtuvo 20% de mortandad, causado por la herbivoría ocasionada por moluscos y larvas de un insecto no identificado.
Las plántulas generaron un promedio de dos hojas y cuatro raíces durante el periodo de aclimatización. Se observó engrosamiento en las hojas nuevas, y las raíces incrementaron su longitud de 2 a 3 cm.
Discusión
Este estudio proporciona información de las fases de germinación asimbiótica in vitro, en las etapas de pregerminación y germinación de semillas de Guarianthe skinneri, en función de su respuesta a cuatro medios de cultivo, Yasuda al 10% y 100%, Dalla Rosa y MS, y dos condiciones de escotoperiodo (12 y 24 h).
El 80.3% de viabilidad de las semillas fue confirmado por los tratamientos con los mayores porcentajes de hinchamiento e imbibición de la Fase 2, Y10/24h, DR/12h y DR/24h (86, 84 y 81%, respectivamente). Por lo que se consideró que este proceso pregerminativo es una excelente aproximación de la viabilidad observada con el tetrazolio, toda vez que durante la imbibición los embriones absorben agua, lo que provoca que las células se expandan e inicien las primeras señalizaciones de los procesos de respiración celular y metabolismo energético (Valadares et al., 2014). No obstante, factores como el medio de cultivo, escotoperiodo y diversidad genética de las semillas podrían contribuir a la variabilidad en la germinación posterior y en algunos casos a un aumento o disminución de esta. Al respecto Hosomi et al. (2011) y Salazar & Osorio, (2022), consignan que en Cattleya spp., es posible observar niveles de germinación inferiores al porcentaje de viabilidad indicado por tetrazolio, por causas desconocidas, por lo que la aplicación de pretratamientos o la inclusión de aditamentos orgánicos en los medios de cultivo, podrían mejorar las tasas de germinación de las semillas.
Germinación de las semillas de G. skinneri
En este estudio, los medios de cultivo en orden del más al menos completo en el contenido de nutrimentos fue MS, después Yasuda al 100 %, Dalla Rosa y Yasuda 10%. Se logró comprobar que los medios Yasuda, a ambas concentraciones (10 y 100%) adicionados con BAP, promovieron las fases de desarrollo durante la pregerminación y germinación, respectivamente. De acuerdo con diversos estudios, el BAP, presente en ambos medios de cultivo (a 10 y 100% de la formulación original), interviene en la división celular, y su efecto puede estar asociado con el estado de diferenciación celular durante el proceso de germinación. Así mismo, Quiroz et al. (2017) reportaron un avance en la germinación de semillas de la orquídea terrestre Chloreaea crispa Lindl. con la formación de protocormos, con una concentración de 0.1 mg L-1 de BAP y en condiciones de oscuridad. En el medio Yasuda al 10%, se obtuvieron todas las fases en menos tiempo, a las 10 sds, comparado con los otros medios, a pesar de que contaba con una concentración mínima de sales. Aunque no hay antecedentes de estos medios usados en G. skinneri, datos similares han sido presentados en Vanilla planifolia Jacks. ex Andres (Orchidaceae), donde Torres-González et al. (2011) obtuvieron el mayor porcentaje de germinación a las 13 sds en el mismo medio Yasuda 10 %. Existen evidencias que comprueban que los medios en concentraciones menores de la fórmula original promueven el arranque de germinación de semillas de orquídeas (Chen et al., 2015), tal y como se comprueba en el presente estudio. Esto coincide con el hecho de que, en condiciones naturales en las copas de los árboles, las epifitas disponen de pocos recursos nutrimentales para la germinación y desarrollo (Damon et al., 2014), y estos serían suministrados indirectamente mediante los HEFM.
El medio DR adicionado con agua de coco, promovió de igual forma las cinco fases de germinación de G. skinneri, incluso a las 14 sds promovió en mayor medida la Fase 4. De acuerdo con lo reportado por (Damon et al., 2014), G. aurantiaca, especie cercana a G. skinneri obtuvo el 92.12% de germinación a los 160 días en este mismo medio. Dado que este medio contiene agua de coco, ha sido documentado que uno de sus componentes es la citoquinina importante para la germinación de semillas (Ma et al., 2008; Zhang et al., 2015). Las citoquininas exógenas pueden ayudar en la movilización de lípidos dentro de los embriones de orquídeas (Kauth et al., 2008), y por ende promover la germinación de semillas mediante la eficiente utilización de los lípidos que usualmente son escasos en el medio natural.
La baja tasa de germinación de las semillas de G. skinneri en el medio MS 100%, estuvo asociada a la alta concentración de sales inorgánicas del medio. Resultados similares han sido reportados para esta misma especie por García et al. (1993) quienes obtuvieron el 3.5% de germinación a los 75 días después de la siembra y con un desarrollo lento. Así mismo, Andrade-Rodríguez et al. (2015) obtuvieron 31% de germinación de semillas del híbrido Brassolaeliacattleya (Orchidaceae) en MS al 100%, quienes argumentaron un efecto osmótico negativo (-0.3349 Mpa) por su alta cantidad de sales, lo cual impidió la absorción eficiente de los macro y micronutrimentos del medio. Es por ello, que se sugiere realizar pruebas previas de susceptibilidad al medio de cultivo, en la fase de imbibición y desarrollo de protocormo, para evitar el desperdicio de semillas y posibles afectaciones en las fases posteriores. El medio MS en este estudio no fue favorable para la etapa de germinación; sin embargo, ha resultado ser idóneo para varias especies, demostrado en diversos estudios donde han probado diferentes concentraciones o han añadido otros componentes (Ávila-Díaz et al., 2009; Mercado & Contreras, 2017; Salazar & Osorio, 2022; Utami & Hariyanto, 2019).
Existen paradigmas ampliamente aceptados con respecto a la relación entre la germinación de semillas de orquídeas y el escotoperiodo, uno de ellos es que las orquídeas epífitas requieren luz y las especies terrestres oscuridad para germinar (Kauth et al., 2008). Los requerimientos de escotoperiodo pueden ser particulares para inducir o inhibir las fases de la germinación de orquídeas epífitas (Castillo-Pérez et al., 2021; Lopéz et al., 1994) y terrestres (Chen et al., 2015). De acuerdo con los datos obtenidos en este estudio, la condición de escotoperiodo no afectó el proceso de desarrollo de las fases de germinación. Las semillas que contaron con 12 h de escotoperiodo formaban embriones y luego protocormos clorofílicos, debido a incidencia de la luminosidad recibido a las células de los embriones desde la Fase 2. Las semillas expuestas a 24 h de escotoperiodo fueron aclorofílicos; sin embargo, esto no fue impedimento para continuar el desarrollo, ya que la fuente de nutrimentos provenía del medio de cultivo. Fue notable, que Zeng et al. (2012), consignen que la luz continua se asoció con el cambio de coloración de blanquecino a marrón (oxidación) y la muerte prematura de los protocormos de Paphiopedilum wardii Summerhayes (Orchidaceae) por ello propusieron que las etapas iniciales permanezcan bajo oscuridad durante las primeras seis semanas y posteriormente sean llevadas a la luz. En el presente estudio, los resultados indican algo diferente, que la oxidación de los embriones estuvo relacionada con el medio de cultivo en las fases 2 y 3 y no con el escotoperiodo.
Valdría la pena reflexionar que, en condiciones naturales, las semillas de orquídeas epífitas aterrizan en diferentes superficies, con o sin disponibilidad de luz. Al ser tan pequeñas es posible que entren en pequeñas grietas en las cortezas de los árboles y podrían ser cubiertas por materia orgánica que impida la recepción de la luz, pero a su vez podría contribuir a evitar la desecación y lograr una estabilidad térmica adecuada durante las etapas iniciales de germinación (Rasmussen et al., 2015). Así podríamos dejar atrás el paradigma del requerimiento de luz de epífitas e impulsar la evaluación del efecto de la oscuridad, en conjunto con otras condiciones ambientales. En estos casos, los protocormos que continuaron con el desarrollo de primordios foliares desarrollados en oscuridad, posiblemente contaban con el almacenamiento de energía obtenida del medio de cultivo; no obstante, requieren de las horas con luz para poder aprovechar la clorofila para fotosintetizar y así optimizar el crecimiento y desarrollo en las siguientes etapas.
La pregerminación y germinación de las semillas de G. skinneri fueron asincrónicas y las respuestas iniciales ocurrieron con diferentes frecuencias en cada fase y más rápidas en Y10/12h, mientras que en DR/12h, DR/24h y Y100/12h los cambios fueron tardíos entre fases. Aún no se ha profundizado en las condiciones que genera la asincronía en la germinación de semillas de orquídeas. Koene et al. (2020) reportaron la germinación asincrónica de Acianthera prolifera (Herb. ex Lindl.) Pridgeon & M.W. Chase (Orchidaceae), y sugirieron probar con otras formulaciones del medio de cultivo utilizado y realizar subcultivos en las etapas tempranas para evitar el agotamiento de los componentes del medio antes de completar la germinación de todas las semillas. La germinación asincrónica se ha presentado en otras orquídeas, documentado en Acianthera ochreata (Lindl.) Pridgeon & M.W. Chase, Laelia autumnalis (Lex.) Lindl. y L. speciosa (Kunth) Schltr. (Aguilar-Morales & López-Escamilla, 2013; Hernández-Muñoz et al., 2017). El fenómeno de asincronía, en conjunto con la posibilidad de germinar tanto en condiciones de luz u oscuridad, seguramente ofrece mayor flexibilidad de respuesta a las condiciones naturales cambiantes, pero requiere de estudios genéticos, fisiológicos y bioquímicos para poder entender y aprovechar estos atributos.
Aclimatación
En este estudio se logró el 80% de sobrevivencia de plántulas hasta los 85 días después del trasplante, y sin evidencias de enfermedades. Esto es una cifra importante, e indica haber evitado la causa principal de mortandad ocasionado por enfermedades fúngicas y bacterianas durante la aclimatación temprana (Teixeira da Silva et al., 2017). Sin embargo, la herbivoría fue un evento externo que propició la disminución de la vitroplantulas en este estudio, y en condiciones naturales, las plantas se enfrentan a este suceso como parte de las inevitables interacciones ecológicas. Fue posible observar que algunas plantas ya defoliadas por herbivoría luego generaron un brote, lo que indica que el meristemo no fue dañado. Sería importante evaluar la capacitad de vitroplantulas aclimatadas de superar tasas leves de herbivoría una vez que se lleven a establecerse en los sitios de conservación.
Conclusiones
La germinación asimbiotica in vitro se realizó con éxito para Guarianthe skinneri y se logró determinar el tiempo de desarrollo en las diferentes fases de pregerminación y germinación, información útil para conocer el tiempo y la producción de una fase de acuerdo con el objetivo de interés. Además, se comprobó que el factor de asincronía es parte del proceso de germinación de semillas de G. skinneri y se determinó que los medios Yasuda 10% + 0.112 mg/L BAP promovió la celeridad de las fases. Para G. skinneri, las condiciones de escotoperiodo no afectaron el proceso de germinación. Con la información generada es posible diseñar el proceso completo de propagación por semillas completo hasta contar con plántulas listas y aptas para su establecimiento en el medio natural, y así, optimizar el aprovechamiento de las semillas para contribuir en la conservación de la diversidad genética de G. skinneri.











 text new page (beta)
text new page (beta)