Introducción
En los bosques de coníferas de México y gran parte de América los pinos (Pinus spp.) son clasificados el género de árboles que ocupan el primer lugar en distribución y también en diversidad de especies arbóreas, destacando su importancia económica y ecológica. En México y América Central se localizan alrededor de 46 especies, las cuales representan cerca del 50% del total a nivel mundial, se tienen especies como Pinus ayacahuite var. veitchii (Roezl) Shaw, Pinus rzedowskii Madrigal y Caball. Del., Pinus leiophylla Schlecht y Cham., Pinus teocote Schlecht y Cham., Pinus pseudostrobus Lindley, Pinus oocarpa Schiede ex Schltdl., Pinus montezumae Lamb. y Pinus devoniana Lindley (Dvorak et al., 2009). La variabilidad climática, topográfica y biótica donde distribuyen los bosques de pino, puede llegar a modificar su desarrollo (Sánchez y Priego-Santander, 2011). Por ejemplo, las características fisicoquímicas del suelo aun tratándose de un mismo sitio pueden ser diferentes, la abundancia y disponibilidad materia orgánica puede modular y diferenciar el desarrollo vegetal, debido entre otras cosas al cambio en estructura del suelo, así como también influir en el perfil microbiológico principalmente de bacterias y hongos (Monson et al., 2006). En sistemas de plantaciones forestales o reforestación factores como la estructura, textura o perfil microbiológico del suelo pueden determinar el éxito del rendimiento o sobrevivencia en campo de la planta, lo que se traduce en una pérdida económica.
Los microorganismos del suelo destacan por su elevada variabilidad y adaptabilidad a diversos hábitats, así como por su potencial para promover y modifican el desarrollo vegetal, debido a que participan en la descomposición de la materia orgánica, liberación de nutrientes minerales e influyen en las propiedades fisicoquímicas del suelo (Nihorimbere et al., 2011). En ecosistemas forestales, dicha variabilidad de las comunidades microbianas son también dependientes de la estacionalidad de la lluvia y disponibilidad de sustrato, demostrando que éstos factores influencian fuertemente la estructura y microbiología del suelo (Priha et al., 2001). Un trabajo realizado por Egamberdiyeva (2007) muestra el efecto de suelos con características areno arcillosa y cambisoles calcáreos más la adición de Pseudomonas alcaligenes PsA15, Bacillus polymyxa BcP26 y Mycobacterium phlei MbP18 sobre el crecimiento de Zea mays L. Este estudio muestra un resultado diferencial en el crecimiento de la planta dependiendo del tipo de suelo y la cepa presente, concluyendo que la presencia de microorganismos puede estar facilitando la solubilidad de nutrientes como el nitrógeno, fósforo y potasio. Por otro lado, en suelos forestales, factores con fuerte impacto sobre las propiedades fisicoquímicas y comunidades microbianas es el “cambio de uso de suelo”, ya que atributos como el pH se pueden modificar (Lauber et al., 2008). Tales respuestas no han sido bien estudiadas y caracterizadas, pero se conoce que la composición de las comunidades bacterianas y fúngicas está fuertemente correlacionada con las propiedades específicas del suelo. El pH y balance de fósforo pueden llegar a alterar el perfil de las comunidades microbianas; además, el pH también funciona como regulador de la composición bacteriana, mientras que la composición de las comunidades fúngicas están más estrechamente asociadas con cambios en el estado nutrimental del suelo (Marschner et al., 2004).
Hacen falta trabajos que contribuyan al aprovechamiento e integren el conocimiento sobre cómo las propiedades del suelo regulan en el crecimiento de las especies forestales, ya que la mayoría de estos estudios están enfocados en analizar la adaptación de los bosques al cambio climático o conservación y manejo de recursos genéticos forestales, el objetivo de este trabajo fue conocer cómo las características fisicoquímicas y microbiológicas de tres distintos suelos forestales pueden afectar el crecimiento de P. devoniana L., bajo condiciones in vitro.
Materiales y métodos
Material vegetal
Para este trabajo se utilizaron semillas de Pinus devoniana L., las cuales fueron proporcionadas por el banco de germoplasma de la Comisión Forestal del Estado de Michoacán (COFOM 2015). Las semillas fueron colectadas (febrero-marzo del 2014) en la localidad de Pátzcuaro Michoacán, México, de nueve distintos árboles de entre 10 y 15 años de edad. Una vez colectadas fueron almacenadas a temperatura ambiente (23°C) y oscuridad hasta su uso.
Muestreo del suelo
Los suelos utilizados para este trabajo se colectaron en tres diferentes bosques de pino, en las localidades: Ciudad Hidalgo (CDH) (Latitud: 19°41'36,22"N y Longitud: 100°32'56,15"O), Pátzcuaro (PTZ) (Latitud: 19°29'17,39"N y Longitud: 101°36'33,31"O) y Cherán (CHE) (Latitud: 19°41'13,60"N y Longitud: 101°52'1,96"O) todas del Estado de Michoacán, México. El muestreo se realizó de acuerdo con la norma NOM-021-RECNAT-2000 (SEMARNAT 2015), en donde se toman los primeros 30 cm de profundidad, obteniendo 10 kg de muestra. El 50% de la muestra colectada se destinó para el análisis cuantitativo de nutrientes (Nitrógeno, Fósforo, Potasio, Calcio, Magnesio, Hierro y Zinc), contenido de materia orgánica (MO), capacidad de intercambio catiónico (CIC), porosidad y pH, los cuales fueron realizados por laboratorios CEMA (http://cemamexico.com), también de acuerdo con la NOM-021-RECNAT-2000.
Crecimiento in vitro
El restante 50% de la muestra colectada de suelo se utilizó para germinar y crecer plántulas de P. devoniana L., utilizando frascos de 500 mL de volumen, en los que se colocaron 300 g de suelo previamente tamizado (malla 2.38 mm), se utilizaron seis réplicas para cada tipo de suelo. Las semillas para este experimento fueron previamente desinfectadas superficialmente mediante el uso de hipoclorito de sodio v/v (CloralexTM, México) al 5% por ocho minutos, posteriormente se lavaron dos veces con agua destilada estéril, después se colocaron en etanol al 15% por dos minutos; finalmente, se lavaron tres veces con agua destilada estéril. En cada frasco se colocaron 20 semillas, al germinar el 50% se retiraron las semillas no germinadas y se estandarizó el experimento a 10 plántulas por frasco. El experimento se realizó en una cámara de crecimiento con luz (16 h/luz 8 h/oscuridad) y temperatura (23°C) controladas. A los 45 días de edad se tomaron datos dasométricos de las plántulas como longitud de la parte aérea (LPA), longitud de raíz (LR), peso fresco de la parte aérea (PPA) y peso fresco de raíz (PR).
Perfil fisiológico microbiano
Mediante el uso de Biolog EcoPlates (Biolog Inc., no. 1506, USA), se realizó el análisis del perfil fisiológico de acuerdo a lo establecido por Gryta et al. (2014) y especificaciones del fabricante. Se prepararon muestras con las colectas de suelo obtenidas con anterioridad con un gramo más 99 mL de agua destilada adicionada con peptona de caseína (5 g L-1). Las muestras se dejaron en agitación y oscuridad (25°C /1 h), posteriormente se reposó por 20 min e inoculó cada pocillo de la placa con 150 µL, para después incubar en oscuridad (25°C/48 h). La actividad metabólica microbiana de acuerdo al uso de fuente de carbono, se cuantificó espectrofotométricamente (590 nm) después de 48 h mediante la reducción de violeta de tetrazolio en formazán, usando un lector de microplacas (Epoch, BioTekMT, USA) restando la absorbancia el pozo de control.
Análisis estadístico
Los resultados se analizaron mediante la prueba estadística de t (t de Student) y un análisis de varianza (ANDEVA), seguido de una prueba de separación de medias de Duncan para comparaciones múltiples (P < 0,05). El análisis de componentes principales (ACP) se realizó a partir de las características fisicoquímicas y nutrientes del suelo, y los datos del perfil de uso de fuente de carbono por los microorganismos del suelo se utilizó para el análisis clúster de agrupación mediante el método de distancias euclidianas, usando el programa “Statsoft statistica v7”.
Resultados
Este estudio mostró, un pH moderadamente ácido en el suelo para los tres sitios (de acuerdo a la norma NOM-021-RECNAT-2000), con un rango entre 5.06 a 5.97. Las muestras de suelo (CDH, PTZ y CHE) también mostraron que la porosidad estuvo por arriba de 50 % (tabla 1), a su vez, los resultados también señalaron valores bajos de MO en suelo de PTZ (4.3%) y medios para CDH y CHE (MO 6.86 y 6.32 % respectivamente). También destaca que la CIC en suelo de CHE se obtuvieron valores de hasta 33.3 contra 21.5 para CDH y 23.5 (Cmol(+) Kg-1) en PTZ.
Tabla 1. Características fisicoquímicas y nutrientes del suelo proveniente de las localidades Ciudad Hidalgo (CDH), Pátzcuaro (PTZ) y Cherán (CHE).
| Características fisicoquímicas | Nutrientes (mg kg -1) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Localidad | pH (UPH) | MO (%) | CIC (Cmol(+) Kg-1) | (%) | Nitrógeno | Fósforo | Potasio | Calcio | Magnesio | Zinc | Hierro |
| CDH | 5.06 | 6.86 | 21.5 | 52.6 | 2.130 | 1.3 | 358.8 | 2.0748 | 5.8071 | 22.7 | 15.009 |
| PTZ | 5.47 | 4.3 | 23.5 | 51.6 | 1.790 | < 0.5 | 553.8 | 1.7394 | 4.9803 | 84.3 | 50.214 |
| CHE | 5.97 | 6.32 | 33.3 | 59.5 | 1.940 | < 0.5 | 1.1505 | 4563 | 4.1496 | 45.6 | 43.212 |
Por su parte, los datos más destacados de los nutrientes encontrados en las muestras se suelo, tenemos que el fósforo se registró en cantidades limitadas ˂0,5 mg kg-1 en suelo de PTZ y CHE. También destaca que el potasio y el calcio en suelo de Cherán (CHE) se encuentran en cantidades de hasta más del doble en comparación con las muestras de CDH (tabla 1). Por su parte, a excepción del hierro el resto de los nutrientes analizados se encuentran en cantidades muy cercanas entre las tres localidades.
El ACP, conforme a la agrupación de factores fisicoquímicos y nutrimentales de los suelos CDH, PTZ y CHE se determinó que presentan características diferentes (fig. 1A). Así mismo, en función del uso de fuente de carbono por parte de las comunidades microbianas del suelo entre los tres sitios CDH, PTZ y CHE, el análisis clúster de agrupación mostró una similitud entre CDH y PTZ, pero diferente al suelo de CHE (fig. 1B).

Fig. 1. El análisis de componentes principales (ACP) realizado a partir de las características fisicoquímicas y nutrientes del suelo (A), y análisis clúster de agrupación mediante el método de distancias euclidianas, realizado a partir del perfil de uso de fuente de carbono por los microorganismos del suelo (B), análisis realizados con el programa “Statsoft statistica v7”.
La LPA no mostró diferencias estadísticamente significativas entre suelos (fig. 2A), pero los datos de LR mostraron que el suelo influye sobre el desarrollo radical (en CHE y PTZ), aumentando su longitud (fig. 2B). También se encontró que el PPA en P. devoniana L. no fue estadísticamente diferente entre tratamientos (fig. 2C), por su parte, la figura 2D muestra un aumento del PR en plántulas crecidas sobre suelo de CHE (67.3 mg), estadísticamente diferente a CDH (41.5 mg) y PTZ (46.8 mg). Finalmente, en la figura 2E-G se observó la arquitectura de raíz en las plántulas utilizadas, mostrándose una mayor longitud y densidad de raíces laterales en los tratamientos CHE y PTZ.
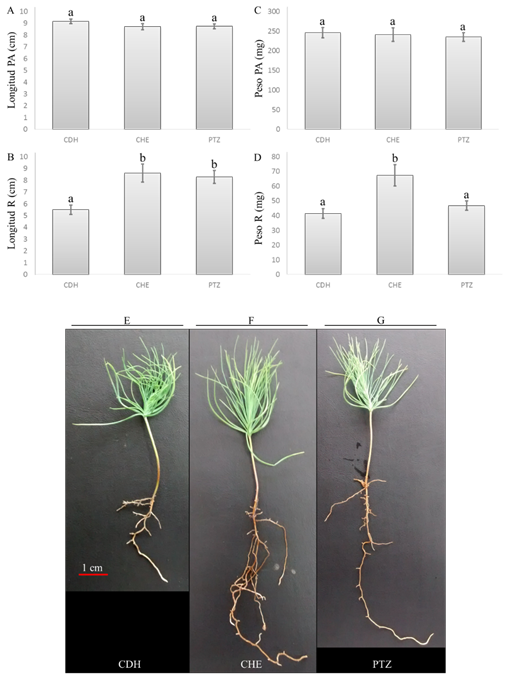
Fig. 2. Crecimiento de P. devoniana L. en suelo de diferente localidad, se muestra la longitud de la parte aérea y de la raíz (A y B), así como peso fresco de la parte aérea y de raíz (C y D). Arquitectura de la parte aérea y raíz a los 45 días de edad de las plántulas creciendo en suelo de Ciudad Hidalgo (E), Cherán (F) y Pátzcuaro (G). Los datos fueron analizados mediante ANDEVA, seguido de una prueba de Duncan (P < 0,05), las barras calificadas con la misma letra muestran no tener diferencias estadísticas.
Discusión
El pH del suelo es un factor determinante en la solubilidad de nutrientes como nitrógeno, calcio, magnesio, hierro, manganeso, boro, cobre y zinc, el presente trabajo reportó valores de pH ligeramente ácidos en el suelo de los tres sitios CDH, CHE y PTZ (COFOM 2015), lo que puede sugerir una disminución en la solubilidad de elementos como el fósforo y calcio. Existen reportes en los que se demuestra una precipitación del fósforo y calcio a pH acido (Fernández y Hoeft, 2009), también aumentando la solubilidad de nutrientes como nitrógeno, potasio y hierro. El calcio al igual que el nitrógeno son elementos que determinan la fertilidad del bosque, se sabe que el nitrógeno está directamente relacionado con la síntesis proteica, vigor y crecimiento en general de las plantas, y que nutrientes como potasio y fósforo participan en procesos como la floración, una baja disponibilidad de fósforo limita la productividad de plantas en los ecosistemas terrestres (Plassard y Dell, 2010). La deficiencia de fósforo disponible también es común en suelos ácidos, los cuales ocupan aproximadamente el 30% de la superficie terrestre y más de la mitad de esta área se localiza en bosques de clima frío y zonas templadas, es el primer o segundo elemento inhibidor de la productividad primaria neta de estos bosques (Plassard y Dell, 2010), debido a que limita el desarrollo vegetal por su importante participación en procesos como el desarrollo radical, la fotosíntesis, la formación de tejidos constituyentes del crecimiento y desarrollo fisiológico general (Wissuwa, 2003).
De acuerdo con la NOM-021-RECNAT-2000 la baja concentración de MO en los suelos estudiados, indica que esta podría representar una limitada fuente de nitrógeno, la MO también está involucrada en funciones como la estructura y estabilidad del suelo, aumenta la solubilidad de varios nutrientes y se asocia a coloides ampliando la capacidad de intercambio catiónico, esto provoca que su presencia sea importante donde se presenten plantas con una fuerte demanda de nitrógeno (Martínez et al., 2008). Los suelos provenientes de CHE y PTZ mostraron mayor efecto en la raíz de P. devoniana L., posiblemente porque en estos sitios es donde se obtuvo una menor concentración de MO y fósforo. Existen reportes indicando que en algunas plantas cuando hay deficiencia de fósforo la longitud de raíz incrementa (Fragoso et al. 2005), además que la planta libera diversos aminoácidos y gamma-aminobutirato que acrecientan la exudación de azucares, aumentando la actividad microbiana en la rizósfera (Carvalhais et al., 2011); en su conjunto, dichos eventos pudieron reflejar al modificar la arquitectura de la raíz de P. devoniana L. (CHE y PTZ).
Resultó claro que tanto el ACP basado en las características fisicoquímicas y nutrientes del suelo diferenciaron la muestra de CHE con las de PTZ y CDH, así mismo, el análisis clúster realizado señaló también la misma diferenciación de las muestras CHE con las de PTZ y CDH. Para el ACP la explicación de dicho evento radica en que características como la CIC, porosidad, concentración de potasio y calcio en el suelo CHE son diferentes sustancialmente a las muestras de PTZ y CDH, pero en el resto de las características todos los valores son diferentes entre las tres muestras, de igual manera, en el análisis clúster de agrupación se encontraron diferencias suficientes para separar los datos de suelo de CHE. La diferencia reportada en el perfil fisiológico de las comunidades microbianas para CDH, CHE y PTZ, sugiere que estas pudieran estar influenciando el crecimiento de P. devoniana L.
La diversidad de organismos del suelo puede mejorar el desarrollo vegetal de diferente manera, el mejor ejemplo son las bacterias fijadoras de nitrógeno como Rhizobium y Bradyrhizobium que pueden formar nódulos en las raíces de leguminosas, pero también en P. sylvestris se presentan simbiontes del género Burkholderia y Paenibacillus (Poole et al., 2001; Izumi et al., 2006), que contribuyen con la adquisición de nitrógeno, ya que las bacterias potencialmente diazotróficas albergar nitrógeno reductasa. P. radiata presenta simbiontes como Betaproteobacteria, Bacilli, Alphaproteobacteria, Actinobacteria, Sphingobacteria, Gammaproteobacteria y Acidobacteria, involucradas en la fijación de nitrógeno, oxidación de amonio y control biológico de organismos patógenos (Lottmann et al., 2010; Singh et al., 2011). Otro grupo de bacterias que solubilizan fosfato, debido a la presencia fosfatasas, fitasas, fosfonatasas y carbono-fosforoliasas, liberan fosfato soluble a partir de compuestos orgánicos del suelo, las carbono-fósforoliasas rompen enlaces C-P en organofosfonatos y así liberan fósforo de los minerales (Khan et al., 2009; Hayat et al., 2010). Los resultados de este trabajo ofrecen evidencias de como las características fisicoquímicas y biológicas del suelo puede diferenciar el crecimiento radical de P. devoniana L., esta información es trascendental en trabajos de reforestación o implementación en plantaciones forestales comerciales, ya que pueden aportar elementos para mejorar la producción y el establecimiento de la planta con base en una adecuada selección del suelo.











 text new page (beta)
text new page (beta)


