Introducción
La complejidad ecológica de las interacciones bióticas en combinación con la variación espacial y temporal de recursos provoca una amplia gama de respuestas en los diferentes niveles de la organización biológica, de individuos a ecosistemas. En el caso de las plantas estas respuestas son de gran interés, en primer lugar debido a su capacidad autótrofa que las sitúa en la base de las cascadas tróficas en cualquier ecosistema terrestre (Grover y Holt, 1997), y que son éstas las mediadoras de relaciones entre diferentes organismos que no se encuentran en el mismo espacio físico, es decir, por arriba y por abajo del suelo (Van Dam y Heil, 2011).
Las interacciones ecológicas (por ejemplo, herbivoría arriba y micorrizas abajo del suelo) consumen el carbono que asimilan sus hospederos a través de la fotosíntesis, las respuestas en el balance de los costos y beneficios que éstas generan pueden estar fuertemenete influenciadas por la disponibilidad de nutrientes en el suelo y la disponibilidad de luz, afectando los patrones de asignación de recursos (crecimiento, reproducción y defensa) de éstos (Gehring y Whitman, 1994; Borowicz, 2013).
La herbivoría puede generar importantes costos para las plantas, a nivel ecosistémico se estima que los herbívoros consumen entre 10% y 20% de la masa vegetal por año (Barbour et al., 1998). Por esta razón, pueden afectar no sólo el crecimiento y la reproducción de las plantas consumidas sino además podrían tener efectos importantes en la progenie, por ejemplo reduciendo la tasa de germinación de semillas y la probabilidad de establecimiento de plántulas (Hendrix, 1988). Las mismas plantas que son atacadas por herbívoros pueden, a su vez, estar asociadas a otros organismos por abajo del suelo y crecer en simbiosis con hongos del phylum Glomeromycota (Wang y Qiu, 2006), formando lo que se conoce como simbosis micorrícica arbuscular. En general se ha reportado como una interacción mutualista en la cual las plantas hospederas obtienen una mejora en la adquisición de nutrientes del suelo, principalmente fósforo, a cambio de compuestos de carbono que son consumidos por los hongos micorrizógenos arbusculares (HMA) (Nutman, 1976; Koide y Dickie, 2002; Lambers et al., 2008). Sin embargo, la asociación micorrícica representa también un costo importante para las plantas. Se ha estimado que los hongos micorrizógenos consumen entre 10% y 30% del carbono asimilado por sus hospederos (Fogel y Hunt, 1983; Finlay y Söderström, 1992; Smith y Read, 2008). Por lo tanto, las condiciones ambientales como la disponibilidad de nutrientes en el suelo juegan un papel importante en la determinación de la intensidad de colonización en las raíces de las plantas por estructuras fúngicas como hifas, vesículas, arbúsculos o esporas (correspondiendo a la intensidad de la interacción micorrícica), lo cual tiende a reducirse rápidamente en suelos con alta disponibilidad de nutrientes e incluso afectar la abundancia de éstos (Treseder, 2004; Guevara y López, 2007, Garrido et al., 2010b).
Los efectos de la herbivoría y la micorriza arbuscular en el desempeño de sus hospederos, han sido estudiados durante décadas de manera individual (Koide y Dickie, 2002; Smith y Read, 2008; Nuñéz-Farfán et al., 2007). Se sabe que la disponibilidad de nutrientes en el suelo y de luz regulan los efectos negativos de la herbivoría por ejemplo, al incrementar los recursos existe una mayor capacidad de las plantas para reponer el tejido vegetal dañado y a menor costo (Herms y Mattson, 1992). Y en el caso de las micorriza arbuscular se espera que un aumento en la disponibilidad de luz permita mantener a las micorrizas a un costo relativamente menor, ya que las plantas tendrían mayor disponibilidad de carbono (Gehring y Whitman 2003: Johnson et al., 2010). Por otra parte, en ambientes con alta disponibilidad de nutrientes en el suelo, las micorrizas podrían resultar redundantes, y por ende costosas, ya que las plantas podrían acceder a estos nutrientes de forma directa (Daft y El-Giahmi, 1978; Whitbeck, 2001; Hurst, 2002; Gehring, 2003, Vannettte y Hunter 2011).
Identificar los factores que pueden alterar los patrones de abundancia, éxito reproductivo y variación genética entre interacciones de organismos es de gran interés para entender el papel de éstos en los ecosistemas (Strauss y Irwin, 2004; Van Dam y Heil, 2011). Existen estudios en los que se establecen relaciones directas de los efectos conjuntos de ambas interacciones sobre el desempeño de sus hospederos y de retroalimentacion entre interacciones encontrándose además resultados discordantes (véase Barto y Rillig, 2010). No obstante se puede esperar que la coexistencia de estos dos tipos de interacciones tenga efectos emergentes. Por ejemplo, la asociación con hongos micorrizógenos, al mejorar el estatus nutricional de sus hospederos, podría facilitar el despliegue de respuestas de defensa antiherbívoro (Bennett, et al., 2006; Fontana et al., 2009), lo que a su vez podría disminuir el nivel de herbivoría. Por otra parte, la actividad de los herbívoros potencialmente podría reducir la capacidad fotosintética de las plantas, limitando los recursos disponibles para sostener las micorrizas y a su vez la adquisición de nutrientes del suelo. Algunos estudios describen efectos negativos de la herbivoría sobre la colonización micorrícica en las raíces de sus hospederos (Gange et al., 2002), mientras que otros describen efectos positivos de la defoliación en la micorrización y crecimiento de las plantas (Kula et al., 2005), sugiriendo que las respuestas son idiosincrásicas y dependen fuertemente de la identidad de los interactuantes (Klironomos et al., 2004) y la disponibilidad de recursos, entre otros (Vennet y Hunter, 2011).
En este trabajo presentamos una descripción general de la interacción con micorrizas arbusculares y herbivoría en la planta herbácea anual Datura stramonium bajo condiciones naturales y exploramos su correlación con la fertilidad del suelo. También exploramos, si los atributos de desempeño de las plantas se relacionan con ambos tipos de interacción (estimaciones del nivel de colonización por micorrizas arbusculares y herbivoría), y por otro lado, si existe retroalimentación entre ambos tipos de interacción. De acuerdo a la teoría esperaríamos una correlación positiva de la fertilidad del suelo con la biomasa vegetativa y preproductiva de las plantas, pero negativa con el nivel de colonización por hongos micorrizógenos. Además esperaríamos una relación negativa de los niveles de herbivoría con los niveles de colonización por hongos micorrizógenos. Esperaríamos una relación negativa del desempeño de las plantas con los niveles tanto de herbivoría como de micorrización en suelos de baja fertilidad.
Datura stramonium L., fue nuestro sistema modelo para probar estas hipótesis. D. stramonium es una planta herbácea anual de la familia Solanaceae que se propaga sólo por semilla. Se distribuye en zonas templadas y subtropicales del sur de Estados Unidos, México, Centroamérica y Sudamérica, creciendo en sitios de vegetación secundaria en parches o manchones de densidad variable (Hernández, 2006; Núñez-Farfán, 1991), es facultativamente autocompatible (Motten y Antonovics, 1992); sin embargo, es posible que la progenie de autocruza sufra de mayor daño por herbívoros que la progenie de entrecruza (Bello-Bedoy y Núñez-Farfán, 2010). En cuanto a sus herbívoros, se conoce que son depredadas mayormente por el crisomélido Lema trilineata (Coleoptera), pero también puede ser consumida por otros herbívoros de los órdenes Lepidoptera y Homoptera (Núñez-Farfán, 1991). Respecto a las interacciones micorrícicas en D. stramonium existe nula información en poblaciones naturales pero bajo condiciones controladas han sido estudiadas con fines farmacológicos (Saleh et al., 1998) así como ecológicos (Garrido et al., 2010a).
Material y métodos
Sitios de colecta
En agosto de 2011, 30 individuos de D. stramonium fueron colectados de ocho sitios de la zona central del estado de Veracruz, México. Tres de los sitios se localizaron aledaños a la localidad de Zimpizahua (19°26'8.48" N y 96°57'5.94" O) registrando ocho individuos y cinco en la localidad de Coatepec (19°27'19.53" N y 96°57'33.60" O) con 22 individuos. Las plantas estaban en edad reproductiva, con presencia de flores o frutos. Este último se encuentra a una elevación de 1252 m sobre el nivel del mar. El clima es templado-húmedo con una temperatura media de 19°C y la precipitación anual alcanza 1 900 mm, siendo la lluvia más abundante en verano, con un promedio mensual de lluvia de casi 283 mm y una temperatura media de 20°C en el año de estudio (CNA, 2012). En ambas zonas la presencia de D. stramonium estuvo asociada a la perturbación humana.
Análisis químico del suelo y follaje
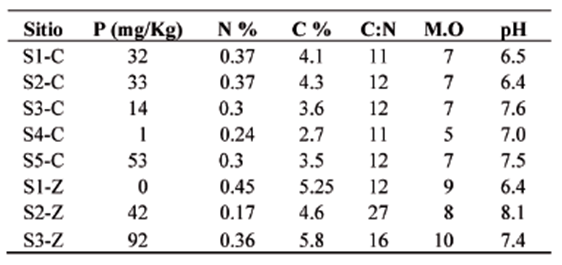
De los sitios donde se localizaron las plantas en estado reproductivo de D. stramonium, se tomaron muestras de suelo. Las muestras de suelo se colectaron cerca de las raíces de cada planta, alrededor de 200 gr de suelo por planta. Las muestras pertenecientes a cada uno de los sitios fueron homogeneizadas para formar una muestra compuesta por sitio (ca. 800 gr en cada sitio), y se estimaron los siguientes parámetros químicos: concentraciones de fósforo disponible (Bray y Kurtz, 1945), y contenido total de nitrógeno y carbono (LECO, TruSpec). Los análisis químicos fueron realizados en el Laboratorio de Análisis Químicos de Suelos, Aguas y Plantas del Instituto de Ecología, A.C. También se seleccionaron al menos cinco hojas al azar de cada planta, de las cuales se usaron las hojas maduras con el menor daño por herbívoros, para estimar la concentración de nitrógeno y carbono del follaje en cada individuo y se calculó el cociente carbono/ nitrógeno (C/N) (LECO, TruSpec).
Colonización micorrícica
Para determinar el nivel de colonización por micorrizas arbusculares, se tomaron muestras de raíces finas (< 2mm) de cada una de las plantas y se procesaron con la técnica de clareo y tinción de Koske y Gemma (1989). Este método consiste en tratar las raíces con una solución de KOH al 10% a temperatura ambiente, hasta que la pigmentación de las mismas se ha desvanecido, para D. stramonium tomó 24 horas. Posteriormente las raíces se remojaron en una solución de HCl al 5% durante 10 minutos para acidificar el tejido y así facilitar la tinción que se realizó con una solución ácida de glicerol con azul de Tripano al 0.05% por 72 horas. Una vez teñidas las preparaciones se colocaron 30 segmentos de raíz, de aproximadamente 1.5 cm de largo cada uno, en portaobjetos (preparaciones). Cada preparación fue aplastada colocando un segundo porta objetos sobre ellos para exponer el cortex de la raíz en donde, de existir colonización por hongos micorrizógenos, se pueden observar estructuras como hifas, vesículas y arbúsculos. La observación de estas dos últimas estructuras, en especial los arbúsculos, es por lo general muy complicada en muestras de campo por la edad de las raíces, ya que la pigmentación prevalece aún después del proceso de clareó con KOH. Por lo tanto nuestras observaciones se restringieron a las hifas. En total se obtuvieron 30 segmentos de raíz en cada preparación y dos preparaciones por planta. Para estimar la intensidad de la colonización por hifas de hongos micorrizógenos cada segmento de raíz se examinó en tres secciones de la misma, espaciados de manera equitativa usando el método estandarizado de McGonigle et al. (1990), además, se estimó el promedio de la longitud de hifas de hongos micorrizógenos arbusculares por milímetro de raíz, siguiendo el método propuesto por Vega-Frutis y Guevara (2009). Para esto se utilizó una rejilla en el ocular del microscopio óptico (Nikon E600 usando siempre el aumento 10x), que cubrió un área de 10 x 10 mm. Colocando cada campo de observación al centro de esta rejilla, se contabilizó el número de intersecciones entre las hifas y la rejilla. Aplicando una modificación del teorema de Buffon (Schroeder, 1974) obtuvimos la longitud promedio en cada campo de observación de cada planta utilizando la siguiente fórmula:
LH(mm) = (100pƩ IC)/4F
donde LH es la longitud promedio de hifas, I es el número de intersecciones observadas entre hifas y la rejilla, C es el número de campos colonizados por hongos micorrizógenos arbusculares y F es el número total de campos observados. Las constantes 100 μm y 4 corresponde a la apertura de la rejilla y al número de lados en la rejilla, respectivamente. Cada segmento de raíz se observó en tres puntos: arriba en medio y abajo, por preparación se tuvieron 90 campos de observación y se tuvo el mismo número de campos observados para todas las plantas.
Porcentaje de herbivoría
Para estimar el porcentaje de herbivoría de cada planta se colectaron 20 hojas al azar y se prensaron en papel periódico para su digitalización posterior mediante fotografía. Las imágenes de las hojas se analizaron con el paquete ImageJ 1.42 ( HYPERLINK "http://rsb.info.nih.gov/ij/" http://rsb.info.nih.gov/ij/ ). Para cuantificar el porcentaje de herbivoría se estimó primero el área de las hojas dañadas. Posteriormente, reconstruyéndolas se simuló su área total (hoja sin daño). Finalmente del cociente de estas dos áreas foliares (de la hoja dañada y de la hoja reconstruida), se estimó el porcentaje de herbivoría por hoja y en promedio por cada planta.
Desempeño de Datura stramonium
Antes de secar las plantas se obtuvieron las muestras de raíces para estimar la intensidad de colonización por hongos y de hojas para los análisis químicos. Las 30 plantas colectadas de D. stramonium fueron secadas a 65°C por 72 horas. Posteriormente se obtuvo la masa seca de hojas, tallos, raíces, frutos y semillas con ayuda de una balanza electrónica (OHAUS Adventur TM®, con precisión de 0.001g). La biomasa asignada a la reproducción fue considerada la suma del peso de las estructuras relacionadas a la reproducción y el esfuerzo reproductivo fue considerado como la proporción de ésta con respecto a la biomasa vegetativa. De tres hojas intactas por planta se estimó el área foliar específica (AFE), que es la relación entre el área y el peso de cada hoja (cm2 g-1) y es una estimación indirecta de la capacidad fotosintética (Reich et al., 1998).
Análisis de datos
Para analizar la abundancia local de D. stramonium en función de los nutrientes del suelo se utilizó un modelo lineal generalizado (GLM) con error gamma y función de liga raíz cuadrada. El modelo incluyó como variables explicativas las concentraciones de carbono, nitrógeno y fósforo en el suelo así como la interacción entre las concentraciones de nitrógeno y fósforo. Para explorar las relaciones entre la disponibilidad de nutrientes del suelo con los estimadores de desempeño de las plantas [peso seco vegetativo, área foliar específica (AFE), peso seco de estructuras reproductivas, esfuerzo reproductivo (peso seco de estructuras reproductivas/peso seco vegetativo)], los niveles de herbivoría y la longitud de hifas de hongos micorrizógenos arbusculares se utilizaron modelos de efectos mixtos. El componente fijo en los modelos fue el mismo descrito para el modelo GLM y el componente aleatorio de los modelos incluyó la identidad de la planta en función de la población en la que cada planta se encontró. Igualmente se utilizó un modelo de efectos mixtos para analizar las relaciones entre el nivel de herbivoría en función del nivel de colonización micorrícica y atributos de desempeño de las plantas [AFE, cociente del contenido de carbono y nitrógeno en las hojas (C/N)]. Se utilizó un modelo análogo para analizar las relaciones entre micorrización en función de la herbivoría, AFE y C/N. En todos los modelos mixtos se utilizó una función de potencia o exponencial para modelar la varianza, lo que permitió cumplir con los supuestos de normalidad y homocedasticidad de los residuales, todos los análisis fueron realizados en el programa estadístico R (R Development Core Team, 2009).
Resultados
Caracterización química del suelo
La distribución de las plantas de D. stramonium resultó a manera de pequeños parches en los que se encontró hasta siete plantas, siempre en lugares de dosel abierto cercanos a sitios con perturbación humana, como terrenos con reciente remoción de la vegetación, acahuales y orillas de caminos. Se observó que la abundancia local de D. stramonium (número de plantas por sitio) presentó una relación negativa con la concentración de fósforo en el suelo (χ2 = 36.3; g.l. = 1; P < 0.0001; fig. 1), es decir la abundancia local fue menor cuando la disponibilidad de fósforo en el suelo fue mayor. Otros nutrientes del suelo, i.e., carbono y nitrógeno no se correlacionaron significativamente con la abundancia local de D. stramonium (cuadro 1).

Fig. 1 Relación entre la abundancia local de plantas de Datura stramonium y la concentración de fósforo en el suelo en poblaciones silvestres en el centro del estado de Veracruz. Las líneas punteadas marcan el intervalo de confianza 95%.
Desempeño de Datura stramonium
En relación al desempeño de D. stramonium, en general las plantas tuvieron una masa de 69.63 g (EE ± 9.6), el valor promedio más alto por sitio fue de 183.33 g (EE ± 72.18) registrado en el sitio Zima en la localidad de Zimpizahua donde se observó el mayor contenido de fósforo. Sin embargo, por sitio observamos que el peso seco total de las estructuras vegetativas (raíces + tallos + hojas) estuvo positivamente relacionado con la concentración de carbono en elsuelo(F=9.13;g.l.=1,22;p=0.006; fig. 2a) más que con el fósforo, es decir que plantas mas grandes se encontraron en sitios donde la concentración de carbono es mayor. La relación fue igualmente significativa y positiva cuando se analizó por separado el peso seco de raíces (F = 10.8; g.l.= 1, 22; p = 0.003) y tallos (F = 11.2; g.l = 1, 22; p = 0.002). Sin embargo, la relación raíces/tallos (R/T) no fue significativa con ninguno de los nutrientes del suelo.

Fig. 2 Relación entre la concentración de carbono en el suelo y a) peso seco total (hojas, tallos y raíces), b) área foliar específica y c) biomasa reproductiva (flores y frutos) de Datura stramonium. Las líneas punteadas marcan el intervalo de confianza 95%.
El AFE se relacionó negativamente con la concentración de carbono en el suelo (F = 4.11,g.l.=1,21,p=0.05; fig 2b),detal manera que se registro mayor AFE de las plantas de sitios con menor concentración de carbono.
Por otro lado, observamos una relación positiva con la masa de estructuras reproductivas (F = 4.92, g.l. = 1, 22, p = 0.03; fig. 2c) con el contenido de carbono en el suelo.
Herbivoría y micorrización
La herbivoría en el total de plantas registradas de D. stramonium fue entre 0.4% y 14.5%, mientras que en los sitios varió entre 0.9% y 4.1%. Los niveles de herbivoría observados en campo no estuvieron significativamente relacionados con la concentración de nutrientes en el suelo (cuadro 2), ni con la razón C/N en las hojas (cuadro 3). Sin embargo, sí se relacionó significativamente con el AFE de las plantas (F = 4.68, g.l. = 1, 22, p = 0.0418). A mayor AFE las plantas tuvieron mayor porcentaje de herbivoría.

Cuadro 2 Resumen de los modelos estadísticos utilizados para evaluar la relación de la abundancia local de Datura stramonium (modelo lineal generalizado, con error gamma y función de liga raíz cuadrada), indicadores de desempeño de las plantas y los niveles de herbivoría (modelo mixto, en la parte aleatoria incluyó la identidad de cada planta dentro de cada población) en función de la concentración de nutrientes en el suelo.

Cuadro 3 Resumen de los modelos estadísticos utilizados para evaluar la relación de los niveles de herbivoría y micorrización (modelo mixto en el que la parte aleatoria incluyó a identidad de cada planta dentro de cada población) en función de indicadores de desempeño de las plantas y la intensidad de la interacción micorrícica o la defoliación respectivamente.
Por otra parte la longitud de hifas en el córtex de la raíz varió entre cero y 843 μm de hifas/ mm de raíz. Considerando los sitios, la longitud de hifas en el córtex varió entre cero y 396.5 μm de hifas/mm. La intensidad en la colonización micorrícica no estuvo relacionada significativamente con la concentración de nutrientes del suelo (cuadro 2), ni con los indicadores de desempeño de las plantas: AFE y la razón C/N en las hojas (cuadro 3). Finalmente, en este estudio no detectamos una relación significativa entre los niveles de herbivoría y la intensidad de la colonización micorrícica o viceversa.
Discusión
La distribución de las plantas de D. stramonium está influenciada, posiblemente, por la presencia de otras especies de plantas con mayor habilidad competitiva por nutrientes del suelo, lo que podría reducir la abundancia de D. stramonium (Suter, 2009; Van der Waal et al., 2009). Por otra parte existen otros factores no analizados en este estudio que podrían afectar la abundancia local de D. stramonium. Por ejemplo, Benvenuti y Macchia (1997) mencionan que el género Datura tiene una marcada dormancia de sus semillas por lo que requieren de ambientes con mucha disponibilidad de luz para la germinación. Aunque no lo consideramos explícitamente, todas las poblaciones se localizaron en espacios abiertos, sin un dosel, que pudiese generar variaciones significativas en la cantidad de luz que incidía en cada población. Además, en un experimento en invernadero se demostró que D. stramonium responde principalmente a los cambios de fertilidad en el suelo (Aguilar-Chama y Guevara, 2012), más que la intensidad de luz. Alternativamente, la historia del disturbio y el tiempo a partir del mismo son sin duda factores relevantes que afectan fuertemente la abundancia local de las especies que colonizan nuevos sitios.
Sin embargo, es de resaltar que la relación existente entre la abundancia local de D. stramonium y la concentración de fósforo en el suelo es fuerte, con más del 80% de la varianza explicada por este factor, lo que sugiere que esta relación tiene relevancia biológica que debe ser explorada con mayor profundidad.
Lo anterior se relaciona con algunos atributos de crecimiento de las plantas explorados en este trabajo, al menos con la concentración de carbono en el suelo. Estas relaciones pueden ser explicadas en términos de fertilidad del suelo, que como se mencionó anteriormente, para D. stramonium es un factor fundamental. Se conoce que la capacidad de intercambio catiónico incrementa con el porcentaje de carbono presente en el suelo. En general se crea un ambiente edáfico más fértil y se pueden liberar otros nutrientes como el P. Se espera que tanto el incremento de biomasa como la asignación a la reproducción incremente con el aumento de nutrientes en el suelo, relación que se encontró en este trabajo, plantas de D. stramonium alcanzaron mayores tallas en suelos con mayor fertilidad. Este resultado es apoyado por la evidencia experimental reportado por Aguilar-Chama y Guevara (2012), en el que observaron el tamaño de D. stramonium es fuertemente afectado por cambios en la fertilidad del suelo. En el caso de la eficiencia en la cual las plantas invierten tejido para realizar fotosíntesis (área foliar en relación al peso seco o AFE), la relación entre tamaño y peso es importante, hojas pequeñas y con mayor masa (AFE bajo) puede reflejar mayor contenido de tejido estructural y hojas agrandes y livianas representan una mayor intercepción de luz y asimilación fotosintética (Evans y Poorter, 2001). Reich (1998) indica que plantas en ambientes fértiles tienen potencialmente mayor capacidad de fotosíntesis, nosotros observamos que esta relación es inversa lo cual es contrastante, sin embargo consideramos que en el caso de D. stramonium y en particular las poblaciones estudiadas el AFE no es un indicador fiable de su capacidad de fotosíntesis.

Fig. 3 Relación entre el porcentaje de herbivoría y el área foliar específica de Datura stramonium en 32 plantas. Las líneas punteadas marcan el intervalo de confianza 95%.
En cuanto a las interacciones de manera individual, los niveles de herbivoría en general fueron bajos, considerando que se ha reportado que el daño por herbívoros puede alcanzar hasta un 90% (Núñez-Farfán, 1991). Aunque los valores observados, están acorde a lo reportado por Valverde et al. (2003) entre 1.06% a 47.8% de daño foliar a nivel de población. Sin embargo, hay que considerar dos aspectos importantes: cambios relacionados con la abundancia local de los herbívoros en estas poblaciones, lo cual no fue considerado en este estudio, y por otro lado, que no es posible descartar si las respuestas a la herbivoría se deben a un componente genético de las plantas.
Por otra parte, la ausente relacion entre la colonización micorrícica y la concentración de nutrientes del suelo o con el desempeño de las plantas, es opuesto con la evidencia experimental (Koide, 1991; Treseder, 2004) y con los pocos estudios en sistemas naturales que muestran que la intensidad de la colonización micorrícica decrece en sustratos fértiles (Guevara y López, 2007). La aparente falta de respuesta de la micorrización a los cambios en la concentración de nutrientes en el suelo podría estar dada por diferencias en la disponibilidad de inóculo micorrícico (esporas viables, hifas en fragmentos vivos de raíz, y/o micelio extrarradical) en las diferentes poblaciones estudiadas, cabe señalar que la disponibilidad de fósforo en el suelo determina no sólo el nivel de colonzación de las plantas hospederas, sino también la abundancia o densidad fíngica (Vannette y Hunter, 2011), lo que puede determinar de manera importante el nivel de clonización y la relación costo-beneficio en la relación planta-hongo (Bennett et al., 2006), lo cual es interesante explorar a fondo en estudios bajo condiciones naturales.
Por otro lado, la disponibilidad de inóculo micorrícico también puede variar con la historia de disturbio de cada sitio, es decir la particular forma de alteración en la estructura del suelo y vegetación que se haya dado en cada sitio (Allen et al., 1998; Zapata y Guadarrama, 2004), incluso con la época del año, es decir por la estacionalidad. (Allen, 1998; Camargo-Ricalde y M. Esperón-Rodríguez, 2005).
Finalmente, en este estudio no se detectó una relación significativa entre los niveles de herbivoría y la intensidad de la colonización micorrícica o viceversa. Este aspecto de la retroalimentación entre estas dos interacciones tróficas ha recibido creciente interés (Daft y El-Giahmi, 1978; Bethlenfalvay y Pacovsky, 1983; Tester et al., 1986; Allsop, 1998; Aikio, 2000; Whitbeck, 2001; Klironomos et al., 2004; Wearn y Gange, 2007). En particular para el caso de D. stramonium, Garrido et al. (2010a) reporta que existe una relación negativa entre la densidad de inóculo micorrícico suministrado y la tolerancia a la defoliación manual, y a su vez. Garrido et al. (2010b) mencionan que las respuestas a la herbivoria de D. stramonium en relacion a la biota del suelo puede ser altamente dependiente de la identidad de las especies de hongos micorrícos pero además de las bacterias asociadas a la rizosfera del hospedero, lo cual lleva a un nivel de estudio de mayor complejidad. Sin embargo, pueden registrarse respuestas muy variables cuando se estudian las interacciones en campo, debido a que la composición de especies y abundancia varían en tiempo y espacio, y que la presencia de algunas interacciones pueden modificar la presencia o ausencia de otros miembros dentro de la comunidad o bien por condiciones abióticas (Strauss y Irwin, 2004). La relevancia de estudios bajo condiciones naturales es alta, pues permite elucidar los posibles patrones que han llevado a la evolución de estas relaciones.
Conclusiones
La abundancia de D. stramonium en pequeños parches disminuyó con la disponibilidad de fósforo en el suelo. No obstante, en los ambiente más fértiles fue donde las plantas de D. stramonium alcanzaron su mayor tamaño, lo que sugiere una mayor tasa fotosintética y está acorde con el rápido crecimiento de esta especie.
La herbivoría se presentó en niveles bajos pero factores como la abundancia de herbívoros o bien de nutrientes del suelo podría modular las respuestas del hospedero.
No se encontró relación entre la concentración de nutrientes en el suelo ni de los indicadores de desempeño de las plantas, con la intensidad de la interacción micorrícica. Sin embargo, es probable que la variación de la disponibilidad de nutrientes en los sitios no fuese suficientemente grande para evidenciar respuestas en la micorrización de las plantas a cambios en la fertilidad del suelo, además variaciones en la identidad y abundancia de la fuente de colonización micorrícica podrían estar enmascarando posibles relaciones de los hongos micorrizógenos arbusculares con los nutrientes del suelo o el desempeño de las plantas.
Así mismo, es de relevancia considerar de manera conjunta, factores como la disponibilidad de nutrientes, abundancia de especies de hongos, variacion genética de las poblaciones de plantas que podrían enmascarar posibles correlaciones entre los niveles de micorrización y herbivoría, y en general en estudios de interacciones multiespecífica.











 text new page (beta)
text new page (beta)