Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Polibotánica
Print version ISSN 1405-2768
Polibotánica n.26 México Oct. 2008
Evaluación de dos parámetros bioquímicos en tres macrofitas acuáticas expuestas a cobre
Evaluation of two biochemical parameters in three aquatic macrophytes exposed to copper
Nayeli Ismene Armendáriz Sáenz, María Teresa Aquino Terrazas, Lauraceli Romero Ortiz, Mayra Luz Sánchez Villavicencio, Alma Socorro Sobrino Figueroa* y María Guadalupe Miranda Arce*
* Departamento de Hidrobiología, División de Ciencias Biológicas y de la Salud Universidad Autónoma Metropolitana-Iztapalapa. San Rafael Atlixco Núm. 186, Col. Vicentina. CP 09340. Delegación Iztapalapa, DF, México.
Recibido: 28 febrero 2008.
Aceptado: 1 septiembre 2008.
Resumen
El lago de Pátzcuaro en Michoacán recibe continuamente descargas de aguas urbanas, fertilizantes y biocidas. Esta circunstancia ha contribuido a que se eleven los contenidos de cobre (Cu) en el cuerpo de agua. El Cu, aunque es un micronutriente esencial para las plantas, en concentraciones altas es tóxico, afectando la fisiología y el desarrollo de las mismas. El objetivo de este trabajo fue evaluar el contenido de clorofilas y azúcares libres totales, dos parámetros de respuesta o biomarcadores, los cuales se determinaron por métodos colorimétricos en tres macrofitas acuáticas que son comunes en el lago de Pátzcuaro: Eichhornia crassipes (Martius) Solms Laubach., Hydrocotyle ranunculoides L. y Lemna gibba L. Los resultados obtenidos mostraron que tanto las clorofilas como los azúcares libres totales variaron en función del incremento de Cu en el medio nutritivo, sin embargo, los azúcares libres totales resultaron ser el parámetro de respuesta más adecuado para detectar cambios fisiológicos en este bioensayo.
Palabras clave: clorofila, azúcares, cobre, biomarcadores, macrofitas acuáticas.
Abstract
Lake Patzcuaro in Michoacan, Mexico, continually receives influxes of wastewater, fertilizers and biocides. This circumstance has contributed to the rise of copper (Cu) within the water body. Although Cu is an essential micronutrient for plants, in high concentrations it is toxic, affecting their physiology and development. The objective of this work was to evaluate through colorimetric methods the content of chlorophylls and total free sugars, two response parameters or biomarkers, in three aquatic macrophytes that are common in Lake Patzcuaro: Eichhornia crassipes, Hydrocotyle ranunculoides y Lemna gibba. The results showed that both types of chlorophylls as well as the total free sugars varied in function with the increase in Cu within the nutritive solution; however, total free sugars were the most useful response parameter for detecting physiological changes in this bioassay.
Key words: chlorophyll, sugars, copper, biomarkers, aquatic macrophytes.
INTRODUCCIÓN
En nuestro país se ha acentuado de manera alarmante la contaminación de los distintos cuerpos de agua, un ejemplo es el lago de Pátzcuaro que recibe constantemente descargas de aguas residuales, municipales y de retorno agrícola en los que figura el cobre ya que está presente en los fertilizantes y biocidas (Rivas 2006). Tanto las actividades agropecuarias, industriales, de urbanización así como la tasa de infiltración de la cuenca están deteriorando seriamente los ecosistemas del lago de Pátzcuaro (García, 2000; Ochoa, et al., 2006).
De entre los metales pesados, pusimos atención al cobre (Cu) debido a que el cobre es un micronutriente requerido por los sistemas biológicos como componente estructural y catalítico de proteínas y enzimas, así como cofactor esencial para el crecimiento y desarrollo normal de los organismos. En particular, el cobre es constituyente de la proteína plastocianina, la cual está involucrada en el transporte de electrones en el fotosistema I de la fotosíntesis (Taiz y Zeiger 1991; Goodwin y Mercer 1983; Blakenship, 2002). No obstante, en exceso puede unirse a ligandos no específicos de los iones metálicos, ocupando así espacios celulares o receptores cuya función es bloqueada por la presencia de este metal (Viarego, 1989; Viarego y Nott, 1993; Visviki y Racklin, 1994; Rai, 1996).
Se ha observado que la toxicidad del cobre aumenta cuando disminuye la dureza del agua y el oxígeno disuelto, ya que produce una disminución en la presencia de agentes quelantes, ácidos húmicos, aminoácidos y sólidos en suspensión esenciales para atrapar metales (Alabaster y Lloyd, 1982).
La utilización de plantas acuáticas ha sido desarrollada como un tratamiento alternativo de aguas residuales y ha demostrado ser eficiente en la remoción de una amplia gama de sustancias orgánicas así como nutrientes (Novotny and Olem, 1994; Moore,1995; Pezzolesi, 1998; Eickson y Wesner, 1997; Machate,1999; Burke etal., 2000; Huddleston, 2000; Dellarosa et al., 2001). Así mismo, en la remoción de metales pesados las macrofitas acuáticas tambien han mostrado ser eficientes (Maine et al. 2001; Mays y Edwards 2000; Windham, 2001; Wu, 2002; Overall y Parcy, 2004).
Entre las macrofitas acuáticas usadas para la remoción de contaminantes destacan Lemna gibba, Eichhornia crassipes e Hydrocotyle ranunculoides debido a que son de fácil manejo en el laboratorio, se encuentran ampliamente distribuidas en México, son de alta productividad y en ocasiones consideradas como una plaga debido a su rápido crecimiento y de esta forma invaden en corto tiempo los cuerpos de agua (Arrivallaga y Arredondo, 1978; Wang, 1990). Para conocer el efecto del medio ambiente sobre las especies tanto vegetales como animales es necesario recurrir a estudios finos, así tenemos que los efectos tóxicos de los metales pesados y otros contaminantes, pueden ser medidos en términos de respuestas bioquímicas en los organismos, estas respuestas son conocidas como biomarcadores moleculares o bioquímicos (Livingstone, 1993). Es un hecho que los efectos de los contaminantes en un ecosistema se inician con reacciones bioquímicas de los organismos, por esta razón los biomarcadores moleculares son también conocidos como "señales de alarma temprana" para la evaluación de la salud ambiental (Payne et al.,1987). De entre los posibles biomarcadores bioquímicos, es importante considerar a los de costo más bajo y cuyas técnicas de análisis sean simples para realizarlos de manera rápida en el laboratorio (Melacon, M., 1995).
De esta forma surge el interés por evaluar a las clorofilas totales y a los azúcares libres totales como parámetros bioquímicos que se pueden evaluar de manera sencilla en el laboratorio.
Las clorofilas son indispensables en el metabolismo de las plantas, porque sintetizan carbohidratos por medio de mecanismos enzimáticos especializados, puede haber cambios en el contenido de clorofilas que pueden usarse como biomarcadores cuando la planta presenta síntomas de estrés (Blakenship, 2002; Salisbury,1996). Por otra parte los azúcares representan fisiológicamente el metabolismo activo de los carbohidratos y están implicados en todas las actividades de biosíntesis y conservación, sirven como almacenamiento cuando las temperaturas son bajas ya que el azúcar actúa como un anticongelante dentro de las células (Kramer y Kozlowski, 1979; Guy et al., 1992).
Las clorofilas y los azúcares son componentes ampliamente distribuidos en los tejidos de las plantas y pueden ser utilizados como parámetros bioquímicos en respuesta (PBR) al daño causado por presencia de tóxicos y contaminantes, por lo que el objetivo de este trabajo fue cuantificar los PBR o biomarcadores moleculares ante la exposición al cobre de tres diferentes macrofitas acuáticas comunes del lago de Pátzcuaro, Michoacán, usando técnicas colorimétricas que son factibles de realizar a bajo costo en el laboratorio.
Características de las macrofitas acuáticas
Lemna gibba L. (lenteja de agua) pertenece a la Familia LEMNACEAE la cual incluye a las fanerógamas más pequeñas del Reino Plantae, se caracterizan por tener flores pequeñas, cíclicas, con perigonio sencillo o doble. Se trata de plantas acuáticas diminutas, reducidas a un cuerpo taliforme, membranoso, que flota libremente en el agua, presentan reproducción vegetativa muy activa, su hábitat es cosmopolita en agua dulce de zonas templadas y cálidas (Sánchez, 1979).
Hydrocotyle ranunculoides L. (paragüitas) pertenece a la Familia UMBELLIFERAE son plantas glabras, algo suculentas, con los tallos rastreros o flotantes; hojas con pecíolo delgado, de 1 a 35 cm. de largo, láminas no peltadas, reniformes. Habitan en cuerpos de agua dulce de zonas templadas y cálidas. (Rzedowski et al.,1985).
Eichhornia crassipes (Martius) Solms Laubach., pertenece a la Familia PONTE-DERIACEAE. El jacinto o lirio de agua como también se le conoce es una planta flotante que está ampliamente expandida alrededor del mundo. Es nativa de Sudamérica y tiene un crecimiento rápido y de altas densidades y es por ello que cubre y llega a obstruir completamente los cuerpos de agua. Habita en aguas dulces y salobres de zonas templadas y cálido-húmedas (Miranda y Lot, 1999).
MATERIAL Y MÉTODO
I. Zona de estudio
La cuenca de Pátzcuaro se localiza en el centro-norte del estado de Michoacán (Fig. 1) y se encuentra en la provincia fisiográfica del Eje Neovolcánico. Pátzcuaro se localiza en las coordenadas geográficas de 101° 26' y 101° 54' de longitud Oeste y 19° 25' de latitud Norte, tiene una superficie de 919 km2, con una altura media de 2 369 m.s.n.m. (García, 2000). Se extiende a lo largo de los municipios Pátzcuaro, Erongaricuaro, Quiroga y Tzintzuntzán, incluyendo también las localidades de Pichátaro (Tingambato) y San Isidro (Nahuatzen) (INEGI, 2003).

Recibe las aguas de pequeños ríos, como el Guaní y el Chapultepec. El área total del lago, incluyendo las islas, es de 130 m2, con una profundidad media de entre 5 y 8 metros y una máxima de entre 12 y 15 metros. Actualmente posee ocho islas, la de Jarácuaro es la de mayor extensión (INEGI, 2003).
II. Colecta de material vegetal y tratamientos experimentales
Los ejemplares de Lemna gibba, Eichhornia crassipes e Hydrocotyle ranunculoides se colectaron en época de lluvias en la zona conocida como Los Urandenes que se localiza al sur del lago de Pátzcuaro, Michoacán (Fig. 2). La colecta de las plantas se llevó a cabo manualmente, utilizando bolsas de plástico para mantenerlas con una determinada cantidad de agua, éstas se colocaron en una hielera de plástico para transportarlas hasta el laboratorio. Se cultivaron por triplicado en medio nutritivo Hoagland diluido 1/40 en palanganas de plástico, con 2 000 ml de volumen total y 100 g de plantas en peso fresco (Miranda e Ilangovan, 1996). Se mantuvieron con un fotoperiodo de 12/12 horas luz-oscuridad y una temperatura entre 19° y 21°C, el pH se mantuvo en un valor de 7. Después de una semana de aclimatación se montaron los bioensayos. De acuerdo a Taiz y Zeiger, 1991, la concentración óptima de Cu determinado en biomasa seca de plantas es de sólo 6 mg/L. Sin embargo, Jain et al., 1989 y Low et al., 1994 reportan que tanto la lenteja de agua como el lirio acuático acumulan niveles altos de Cu. Debido a lo anterior las concentraciones probadas en este estudio fueron de 50 y 100 mg/L de Cu en forma de (Cu2SO4 5H2O). Se usaron las mismas condiciones de luz y temperatura de la aclimatación. Los bioensayos se realizaron por triplicado y se mantuvieron durante cinco días, después de los cuales se determinó el contenido de clorofilas que fue evaluado por el método colorimétrico de Arnon (1949) y el contenido de azúcares fue determinado por el método colorimétrico de Dubois, et al. (1956).

A los datos obtenidos se les aplicaron las pruebas estadísticas de normalidad de Lilliefors y homoscedasticidad de Barlett. Posteriormente, para determinar algún patrón de variación, se evaluaron las diferencias significativas entre las tres especies vegetales estudiadas y las concentraciones de Cu con base en un análisis de varianza de una vía (ANDEVA). En todos los casos se utilizó el programa NCSS (2001).
RESULTADOS Y DISCUSIÓN
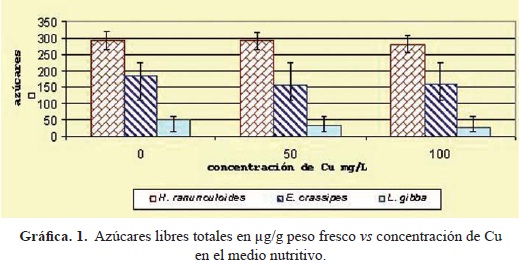
En las gráficas 1 y 2 se muestran la producción de azúcares libres y el contenido de clorofilas totales respectivamente. Para el caso de los azúcares libres entre las tres especies de macrofitas no hubo diferencias significativas, F(2, 9) = 5.71 (P > 0.05), pero sí hubo diferencias estadísticamente significativas con respecto a los tratamientos de 50 y 100 mg/L en relación al testigo sin Cu. Hydrocotyle ranunculoides F(2, 6) = 3.8 (P < 0.05). Eichhornia crassipes F(2, 6)= 3.2 (P < 0.05). Lemna gibba F(2, 6)= 4.0 (P < 0.05). Observando la morfología de las plantas a simple vista, las plantas de Hydrocotyle presentaron clorosis desde las 24 hrs. de exposición al Cu mientras que, Lemna gibba y Eichhornia crassipes no presentaron daños aparentes. Esta observación denota que estas últimas pudieran ser más tolerantes a la presencia del cobre en este tiempo de exposición.

La variación en la producción de clorofilas no fue del todo proporcional al tiempo de exposición y a la concentración de cobre, el análisis estadístico indicó que no hubo diferencias signiicativas en el contenido de clorofilas entre las tres especies de macrofitas F(2, 9) = 8.4 (P > 0.05); ni con relación a la concentración de 50 y 100 mg/L de Cu, en relación al lote control sin Cu, Hydrocotyle ranunculoides F(2, 6)= 6.2 (P > 0.05). Eichhornia crassipes F(2, 6) = 5.7 (P > 0.05). Lemna gibba F(2, 6) = 5.3 (P > 0.05). Estos resultados concuerdan con los de Kara (2005) que reporta que Nasturtium officinale tolera niveles elevados de Cu sin cambios significativos en la concentración de pigmentos fotosintéticos.
Como se observó a través de este estudio, se presentaron cambios tanto en azúcares libres totales como en las cloroilas totales lo que muestra que ocurren cambios a nivel bioquímico como respuesta a contaminantes como el Cu, el cual, de manera indirecta, inactiva a varias enzimas del ciclo de Calvin, es decir, el Cu inactiva proteínas-enzimas que contienen grupos sulfhidrilo como las tioredoxinas las que transieren electrones a enzimas del estroma como la gliceraldehido 3-fosfato-deshidrogenasa entre otras (Larcher, 1995). La detección de la primera respuesta que tienen las plantas es útil en trabajos de monitoreo ambiental, ya que ocurre inmediatamente después de estar en contacto con el contaminante, pudiendo ser reversible, en tanto que las respuestas a niveles de organización biológica más complejas, suelen ser detectadas tras lapsos de tiempo más largos y suelen resultar en efectos irreversibles. La aplicación de las respuestas bioquímicas o biomarcadores de contaminación como los estudiados aquí, son muy convenientes debido a su bajo costo y rápida detección en el laboratorio.
CONCLUSIÓN
De acuerdo a los biomarcadores evaluados, los azúcares libres totales resultaron ser los PBR más adecuados para detectar cambios fisiológicos en las macrofitas acuáticas estudiadas con exposición al Cu en las condiciones del bioensayo aquí descritas.
LITERATURA CITADA
Alabaster, J. & R. Lloyd, 1982. Water Quality Criteria for Freshwater Fish. 2nd edition. Food and Agriculture Organization of the United Nations. Butterworths, London, 361 pp. [ Links ]
Arnon, D., 1949. "Cooperenzime in isolated chloroplast. Polyphenoloxidasein Beta vulgaris". Plant. Physiol., 24: 1-15. [ Links ]
Arrivallaga, C. y J. Arredondo, 1978. "Una revisión sobre el potencial de las macrofitas acuáticas en la acuacultura". Universidad y Ciencia, 4: 55-67. [ Links ]
Blankenship, R., 2002. Molecular Mechanisms of Photosynthesis. Blackwell Science Limited. Londres. pág. 139. [ Links ]
Dellarosa, V. Céspedes, J. y C. Zaror, 2001. "Eichhornia crassipes-based tertiary treatment of Kraft pulp mill effluents in Chilean Central Region". Hydrobiology, 443: 187-191. [ Links ]
Dubois, M., Gilles, K., Hamilton, J., Rebers, P. & F. Smith, 1956. "Colorimetric method for determination of sugars and related substances". Anal. Chem., 28: 300-306. [ Links ]
Erickson, P. & S. Weisner, 1997. "Nitrogen removal in wate water reservoir; The importance of denitriication by epiphyticbioilms on submerged vegetation". J. Environ. Qual., 26: 905-910. [ Links ]
García A., 2000. Simulación dinámica del impacto ambiental por actividad agrícola en la cuenca de Pátzcuaro, Mich. Tesis de Maestría en la Facultad de Biología de la Universidad Michoacana de San Nicolas de Hidalgo. Morelia, Michoacán. 101 pp. [ Links ]
Goodwin, T. & E. Mercer, 1983. Introduction to Plant Biochemistry. 2a. ed. Pergamon Press. Londres. págs. 234, 239-248. [ Links ]
Guy, C. Huber, J. & S. Huber, 1992. "Sucrose phosphate synthase and sucrose accumulation at low temperature". Plant Physiol., 100: 502-508. [ Links ]
Huddleston, G.,Gillespie, W. & J. Rodgers, 2000. "Using constructed wetland to treat biochemical oxygen demand and ammonia associated with a reinery effluent". Ecotoxicol Environ. Safety, 45: 188-193. [ Links ]
Instituto Nacional de Estadística,Geografía e Informática (INEGI), 2003. Anuario de estadísticas por entidad federativa. Instituto Nacional de Estadística, Geografía e Informática, Michoacán. 440 pp. [ Links ]
Jain, S. Vasudeman, P. & N. Jha., 1989. "Removal of some heavy metals from polluted water by aquatic plants: studies on duckweed and water velvet". Biol. Wastes, 28: 115-119. [ Links ]
Kara, Y., 2005. "Bioaccumulation of Cu, Zn and Ni from the wastewater by treated Nasturtium officinale". Int. J.Environ. Sci.Tech., 2(1): 63-67. [ Links ]
Kramer, P. & T. Kozlowski, 1979. Physiology of woody plants. Academic Press, New York. [ Links ]
Larcher, W., 1995. Physiological Plant Ecology. Springer (3a) Nueva York. pp. 327-333, 424-432. [ Links ]
Livingstone, D., 1993. "Biotechnology and pollution monitoring: Use of molecular biomakers in the aquatic environment". J.Chem. Tech. Biotechnol., 57: 195-211. [ Links ]
Low, K.,Lee, C. & C. Tai, 1994. "Biosorption of copper by water hyacinth roots". J. Environ. Sci. Health, A29(1): 171-188. [ Links ]
Machate, T. Heuermann, E., Schamm, K. & A. Kettrup, 1999. "Purification of fuel and nitrate contaminated ground water using a free water surface constructed wetland plant". J. Environ. Qual., 28: 1665-1673. [ Links ]
Maine, M. Duarte, M. & N. Suñé, 2001. "Cadmium uptake by floating macrophytes". Water Res., 35(11): 2629-2634. [ Links ]
Mays, P. & G. Edwards. 2001. "Comparison of heavy metal accumulation in a natural wetland and constructed wetlands receiving acid mine drainage". Ecol. Eng., 16(4): 487-500. [ Links ]
Melacon, M., 1995. "Bioindicators used in aquatic and terrestrial monitoring". En: Handbook of Ecotoxicology. Lewis Publisher. Boca Ratón. CRC. Press. Inc. 755 pp. [ Links ]
Miranda, M.G. & K. Ilangovan, 1996. "Uptake of lead by Lemna gibba L.: Influence on Specific Growth Rate and Basic Changes". Bull. Environ. Contam. Toxicol., 56(6): 1000-1007. [ Links ]
Miranda M.G. y A. Lot, 1999. "Lirio acuático, ¿una planta nativa de México?" Ciencias, 53: 50-54. [ Links ]
Moore, T., Bubier, J., Heyes, A. & R. Flett, 1995. "Methyl and total mercury in boreal wetland plants, Experimental Lakes Area, Northwestern Ontario". J. Environ. Qual., 24: 845-850. [ Links ]
Novotny, V. & H.Olem, 1994. "Water quality: prevention, identiication and management of diffuse pollution". Van Nostrand Reinhold, New York. 1054 pp. [ Links ]
Ochoa, E., Zamudio, N. y G. Estevez, 2006. "La Ecología Social, Acción, Conocimientos y Educación. Coordinación de Innovación Educativa". Universidad Michoacana de San Nicolas de Hidalgo. Morelia, Michoacán, México. pág. 12. [ Links ]
Overall, R. y D. Parcy, 2004. "The uptake of uranium by Eleocharis dulcis (Chinese water chesnut) in the Ranger Uranium Mine constructed wetland ilter". Environ. Poll., 132: 307-320. [ Links ]
Payne, J., Fancey, L. Rahimtula, A. & L. Gedamu, 1987. "Review and perspective on the use of mixed-function oxygenase enzymes in biological monitoring". Comp. Biochem. Physiol. C., 86: 233. [ Links ]
Pezzolesi, T., Zartman, R., Fish, E. & M. Hickey, 1998. "Nutrients in a plata wetland receiving wastewater". J. Environ. Qual. , 27: 67-74. [ Links ]
Rai, U., Sinha, S. & P. Chandra. 1996. "Metal Biomonitoring in water resources of Estern Ghats, Karaput (Orissa), In-diaby aquatic plants". Environ. Moni. Assess., 43: 125-137. [ Links ]
Rivas, A., 2006. "Experiencia exitosa del uso de humedales construidos para la protección de la calidad del agua del lago de Pátzcuaro". Instituto Mexicano de Tecnología del Agua. Jiutepec, Morelos. pp. 1-6. [ Links ]
Rzedowski, G. De, J., Rzedowski y colaboradores, 1985. "Flora Fanerogámica del Valle de México". Escuela Nacional de Ciencias Biológicas. Instituto de Ecología. México. Volumen II pág. 177. [ Links ]
Salisbury, F., 1996. "Units, Symbols and Terminology for Plant Physiology". Oxford University Press. Nueva York. pág. 144. [ Links ]
Sánchez, O., 1979. "La Flora del Valle de México". Herrero, México, pág. 519. [ Links ]
Taiz, L. & E. Zeiger, 1991. Plant Physiology. The Benjamin/Cummings Publishing Company, INC. California, USA. pp. 68-69, 75. [ Links ]
Viarengo, A., 1989. "Heavy metals in marine invertebracation homeostasis in marine invertebrates.: Mechanisms of regulation a toxicity at cellular level". Aquatic. Sci., 1: 295-317. [ Links ]
Viarengo A. & J. Nott., 1993. "Mechanisms of heavy metal cation homeostasis in marine invertebrates". Comp. Biochem. Physiol., 104C: 355-372. [ Links ]
Visviki, I. & W. Rachlin, 1994. "Acute and chronic exposure of Dunaliella salina and Chlamydomonas bullosa to cooper and cadmium effects on growth". Arch. Env. Comp. Toxicol., 26: 149-153. [ Links ]
Wang, W., 1990. "Literature Review on Duckweed Toxicity Testing". Environ. Res., 52: 7-22. [ Links ]
Windham, L. Weiss, J. & P. Weiss, 2001. "Lead uptake, distribution, and effects in two dominant salt marsh macro-phytes, Spartina alterniflora (cord-grass) and Phragmites australis (common reed)".Mar. Pollut. Bull., 42(10): 811-816. [ Links ]
Wu, L. & X. Guo, 2002. "Selenium accumulation in submerged aquaric macrophytes Potamogeton pectinatus L. and Ruppia maritime L. from water with elevated chloride and sulfate salinity". Ecotoxicol. Environ. Safety, 51: 22-27. [ Links ]














