Introducción
Bursera Jacq. ex L. es uno de los 25 géneros más diversos de la flora de México con 94 especies, de las cuales 73 son endémicas (Villaseñor, 2016); aun cuando su tasa de endemismo es alta (78%). Sus especies son abundantes y dominantes en el bosque tropical seco (BTS), el bosque tropical de mayor extensión en México (Miranda y Hernández, 1963; Becerra, 2005; Rzedowski, Lemos y Calderón de Rzedowski, 2005; Hernández-Pérez, González-Espinosa, Trejo y Bonfil, 2011).
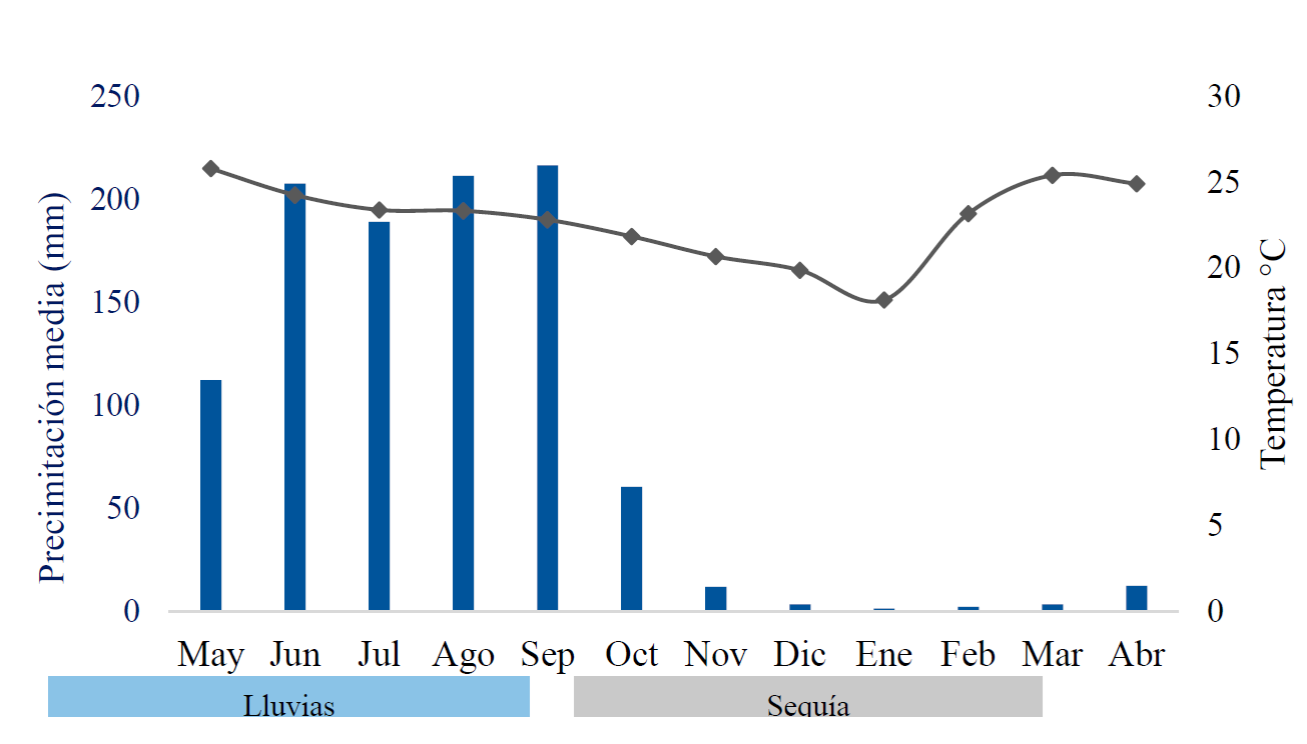
Una de las características del BTS es la alternancia de las estaciones de lluvia y estiaje, que condiciona casi en su totalidad los patrones fenológicos de las plantas que lo habitan (Bezaury-Creel, 2010). La mayoría de las especies en el BTS son deciduas con la foliación en la temporada de lluvias y la senescencia al inicio o durante la temporada de estiaje, mientras que su fase reproductiva sucede durante el periodo de sequía (Bullock y Solis-Magallanes, 1990; Trejo-Vázquez, 1999; Singh y Kushwaha, 2006; Singh y Chaturvedi, 2018). Sin embargo, ciertas especies muestran fenología menos común, como follaje perenne o la reproducción durante el periodo de lluvias (Choat, Ball, Luly y Holtum, 2005, Rojas-Jiménez et al., 2007). Los patrones fenológicos foliares en los BTS según Borchert, Rivera y Hagnauer, (2002) están relacionados con la distribución de la precipitación y con la fisiología de cada especie. Rivera y Borchert (2001) y Singh y Kushwaha (2005) han observado varios patrones fenológicos foliares en estos ambientes, que incluyen las especies deciduas, brevideciduas, semi-siempreverdes, perennes y de hojas intercambiables. Con relación a la fenología reproductiva, hay especies que florecen y fructifican junto con la senescencia foliar, generalmente durante la estación seca, pero otras florecen y fructifican durante la estación lluviosa (Borchert, Meyer, Felger y Porter-Bolland, 2004).
Los estudios de fenología han sido de utilidad para entender la temporalidad de los eventos biológicos cíclicos y su relación con la estacionalidad (Williams-Linera y Meave, 2002); el patrón fenológico de las plantas es el indicador biológico más mencionado del cambio climático antropogénico, porque es susceptible a las variables ambientales en espacio y tiempo (Alvarado Foroughbakhch, Jurado-Ybarra y Rocha, 2002; Workie y Debella. 2018). El conocimiento de esta variación es fundamental para los modelos globales de captura de carbono, la predicción precisa del cambio climático futuro y la estimación de los cambios en los principales servicios del ecosistema (Wolkovich y Ettinger, 2014).
Bursera simaruba Jacq. ex L (palo mulato) y Bursera tomentosa (Jacq.) Triana & Planch (estoraque) son especies comunes del bosque tropical seco del sureste de México (Rzedowski et al., 2005; Bezaury-Creel, 2010). B. simaruba se ha registrado en 40 municipios del Estado de Chiapas, mientras que B. tomentosa en ocho (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad [Conabio], 2019). Ambas especies tienen importancia ecológica y económica debido a que son especies pioneras con una densidad alta en sus comunidades (Gutiérrez-Granados, Perez-Salicrup y Dirzo, 2011), además de su empleo en la medicina tradicional y utilización como cercas vivas, forraje y en la producción de miel (Rzedowski y Calderón, 1996; Porter-Bolland, 2003; Castillo, Sanabria, Hidalgo y Perozo, 2005
Se conoce la descripción fenológica de pocas especies del género Bursera y de los factores que la determinan (Núñez-Cruz, Meave y Bonfil, 2018), en general se sabe que son de follaje caducifolio en época de seca, que florecen de marzo a junio y fructifican a lo largo del año principalmente en mayo y junio (Rzedowski et al., 2005; Rojas-Rodríguez y Torres-Córdoba, 2011, Berdugo-Lattke y Rangel-Ch, 2015). Particularmente con B. simaruba se han realizado algunos estudios fenológicos: Daubenmire (1972), en un bosque tropical semideciduo al noroeste de Costa Rica, caracterizó la fenología vegetativa, señalando que el rebrote de hojas sucede antes de que termine la estación seca. Borchert et al. (2002) monitorearon la fenología durante una sequía severa anormal en bosques semicaducifolios de Costa Rica, a diferencia de otras especies que respondieron con cambios en su fenología vegetativa, B. simaruba conservó sus patrones fenológicos. De manera consistente, Valdez-Hernández et al. (2011) observaron que la fenología egetativa y reproductiva fueron similares en años consecutivos y en sitios con diferencias microclimáticas, su fenología foliar fue catalogada como decidua con brotación de hojas en primavera y senescencia foliar durante la estación seca y fría. La floración sucedió en los meses más calientes de la estación seca, mientras que los frutos se desarrollan durante todo el año. De B. tomentosa solo se ha señalado su fenología decidua sin datos de su patrón fenológico (Werger, de-Bok y Orange, 1991).
Por lo antes mencionado, estudiar los aspectos fenológicos de estas burseras en otros sitios puede contribuir a tener un panorama más completo de la biología de estas especies dominantes en el BTS. En este estudio se planteó responder ¿Cuáles son los patrones fenológicos de estas especies y cuál su asociación a los factores estacionales, humedad relativa, temperatura y precipitación? ¿Cuáles son sus similitudes y diferencias? ¿Siguen los mismos patrones de otras especies de burseras en los diferentes BTS? Dados los antecedentes se hipotetizó que la floración y el inicio de la foliación se asocian con las variables ambientales del final de la temporada seca (aumento de la humedad relativa y temperaturas altas), mientras que la senescencia foliar con las temperaturas más bajas de la estación seca. También se intuyó que ambas especies, debido a que comparten características genéticas y ambiente, se comportarían de manera similar en la mayoría de sus fenofases foliares y reproductivas, sin embargo, algunas fenofases deberían tener particularidades en la duración.
Objetivos
El presente estudio tuvo como objetivos caracterizar la fenología de Bursera simaruba y Bursera tomentosa y evaluar la relación de las fenofases reproductivas (botón floral, flor abierta, desarrollo de frutos y permanencia de frutos) y fenofases vegetativas (brote foliar, hojas maduras, senescencia) con las variables ambientales del BTS del Área Natural Protegida “Villa Allende” en Chiapas, México donde se desarrollan.
Materiales y métodos
Área de estudio
El área de estudio se localiza dentro de los límites del vértice 4 “La Chacona” en el Área Natural Protegida “Los terrenos forestales de Villa Allende” (Zona Protectora Forestal Vedada), que abarca parte de los Municipios de Tuxtla Gutiérrez, San Fernando y Berriozábal, Chiapas, México (Diario Oficial de la Federación [DOF], 1939). Dentro del vértice 4 se identificó un sendero ya establecido con una extensión cercana a 5 km, la zona de observación inicia en las coordenadas 16°48´11.7´´N, 093°11´18.7´´O y finaliza en las coordenadas 16°47´28.5´´N, 093°11´16.1´´O. Ambas especies conviven en esta zona de estudio. Un ejemplar de cada especie fue ingresado al herbario Eizi Matuda de la Universidad de Ciencias y Artes de Chiapas, para su confirmación.
Las condiciones climáticas fueron caracterizadas en dos temporadas: la temporada de lluvias (mayo a octubre) con eventos de precipitación por arriba de los 40 mm mensuales y la temporada de estiaje (noviembre a abril) con eventos de precipitación menores a 40 mm mensuales (Fig. 1). Los valores diarios de temperatura y humedad relativa se registraron cada 30 minutos en el sitio de estudio con un sensor electrónico de datos marca Extech modelo RHT 10 colocado en la parte media del transecto, mientras que los datos de precipitación se tomaron de la estación meteorológica cercana (16°47´10´´N, 093°07´00´´O, Tuxtla Gutiérrez, Chiapas, México).
Observaciones fenológicas
Dentro de los límites establecidos como zona de recolecta, se reconoció a una población con alrededor de 200 individuos de cada especie de Bursera, ambas cohabitando de manera estrecha y con una distribución mezclada. Se seleccionaron 50 individuos al azar de cada especie (con diámetro a la altura de pecho mayor a 20 cm), de tal forma que quedaran homogéneamente distribuidos desde el inicio hasta el fin del transecto. Las fenofases consideradas para la fenología vegetativa fueron, brote foliar, hoja madura, senescencia. Para la fenología reproductiva fueron botón floral, flor abierta, desarrollo de frutos y permanencia de frutos. El estudio se realizó de mayo de 2017 a abril de 2018. Las observaciones se realizaron mensualmente (fenología vegetativa) y quincenalmente (fenología reproductiva) por dos observadores.
El índice de intensidad o frecuencia relativa de cada fenofase se estimó mediante el método de Fournier (1974) con la escala semicuantitativa de cinco categorías (0-4), considerando a la copa total de cada árbol como el total (100%) con intervalos de 25% entre las categorías, como se describe a continuación: 0= ausencia de la fenofase observada (0%); 1= una cuarta parte de la copa presenta la fenofase observada (25%); 2= la mitad de la copa presenta la fenofase observada (50%); 3= tres cuartas partes de la copa del árbol presenta la fenofase (75%); 4= el total de la copa presenta la fenofase (100%). Con la estimación del índice de intensidad de cada fenofase, se calculó el índice de actividad (IA) mediante la siguiente ecuación (RB):
También se determinó el tipo funcional de la fenología vegetativa de acuerdo con las categorías utilizadas por Rivera et al. (2002) y Kushwaha y Singh (2005): brevi-caducifolio cuando el periodo de caducidad foliar es menor a 4 meses; caducifolio: árboles sin hojas por más de cuatro meses; semisiempreverde: cuando pierden las hojas por un periodo breve (de días a pocas semanas).
El patrón de duración de la fenología reproductiva (floración y fructificación) se categorizó de acuerdo con las clases de amplitud y regularidad establecidas para la floración por Newstrom et al. (1994): floración o fructificación breve: <1 mes; floración o fructificación intermedia: 1 mes - 5 meses; y floración o fructificación extendida: >5 meses.
Análisis estadístico
Los datos fenológicos del índice de actividad fenológica fueron analizados mediante estadística circular con una versión de prueba del software Oriana 4.0 (Kovach, 2018), de acuerdo con Morrellato et al. (2010); para describir los patrones fenológicos de las especies se calculó el ángulo o vector medio (μ), para ello inicialmente cada uno de los días muestreados se convirtió a un ángulo (α) de la escala circular mediante la fórmula
donde:
X = día del mes en que ocurrió el muestreo
k = número total de días del año
posteriormente, el ángulo promedio se calculó de acuerdo con Zar (2010). El ángulo medio representa el promedio de los datos de actividad fenológica (índice de intensidad).
También se determinó la longitud del vector (r) que varía entre 0 y 1, valores altos (> 0.5) indican el grado de agregación temporal o sincronía de las fenofases (Morellato, Alberti y Hudson, 2010; Sigrist et al., 2018). La prueba de Rayleight (Z) (Zar, 2010) fue aplicada para probar la hipótesis nula de que la población no tiene una dirección media. H0: la muestra de la población se distribuye uniformemente a través del año, mientras que para HA: la muestra de la población no muestra uniformidad. Si la hipótesis nula es rechazada, los datos no se distribuyen uniformemente en el año; es decir, existe una estacionalidad de la fenofase.
Se calculó el coeficiente de correlación de Spearman (rs) con el programa estadístico PAST (Hammer, Harper y Ryan, 2001) para determinar el grado de asociación de la actividad fenológica de cada fenofase con las variables ambientales. Para utilizar los datos ambientales (temperatura, humedad relativa y precipitación) en forma pareada con los fenológicos se realizaron los promedios y sumatorias mensuales correspondientes a cada variable ambiental. Para las fenofases de botón y flor abierta los promedios de las variables ambientales se calcularon quincenalmente en correspondencia con el registro fenológico.
Resultados
Fenología de Bursera simaruba
Fenología reproductiva
Las fases de la floración (botón floral y flor abierta) fueron unimodales y sincrónicas (r > 0.95; Fig. 2; Tabla 1), sucedieron en un periodo único y corto durante la temporada de estiaje (entre marzo y mayo); la fase de botón floral alcanzó su intensidad fenológica máxima en abril (56.5%) y la de flor abierta (antesis) entre abril y mayo (40%-45%), por lo que la intensidad media estimada entre estas difiere en dos semanas. La etapa de botón floral se estimó en la segunda semana de abril (µ = 98.884°) y la de flor abierta a fin del mes (µ = 117.595°); los botones mostraron una correlación con la temperatura (rs= 0.752, p = 0.004), mientras que en las florares no es tan clara (rs = 0.51, p = 0.089).
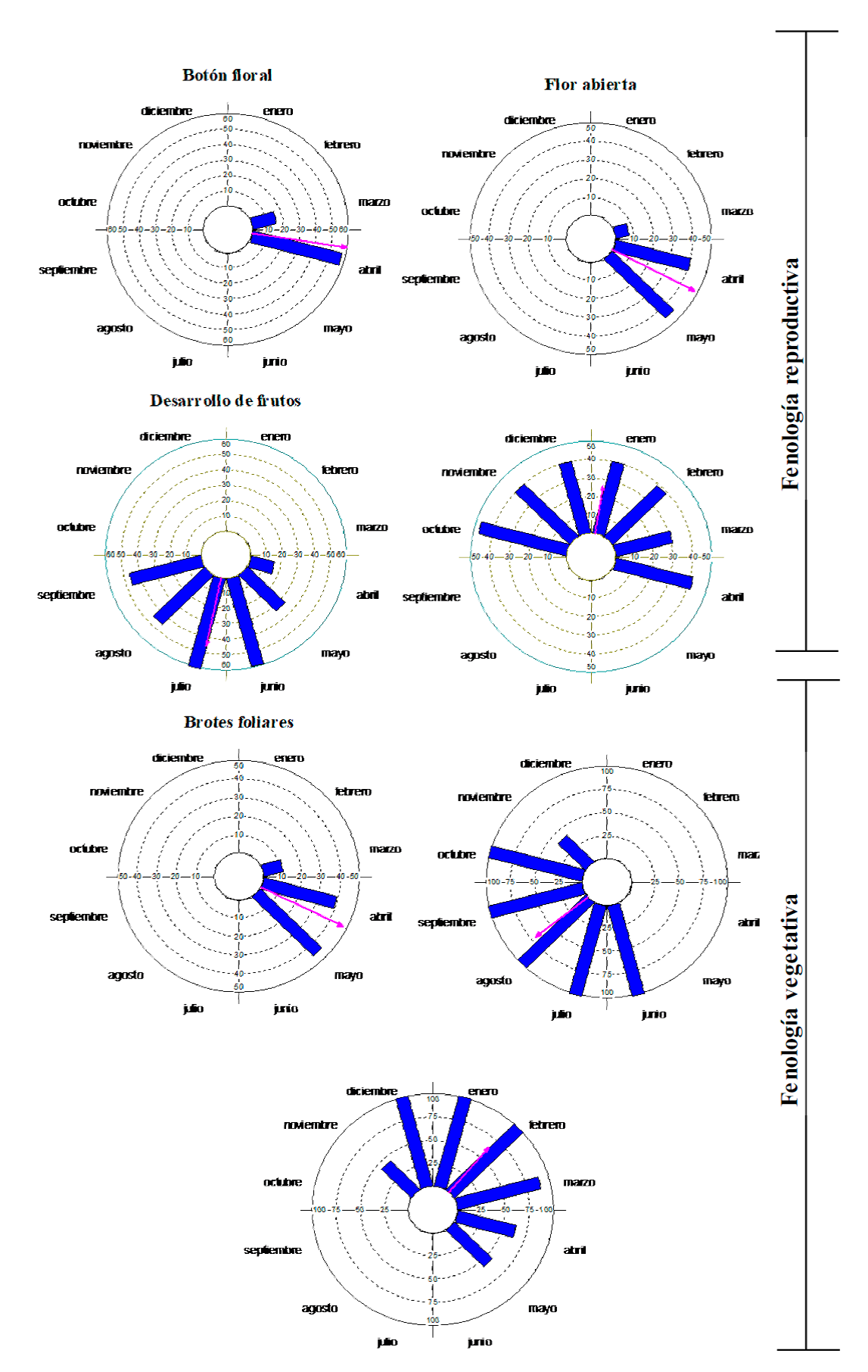
Figura 2 Fases fenológicas de Bursera simaruba durante un ciclo anual. Análisis de estadística circular, se representa el índice de actividad fenológica en cada mes (barras) y el vector promedio r (flecha).
Tabla 1 Variables descriptivas del análisis de estadística circular aplicado para las etapas de fenología vegetativa y reproductiva de Bursera simaruba.
| Fenofase | Etapa | Número de observaciones | Media del vector (μ) | Fecha media | Longitud media del vector (r) | Test de Rayleigh (Z) |
| Botón floral | 72 | 98.884° | 10-abr | 0.989 | 70.412 | |
| Floración | ||||||
| Flores abiertas | 92 | 117.595° | 29-abr | 0.958 | 84.429 | |
| Desarrollo de frutos | 258 | 191.757° | 13-jul | 0.744 | 142.969 | |
| Fructificación | ||||||
| Permanencia de frutos | 277 | 8.966° | 09-ene | 0.527 | 76.822 | |
| Brotes foliares | 94 | 116.42° | 28-abr | 0.951 | 85.023 | |
| Foliación | ||||||
| Hojas desarrolladas | 542 | 231.409° | 23-ago | 0.7 | 265.535 | |
| Senescencia | Ausencia de hojas | 551 | 40.619° | 10-feb | 0.635 | 221.904 |
Para obtener la fecha media se convirtió a los días del año a grados. *Valor de siginificancia P < 0.005.
Las fructificación fue una etapa que prácticamente abarcó todo el año, para un mejor análisis, en este estudio se dividió en dos fases (frutos en desarrollo y permanencia de frutos), la fase de desarrollo se consideró terminada cuando los frutos visiblemente alcanzaron su tamaño final, la fase fue estacional (r = 0.744) y sucedió prácticamente desde el inicio de lluvias (de abril a septiembre), con una actividad máxima en julio (60%) y actividad media estimada en la segunda semana de este mes (µ = 191.757°); al alcanzar el tamaño final, la fase fue considerada como permanencia de frutos, la cual transcurrió de octubre a abril del siguiente ciclo; este periodo amplio resultó en una fase semi-estacional (r = 0.527), con el índice de actividad más alta en octubre (47%) y la media estimada a inicios de enero (µ=8.966°); ambas fenofases mostraron una alta correlación con la precipitación, el desarrollo de frutos tiene una correlación directa (rs= 0.845, p= 0.0005) mientras que la permanencia de frutos muestra una correlación inversa (rs= -0.65, p= 0.02).
Fenología vegetativa
La presencia de brotes foliares fue una fenofase estacional, unimodal y sincrónica (r = 0.951), perduró de marzo a mayo, con una intensidad media estimada en abril y un índice de actividad máxima en mayo (44.5%), coincidió con la floración; la permanencia de las hojas maduras significó una fenofase estacional, multimodal y sincrónica (r= 0.7), un poco más extendida hacia la temporada de lluvias (de junio a noviembre), y coincidió con la presencia de los frutos en desarrollo. La senescencia foliar fue multimodal y prolongada (de noviembre a mayo), ligeramente estacional y sincrónica (r = 0.635; Z = 221.904, P < 0.005), incluso hubo una convergencia de abril a mayo con los brotes foliares del siguiente ciclo fenológico y con los frutos desarrollados en la temporada de estiaje. La fenofase de brotes foliares estuvo asociada a la temperatura (rs = 0.752, p = 0.004), la de hojas maduras con la humedad (rs = 0.927, p<0.0001) y la de senescencia de noviembre a mayo se asocia inversamente con la precipitación (rs = -0.912, p<0.0001).
Fenología de Bursera tomentosa
Fenología reproductiva
Las fases de botón floral y flor abierta (Fig. 3) fueron estacionales, unimodales, sincrónicas y de periodo breve (2 meses a 3 meses) (Fig. 4; Tabla 2). La fase de botón floral tuvo la máxima actividad fenológica en abril (28.25%) y la de flor abierta en mayo (88%). Contrario a lo observado en B. simaruba, estas fenofases no estuvieron correlacionadas a la misma variable ambiental; la de botón floral estuvo inversamente correlacionada con la humedad relativa (rs = -0.639, p = 0.025) y la de flor abierta con la temperatura (rs = 0.591, p = 0.042). La fase de frutos en desarrollo también fue estacional, sincrónica y relativamente corta (4 meses) con mayor actividad fenológica en junio (33%) y una alta correlación con la precipitación (rs = 0.819, p = 0.001), en contraste, la permanencia de frutos desarrollados ocurrió durante un lapso extendido (octubre a marzo), con el índice de actividad fenológica más alto en octubre (21%) y con una correlación negativa con la temperatura (rs = -0.668, p = 0.017).
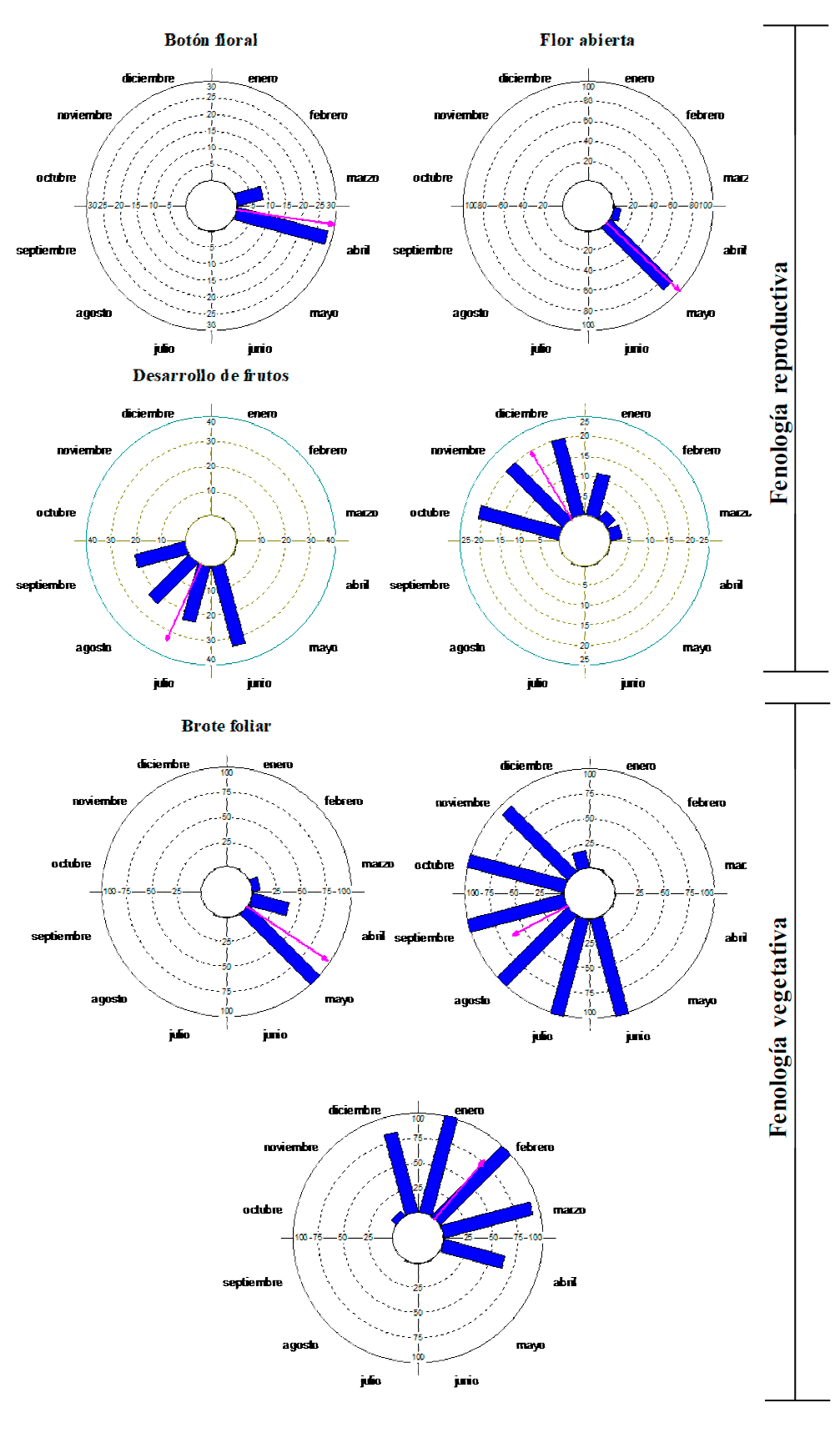
Figura 3 Fases fenológicas de Bursera tomentosa durante un ciclo anual. Análisis de estadística circular, se representa el índice de actividad fenológica en cada mes (barras) y el vector r (flecha).
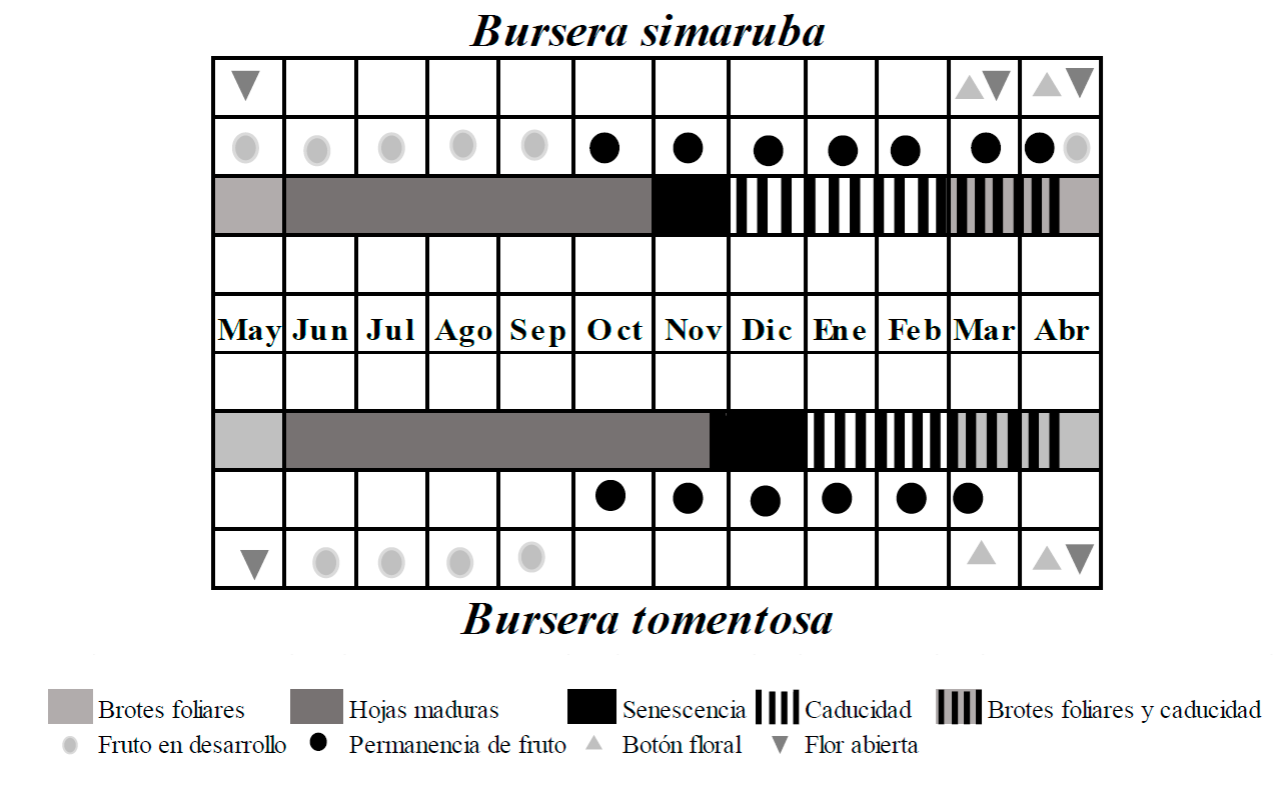
Figura 4 Categorización de los tipos funcionales de la fenología vegetativa Bursera simaruba y Bursera tomentosa de acuerdo con Kushwaha y Singh, (2005) y del patrón de duración de la fenología reproductiva de acuerdo con Newstrom et al. (1994).
Tabla 2 Variables descriptivas del análisis de estadística circular aplicado para las etapas de fenología vegetativa y reproductiva de Bursera tomentosa
| Fenofase | Etapa | Número de observaciones | Media del vector (μ) | Fecha media | Longitud media del vector (r) | Test de Rayleigh (Z) |
|---|---|---|---|---|---|---|
| Brotes florales | 36 | 98.467° | 10-abr | 0.988 | 35.128 | |
| Floración | ||||||
| Flores abiertas | 95 | 132.869° | 14-may | 1 | 95 | |
| Desarrollo de frutos | 100 | 204.136° | 26-jul | 0.84 | 70.572 | |
| Fructificación | ||||||
| Permanencia de frutos | 78 | 328.807° | 29-nov | 0.795 | 49.256 | |
| Brotes foliares | 146 | 124.276° | 06-may | 0.965 | 136.069 | |
| Foliación | ||||||
| Hojas desarrolladas | 613 | 241.755° | 02-sep | 0.624 | 238.999 | |
| Senescencia | Ausencia de hojas | 445 | 40.228° | 10-feb | 0.774 | 266.507 |
Para obtener la fecha media se convirtió a los días del año a grados. *Valor de siginificancia P < 0.005.
Fenología vegetativa
La fase de brotes foliares fue estacional, unimodal y sincrónica (r = 0.965), coincidió con la aparición de los botones florales y de las flores abiertas, los brotes se desarrollaron durante la transición de la temporada de estiaje a lluvias (marzo a mayo), con el índice de actividad más elevado en mayo (100%) y la media estimada en la primera semana de ese mes (µ = 124.276°); la mayor correlación observada fue con la temperatura (rs = 0.752, p = 0.004). La presencia de hojas maduras fue más prolongada en comparación con B. simaruba y coincidió tanto con los frutos en desarrollo como desarrollados, la actividad fenológica más elevada ocurrió de junio a octubre (100%) y la media a inicios de septiembre (µ = 241.755°), con fuerte correlación con la humedad relativa (rs = 0.936, p< 0.0001). La senescencia del follaje fue una fenofase estacional (r = 0.774) y extensa (noviembre a abril) con mayor actividad fenológica durante el estiaje (enero y febrero) y una fuerte correlación negativa con la precipitación (rs = -0.922, p < 0.0001).
Por último, de acuerdo con las clases de amplitud y regularidad establecidas por Newstrom, Frankie y Baker (1994), los periodos fenológicos aquí descritos indicarían un patrón de duración breve de las fenofases de botón floral (2 meses) y flor abierta (2 meses - 3 meses) en ambas especies. En tanto que para la fenofases reproductivas, B. simaruba presentó un patrón extendido en el desarrollo de frutos (6 meses), mientras que el de B. tomentosa fue intermedio (4 meses). El patrón de duración de la permanencia de frutos fue prolongado para ambas especies (>5 meses) (Fig. 4)
Discusión
Fenología reproductiva
La actividad principal de la fenología floral de B. simaruba y B. tomentosa sucedió al final de la estación de estiaje e inicio de las lluvias (de abril a mayo), condiciones similares durante la floración de B. simaruba fueron observados en otros BST; en Yucatán, México, Valdez-Hernández, Andrade y Jackson, (2010) registraron la floración en los meses más cálidos y secos (abril y mayo); mientras que en Colombia, Berdugo-Lattke y Rangel-Ch (2015) cuantificaron la intensidad más alta en marzo (23% de los ejemplares estudiados). La floración al final del estiaje parece ser constante, Frankie, Baker y Opler, 1974 reportaron el mismo patrón en bosques secos en la cuenca del Pacífico de Costa Rica, lo que indicaría que es una especie cuya floración está asociada a condiciones de sequía y altas temperaturas. Estos últimos también observaron que B. tomentosa floreció de mayo a agosto, mientras que en el presente estudio la floración fue más corta, prácticamente de abril a mayo, lo que demostraría la plasticidad fenotípica de la especie.
Aunque la floración coincide en tiempo, hay diferencias que hacen que el periodo floral distintivo de B. tomentosa sea más corto, sustancialmente sus botones florales se presentaron en abril y la antesis en mayo, en tanto que B. simaruba produjo botones florales en marzo y abril, con la antesis en abril y mayo.
El patrón de fenología floral del género Bursera está asociada al fin de la temporada de secas o muy tempranamente a la estación lluviosa en los BTS, por ejemplo, para Bursera graveolens la floración sucede durante la transición de la temporada seca y la de las lluvias (Morgan y José, 2013); mientras qué B. bicolor, B. biflora, B. bipinnata, B. copallifera, B. glabrifolia, B. grandifolia, B. lancifolia, B. submoniliformis, B. aptera, B. arida, B. fagaroides y B. schlechtendalii de los BTS del centro de México, florecen al iniciar la temporada de lluvias, particularmente una semana después de las primeras precipitaciones (Ramos-Ordoñez, Arizmendi y Marquez-Guzman, 2012).
Según Valdez-Hernández et al. (2011) B. simaruba florece en la estación seca debido a su capacidad de reservar agua en su tallo de madera blanda o para obtenerla de fuentes subterráneas. Esto a su vez pudiera estar asociada a mecanismos foliares como reducir la transpiración antes de desprender todas sus hojas (Reich y Borchert, 1984).
Singh y Kushwaha (2006) proponen cinco tipos funcionales de floración para los árboles de los BTS de la India que dependen de las condiciones climáticas: 1) floración de verano; 2) floración en temporada de lluvia; 3) floración otoñal; 4) floración invernal; y 5) floración en el periodo de sequía. Las burseras de este estudio pudieran ser incluidas en las del último tipo, ya que su episodio floral antecedió a las primeras lluvias de la temporada.
Frankie et al. (1974) registraron la presencia de frutos maduros en abril (al final de la sequía) para B. simaruba y de agosto a octubre (temporada de lluvias) para B. tomentosa, algo que difiere de los resultados obtenidos en este estudio, ya que los frutos inician su desarrollo en abril-mayo y llegan a su tamaño final en octubre. Declarar la madurez de los frutos de las burseras es algo complejo, dado que después de alcanzar el tamaño final son pocos los cambios morfológicos que exhiben en este largo periodo, observaciones personales sugieren que un buen indicador de madurez es la visita de aves que se alimenta de los frutos.
El periodo de fructificación de ambas especies fue largo, en B. simaruba el desarrollo de frutos y su permanencia fueron temporalmente simétricos (6 meses cada uno), mientras que en B. tomentosa el periodo de formación fue más rápido (4 meses) que la permanencia y dispersión (seis meses).
Las observaciones en Yucatán, México (Valdez-Hernández et al., 2010), Colombia (Berdugo-Lattke y Rangel-Ch, 2015) y Costa Rica (Frankie et al., 1974) coinciden al señalar que la fructificación de B. simaruba es prolongada (cercana a nueve meses) y que el desarrollo de frutos sucede prácticamente durante la temporada de lluvias y su maduración durante la época de secas e incluso se empalma con la nueva floración. La superposición de las fenofases de frutos maduros y brotes florales del nuevo ciclo en B. simaruba fue observada también por Hulshof, Stegen, Swenson, Enquist, y Enquist (2012) y por Valdez-Hernández (2015). En este estudio no se alcanzó a detectar el traslape de dos ciclos consecutivos de fructificación, pero Valdez-Hernández et al (2010) sí.
Otras burseráceas también presenta un periodo largo de maduración de frutos, Bursera graveolens inicia su fructificación en la última semana de abril y alcanza la madurez en la primera semana de junio (Morgan y José, 2013), otros géneros como Boswellia papyrifera y Boswellia serrata tienen periodos completos de fructificación de tres y cuatro meses respectivamente (Singh y Kushwaha, 2006; Zinaw, 2012).
Ramos Ordoñez et al. (2012) agruparon a un conjunto de burseras según la duración de su fructificación, un grupo con un periodo más corto (de junio a diciembre: B. bicolor, B. biflora, B. bipinnata y B. copalifera) y otro con un periodo extenso (junio a mayo: B. aptera, B. arida, B fagaroides y B. schlechtendalii), las burseras de este estudio, pertenecerían al segundo, debido a que su permanencia de frutos es prolongada.
Fenología vegetativa
Los patrones fenológicos vegetativos de los BTS han sido bien documentados (Rivera et al., 2002; Kushwaha y Singh, 2005; Singh y Kushwaha, 2006; Kushwaha, Tripathi y Singh, 2010; Berdugo-Lattke y Rangel-Ch, 2015; Kushwaha et al., 2015), indicando que pueden coexistir especies de hábitos perennes, de intercambio foliar, brevi-caducifolias y caducifolias. De acuerdo con las características que presentan B. simaruba y B tomentosa, pueden considerarse de tipo funcional caducifolio, con la senescencia de las hojas al inicio de la sequía, con un lapso de más de 4 meses sin hojas y la foliación desde los inicios de las lluvias. Otras burseráceas han sido registradas también como caducifolias, incluyendo a Bursera arborea, Bursera heteresthes (Bullock y Solis-Magallanes, 1990) y Boswellia serrata (Singh y Kushwaha, 2006), en contraste con Bursera microphylla que presenta follaje perenne (Ávila-Lovera, 2020).
Las observaciones de Frankie et al. (1974), en los BTS de Costa Rica, coinciden en lo general con las de este estudio, para B. simaruba se observó la senescencia foliar en la estación de secas (de noviembre a marzo) y para B. tomentosa de octubre a abril, esta última especie parece mantener por más tiempo sus hojas. Valdez-Hernández et al. (2010) también registraron la caída de hojas de B. simaruba durante la estación seca y más fría (noviembre a marzo) en los BTS de Yucatán, México.
Periodos únicos de brotación son comunes en el BTS y se han observado para estas burseras; en Costa Rica fueron registrados periodos similares (de mayo a junio) en las dos especies (Frankie et al., 1974), ligeramente desfasados a los aquí observados (de marzo a mayo), pero probablemente alineados al principio de las lluvias. B. simaruba presentó una cobertura foliar máxima de agosto a octubre en Yucatán, México (Valdez-Hernández et al., 2010), coincidiendo con el periodo de junio a noviembre para la fenofase que se denominó presencia de hojas maduras.
La presencia de hojas maduras converge con el desarrollo de frutos en ambas especies, indicando una asociación que permite captar recursos fotosintéticos y destinarlos para crecer y sostener el desarrollo de semillas, las dos fases suceden durante la estación de lluvias. En contraste la floración coincide con el rebrote foliar al final del estiaje, cuyos recursos deben provenir de las reservas de los tallos o raíces. Estos mecanismos de asignación de recursos es parte de las estrategias de supervivencia (Bazzaz, Ackely y Reekie, 2000), en este caso adaptadas a las condiciones del BTS.
La duración de la temporada de lluvias y la disponibilidad de agua en el suelo son importantes en estos patrones, pues los árboles caducifolios deben rehidratarse antes de su periodo de foliación (Borchert, 1994; Borchert et al., 2002). En este estudio se observó que la humedad relativa y la temperatura influyen de forma directa sobre la fenología foliar de ambas especies de Bursera. En contraste con estudios fenológicos que señalan la existencia de una correlación negativa de la floración con la temperatura y del periodo de fructificación con la precipitación (Sobrinho et al., 2013); también se ha encontrado que la caída de las hojas muestra una correlación negativa con la temperatura media mensual (Sigrist et al., 2018).
Debido a que la temperatura, la humedad relativa y la precipitación son los principales factores que definen al BTS (Rzedowski, 2006), las propiedades estructurales y ecofisiológicas de su vegetación están estrechamente relacionadas con la duración y estacionalidad del periodo de sequía, que condiciona las adaptaciones asociadas a evitar, escapar o tolerar al estrés hídrico; es decir, son los principales factores ambientales que definen a los grupos enológicos funcionales que habitan este tipo de bosques (Valdez-Hernández, 2008; Kushwaha et al., 2015).
Varias fenofases fueron estacionales y sincrónicas (r > 0.7). De acuerdo con Morellato et al. (2010) el valor alto de r indica un estado de agregación de las fenofases. Esta sincronía de actividad fenológica puede estar asociada a la amplitud o duración de la fenofase en cuestión. Por ejemplo, en B. simaruba y B. tomentosa hay una correlación entre la alta sincronía de la floración y la poca duración de esta fenofase (r > 0.96-1.0), así como la baja sincronía está relacionada con la larga permanencia de frutos de B. simaruba (r = 0.57) o el inicio más pronto y prolongado de la senescencia foliar (r = 0.63). El periodo prolongado del desarrollo y madurez de los frutos (casi todo el año) genera ventajas en su dispersión ya que, de esta forma, las semillas se dispersan al final de la temporada de sequía y germinan desde el inicio de la próxima temporada de lluvias. En contraparte, los periodos rápidos de brotes foliares podrían permitir tener hojas prontamente para captar recursos fotosintéticos, en tanto que las fases florales breves y elevada sincronía puede ser una estrategia para evitar la competencia por los polinizadores (Frankie et al., 1974), pero quizá también representaría una desventaja, Ramos Ordoñez et al. (2008) en Bursera morelensis señalan una breve floración de dos semanas con desfase entre las flores femeninas (con duración de hasta 4 días) y masculinas (hasta 7 días), que podría ocasionar la no coincidencia en su polinización y/o polinizadores. La partenocarpia de frutos es frecuente en este género botánico, que pudiera ser consecuencia de la breve exposición de las flores (Ramos-Ordoñez et al., 2012).
Conclusiones
La fenología reproductiva y vegetativa de Bursera simaruba y B. tomentosa son similares; las fases reproductivas de botón floral y flor abierta suceden durante periodos breves (1-2 meses) mientras que las de fructificación son más prolongadas; en tanto que el patrón fenológico vegetativo se puede clasificar como del tipo funcional caducifolio, por conservar su follaje durante la temporada de lluvias y perderlo durante la temporada de estiaje. Las variables ambientales que estuvieron correlacionadas con la fenología de Bursera simaruba y B. tomentosa fueron la temperatura y la humedad relativa que antecede a las lluvias. Este estudio ayuda a comprender la dinámica de los cambios de las fenofases de estas especies, lo cual es un referente de información para evaluaciones en las variaciones fenológicas ante cambios ambientales o bien como referentes del conocimiento de su periodo reproductivo para hacer un mejor uso y manejo de las especies para su conservación.











 text new page (beta)
text new page (beta)