Introducción
La germinación de semillas de especies forestales en las selvas tropicales es influenciada por una gran variedad de factores endógenos y exógenos. Son de particular importancia la temperatura, la luz, la humedad, el tipo de sustrato, así como la interacción con los microorganismos del suelo como las micorrizas (Smith, Jakobsen, Grønlund y Smith, 2011).
Comúnmente en las especies forestales se han registrado asociaciones micorrízicas de tres tipos: ectomicorriza, endomicorriza y ectendomicorriza. Las asociaciones más abundantes son las ectomicorrizas y la micorriza arbuscular (MA) (Martínez y Pugnaire, 2009). Los requisitos ambientales de las MA trascienden sus necesidades por una planta específica, por lo que la estructura de sus comunidades se explica principalmente por las condiciones edafoclimáticas (Lozano-Contreras, Rivas-Pantoja y Castillo-Huchim, 2013).
Aunque no se sabe aún si las MA mejoran la germinación, estas sí incrementan la adecuación (reproducción y supervivencia) de las plantas y su producción (Daza y Walter-Osorio, 2011). Esto se debe a que actúan como extensiones del sistema radicular y aumentan la asimilación de nutrimentos del suelo, principalmente fósforo, incrementando el volumen explorado del ambiente edáfico (Lozano-Contreras et al., 2013).
En los últimos años, las MA han sido aplicadas en plantaciones de reforestación, debido a que juegan un papel importante en el establecimiento de las plántulas en el campo (Allen, Allen y Gómez-Pompa, 2005), sobre todo en ambientes oligotróficos en donde se establecen plantas de especies pioneras (Lovera y Cuenca, 1996).
Cuando las semillas llegan al suelo de la selva, en forma de banco de semillas, interactúan con diversos microorganismos de la rizósfera. En este sentido, las bacterias rizosféricas promotoras del crecimiento vegetal (PGPBs) forman asociaciones con hongos MA, ayudando a la fijación de N2, la producción de fitohormonas como giberelinas y del ácido indolacético (Zambrano y Díaz, 2008), lo que estimula y acelera la germinación (Constantino, Gómez-Álvarez, Álvarez-Solis, Pat-Fernández y Espín, 2010).
La germinación es un proceso que involucra muchos factores: aparte de los microorganismos del suelo, también actúan otros como la luz. La cantidad y calidad de la luz disponible se torna bastante crítica en la germinación de especies en la selva, considerando la alta heterogeneidad de luz que llega al suelo como resultado de la marcada estacionalidad y las especies caducifolias que las habitan (González-Rivas, Tigabu, Castro-Marín y Odén, 2009), afectando los bancos de semillas que contribuyen a la regeneración de las selvas secas (Álvarez-Aquino, Barradas-Sánchez, Ponce-González y Williams-Linera, 2014).
Las especies de selva seca con gran valor son Tecoma stans (L.) Juss. ex Kunth, Senna racemosa (Mill.) H.S. Irwin y Barneby; Bauhinia forficata Link. T. stans crece en sitios de vegetación secundaria (Vázquez-Yanes, Batis-Muñoz, Alcocer-Silva, Gual-Díaz y Sánchez-Dirzo, 2001); S. racemosa crece en el neotrópico y demanda una gran cantidad de luz (Centro de Investigación Científica de Yucatán [CICY], 2010) y B. forficata demanda también una gran cantidad de luz y resiste la sequía (Gilman y Watson, 2014). Por lo tanto, las hipótesis de este trabajo fueron:
S. racemosa y B. forficata reducen significativamente su germinación en condiciones de valores altos de luz y T. stans presenta un comportamiento opuesto.
La presencia de la micorriza arbuscular incrementa la germinación de las tres especies consideradas.
Para tal fin se evaluaron nueve medidas de germinación que en conjunto explican su dinámica. Esas características son importantes, no únicamente para fisiólogos y tecnólogos de semillas, sino también para ecólogos, ya que es posible predecir el grado de éxito de una especie con base en la capacidad de las semillas para distribuir la germinación a lo largo del tiempo, permitiendo el reclutamiento de las plántulas formadas.
Objetivos
Evaluar el efecto de la luz (10%, 30%, 50% y 70%) y la inoculación con micorriza arbuscular Glomus intrarradices sobre la germinación de semillas de Tecoma stans (L.) Juss. ex Kunth, (Bignoniaceae), Senna racemosa (Mill.) H.S. Irwin y Barneby (Leguminosae) y Bauhinia forficata Link (Leguminosae).
Materiales y métodos
Sitio de estudio
El estudio se realizó en marzo y abril de 2011, en una selva seca al norte de Yucatán (21° 04’ 57” N, 89° 32’ 21” O). El clima presenta una marcada estacionalidad seca de marzo a mayo, que es cuando los árboles pierden sus hojas; lluvias entre junio y octubre y una estación de ligera sequía de noviembre a febrero, caracterizada por fuertes vientos (Orellana, 1999). Este sitio posee una precipitación y temperatura media anual de 900 mm y 25.8 °C (Instituto Nacional de Estadística y Geografía [INEGI], 2009).
Las semillas se colectaron de cuatro árboles de Tecoma stans (L.) Juss. ex Kunth, (Bignoniaceae), Senna racemosa (Mill.) H.S. Irwin & Barneby (Leguminosae) y Bauhinia forficata Link (Leguminosae) de la selva seca. Las semillas se extrajeron inmediatamente después de la colecta y únicamente de frutos maduros y se dejaron reposar 24 horas antes de la siembra. Las semillas se usaron sin presencia de daño o deformaciones y se analizó la viabilidad mediante la prueba de flotabilidad en agua, para lo cual las semillas se colocaron en agua corriente durante cinco minutos, eliminándose aquellas que flotaron.
Experimento de germinación
El experimento se realizó en la Unidad de Producción del Instituto Tecnológico de Conkal (ITC) (21° 04’ 57” N, 89° 32’ 20” O), Yucatán, México; el cual se encuentra rodeado de la selva seca donde se colectaron las semillas. De esta manera, las condiciones ambientales fueron similares entre los sitios de colecta y experimentación. Se aplicaron cuatro tratamientos con relación a la disponibilidad de luz (10%, 30%, 50% y 70% de la luz total), con tres repeticiones cada uno. Cada sitio tuvo una orientación este a oeste, paralelo al movimiento solar diario. Los tratamientos de 90% y 100% de luz no se usaron debido a que en un estudio previo (datos no publicados) no se observaron diferencias de germinación entre 100% y 70% de luz.
En cada repetición de luz se colocó una bandeja con 10 semillas por tratamiento por especie y por condición de germinación (suelo de la selva de origen + nutrimentos [S+N]; Micorriza: Glomus intrarradices [S+M]; testigo químico [S+NPK]: Triple 17= N-P-K). El bajo número de semillas usadas por réplica se debió a su escasez con características similares (origen, fecha de colecta, tamaño, viabilidad y libres de plaga y enfermedades).
El sustrato del testigo se esterilizó con el método de vaporización (Caldera No.-08-3095, Sioux Corporation Bresford, SD USA) y posteriormente se inoculó con 50 ml de una solución filtrada del suelo de la selva para restablecer la microbiota del suelo. El filtrado se realizó con papel filtro Whatmann 42 para prevenir el paso de esporas de hongos vesículo-arbusculares (Ramos-Zapata, Orellana y Allen, 2006). El hongo Glomus intrarradices N.C. Schenck & G.S. Sm (1982) se usó en el tratamiento de la micorriza y este fue producido en forma comercial por el Instituto Nacional de Investigaciones Forestales, Agrícola y Pecuarias (Inifap).
Previo a la siembra de las semillas, los sustratos se remojaron de 5 min a 10 min en una solución de 0.81 g de micorriza en 50 ml de agua destilada. El testigo químico (triple 17: nitrógeno, fósforo y potasio) se aplicó en una dosis de 0.25 g por charola, durante el sembrado de las semillas.
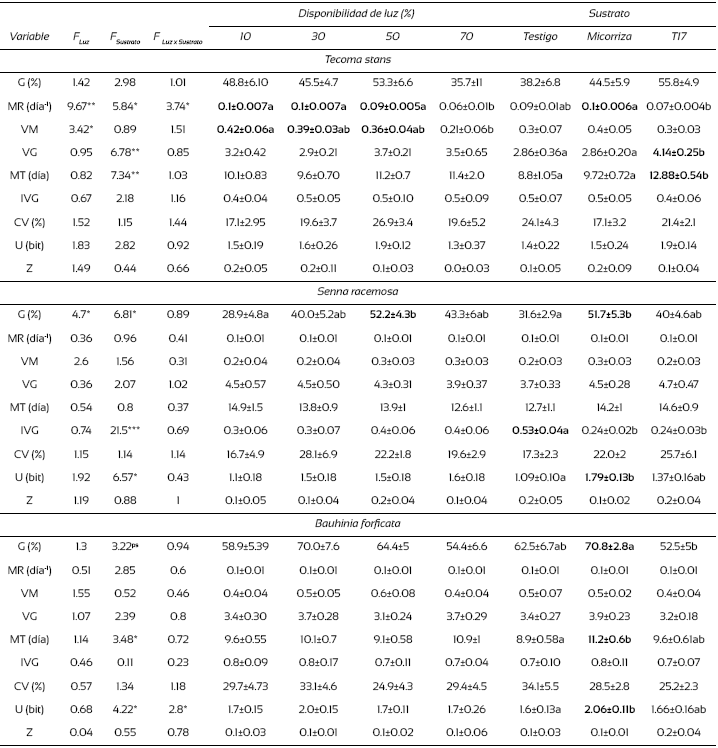
Cada repetición del tratamiento de luz consistió físicamente de una estructura de 4 m × 2 m por 2.5 m de alto, cubierta por una malla de 90%, 70%, 50% y 30% de sombra; de manera respectiva, se produjeron los tratamientos de 10%, 30%, 50% y 70% de luz. Al inicio del experimento, la cantidad de luz se registró para cada tratamiento durante dos días, por cada dos horas entre las 07 h 00 y 19 h 00 a través de la densidad de flujo de fotones (DFF) (LI-1400 data-logger, Li-Cor, Nebraska, USA), temperatura y humedad relativa (THDW-3 termohygrometer Amprobe, Washington, USA) (Tabla 1).
Tabla 1 Medidas ambientales registradas en la germinación (promedio ± error estándar).
Las medidas de luz se registraron en días claros y los porcentajes se calcularon con relación a una densidad de flujo de fotones fotosintéticos (DFFF) de 100%.
La germinación de las semillas se registró diariamente durante 40 días. El criterio para considerar a una semilla germinada fue la emergencia de la radícula. Nueve variables de respuesta se usaron para describir el proceso de la germinación: porcentaje de germinación (G), tasa promedio de germinación (MR) (Ranal y García de Santana, 2006), valor máximo del promedio de la germinación diaria (VM), valor de germinación (VG) (Zambrano y Díaz, 2008), tiempo promedio de germinación (MT) (Ranal y García de Santana, 2006), índice de velocidad de germinación (IVG) (Woodstock, 1976), coeficiente de variación del tiempo de germinación (CV), incertidumbre de la sincronía de la germinación (U) y el índice de sincronización de la germinación (Z) (Ranal y García de Santana, 2006).
Análisis de datos
A los datos de las nueve variables (Tabla 2) se les realizó un análisis de varianza factorial de dos vías. Los análisis se realizaron por separado para cada variable y especie. Los supuestos de igualdad de varianzas y normalidad se corroboraron. Cuando fue necesario, los datos de las variables se transformaron mediante el arco seno de la raíz cuadrada para los porcentajes y con el logaritmo natural para los datos continuos. Posteriormente se usaron pruebas pareadas de Tukey para analizar las diferencias entre tratamientos. Todos los análisis se realizaron con Statistica 8 (Statistica, 2007).
Resultados
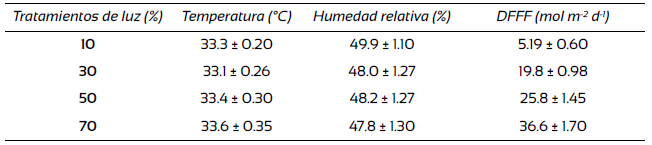
En T. stans no se encontraron efectos de la disponibilidad de luz ni del sustrato sobre los porcentajes de germinación (Tabla 2; Fig. 1). Aunque en el caso de la variable de la tasa promedio de germinación (MR), los factores luz, sustrato y su interacción fueron significativos (Tabla 2). Se encontró que la MR fue significativamente mayor en 10%, 30% y 50% de luz y en el sustrato micorriza, aunque muy similar al testigo. También, el valor máximo del promedio de la germinación (VM) fue afectada significativamente solo por la disponibilidad de luz, obteniendo los mayores valores en la disponibilidad de luz al 10%, 30% y 50%. Además, el valor de germinación (VG) y el tiempo promedio de germinación (MT) solo fueron afectados significativamente por el factor sustrato, siendo mayores en el testigo químico (T17) (Tabla 2).
Figura 1 Efecto de la disponibilidad de luz y el sustrato sobre la germinación acumulada de tres especies de árboles de selvas secas de Yucatán, México.
En S. racemosa no se encontró algún efecto significativo de la interacción luz × sustrato en las variables de germinación. No obstante, sí hubo efectos significativos independientes de ambos factores (Tabla 2; Fig. 1). Por ejemplo, la luz al 50% incrementó el porcentaje de germinación (G) en 52.2% ± 4.3% contrastando con el mínimo obtenido en 10% de luz con 28.8% ± 4.8%. En tanto, el factor sustrato también afectó significativamente al porcentaje de germinación, ya que la aplicación de micorriza lo incrementó en 51.7% ± 5.3% a diferencia del sustrato testigo con 31.6% ± 2.9% (Tabla 2). Respecto al índice de velocidad de germinación (IVG) y la incertidumbre de la sincronía de la germinación (U), no se encontraron efectos significativos de la luz, pero sí del sustrato. Se registró que la velocidad de germinación (IVG) fue mayor con el sustrato testigo que con la micorriza y el testigo químico. Además, se obtuvo una mayor incertidumbre de la sincronía de la germinación (U), es decir, una alta asincronía en la germinación con la micorriza, en comparación al sustrato testigo (Tabla 2).
En B. forficata no se encontraron efectos significativos de la disponibilidad de luz ni del sustrato sobre los porcentajes de germinación (G), aunque si un efecto parcialmente significativo del factor sustrato (P = 0.057), en el cual se observó una tendencia de mayor porcentaje de germinación (G) con la micorriza (Tabla 2; Fig. 1). El tiempo promedio de germinación (MT) también fue afectado significativamente por el factor sustrato, siendo también mayor con la micorriza. Asimismo, la incertidumbre de la sincronía de la germinación (U) varió significativamente por el sustrato y por la interacción luz × sustrato (Tabla 2), produciendo una alta asincronía con la micorriza.
Discusión
La respuesta de germinación en las especies fue muy variable. Aunque generalmente las tres especies respondieron más al factor sustrato, y únicamente T. stans y S. racemosa a la luz. Ciertamente T. stans se benefició de niveles bajos a intermedios de luz para su tasa promedio de germinación (MR) y para su valor máximo del promedio de la germinación diaria (VM), lo cual difiere con la demanda de intensidades altas de luz registradas anteriormente para su germinación (Socolowski, Vieira y Takaki, 2008). Se ha encontrado que en el caso de Jacaranda mimosifolia (Bignoniaceae), aunque sus semillas presentan germinación en un amplio espectro de luz; cuando las intensidades son muy altas, el estrés hídrico puede afectar negativamente la germinación (Socolowski y Takaki, 2004). En contraste, S. racemosa presentó un comportamiento opuesto al beneficiarse mayormente de intensidades intermedias a altas de luz (43.3% a 52.5% de germinación). Esto resulta importante, ya que no existe información sobre germinación para esta especie y mucho menos para sus requerimientos lumínicos. Godínez-Álvarez y Flores-Martínez (1999) encontraron para Senna occidentalis y S. obtusifolia una germinación no mayor a 60% con la aplicación de tratamientos pregerminativos, y menor a 10% sin tales tratamientos, en todos los casos en sombra. Considerando los porcentajes de luz en los que S. racemosa puede germinar mejor, esta especie podría considerarse para procesos tempranos de restauración in situ, ahorrando tiempo y costo en el proceso de obtención de plántulas. No obstante, estudios de tratamientos pregerminativos deben realizarse para esta especie. En B. forficata se registraron los mayores porcentajes de germinación (64.4% a 70%) en condiciones intermedias de luz (30% y 50%). Este resultado, por un lado, es similar a lo registrado para otras especies de Bauhinia spp., con porcentajes entre 64% y 75%, aunque en condiciones de laboratorio y con intensidades de luz reducidas (Yücedag y Gültekin, 2011); pero, por otro, opuesto a los registros que ubican a B. forficata como una especie con baja tolerancia a la sombra (Campanello, Gatti, Montti, Villagra y Goldstein, 2011).
A pesar de que generalmente los efectos de las micorrizas para el establecimiento, crecimiento vegetal y supervivencia de plántulas son positivos (Ramos-Zapata et al., 2006; Hernández-Cuevas, Santiago-Martínez y Cuatlal-Cuahutencos, 2011), su influencia sobre la germinación es poco conocida (Horton y Van der Heijden, 2008). El presente estudio mostró que las micorrizas tuvieron efectos negativos en el proceso de germinación para T. stans, lo cual concuerda con los estudios de Varga (2015) y Wu et al. (2014) con las especies Geranium sylvaticum y Phragmites australis, respectivamente. Esta dicotomía entre las respuestas de crecimiento y germinación puede deberse a la introducción de patógenos junto con las esporas de las micorrizas, los cuales podrían actuar como antagonistas para el proceso de germinación (Varga, 2015), incluso posiblemente los exudados de las micorrizas, en vez de beneficiar a la germinación, la supriman, como se ha registrado para plantas parásitas (Louarn, Carbonne, Delavault, Bécard y Rochange, 2012). En forma contrastante, también se detectaron efectos parcialmente positivos para S. racemosa y B. forficata, ya que, aunque incrementaron sus porcentajes de germinación, lo hicieron en detrimento de su velocidad (IVG) y en forma asincrónica (como lo indicaron los mayores valores de U y menores de Z). Los mecanismos que disparan estas respuestas positivas son aún desconocidos; no obstante, es posible que la micorriza cause un efecto de recubrimiento de las semillas lo cual retarda el rompimiento de la testa por parte de otros microorganismos del suelo, aunque, una vez logrado esto, las hifas del hongo incrementen la absorción de agua y nutrimentos (Dalling, Davis, Schutte y Elizabeth Arnold, 2011), beneficiando la germinación total. Este resultado subraya el papel relevante de las micorrizas en la germinación, lo cual tiene impacto tanto en la regeneración natural de las selvas secas (Huante et al., 2012), como en su potencial uso en planes de restauración ecológica.
Conclusiones
Los niveles de luz de bajos a intermedios aumentaron la tasa promedio de germinación (MR) y su valor máximo del promedio de germinación diaria (VM) de T. stans; en forma opuesta, S. racemosa incrementó su germinación principalmente en niveles de intermedios a altos de luz (50% y 70%). En tanto, B. forficata no difirió en gran medida los porcentajes de germinación por la disponibilidad de luz, aunque esta especie presentó los mayores porcentajes de germinación en comparación a las otras dos.
Respecto a la micorriza, en general se observaron efectos positivos para las tres especies, aunque no en todas las variables de germinación, ya que, al menos en S. racemosa y B. forficata, la germinación se produjo en forma asincrónica. Se presenta un primer reporte del efecto benéfico de las micorrizas sobre el proceso de germinación de especies forestales características de selvas secas.











 text new page (beta)
text new page (beta)