Introducción
La mucormicosis es una infección emergente causada por hongos pertenecientes al orden de los mucorales,1 ocurre principalmente en pacientes con inmunosupresión como una neoplasia maligna hematológica, trasplante de células madre hematopoyéticas u órganos sólidos y diabetes mellitus;2 en este contexto los pacientes con COVID-19 pueden presentar una respuesta inmunitaria mediada por células alterada y mayor susceptibilidad a las coinfecciones por hongos.3 La enfermedad se caracteriza por una vasculitis necrosante extensa, que resulta en trombosis y subsecuente infarto tisular. La enfermedad gastrointestinal primaria es la forma más rara siendo el estómago el sitio más común de infección. Puede adquirirse por ingestión de alimentos contaminados, pero también puede asociarse a dispositivos contaminados asociados a cuidados de la salud. El diagnóstico puede sospecharse por hallazgos endoscópicos que muestren una masa fúngica o lesiones necróticas que recubren un área ulcerada, los hallazgos radiológicos son inespecíficos.3 El diagnóstico temprano ayuda a acelerar la terapia antimicótica y mejorar la supervivencia, la anfotericina B liposomal es el tratamiento de elección. Por su parte el desbridamiento quirúrgico o la resección completa del órgano afectado son de suma importancia para eliminar la necrosis y mejorar la penetración de los agentes antimicóticos en el sitio objetivo, estos pacientes presentan alto riesgo de perforación y hemorragia, lo cual exige una resección quirúrgica extensa.4 Realizamos una revisión de la literatura en bases de datos como wiley y pubmed utilizando las palabras clave mucormycosis, COVID, infection encontrando muy pocos reportes de caso de la enfermedad fúngica asociada a COVID-19 y ningún reporte al buscar asociación entre las palabras gastric, mucormycosis, COVID.
Caso clínico
Paciente masculino de 69 años de edad con historia de diabetes mellitus tipo 2 en tratamiento con metformina y clorpropamida, hipertensión arterial en tratamiento con losartán y amlodipino. Se presenta al servicio de urgencias por mostrar cefalea, dolor torácico, tos, mialgias, artralgias y disnea de una semana de evolución. A su ingreso muestra frecuencia cardiaca 114 lpm, frecuencia respiratoria de 24 rpm, saturación de oxígeno de 80% sin apoyo de oxígeno suplementario, glucosa 587 mg/dl, leucocitos de 25,690 cel/mm3, neutrófilos 85%, linfocitos 1.2%, hemoglobina 16.3 g/dl, procalcitonina 3.78 ng/dl, gasometría arterial con pH 7.41, pCO2 21 mmHg, PO2 35 mmHg, HCO3 13 mmol/l, saturación de oxígeno 62%. Se realiza prueba rápida de antígeno para SARS-CoV-2 resultando positiva, tomografía axial computarizada (TAC) de tórax en la que se observan datos radiológicos sugestivos de infección por SARS-CoV-2 (Figura 1), se inicia manejo con oxígeno suplementario, bomba de infusión de insulina, carbapenémicos, antihipertensivos, dexametasona y profilaxis antitrombótica con enoxaparina. A las 48 horas de su ingreso continúa con choque séptico, se inician aminas vasopresoras, se realiza intubación orotraqueal y soporte con ventilación mecánica invasiva, se coloca sonda nasogástrica (SNG), la cual 24 horas posterior a su colocación reporta hematemesis acompañada de distensión abdominal, leucocitosis de 40,000 cel/mm3, se realiza TAC abdominopélvica simple, la cual revela neumatosis gástrica y neumoperitoneo (Figura 2), se efectúa laparotomía exploradora urgente encontrando necrosis de la curvatura mayor del estómago, se lleva a acabo gastrectomía vertical con engrapadora GIA cartuchos morados de 45 y 60 mm (Figura 3), se refuerza línea de grapeo con sutura continua prolene 00, se coloca sonda de yeyunostomía de alimentación a 60 cm del ángulo de Treitz y se dejan drenajes tipo Saratoga. A las 24 horas postoperatorias paciente reporta estabilidad hemodinámica y se suspenden aminas vasopresoras, se inicia nutrición enteral con dieta elemental. El quinto día postquirúrgico muestra adecuada tolerancia a dieta enteral por yeyunostomía, se realiza prueba con azul de metileno por SNG sin evidencia de fugas y descenso de leucocitos a 24,000 cel/mm3. Se recaba resultado de histopatología, el cual revela necrosis panmural asociada a trombosis arterial secundaria a microorganismos compatibles con Mucor sp., por lo que se inicia manejo con anfotericina B (Figuras 4 y 5). En el seguimiento muestra buena evolución, se realiza TAC abdominopélvica con contraste por SNG, la cual descarta fugas y colecciones intraabdominales y se corrobora integridad de la pared gástrica, se retiran drenajes y se da alta de cirugía general el día nueve postquirúrgico continuando manejo a cargo del servicio de medicina interna. Durante los siguientes días de hospitalización, el paciente presenta deterioro cardiovascular y pulmonar, se toma urocultivo, el cual evidencia crecimiento de Candida tropicalis, se realiza TAC de cráneo, tórax y abdominopélvica con contraste oral (Figuras 6 y 7), continúa sin evidencia de fugas a nivel abdominal, se descarta mucormicosis rinocerebral y pulmonar, se reporta probable neumonía bacteriana sobreañadida y neumopatía intersticial secundaria a COVID-19, persiste deterioro clínico y choque refractario, el paciente fallece a 29 días de su ingreso.

Figura 1: Tomografía axial computarizada (TAC) de tórax en la que se observan datos radiológicos sugestivos de infección por SARS-CoV-2.
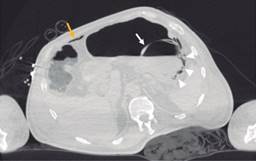
Figura 2: Tomografía axial computarizada abdominopélvica simple, en la que se observa neumatosis gástrica y neumoperitoneo.

Figura 4: Pieza patológica con necrosis panmural asociada a trombosis arterial secundaria a microorganismos compatibles con Mucor sp.

Figura 5: Tinción con H-E en la que se identifica necrosis panmural asociada a trombosis arterial secundaria a microorganismos compatibles con Mucor sp.
Discusión
La mucormicosis es una infección micótica invasiva con alta mortalidad, su incidencia ha aumentado en los últimos años debido al incremento de la población en riesgo de infección y la mejora en las herramientas diagnósticas. Fue descrita por primera vez a nivel pulmonar en 1876 por Furbringer.5 Ocurre principalmente en el contexto de un paciente inmunocomprometido.1 La mortalidad varía de 32 a 70%, la infección localizada se asocia con mejor supervivencia,6 se diagnóstica ante-mortem sólo en 25% de los casos. En su revisión de 31 casos, Dioverti y colaboradores reportan predominio en el sexo masculino (61%) y edad media de 47 años, 52% de los casos eran pacientes postrasplantados de órgano sólido y 35% pacientes en quimioterapia por neoplasia hematológica maligna, 100% de los pacientes presentaba al menos una comorbilidad, siendo la neutropenia la más común.2 Se ha descrito en pacientes con desnutrición severa, uso de corticoides, pero también en pacientes sin ningún factor predisponente.7 En nuestro caso el paciente tenía múltiples factores de riesgo ya descritos, la diabetes mellitus tipo 2 descompensada, la infección aguda por coronavirus y la terapia con esteroides que se inició para el manejo de COVID-19, como único factor que mejoraba el pronóstico se encontró la infección focal en estómago. La enfermedad se caracteriza por presentar vasculitis necrosante extensa con trombosis arterial e infarto tisular1 y presencia patognomónica de hifas ramificadas no septadas en ángulo recto en los tejidos,8 el género Rhizopus es el género que con más frecuencia se aísla.9 Entre los factores de riesgo conocidos se encuentra la hiperglucemia y la acidosis, ya que causan disfunción leucocitaria de neutrófilos y/o macrófagos afectando su quimiotaxis.10 Seis diferentes síndromes clínicos pueden presentarse, la infección rino-órbito-cerebral y la infección pulmonar son las más frecuentes y la gastrointestinal la menos común. Ésta se adquiere a través de la ingesta de alimentos contaminados o en el caso de cuidados asociados a la salud a través de dispositivos contaminados1 el estómago es el sitio más común de afección seguido del colon, intestino delgado y esógafo.11 La mayoría de los síntomas son inespecíficos, lo cual retrasa el diagnóstico y aumenta la mortalidad.2 La presentación clínica puede ser con dolor abdominal (68%), hemorragia gastrointestinal (48%), fiebre (19%) o cambios en la defecación (10%).2 A su ingreso el paciente no reportaba ninguna sintomatología a nivel abdominal, por lo que no existió ninguna sospecha de afección gastrointestinal, posteriormente se realizó sedación intravenosa e intubación orotraqueal siendo así imposible que el paciente manifestara afección a nivel gástrico, como único signo el paciente presentó hematemesis a las 24 horas de colocación de la SNG, lo cual descarta la posibilidad de una mucormicosis asociada a los cuidados de la salud, ya que 24 horas no son suficientes para lograr la introducción, inoculación y crecimiento del hongo, esto abre la hipótesis de que el paciente adquirió la infección micótica en su comunidad. El diagnóstico se puede sospechar por hallazgos endoscópicos, los cuales pueden ser una masa fúngica o lesiones necróticas que cubren áreas ulceradas que pueden perforarse y causar peritonitis.2 A menudo se inicia el protocolo de estudio ante la presencia de un absceso intraabdominal, el diagnóstico se puede efectuar mediante biopsia del área sospechosa durante la cirugía o endoscopia,7 pocas muestras son enviadas a cultivo2 y las que se envían son positivas sólo en 30%, además se requieren medios de cultivo especializados como agar papa dextrosa para favorecer el crecimiento de los hongos,12 se requieren además pruebas moleculares confirmatorias que pudieran detectar antígenos de superficie, los cuales aún no están disponibles.2 Los hallazgos por tomografía pueden ser los siguientes: engrosamiento focal o difuso de la pared gástrica, neumatosis con realce disminuido en la pared a la administración de contraste (gastritis enfisematosa) secundaria a la isquemia y necrosis, colecciones adyacentes, necrosis de la pared con disrupción focal o perforación y rara vez neumoperitoneo.13 Al presentar hematemesis estamos conscientes de que el siguiente paso diagnóstico podría haber sido una endoscopia digestiva alta, pero la distensión abdominal que presentaba el paciente sugería alta probabilidad de perforación de víscera hueca, por lo que inicialmente se realizó TAC de abdomen. Al reportar neumatosis gástrica y neumoperitoneo, se consideró una urgencia quirúrgica descartando la toma de endoscopia en ese momento, la laparotomía exploradora (LAPE) permitió la exploración directa del estómago y la resección parcial del mismo como medida diagnóstica y terapéutica. El tratamiento consiste en antifúngico y desbridamiento quirúrgico urgente, ya que la presencia de tejido necrótico afectará la penetración del antifúngico a los tejidos, además de lo anterior se deberá proporcionar soporte médico agresivo de las comorbilidades.14 La anfotericina B liposomal intravenosa es el tratamiento de elección, ya que ha demostrado ser más eficaz que la anfotericina B convencional,15 el retraso en el inicio de la anfotericina más de seis días aumenta al doble la mortalidad.4 A pesar de que la mayoría de la bibliografía sugiere el tratamiento quirúrgico agresivo, optamos por un tratamiento más conservador al preservar una porción del estómago efectuando solamente una gastrectomía vertical, ya que a la inspección macroscópica se presentaba delimitación clara entre el tejido necrótico y el tejido viable. Consideramos que el tratamiento quirúrgico que efectuamos fue acertado, puesto que en el seguimiento posquirúrgico el paciente mostró buena evolución, la prueba con azul de metileno y las dos tomografías de abdomen con contraste en estómago a través de SNG nos permitieron comprobar la integridad de la línea de sutura desde su primer día postquirúrgico y hasta el día de su fallecimiento, la muestra enviada a patología permitió efectuar el diagnóstico y así iniciar la terapia dirigida con anfotericina B, y ya que no se demostró afección fúngica por Mucor sp. a otro nivel orgánico, se atribuye la causa de muerte a las complicaciones infecciosas nosocomiales a nivel pulmonar y urinario.
Conclusión
La mucormicosis es una infección micótica que pone en peligro la vida. El diagnóstico requiere un alto índice de sospecha, sobre todo en los casos con afectación intestinal, y debe sospecharse en todos los pacientes con factores de riesgo y estudios de imagen sugestivos de isquemia y/o necrosis gastrointestinal inexplicable. El papel del cirujano general en el éxito del tratamiento consiste en el desbridamiento quirúrgico urgente, quien con base en los hallazgos transquirúrgicos deberá optar por un manejo agresivo o preservar en la medida de lo posible la integridad y funcionalidad del órgano afectado.











 text new page (beta)
text new page (beta)





