Introducción
En la antigüedad, los médicos asociaban la curación de las heridas con la formación de pus, por lo que las cubrían con apósitos y emplastos para que se produjera está, pero no fue hasta que Ambrosio Paré, padre de la cirugía moderna, descubriera que el solo mantenimiento de la herida limpia y cubierta llevaba a una evolución más satisfactoria de la misma. Por lo que a partir de ese momento, se han buscado insumos y materiales para llevar a una buena evolución las heridas con las que hoy en día estamos en contacto todo el personal médico. Contamos con gran cantidad de materiales para ayudar a la cicatrización de heridas de una forma óptima, sin embargo, aún con todos los avances e información, aun no estamos capacitados para saber cómo usarlos y cuando indicarlos. El objetivo de esta publicación es conocer todos los materiales con los que contamos, desde productos orgánicos hasta aparatos de la más alta tecnología para la curación de heridas y en que momento utilizarlos.
Historia
El inicio de la medicina se da a la par de la aparición del hombre, por la necesidad de protegerse y curarse, por lo que encontró plantas y sustancias que aun el día de hoy, algunas de ellas seguimos utilizando. Se tiene registro desde el año 3000 a.C. de un manuscrito para la fabricación de medicamentos. En Egipto, utilizaban el aceite de ricino para curar heridas y zonas irritadas de cuerpo y usaban el pan fermentado también, porque observaron un efecto beneficioso sobre las heridas.1 El Papiro de Edwin Smith trata principalmente de las heridas, fracturas y luxaciones, aplicando compuestos de grasas animales, miel y tejidos con algodón y describe diferentes tipos de suturas de heridas.2
Los hebreos tienen registrado la preparación de ungüentos para la curación de heridas.2 En la India, Susruta describió el uso de vendajes y apósitos con las indicaciones de uso para cada uno y fue el primer antecedente para la reconstrucción de orejas y nariz.1,2Los pueblos precolombinos curaban las heridas con una mezcla de hierbas astringentes o sustancias obtenidas de huevos de diferentes aves y las cubrían con plumas o vendas hechas de piel.1 Los aztecas abrían los abscesos y flebones con bisturís de obsidiana y colocaban tortillas de maíz afectadas con fungosis y suturaban las heridas con cabello.2 El pueblo inca utilizaba diversas sustancias, como la coca, el bálsamo de benjuí, los aceites de pepita y el sulfato cúprico, para curar sus heridas.2
En la Grecia antigua, en la época hipocrática, la curación de heridas y úlceras se realizaba mediante la limpieza de estas y la aplicación de sustancias minerales y/o vegetales acompañada siempre de vino y en las heridas purulentas aplicaban el drenaje de las mismas. Durante las cruzadas, el cirujano tuvo la oportunidad de observar el proceso de cicatrización. En ese tiempo, hubo médicos como Ugo de Lucca, su hijo Teodorico, Henri de Mondeville por mencionar algunos, que concluyeron que el mejor manejo para las heridas era mantenerlas limpias sin que fuera necesario la formación de pus, ya que este era más una complicación que parte de la curación.2 Guillermo de Saliceto, en el siglo XIII, en su Cirurgia Magna, menciona que el manejo adecuado de las heridas es mantenerlas limpias y suturán dolas lo más pronto posible. Podemos darnos cuenta que es, a partir de esta época, que empieza el manejo de las heridas manteniéndolas limpias, pero no es hasta el siglo XV cuando Paré descubre que las heridas tratadas con limpieza con esencia de rosas y cobertura pronta tenían un resultado más satisfactorio y con menos inflamación que las tratadas con aceite hirviendo.1
Ya en el siglo XIX y XX, se da un salto en cuanto al conocimiento de microorganismos que son capaces de producir enfermedad y, por ende, contaminación de heridas. Es así como Semmelweis incorpora un sistema de asepsia que, si bien no fue totalmente aceptado por la comunidad médica, abrió la puerta para que se iniciara la aplicación de la asepsia en los hospitales. Lister también observó que para tener buenos resultados en el manejo de heridas tenían que mantenerlas libres de toda contaminación, así que aplicaba ácido carbólico sobre el paciente al momento de realizar cirugías, y esto lo comprobó al conocer los estudios de Pasteur. Estos tres personajes permitieron que se establecieran las bases de la asepsia y la antisepsia.1 A partir de una conferencia dictada por Lister, Robert Wood Johnson inicia una investigación para crear un apósito antiséptico en forma de gasa impregnada con yodoformo con el fin de lograr la antisepsia de la herida y favorecer su curación.3,4En el año 1963, Winter et al, publican que al mantener las heridas en un ambiente húmedo curaban mejor que aquellas expuestas al aire, ya que la humedad impide la deshidratación y la desecación de la misma con una interfase entre la herida y el ambiente. 3,5Actualmente se llevan a cabo proyectos de investigación para entender el proceso molecular de la cicatrización y con ello dar el manejo más adecuado para la curación de heridas y evitar sus complicaciones como la infección y la cronicidad, y para esto, contamos con una gran variedad de suturas, adhesivos, materiales de curación, etc.
Cicatrización
El proceso de curación de las heridas es complejo e intervienen varios procesos celulares y moleculares que aún no se han entendido en su totalidad, pero para su estudio se han dividido en 3 fases principalmente. La respuesta inmediata a la lesión es la vasoconstricción, que es causada por las prostaglandinas y los tromboxanos; las plaquetas se adhieren al colágeno expuesto y se libera el contenido de estas en gránulos, mientras que el factor tisular activa a la cascada de coagulación y a las plaquetas.6 Esta matriz y el control de la coagulación ayudan a la cicatrización.7
Fase de inflamación (3 a 6 días)
Esta fase inicia con una lesión que lleva a la exposición del colágeno a las plaquetas, las cuales, mediante mediadores como fibronectina, serotonina, etc., provocan una desgranulación de las mismas y la activación de la cascada de la coagulación y esto provoca la movilización de células inflamatorias al sitio de la lesión.4 La primera célula en responder son los neutrófilos, estos penetran en la herida y comienzan a limpiar las bacterias invasoras y tejido no viable, esto lo hacen mediante enzimas proteolíticas.7,8Dentro de las 24 a 48 horas siguientes, migran monocitos que se convierten en macrófagos activados, que juegan un rol en la fagocitosis, pero también producen un amplia gama de factores de crecimiento como interleucinas y factores de crecimiento que permiten la transición a la fase de proliferación.7,8
Fase de proliferación (4 a 14 días)
La epitelización ocurre temprano en la reparación de la herida, depende de la proliferación y migración de células epiteliales desde los bordes de la herida y de cualquier remanente de los anexos de la piel (folículos vellosos, glándulas sebáceas y sudoríparas).8 La estimulación se lleva a cabo mediante el factor de crecimiento epidérmico (EGF) y el factor de crecimiento transformante alfa (TGF-A).7
La angiogénesis, estimulada por el factor de necrosis tumoral alfa (TNF-A), está marcada por la migración de las células endoteliales y la formación de capilares, que es crítico para la apropiada curación de la herida.7 La granulación es la parte final de esta fase, requiere nutrientes que son llevados por los capilares, en ella, los fibroblastos comienzan a migrar al sitio lesionado y comienzan a sintetizar colágeno desorganizado y a proliferar; las señales principales para los fibroblastos son el factor de crecimiento derivado de plaquetas (PDGF) y el EGF.7,8
Fase de remodelación (día 8 hasta 1 año)
Esta fase se caracteriza por el depósito de colágeno en una bien organizada red. La colágena que se deposita al principio es mas delgada y esta orientada paralela a la piel (colágena tipo III), con el paso del tiempo está se reabsorbe y se deposita una colágena mas fuerte y organizada a lo largo de las líneas de stress.7 La síntesis de colágena dura aproximadamente de 4 a 5 semanas, pero el volumen aumenta a un año de la lesión.9
Preparación del lecho de la herida
Hay cuatro componentes para la preparación del lecho de la herida, que abordan las diferentes alteraciones fisiopatológicas subyacentes a las heridas. Estos componentes forman un marco que ofrece a los médicos un enfoque integral para el tratamiento de estás y se ha creado un acrónimo que ha sido nombrado TIME.10
Acondicionamiento de los tejidos (Tissue management)
Se debe retirar el tejido no vascularizado, ya que impide el proceso de curación, por lo que la desbridación proporciona una ambiente que estimula la acumulación de tejido sano y así una curación más pronta.
Control de la inflamación y la infección (Inflammation and Infection control)
Las heridas son a menudo colonizadas con organismos bacterianos o fúngicos, en parte porque estas heridas permanecen abiertas durante períodos prolongados, pero también se relaciona con otros factores como la mala circulación de la sangre, la hipoxia y las enfermedades subyacentes. Una carga bacteriana por arriba de 106 organismos o mas por gramo de tejido afecta la cicatrización, por lo que es importante mantener libre a la herida de contaminacion bacteriana.
Equilibrio en la humedad (Moisture balance)
Se ha comprobado que el mantener húmedas a las heridas acelera el proceso de epitelización y esto ha llevado al desarrollo de un amplia gama de apósitos que conservan la humedad y promueven la curación de las heridas. Se ha visto que el exudado de las heridad crónicas y agudas tiene diferentes propiedades, por ejemplo, en las heridas agudas el exudado estimula la proliferación de fibroblastos, queratinocitos y celuas endoteliales, por el contrario, en las heridas crónicas el exudado bloquea la proliferación celular y la angiogenesis y contiene metaloproteinasas que rompe la matriz extracelular.10
Avance en los bordes (Epithelial advancement)
La curación efectiva de las heridas requiere del reestablecimiento de un epitelio intacto y de las funciones de la piel. Este proceso de epitelización se puede ver afectado cuando hay fallas en la matriz celular o hay isquemia por lo que se llega a inhibir la migración de queratinocitos o su adhesión.
Apósitos
Existen actualmente en el mercado, una amplia variedad de materiales para la curación de heridas, han ido aumentando en número, sin embargo, solo hay algunos que tienen todas las características requeridas para la cicatrización. Las características ideales que deben cubrir estos materiales son que deben mantener un ambiente húmedo fisiológico que favorezca la granulación, crear una barrera que aísle la herida y la proteja de contaminación, mantener un ambiente térmico fisiológico, permitir el intercambio gaseoso, adecuada circulación sanguínea, facilitar la eliminación de exudado y ser capaz de absorberlo, que sea adaptable, flexible, de fácil manipulación y bajo costo, que se encuentre libre de tóxicos, con un adhesivo que no lesione la piel circundante, permitir su retiro y cambio sin provocar dolor o traumatismo, que permita valorar la evolución de la lesión sin retirarlo, que no libere mal olor ni que manche la piel ni la herida.
Para elegir el material que debemos usar, es necesario valorar el tiempo de la herida, heridas previas, historia de traumatismo, enfermedades concomitantes, tabaquismo, alergia a medicamentos, características de la herida como el sitio donde se localiza, la piel que la rodea y el nivel de secreción, esto se puede clasificar en cuatro categorías: necrótica, exudativa, granulación y epitelizada.11
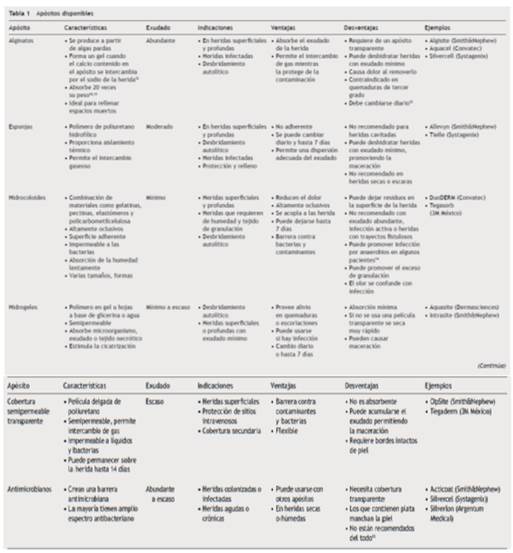
Las heridas necróticas son frecuentemente de color obscuro y están cubiertas por tejido desvitalizado que hay que retirar. La herida exudativa está cubierta por una placa de tejido delgada amarillo-grisácea que esta compuesta de fibrina, leucocitos y proteínas. Para preparar el lecho de la herida se pueden utilizar apósitos o la desbridación quirúrgica. La herida con tejido de granulación tiene una coloración rosa o roja con apariencia de empedrado, este tipo de herida requiere de un medio tibio y húmedo para facilitar la cicatrización. Las heridas epitelizadas se encuentran en la fase final de la cicatrización, por lo que deben de mantenerse en un ambiente húmedo y protegido. Para la selección apropiada de los apósitos hay que conocer las características de cada uno (tabla 1).
Terapia de presión negativa
A principios de los 90´s Argenta y Morykwas introdujeron la terapia de presión negativa con la primera publicación en 199712,13, está ha sido la mayor innovación en el manejo de heridas. El dispositivo consiste en un adhesivo con un tubo conectado a un recipiente de recolección y una fuente de vacio. El material de interfaz es una esponja de poliuretano de poro abierto, hidrófobo que tiene que sellar adecuadamente para mantener el vacio o el aire se fuga causando desecación, otros materiales que se utilizan son esponjas con alcohol polivinílico, o gasas. Estos, deben actuar como una interfaz para distribuir el vacio a lo largo de la herida y permitir que se eliminen los fluidos.13 La presión negativa que se aplica puede ser constante o intermitente, se recomienda una presión de 125 mmHg, pero puede aumentarse hasta 175 mmHg.14 Requiere de cambios cada 48 a 72 horas (fig. 1 ).
Dentro de los mecanismos de acción a parte de funcionar como un apósito oclusivo previniendo así la evaporación y la perdida de calor, están que cambia el flujo sanguíneo a la herida, esto es, que incrementa la perfusión a la herida y el tejido circundante, que es vital para que cicatrice la herida, disminuye el edema y remueve las secreciones, esto disminuye la exposición a bacterias (se ha visto que disminuye la cuenta de bacterias a menos de 105 organismos por gramo de tejido7), citocinas inflamatorias y metaloproteinasas que pueden contribuir a la formación de una herida crónica17, promueve la contracción de la herida y la formación de tejido de granulación.
La terapia de presión negativa se puede aplicar en cualquier tejido siempre y cuando esté bien vascularizado (ya que la necrosis puede ocurrir cuando se aplica en heridas isquemicas 14) y que la herida este libre de tejido necrótico. Las contraindicaciones son pocas pero se deben tomar en cuenta, destacan las siguientes: heridas con tejido necrótico, osteomielitis no tratada, fístulas, malignidad, aplicar directamente la esponja sobre arterias y venas expuestas.7,15
Otras terapias
Miel
Es una solución viscosa, con alta osmolaridad, saturada de carbohidratos derivada del néctar de diversas flores, se ha usado desde tiempos antiguos como un remedio para la curación de heridas. La miel tiene varios mecanismos de acción en los cuales encontramos una acción antibacterial ya que por ser una solución de alta osmolaridad inhibe el crecimiento de bacterias ya que “bloquea” a las moléculas de agua y con esto, las bacterias no tiene la suficiente agua para proliferar, también contiene peróxido de hidrógeno que se genera por la acción de ciertas enzimas que las abejas añaden a la miel. Algunas flores contienen flavonoides y ácidos aromáticos que complementan la acción antibacterial de la miel.16 La acción desodorante es probablemente porque la miel es una fuente rica en glucosa, está sería usada por las bacterias en lugar de aminoácidos lo que resultaría en la producción de acido láctico en lugar de compuestos malolientes.19 Tiene acción antiinflamatoria ya que contiene antioxidantes y se ha demostrado que la actividad antioxidante disminuye la inflamación.19 Promueve la granulación y la epitelización, ya que estimula la angiogénesis y a los fibroblastos por la acción del peróxido de hidrógeno que activa a las proteasas, al mismo tiempo que la acidez de la miel (pH entre 3 y 4 15) promueve la cicatrización al aumentar la oxigenación.17 El exudado de la herida diluye la miel y con esto disminuye la osmolaridad y por ende la actividad antiinflamatoria, por lo que deben hacerse cambios frecuentes hasta que disminuya la secreción.18
Aloe vera
El aloe vera es una planta de la familia Xanthorrhoeaceae y su uso medicinal se describe desde tiempos antiguos y ha sido objeto de diversos estudios para demostrar o no su efectividad.19 Contiene una fracción de glicoproteína que ayuda a la proliferación de queratinocitos y su migración, así como aumenta la expresión de receptores para fibronectina y el factor de crecimiento epidérmico.20 En otro estudio se descubrió que el betasitosterol, un esterol aislado de esta planta, provoca una invasión mejorada de colágena tipo 1 en las células endoteliales en ratones y esto mejora la angiogenesis21, también se encontró una enzima, la lyls oxidasa aumenta los niveles de colágeno en la herida.22 En otro estudio experimental se comparó el aloe vera con la sulfadiacina y con ácido salicílico para la curación de quemaduras, se encontró que los animales tratados con el aloe vera sanaban aproximadamente en 30 días en comparación de 50 días con sulfadiacina.23
Sustitutos dérmicos
Los sustitutos de piel son un grupo de materiales con los cuales se cubren heridas dérmicas para suplir las funciones de la piel, pueden adquirirse de otros humanos, animales o producirse en el laboratorio. Han alcanzado un gran desarrollo y en la actualidad se cuenta con más de ocho de estos prototipos disponibles en el mercado.24 Se clasifican en dos tipos: biológicos o sintéticos con dos subdivisiones, temporales o permanentes.25
Biológicos temporales
Membrana amniótica. Se utiliza en quemaduras de espesor parcial, por su bajo costo se utiliza en países donde el acceso a otros sustitutos es limitado. Tiene como desventaja el riesgo de transmisión de enfermedades.
Oasis® (Smith&Nephew, Inc. Smith&Nephew Wound Management. U.K.). La producción de este xenoinjerto es a base de submucosa de intestino delgado porcino. Su desventaja es que pueden provocar incompatibilidad genética e inmunológica. No debe ser aplicado cuando hay exudado excesivo, sangrado o si hay infección.
Aloinjetos cadavéricos. Se utilizan como injertos de espesor grueso y es un método temporal para el cierre de heridas optimizando el sistema inmunológico del paciente, proporcionando factores de crecimiento y citocinas para provocar quimiotaxis y proliferación celular, sin embargo, las células de Langerhans siguen activas, lo que puede provocar el rechazo de este aloinjerto.25
Biológicos permanentes
Apligraf ® (Organogenesis Inc. Living Technology. New Jersey, USA). Compuesto de fibroblastos neonatales y queratinocitos que son colocados en una matriz de colágeno bovino tipo I, con el tiempo el componente dérmico se cubre de queratinocitos neonatales que crecen en una capa y posteriormente se estratifican.26 Se recomienda su uso en úlceras venosas crónicas, se contraindica en alergias al componente bovino y en heridas infectadas.27
Matriderm ® (MedSkin Solutions Dr. Suwelack AG. Billerbeck, Germany). Matriz extracelular de colágeno bovino con elastina; es utilizado para el tratamiento de heridas profundas de la dermis, mientras el tejido va creciendo, está matriz se reabsorbe y desaparece.28
Alloderm ® (LifeCell Corporation. Bridgewater, NJ, USA). Se fabrica mediante el procesamiento de piel cadavérica, ésto da lugar a una dermis libre de células responsables de la respuesta antigénica en los aloinjertos, reduciéndola a una membrana basal y una matriz dérmica de colágena donde la nueva piel humana se puede regenerar.25 Es inmunologicamente inerte, pero tiene como desventajas que tiene bajo riesgo de transmitir enfermedades y esta contraindicado en heridas infectadas o no vascularizadas27 (figs. 2-4).
Epifast ® (Bioskinco S.A. de C.V. Estado de México, México). Es el primer equivalente de piel viva, desarrollado a partir del cultivo de células epidérmicas humanas que se colocan sobre una capa de gasa vaselinada, que reducen el tiempo de epitelización hasta en 50% de las lesiones causadas por quemaduras, úlceras, dermoabrasiones, áreas donadoras y otras afecciones cutáneas, disminuye el tiempo de recuperación del paciente, disminuye la fibrosis y el dolor, protege contra infecciones.
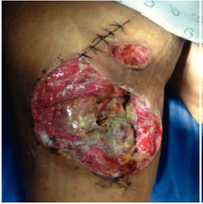
Figura 2 Paciente masculino de 23 años de edad con herida por arma de fuego en miembro pélvico derecho
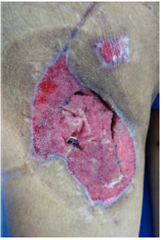
Figura 3 Mismo paciente manejado con desbridamiento quirurgico, terapia V.A.C.® durante 2 semanas y posteriormente aplicación de Alloderm®
Sintéticos temporales
Se forman de moléculas no biológicas o polímeros no presentes en la piel normal, con la finalidad de permitir el cubrimiento por células epiteliales, así como el crecimiento de fibroblastos y vasos sanguíneos. Su ventaja es que evitan que se active la respuesta inmune.
TransCyte ® (Smith&Nephew, Inc. Smith&Nephew Wound Management. U.K). Consiste en una membrana polimérica y células neonatales de fibroblastos cultivadas bajo condiciones asépticas in vitro en una malla de nylon que es cubierta con colágena dérmica de porcino y unida a una membrana de silicón y así esta membrana brinda una epidermis sintética al momento de aplicarse. Tiene la ventaja que es transparente, permitiendo un monitoreo directo al lecho de la herida.25
Biobrane ® (Smith&Nephew, Inc. Smith&Nephew Wound Manage ment. U.K). Esta compuesto de un tejido de nylon resistente unido mecánicamente a una capa ultradelgada de goma de silicón, ambas capas poseen péptidos de colágena derivados de piel de cerdo. Permite su aplicación a heridas irregulares y es transparente. No debe permanecer mas de dos semanas porque existe la posibilidad de que los fibroblastos se entrelacen con la malla.31
Sintéticos permanentes
Integra ® (Integra LifeSciences Holdings Co. Plainsboro, NJ. USA). Consiste en colágena bovina, condroitin-6-fosfato y una membrana de silicona. Se utiliza en heridas o defectos parcialmente profundos. La dermis del paciente se integra con el colágeno bovino y se va formando nueva piel, y cuando es satisfactoria la regeneración, se retira la capa de silicón.29
Dermagraft® (Organogenesis Inc. Living Technology. La Jolla, CA, USA). Es derivado del cultivo de fibroblastos humanos neonatales. Es una matriz sintética la cual permanece sobre una malla bioabsorbible, después de que la malla se reabsorbe (un mes), se coloca un autoinjerto para la recuperación completa.25 Esta indicado en úlceras diabéticas, quemaduras, en reconstrucción mamaria, en recostrucciones de membrana timpánica y de septum nasal.27 No debe usarse en heridas infectadas, con trayectos fistulosos o con hipersensibilidad al producto.27
Terapias nuevas
Terapia con factores de crecimiento
En 1962, Cohen publicó que la purificación de extractos de la glándula submaxilar daba lugar a la separación temprana de los parpados y a la erupción de los incisivos en ratones, lo que eventualmente condujo al aislamiento del primer factor de crecimiento, el factor de crecimiento epidermico.11,33Con este descubrimiento, el conocimiento sobre los factores de crecimiento ha aumentado. El factor de crecimiento derivado de las plaquetas (PDGF-BB) es el único que ha sido aprobado por la U.S. Food and Drug Administration (F.D.A.), su nombre comercial es Becaplermin, que es producto de la levadura Saccharomyces cerevisiae,27 está preparado en forma de gel y se ha utilizado en el tratamiento de úlceras diabéticas en las extremidades inferiores acompañado del adecuado desbridamiento de tejido necrótico o hiperqueratocico.7,27,34,35No debe usarse en pacientes con enfermedades malignas, ya que ha habido reportes que aumenta la mortalidad en esta población.8
El factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) se ha usado en heridas crónicas como un material que se inyecta alrededor del área a tratar o como una solución acuosa tópica, con resultados prometedores,30 pero aún se encuentra en investigación y no se ha aprobado su uso.11,30El factor de crecimiento de queratinocitos (KFG-2) se encuentra en fase 2 de investigación,37 y ha mostrado resultado prometedores en el incremento de la curación y epitelización sobre las úlceras venosas.31,32
Terapia con células madre
Las células madre son células que pueden diferenciarse en muchos tipos celulares y pueden ser útiles para la curación de heridas. Las células madre derivadas de adipocitos son cultivadas a partir de tejido extraído por liposucción y se ha estudiado su uso en heridas crónicas, demostrando que pueden acelerar el cierre de estas.33 Estas células se diferencian en células epiteliales y endoteliales y secretan citoquinas angiogénicas, ayudando a la neovascularización, así como se ha demostrado que promueven la proliferación de fibroblastos por contacto y por activación paracrina.33,34
Las células madre derivadas de la médula ósea promueven la cicatrización aumentando la población de fibroblastos y la producción de colágena en heridas crónicas que no han mejorado con las terapias convencionales.35,36
Se ha demostrado por inmuhistoquímica que las células madre derivadas del cordón umbilical se diferencian en queratinocitos en el tejido con heridas.37 Se han hecho estudios en donde se demuestra que el uso de fibroblastos derivados de estas células en heridas experimentan una epitelización mas rápida, organizada y mas delgada.38,39
Terapia génica
Se ha estado estudiando la inserción de genes en la piel, ya sea de forma tópica o inyectada en la forma de vectores (estos se encargan de insertar DNA en los genes humanos) virales y no virales, la forma no viral tiende a ser menos costosa y con menor riesgo de infección. En diversos estudios se ha comprobado que esta terapia promueve la granulación, vascularización y la epitelización y mejora la calidad de la cicatriz. Por esto, en el 2009, Margolis, et al realizaron un experimento en donde se inyectó un gen de adenovirus en úlceras crónicas, demostrando que su aplicación era segura y factible, teniendo como resultado tejido de granulación y la curación de la herida de difícil manejo.37 Sin embargo, se deben de continuar estos experimentos para asegurar que esta terapia es segura y factible para la curación de heridas tanto agudas como crónicas de difícil manejo.
Discusión
Desde tiempos remotos el hombre ha buscado la mejor manera de manejar las heridas, con el único objetivo de formar tejido viable para el cierre adecuado de estás y con la complejidad que caracteriza el proceso de curación de heridas es claro que no solo un agente o modalidad de tratamiento puede servir para todas las heridas, por lo que cada herida debe ser evaluada para optimizar su curación. En la actualidad contamos con una amplia variedad de herramientas dentro de las cuales tenemos apósitos, donde su elección es escencial de acuerdo a las características de cada herida, que ademas de proteger y mantener la temperatura de la herida, pueden desbridar y/o curar infecciones. La terapia de presión negativa es una excelente herramienta que estimula la formación de tejido de granulación, disminuye el edema y controla la proliferación bacteriana. Se han estado investigando otras modalidades que estimulen la creación de tejido de granulación, que incluyen la utilización de factores de crecimiento, celulas madre y mas recientemente la terapia génica que parece prometedora, sin embargo, se necesitan más estudios para confirmar su efectividad.38-45











 nueva página del texto (beta)
nueva página del texto (beta)