Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo. Serie horticultura
On-line version ISSN 2007-4034Print version ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.27 n.2 Chapingo May./Aug. 2021 Epub Dec 13, 2021
https://doi.org/10.5154/r.rchsh.2020.06.018
Artículos científicos
Efecto de tres condiciones agronómicas diferentes sobre el perfil bioquímico y la diversidad en la rizosfera de plantaciones de banano con Fusarium oxysporum Raza 1
1Instituto Tecnológico de Costa Rica. Av. 14, Calle 15, Basílica de los Ángeles, Cartago, Cartago, C. P. 30102, COSTA RICA.
Los microorganismos del suelo fungen un papel importante como enlace en la transferencia de nutrientes de la rizosfera. Las propiedades físicas y químicas del suelo, los perfiles metabólicos de las comunidades microbianas y las diferentes prácticas de manejo de los cultivos pueden mejorar nuestra comprensión de las interacciones rizosféricas. El objetivo de este estudio fue establecer las diferencias entre las comunidades microbianas asociadas a cultivos de banano, así como sus perfiles bioquímicos, en plantaciones con diferentes condiciones agronómicas. Se analizaron siete plantaciones con diferentes niveles de intervención, manejo e intensidad de fusariosis. El perfil bioquímico de las comunidades microbianas se determinó utilizando placas EcoPlates, y los sustratos consumidos por las comunidades microbianas se identificaron mediante un análisis de componentes principales (ACP) multivariado. Se seleccionaron siete microorganismos como indicadores de los ciclos de nutrientes, patogenicidad y sanidad del suelo. Los indicadores químicos del suelo se determinaron mediante un análisis mineral completo. Con el perfil fisiológico de las comunidades microbianas, se observó que las plantaciones con el mismo manejo tienden a presentar similitudes metabólicas. En el ACP, dos componentes principales explicaron 90 % de la varianza de los datos. Se determinó que el género Bacillus es predominante en todas las plantaciones, y que la plantación 4 (intervención media) presentó los valores más favorables en todos los factores analizados. Los valores de la capacidad de intercambio catiónico efectiva destacaron en el análisis químico, y determinaron que todas las plantaciones tienen nivel de fertilidad alto. El perfil metabólico, la diversidad y la riqueza de cada plantación se vieron afectadas por el tipo de manejo agronómico utilizado.
Palabras clave comparación de suelos; propiedades biológicas y químicas; comunidades de microorganismos del suelo; banano Gros Michel; perfil metabólico
Soil microorganisms play an important role as a link in the transfer of nutrients from the rhizosphere. The physical and chemical properties of soil, the metabolic profiles of microbial communities and different crop management practices can enhance our understanding of rhizospheric interactions. This study aimed to establish differences in microbial communities associated with banana crops and the biochemical profile in farms under different agronomic conditions. Seven farms with different levels of intervention, management, and fusariosis severity were analyzed. The biochemical profile of the microbial community was determined using EcoPlates and the main substrates consumed by the microbial communities were identified through multivariate principal component analysis (PCA). Seven microorganisms were selected as indicators of nutrient cycles, pathogenicity and soil health. Also, soil chemical indicators were determined through a complete mineral analysis. For the physiological profile of soil microbial populations, it was observed that farms with the same management tend to be metabolically very similar. In the PCA, two principal components explained 90 % of the variance in the data. It was also determined that the genus Bacillus is predominant in all farms and that farm 4 (medium intervention) presented the most favorable values in all factors analyzed. The effective cation exchange capacity values are highlighted in the chemical analyses, which determined that all farms have a high fertility level. The metabolic profile, diversity and richness of each of the different farms were affected by the type of agronomic management used.
Keywords soil comparison; biological and chemical properties; soil microorganism communities; Gros Michel banana; metabolic profile
Introducción
La marchitez de Fusarium, producida por el hongo Fusarium oxysporum f. sp. cubense (FOC1; descubierto en 1874), devastó al sector bananero durante la primera mitad del siglo XX debido a la sensibilidad del clon Gros Michel; esto condujo a su reemplazo por el clon Gran Enano a partir de la década de 1950, el cual sigue siendo predominante a nivel mundial (Wang et al., 2012). En la década de 1990, se identificó una nueva cepa de dicho hongo en el sudeste asiático llamada Fusarium oxysporum f. sp. cubense (FOC R4T), que afecta al cultivar Cavendish, los plátanos de cocción, los diploides comestibles y los plátanos verdes. Debido a la creciente diseminación de FOC, una de las bases para el manejo integrado de la enfermedad es el conocimiento del nicho que ocupa el nuevo patógeno y de la manera en que éste afecta las condiciones de vida del hospedero. Por ello, es vital conocer la microbiota del suelo y el fitobioma, especialmente las especies asociadas con las raíces. En este contexto, es importante analizar las comunidades de microorganismos que pueden interactuar con FOC bajo diferentes sistemas de cultivo (Shi et al., 2013).
El suelo es un ecosistema con una gran variedad de poblaciones microbianas, las cuales influyen directamente en su actividad y en el crecimiento de las plantas. Los microorganismos son los primeros en reaccionar ante cambios físicos y químicos en el medioambiente, de ahí la importancia de analizar su comportamiento y sus interacciones, ya que permite establecer condiciones en las que se puede suprimir el FOC de la rizosfera del patosistema de cultivo de banano (Gryta, Frąc, & Oszust, 2014). Se ha demostrado que la elaboración de perfiles fisiológicos de comunidades es muy eficaz para determinar los cambios espaciales y temporales en las comunidades de microorganismos del suelo. La evaluación de los datos generados a partir de pruebas metabólicas miniaturizadas incluye el desarrollo promedio del color (DPC), el índice de riqueza y la diversidad de Shannon (Frąc, Oszust, & Lipiec, 2012). El DPC es un indicador general de la actividad metabólica de las comunidades microbianas, y se puede subdividir entre los grupos que tienen una naturaleza química similar, lo cual permite evaluar el potencial de la comunidad microbiana para degradar diferentes fuentes de carbono (Kenarova, Radeva, Traykov, & Boteva, 2014). La identificación molecular de los indicadores que están presentes en las comunidades microbinas del suelo, así como su comparación, es una manera adecuada de encontrar diferencias entre las funciones de los agroecosistemas.
Los organismos del suelo son un componente integral de los ecosistemas, pero sus actividades son poco reconocidas en las estrategias de manejo. La intensidad en el uso de la tierra aumenta constantemente a escala mundial, con efectos adversos en los ecosistemas del suelo (Stavi & Lal, 2015). Una cuarta parte del suelo a nivel mundial se enfrenta a la degradación, y cada vez más estudios muestran que el uso intensivo de la tierra amenaza la biodiversidad del suelo. Para aumentar la biodiversidad edáfica, los cambios específicos en la composición de la comunidad del suelo se pueden complementar entre sí para aumentar la sostenibilidad del ecosistema (Tsiafouli et al., 2015) y mejorar la sanidad del suelo, esto en términos de promover su resiliencia y ser más supresivo contra algunos patógenos. En general, algunos estudios han demostrado que los microorganismos del suelo participan en los ciclos del nitrógeno y el carbono, y que también mejoran la nutrición de las plantas (Bommarco, Kleijn, & Potts, 2013).
En los ecosistemas naturales, las plantas silvestres dependen de la actividad y la función de sus comunidades de la rizosfera para defenderse de las plagas y las enfermedades del suelo (Huang et al., 2013). A lo largo del tiempo evolutivo, las plantas desarrollaron relaciones estrechas con algunos microorganismos del suelo, beneficiándose de su capacidad para inhibir patógenos de las plantas. Actualmente, existen muchas herramientas moleculares que permiten mejorar nuestro entendimiento del microbioma del suelo y las funciones de los microorganismos asociados a las plantas. La ingeniería de las interacciones de la biota planta-suelo (a través de la inoculación del suelo), la modificación del genoma, la secuenciación del metagenoma y la selección de los rasgos de las plantas ofrecen una vía prometedora para hacer frente de manera rápida a los desafíos futuros, tanto de los sistemas naturales como de los agrícolas (Mariotte et al., 2018).
Un desafío actual es ir más allá de predecir la función del genoma, basándose en el genoma y el metagenoma, para comprender las funciones reales que realiza el microbioma del suelo in situ. Algunos científicos descubrieron que para controlar o manejar el FOC R4T es necesario aplicar estrategias de manejo más eficientes y eficaces (como el control biológico), siendo, posiblemente, necesario usar hongos micorrícicos arbusculares (HMA) y rizobacterias promotoras del crecimiento vegetal (RPCV) para superar la enfermedad (Siamak & Zheng, 2018). Otros autores sugieren que el éxito de la colonización de las rizosferas hospederas es muy importante para el control eficaz de los patógenos transmitidos por el suelo, y han demostrado que la aplicación combinada de cepas de bacterias endófitas y rizosféricas conduce a una supresión eficaz del FOC (Ploetz, 2006; Thangavelu & Gopi, 2015).
El futuro de la lucha contra el FOC está basado en el conocimiento completo de los microbios naturales del suelo, los cuales desempeña un papel muy importante en el control de patógenos y mejoran el crecimiento de las plantas, la sanidad del suelo y su resiliencia frente a todos los cambios climáticos. Las poblaciones y las comunidades microbianas hacen que el suelo sea supresor de enfermedades, y son benéficas para el ciclo de nutrientes del suelo y el crecimiento de las plantas (Xinqi et al., 2015). Por lo anterior, el objetivo de este estudio fue establecer las diferencias entre las comunidades microbianas asociadas con los cultivos de banano clon Gros Michel, así como sus perfiles bioquímicos, en plantaciones bajo diferentes condiciones agronómicas, para comprender los factores que contribuyen al control efectivo de la fusariosis del bananero.
Materiales y métodos
Selección y localización de las plantaciones
Se seleccionaron siete plantaciones dedicadas a la producción de banano clon Gros Michel en Turrialba, Costa Rica, las cuales se encontraban bajo diferentes condiciones agrícolas: orgánica (9° 53’ 57.63” latitud norte - 83° 41’ 41.62” longitud oeste y 9° 52’ 41.7” latitud norte - 83° 42’ 23.18” longitud oeste), convencional intermedia (9° 56’ 43.75” latitud norte - 83° 39’ 44.4” longitud oeste y 9° 56’ 3.28” latitud norte - 83° 37’ 51.07” longitud oeste) y abandonada (9° 56’ 3.61” latitud norte - 83° 37’ 47.8” longitud oeste y 9° 56’ 6.84” latitud norte - 83° 37’ 47.42” longitud oeste), con severidad de fusariosis alta y baja en cada condición; como testigo se utilizó un bosque (9° 56’ 46.22” latitud norte - 83° 41’ 25.07” longitud oeste). Las fincas orgánicas estaban certificadas de acuerdo con organismos internacionales y seguían los estándares, por lo que dichas fincas debieron contar con al menos dos a tres años de aplicación de conceptos de agricultura orgánica. Las fincas convencionales utilizaban manejo agronómico convencional, bajo el cual el agricultor emplea químicos sintéticos con el objeto de controlar enfermedades y de fertilizar. Las plantaciones abandonadas se sembraron con banano en el pasado, pero han estado abandonadas por al menos cinco años, por lo que las plantas continuaron creciendo sin intervención humana.
Determinación del perfil bioquímico de las comunidades microbianas asociadas a FOC TR1
Para medir la diversidad funcional microbiana, se utilizaron placas EcoPlates (Biolog®, EUA) y se siguió un protocolo similar al descrito por Velkeneers (2013). Se resuspendieron 5 g de suelo en 50 mL de amortiguador de fosfato (0.05 M, K2HPO4, pH 7), inoculados con 150 µL de dilución por pozo y mantenidos a 26 °C. Las lecturas se tomaron cada 18 h. El desarrollo promedio del color (DPC) se calculó con la siguiente fórmula:
donde DOi es la densidad óptica y 31 es el número de sustratos de carbono presentes en las placas. El índice de riqueza (IR) se obtuvo mediante el conteo del número de reacciones positivas (DO estandarizada mayor que 0.25) con la siguiente fórmula:
donde R es el número de sustratos de carbono totales (31). El índice Shannon-Weaver (SW) se calculó utilizando la siguiente ecuación:
donde DOi(31) es el total de sustratos de carbono en las placas y DOi(96) es el número total de pozos (tres réplicas de cada sustrato más tres testigos negativos con agua) de las placas.
Se llevó a cabo un análisis de componentes principales (ACP) con los valores del DPC de cada plantación a las 54 h, para determinar los grupos de sustratos que son mayormente metabolizados. Un análisis similar fue realizado por Ge, Du, Gao, y Qiu (2018).
Indicadores microbianos
Con el fin de corroborar la presencia de diferentes grupos importantes en el suelo, se seleccionaron siete microorganismos (Cuadro 1), los cuales son indicadores de la sanidad del suelo y de los principales patógenos de las plantas de banana (Xinqi et al., 2015). Para cada especie se diseñaron cebadores utilizando el programa bioinformático Primer 3Plus. Los microorganismos presentes en el suelo se determinaron por medio de la reacción en cadena de la polimerasa (PCR, por sus siglas en inglés). Se utilizó el kit de extracción de ADN Power Soil® (MoBio Laboratories Inc, Reino Unido), y la integridad del ADN extraído se corroboró por electroforesis en gel de agarosa. Para determinar la identidad específica de los microorganismos, se realizó una secuenciación tipo Sanger de las bandas amplificadas de ADN. Las secuencias se compararon en la base de datos del NCBI (National Center for Biotechnology Information).
Cuadro 1 Microorganismos seleccionados para la identificación molecular.
| Microorganismos | Función | Secuencia de los cebadores | Tm (°C) |
|---|---|---|---|
| Azospirillum sp. | Solubizadoras de fósforo | F: TCGGCCTTAGTGGCGCACGGGT R: GGCCGTGTCTCAGTCCCAGTGTGGC | 67.2 |
| Rhizobium sp. / Azotobacter tropicalis | Fijadoras de nitrógeno | F: TGAGGTGCGAAAGCGTGGGGAGCAA R: TGTGCGGGCCCCCGTCAATTCCTTT / F: AAAGCCTGATCCAGCCATGCCGCGT R: TGAACCACCTACGCGCTTACGCCCA | 66.7 / 66.2 |
| Nostoc sp. | Fotosintetizadoras | F: ATTGGGCGTAAAGCGTCCGCAGGT R: AGCGCCTTCGCCACTGGTGTTCTT | 65.3 |
| Streptomyces sp. | Productoras de sustancias antibióticas | F: GCACAAGCAGCGGAGCATGTGGCTT R: AAGGGTTGCGCTCGTTGCGGGACTT | 66.3 |
| Ralstonia sygygii | Indicadoras de patógenos | F: AAGTCCCGCAACGAGCGCAACCCTT R: ATTAGCTCCACCTCGCGGCTTGGCA | 67.1 |
| Bacillus subtilis | Degradadoras de celulosa | F: ACCCGCGGCGCATTAGCTAGTTGGT R: ACGCGGCGTTGCTCCGTCAGACTTT | 66.6 |
Resultados
Diagnóstico biofísico y medioambiental
El Cuadro 2 resume las características biofísicas predominantes en cada plantación muestreada. La severidad de la enfermedad se clasificó como baja cuando menos de 50 % de las plantas presentaban síntomas moderados, mientras que la severidad alta se asignó cuando más de 90 % de las plantas estaban enfermas, presentando todos los síntomas de marchitez de Fusarium en la última etapa.
Cuadro 2 Características físicas de plantación muestreada.
| Plantación | Severidad de fusariosis | Altitud (m) | Temperatura (°C) | Tipo de suelo | Humedad relativa (%) |
|---|---|---|---|---|---|
| 1 - Orgánica | Baja | 1,000.69 | 25 | Andosol | 77 |
| 2 - Orgánica | Alta | 1,188 | 25 | Andosol | 77 |
| 3 - Convencional | Alta | 763.6 | 29 | Andosol | 72 |
| 4 - Convencional | Baja | 465.19 | 22 | Inceptisol | 82 |
| 5 - Abandonada | Baja | 524.01 | 20 | Inceptisol | 80 |
| 6 - Abandonada | Alta | 427.9 | 22 | Inceptisol | 82 |
| 7 - Bosque | - | 1211 | 28 | Andosol | 70 |
Perfil bioquímico de las comunidades microbianas asociadas a FOC R1
Los valores del DPC se transformaron utilizando el log10, y mostraron cambios en la abundancia microbiana y la actividad metabólica (Figura 1). Se observó un aumento en la absorbancia conforme avanzó el tiempo de incubación. Las plantaciones abandonadas (5 y 6) mostraron la reacción más rápida, y la plantación testigo (7), la más lenta.

Figura 1 Desarrollo promedio del color (DPC) de las siete plantaciones estudiadas durante las 108 h de incubación. Plantaciones 1 y 2 = orgánicas; Plantaciones 3 y 4 = manejo agronómico convencional intermedio; Plantaciones 5 y 6 = abandonadas; Plantación 7 = bosque (testigo negativo).
La plantación 6 presentó los mayores valores de absorbancia entre las 20 y 108 h, lo cual indica una respuesta metabólica alta a los sustratos. Las plantaciones 1, 2 y 5 mostraron comportamientos similares en los perfiles a lo largo del experimento, y las plantaciones 3 y 7 presentaron un perfil menor a 1 en el valor de absorbancia.
El número total de fuentes de carbono metabolizadas por los microorganismos del suelo en relación con el número total de sustratos se observa mediante la riqueza específica (Figura 2), en donde el mayor número de sustratos metabolizados se obtuvo a las 108 h con la plantación 6 (abandonada). En términos de diversidad, los resultados muestran que la plantación 2 tuvo la mayor diversidad funcional a las 108 h de incubación (Figura 3).
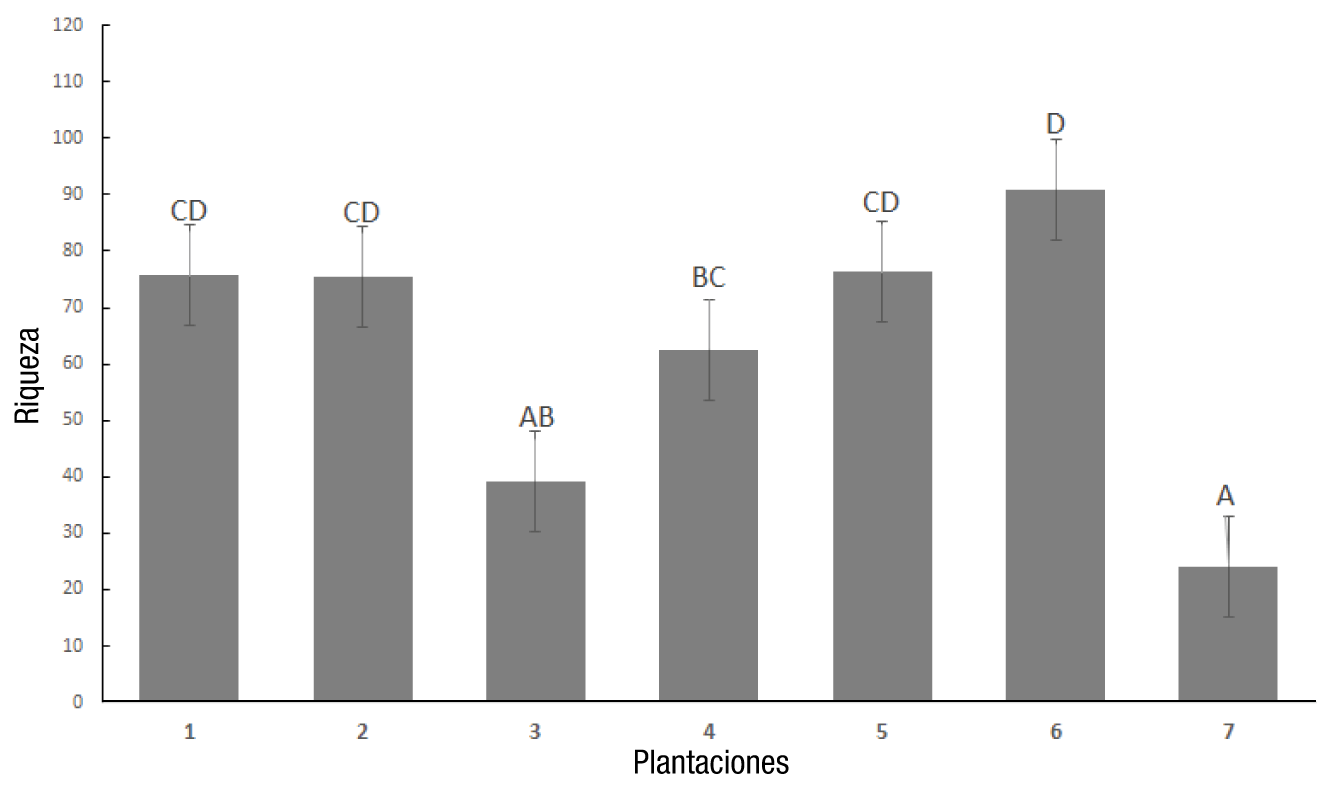
Figura 2 Índice de riqueza de las comunidades microbianas de las siete plantaciones estudiadas a las 108 h de incubación en placas EcoPlates a 26 °C. Plantaciones 1 y 2 = orgánicas; Plantaciones 3 y 4 = manejo agronómico convencional intermedio; Plantaciones 5 y 6 = abandonadas; Plantación 7 = bosque (testigo negativo). zLetras iguales entre barras no difieren estadísticamente (Kruskal-Wallis, P ≤ 0.001).
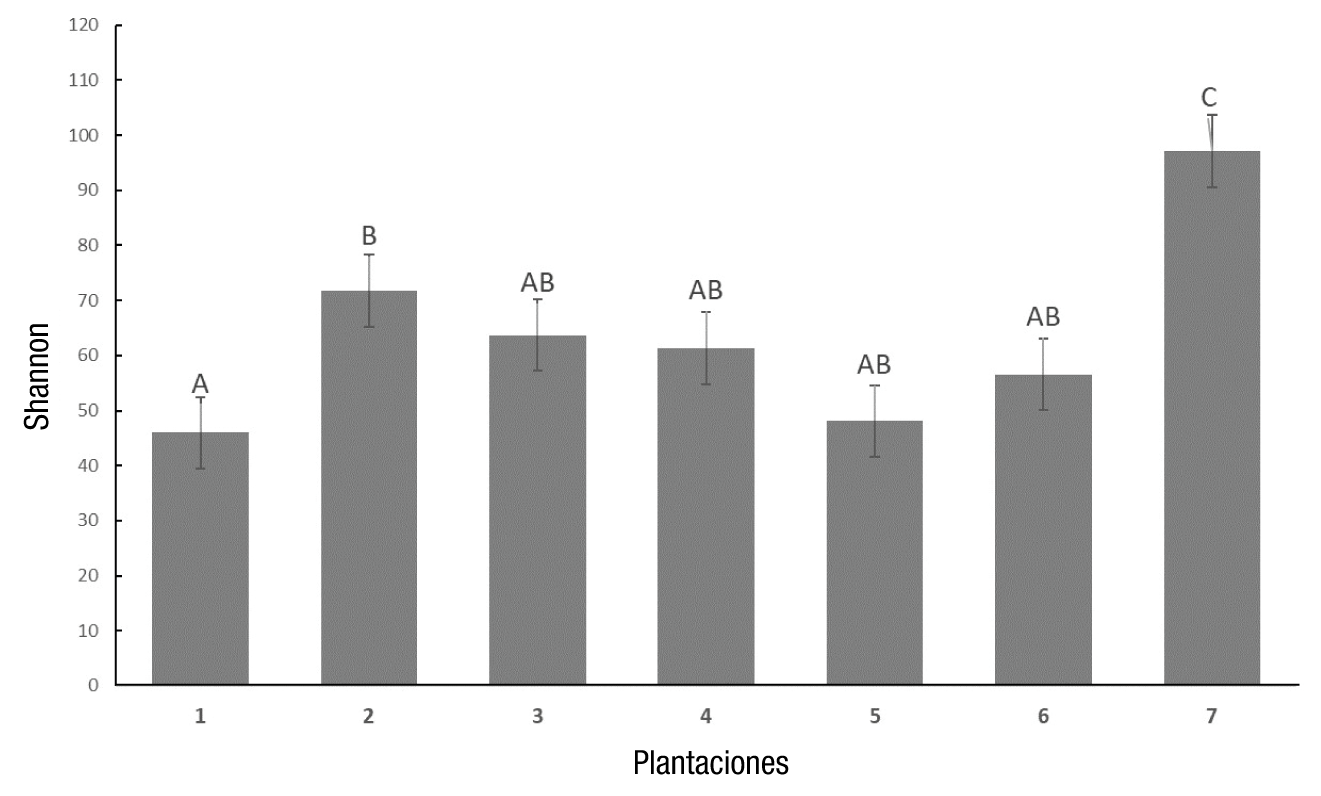
Figura 3 Índice de Shannon-Weaver de las comunidades microbianas de las siete plantaciones estudiadas a 108 h de incubación en placas EcoPlates a 26 °C. Plantaciones 1 y 2 = orgánicas; Plantaciones 3 y 4 = manejo agronómico convencional intermedio; Plantaciones 5 y 6 = abandonadas; Plantación 7 = bosque (testigo negativo). zLetras iguales entre barras no difieren estadísticamente (Kruskal-Wallis, P ≤ 0.004).
En cuanto al ACP, los dos primeros comprendieron el 88.8 % de la varianza (Figura 4). El CP1 muestra una importante correlación positiva con los aminoácidos, polímeros y ácidos carboxílicos y, al mismo tiempo, existe una fuerte correlación negativa con las aminas. El CP2 tiene una correlación alta y positiva con los carbohidratos, una importancia media con las aminas y una fuerte correlación negativa con los fenoles. Las plantaciones 3 y 7 están influenciadas positivamente por el CP1, mientras que las plantaciones 2 y 3 están influenciadas positivamente por el CP2. El resto de las plantaciones (1, 6, 5 y 4) están muy cerca del valor 0, o del eje del gráfico, aunque la plantación 4 también parece estar un poco asociada con los compuestos fenólicos (Figura 4).
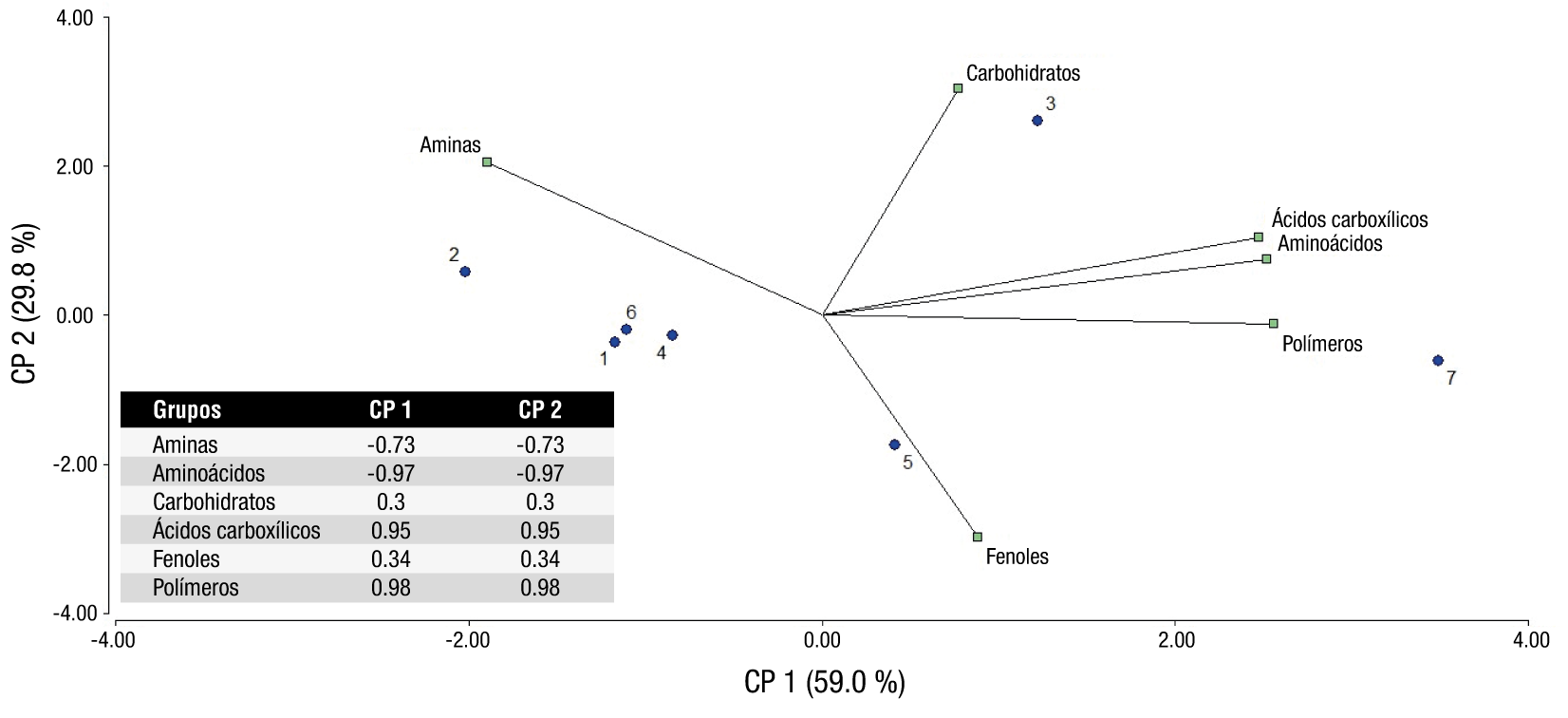
Figura 4 Diagrama Biplot del análisis de componentes principales obtenido del análisis del desarrollo promedio del color (DPC) a las 54 h de incubación en placas EcoPlates. Plantaciones 1 y 2 = orgánicas; Plantaciones 3 y 4 = manejo agronómico convencional intermedio; Plantaciones 5 y 6 = abandonadas; Plantación 7 = bosque (testigo negativo).
Indicadores microbianos
Todos los cebadores diseñados se evaluaron en las siete plantaciones muestreadas para corroborar la presencia o ausencia de los diferentes microorganismos. Los microorganismos con un porcentaje de identidad mayor a 95 % se muestran en el Cuadro 3, en donde se puede observar que entre las plantaciones con las mismas condiciones se encontraron diferentes especies de bacterias; aunque Bacillus se identificó en todas las plantaciones. La presencia de Ralstonia en muchos de los suelos analizados indica que tienen condiciones ideales para el desarrollo de patógenos radiculares. En general, los suelos fueron muy diversos en cuanto a los microorganismos indicadores encontrados.
Cuadro 3 Microorganismos identificados en cada plantación.
| Plantación | Microorganismos encontrados | Identidad (%) | E-value |
|---|---|---|---|
| 1 | Nostoc | 94 | 2e-19 |
| Bacillus sp. | 99 | 6e-64 | |
| 2 | Ralstonia sp. | 97 | 6e-62 |
| Rhizobium | 97 | 4e-08 | |
| Bacillus subtillis | 99 | 2e-51 | |
| 3 | Ralstonia sp. | 94 | 1e-46 |
| Streptomyces | 95 | 4e-08 | |
| Bacillus subtillis | 100 | 9e-63 | |
| 4 | Azospirillum | 95 | 3e-21 |
| Nostoc sp. | 100 | 5e-07 | |
| Bacillus sp. | 100 | 6e-60 | |
| 5 | Ralstonia sp. | 95 | 1e-50 |
| Bacillus subtillis | 100 | 7e-56 | |
| 6 | Nostoc sp. | 100 | 3e-07 |
| Bacillus sp | 100 | 1e-56 | |
| 7 | Ralstonia sp. | 98 | 1e-63 |
| Bacillus subtillis | 100 | 4e-66 |
Indicadores químicos
Como se puede observar en el Cuadro 4, las plantaciones 3 y 7 tienen problemas de acidez, y porcentajes de materia orgánica bastante elevados. Todos los valores de la capacidad de intercambio catiónico efectiva (CICE) y de micronutrientes se encontraron dentro del rango establecido para suelos moderadamente fértiles (Estrada-Herrera et al., 2017).
Cuadro 4 Análisis químico del suelo de las siete plantaciones muestreadas.
| Plantación | pH | Acidez | Ca | Mg | K | CICE | SA (%) | (Ca+Mg)/K | P | Fe | Cu | Zn | Mn | B | MO (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 5.32 | 1.23 | 4.39 | 0.91 | 0.16 | 12.63 | 9.74 | 33.13 | 6 | 150 | 6.1 | 1.3 | 15 | 0.15 | 16.7 |
| 2 | 5.62 | 0.30 | 19.90 | 4.77 | 0.44 | 28.27 | 1.06 | 56.07 | 26 | 271 | 3.3 | 6.4 | 88 | 0.31 | 11.2 |
| 3 | 4.26 | 13.00 | 5.44 | 2.29 | 0.27 | 25.93 | 50.13 | 28.63 | 10 | 247 | 5.2 | 2.4 | 104 | 0.14 | 8.6 |
| 4 | 5.88 | 0.22 | 20.70 | 4.92 | 0.70 | 29.94 | 0.73 | 36.60 | 26 | 229 | 4.1 | 7.9 | 74 | 0.38 | 10.5 |
| 5 | 6.02 | 0.14 | 16.00 | 3.81 | 0.60 | 28.35 | 0.49 | 33.02 | 41 | 291 | 8.4 | 4.3 | 99 | 0.29 | 7.2 |
| 6 | 5.74 | 0.24 | 13.30 | 3.83 | 0.49 | 19.57 | 1.23 | 34.96 | 26 | 164 | 2.2 | 1.2 | 49 | 0.28 | 11.4 |
| 7 | 4.68 | 3.08 | 1.21 | 0.47 | 0.26 | 7.66 | 40.21 | 6.46 | 13 | 222 | 2.9 | 2.1 | 16 | 0.19 | 35.7 |
CICE = capacidad de intercambio catiónico efectiva; SA = saturación de acidez; MO = materia orgánica.
Discusión
El análisis metabólico de las comunidades microbianas implica la caracterización de patrones bioquímicos que permiten establecer el consumo de las fuentes de carbono en un tiempo determinado. En términos generales, la relación diversidad-función se puede determinar a partir de la comunidad microbiana presente (Arteaga-Garibay, Gómez-Estrada, Martínez-Peña, Cadena-Zamudio, & Avendaño-Arrazate, 2016).
El perfil metabólico obtenido mostró que el abandono y la intervención agronómica son condiciones que hacen que las comunidades microbiana sean diferentes. En este caso, los niveles más altos de DPC estuvieron presentes en las plantaciones de manejo convencional (4) y la abandonada (6). No obstante, en términos de riqueza y diversidad, las plantaciones orgánicas (1 y 2) se mantuvieron entre los índices más altos junto con la plantación abandonada (6) y la testigo (7).
El DPC de las plantaciones orgánicas es similar en ambas, aunque son muy diferentes de los otros sistemas (sistemas convencionales y abandonados). Algunos autores como Liu, Tu, Hu, Gumpertz, y Beagle-Ristaino (2006) indican que las plantaciones orgánicas son las que muestran las mayores diferencias en relación con otros tipos de manejo, lo cual coincide con lo encontrado en este trabajo, en donde la plantación 4 presentó valores más altos en el DPC en comparación con el comportamiento de las plantaciones orgánicas. No obstante, esto se puedo deber al alcance de la intervención en cada plantación.
Liu et al. (2006) encontraron diferencias significativas en cuanto a la riqueza funcional de las comunidades microbianas, obteniendo valores de riqueza más altos en las plantaciones orgánicas al realizar análisis comparativos entre los distintos tipos de sistemas de manejo agronómico. En este trabajo, se obtuvieron valores de riqueza altos en las plantaciones orgánicas (1 y 2), observándose diferencias estadísticas con la plantación 3 (Figura 2).
Las similitudes encontradas en el índice de Shannon sugieren que las prácticas de manejo no ejercen una influencia importante en la estructura funcional de las comunidades microbianas del suelo (Lopes et al., 2010). Los bajos valores del índice de Shannon-Weaver sugieren que los miembros de las diferentes comunidades son muy similares entre sí, lo cual no les permite tener niveles altos de diversidad funcional.
Deltour et al. (2017) analizaron el impacto del FOC en diferentes lugares de una plantación manejada bajo un sistema agroforestal basado en principios agroecológicos (sin el uso de fertilizantes sintéticos), y encontraron que el área con los niveles más altos de supresión de FOC era la manejada sobre la base de un sistema agroforestal total desde 1995. Dichas áreas tenían algunas características específicas, como valores más altos del contenido de arcilla en el suelo, del pH y de conductividad eléctrica (CE). Estos autores también observaron que las áreas con un mayor grado de supresión presentaban una mayor diversidad de otros cultivares de banano, una menor cobertura del suelo y una mayor abundancia de árboles adultos (Deltour et al., 2017).
Se ha comprobado que una combinación de al menos dos variedades de banano, con diferentes niveles de resistencia a la marchitez por Fusarium, se asocia con un mayor grado de supresión de la enfermedad (Karangwa, Blomme, Beedd, Niyongere, & Viljoen, 2016). Dado que los bananos difieren en la composición bioquímica de sus raíces y en la exudación de las mismas, estos pueden ser colonizados por diferentes comunidades microbianas y, por lo tanto, modular los patógenos edáficos (Wuyts et al., 2007).
Shen et al. (2019) estudiaron el uso de fertilizantes sintéticos y plaguicidas químicos (como el amoníaco) en el manejo agronómico convencional y encontraron que los suelos fumigados presentaban una menor abundancia de microbios fúngicos y de FOC; sin embargo, hubo una diferencia no significativa en la comunidad bacteriana en ambos casos: suelos fumigados y suelos no fumigados. Además, la diversidad de Shannon no mostró ningún efecto significativo en la comunidad microbiana de ambos suelos.
La aplicación de biofertilizantes después de fumigar el suelo modifica la comunidad microbiana del suelo perturbada por el monocultivo de banano, lo cual da lugar a una comunidad microbiana única. Esto indica que, en algunos casos, los mejoradores orgánicos (como los biofertilizantes) aplicados al suelo después de la fumigación pueden ser benéficos para la diversificación de la comunidad microbiana, lo que da lugar a una reducción del FOC en el suelo (Shen et al., 2019; Wang et al., 2012).
El ACP mostró una alta correlación positiva de los ácidos carboxílicos, polímeros y aminoácidos en el CP1, lo que denota la importancia de estas sustancias en la dinámica microbiana del suelo. Estos compuestos forman parte de la materia orgánica, que está constituida por residuos animales y vegetales en diferentes grados de descomposición; la mayoría de estos compuestos son carbohidratos, celulosa, lignina, proteínas, aminoácidos y ceras. Todas estas sustancias son fuente primaria de nutrientes para macro- y microorganismos (Schmidt et al., 2011). Los ácidos carboxílicos también pueden ser exudados por las plantas a través de las raíces (esto puede ocurrir debido al estrés causado por la falta de nutrientes); estos exudados, a su vez, proporcionan alimento y energía para los microorganismos en el suelo (López-Reyes et al., 2012). En los procesos de renovación del suelo se metabolizan principalmente los polímeros más complejos, los ácidos carboxílicos y los aminoácidos (Food and Agriculture Organization of the United Nations [FAO], 2006).
En cuanto a las aminas, en el CP1 no son consumidas, pero en el CP2 son el segundo factor de consumo. Esto sitúa los puntos muy cercanos del eje central del gráfico, lo que puede sugerir que las plantaciones situadas cerca de él no muestran una predilección clara por un determinado sustrato. Las plantaciones orgánicas (1 y 2) no mostraron diferencias estadísticas significativas entre sí, tanto en el análisis del perfil fisiológico como en algunos de los CP; por lo tanto, se puede decirse que tienen un comportamiento bioquímico muy homogéneo.
La plantación 7 (testigo) muestra un comportamiento altamente influenciado por los ácidos carboxílicos, aminoácidos y polímeros; por ende, tiende a los valores positivos del CP1. Jangid et al. (2008) detallaron las diferencias químicas y biológicas de bosques que se utilizan frecuentemente como testigos en estudios agronómicos de plantaciones. Se han encontrado diferencias en el uso de fuentes de carbono por parte de los microorganismos forestales en comparación con los de suelos agrícolas, y se ha observado un mayor consumo de sustratos menos energéticos como los ácidos carboxílicos y los aminoácidos. Lo anterior debido, probablemente, a que la cobertura forestal tiene altas concentraciones de materia orgánica, y sin alteración mecánica del suelo se presentan valores de pH más bajos; por tanto, los microorganismos presentes tienen una mayor preferencia por sustratos ácidos (Brackin, Robinson, Lakshmanan, & Schmidt, 2013).
En cuanto a las diversas funciones desempeñadas por los microorganismos en el suelo, se eligieron los grupos de mayor importancia para las plantaciones bananeras. Los resultados muestran la presencia de la bacteria Bacillus en todos los sitios, situación que han informado otros investigadores (Fu, Ruan, Tao, Rong, & Shen 2016), donde Bacillus spp. está catalogada como una de las especies más predominantes en los suelos de explotaciones bananeras, incluso bajo diferentes tipos de manejo agronómico (orgánico y convencional). Una de las funciones principales de Bacillus spp. es degradar la celulosa; sin embargo, algunos autores indican que estas bacterias también pueden desempeñar otras funciones vitales en los suelos, como la solubilización de la urea, la oxidación de compuestos nitrogenados y la producción de antibióticos (Chaparro, Sheflin, Manter, & Vivanco, 2011).
Otros organismos, como Azospirillum spp. y Nostoc spp., presentaron resultados variables en cuanto a su presencia en diferentes áreas de muestreo. Los resultados muestran que no hay uniformidad entre las comunidades microbianas de los sitios bajo el mismo manejo agronómico, lo cual coincide con otros estudios que describen diferencias microbiológicas en plantaciones orgánicas. Wessén, Hallin, y Philippot (2010) encontraron que realizar actividades diferentes y aplicar diferentes mejoradores orgánicos a esta modalidad de cultivo causan efectos distintos en el suelo, lo que promueve la actividad metabólica en algunos casos, pero en otros no. Por lo tanto, bajo el mismo tipo de manejo agronómico, las actividades agrícolas podrían marcar una diferencia importante en términos de la composición del microbioma.
Los resultados muestran que la plantación con mayor presencia de microorganismos indicadores benéficos es una de manejo convencional (plantación 4), en la cual se destacaron los microorganismos Azospirillum spp., Nostoc spp. y Bacillus spp. (Cuadro 3), mientras que no se detectó la presencia de Ralstonia spp. La ausencia de este patógeno podría ser una señal de prácticas eficaces de protección del cultivo, y la presencia de numerosos indicadores benéficos podría indicar un buen manejo del suelo. Nostoc spp. se caracteriza por ser un fotosintetizador con capacidad para fijar nitrógeno atmosférico; estas características le permiten ser uno de los primeros colonizadores de la materia en descomposición, al proporcionar oxígeno al medioambiente por medio de la fotosíntesis, y con ello permitir el crecimiento de otras bacterias aeróbicas (Obana, Miyamoto, Morita, Ohmori, & Inubushi, 2007). Por su parte, Azospirillum spp. se asocia con compuestos ricos en fósforo, solubilización y fijación de nitrógeno atmosférico, y secreción de reguladores de crecimiento vegetal (García-Orenes et al., 2010; Méndez-Gómez, Castro-Mercado, & García-Pineda, 2014).
Debido a la alta incidencia de Bacillus en la rizosfera de todas las plantaciones muestreadas, se considera que es un microorganismo muy importante para la sanidad del suelo, ya que promueve el crecimiento vegetativo y, al mismo tiempo, tiene un efecto antibiótico contra fitopatógenos. Sorpresivamente, la plantación 7 (testigo) presenta Ralstonia sp. y no la mayoría de los indicadores de ciclo.
Los resultados obtenidos en el análisis químico del suelo muestran que todas las plantaciones tienen una CICE más alta que el valor teórico establecido para un nivel de fertilidad alto (Estrada-Herrera et al., 2017). En las plantaciones con labranzas cero (abandonadas), se pueden apreciar valores altos de CICE. Esta característica favorece la concentración de materia orgánica y compuestos de nitrógeno; además, evita la erosión, disminuye la lixiviación de minerales en el suelo y las condiciones microbiológicas generales (Sadzawka, 2011). La acidificación que se produce en los sistemas de labranza cero no necesariamente significa un aumento del aluminio intercambiable, ya que no se altera la estructura física del suelo y el contenido de compuestos orgánicos aumenta, los cuales son capaces de atrapar iones de Al y disminuir la toxicidad de este compuesto para las plantas.
Conclusiones
El perfil metabólico, la diversidad y la riqueza de cada plantación se vieron afectados por el tipo de manejo agronómico utilizado, aunque la composición de las comunidades en la rizosfera de las plantas de banano parece estar determinada por una serie de factores sumamente complejos. La plantación 4 (convencional intermedia) presentó los valores más favorables en todos los factores analizados; dichos valores indican que se trata de un suelo metabólicamente activo bajo la presencia de poblaciones benéficas.
Se observaron diferencias en los factores químicos y físicos, y en las comunidades microbianas del suelo en los diferentes sistemas de manejo agronómico. El análisis de secuenciación determinó que el género Bacillus es el grupo que predominó en todas las plantaciones, pero se encontraron diferencias en cuanto a la presencia de otros microorganismos indicadores. Existen importantes grupos de microorganismos que reflejan la sanidad del suelo y la resistencia a patógenos (Baccillus, Azospirrillum, Nostoc, y Streptomyces). Las comunidades microbianas establecidas en la rizosfera del banano y los factores que las afectan son algunos de los aspectos menos conocidos en el desarrollo de buenas prácticas agrícolas.
References
Arteaga-Garibay, R. I., Gómez-Estrada, M. M., Martínez-Peña, M. D., Cadena-Zamudio, J. D., & Avendaño-Arrazate, C. H. (2016). Diversidad metabólica funcional de comunidades microbianas asociadas a suelo rizosférico de maíz (Zea mays L.) razas amarillo-zamorano y jala. Agro Productividad, 9(8), 87-91. Retrieved from http://revista-agroproductividad.org/index.php/agroproductividad/article/view/807/671 [ Links ]
Bommarco, R., Kleijn, D., & Potts, S. (2013). Ecological intensification: harnessing ecosystem services for food security. Trends in Ecology & Evolution, 28(4), 230-238. doi: 10.1016/j.tree.2012.10.012 [ Links ]
Brackin, R., Robinson, N., Lakshmanan, P., & Schmidt, S. (2013). Microbial function in adjacent subtropical forest and agricultural soil. Soil Biology & Biochemistry, 57, 68-77. doi: 10.1016/j.soilbio.2012.07.015 [ Links ]
Chaparro, J. M., Sheflin, A. M., Manter, D. K., & Vivanco, J. M. (2011). Manipulating the soil microbiome to increase soil health and plant fertility. Biology and Fertility of Soils, 48, 489-499. doi: 10.1007/s00374-012-0691-4 [ Links ]
Deltour, P., Françaa, S. C., Liparini-Pereira, O., Cardoso, I., de Neve, S., Debode, J., & Höfte, M. (2017). Disease suppressiveness to Fusarium wilt of banana in an agroforestry system: influence of soil characteristics and plant community. Agriculture, Ecosystems and Environment, 239, 173-181. doi: 10.1016/j.agee.2017.01.018 [ Links ]
Estrada-Herrera, I. R., Hidalgo-Moreno, C., Guzmán-Plazola, R., Almaraz-Suárez, J. J., Navarro-Garza, H., Etchevers-Barra, J. D. (2017). Soil quality indicators to evaluate soil fertility. Agrociencia, 51(8), 813-831. Retrieved from http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1405-31952017000800813&lng=es&tlng=en [ Links ]
Food and Agriculture Organization of the United Nations (FAO). (2006). Conservación de los recursos naturales para una agricultura sostenible. Materia orgánica y actividad biológica. Retrieved November 2, 2017 from http://www.fao.org/ag/ca/training_materials/cd27-spanish/ba/organic_matter.pdf [ Links ]
Frąc, M., Oszust, K., & Lipiec, J. (2012). Community level physiological profiles (CLPP), characterization and microbial activity of soil amended with dairy sewage sludge. Sensors, 12(3), 3253-3268. doi: 10.3390/s120303253 [ Links ]
Fu, L., Ruan, Y., Tao, C., Rong, L., & Shen, Q. (2016). Continous application of bioorganic fertilizer induced resilient culturable becteria community associated with banana Fusarium wilt suppression. Scientific Reports, 6(1), 27731. doi: 10.1038/srep27731 [ Links ]
García-Orenes, F., Guerrero, C., Roldán, A., Mataix-Solera, J., Cerdá, A., Campoy, M., Zornoza, R., Bárcenas, G., & Caravaca, F. (2010). Soil microbial biomass and activity under different agricultural management systems in semiarid Mediterranean agroecosystem. Soil & Tillage Research, 109(2), 110-115. doi: 10.1016/j.still.2010.05.005 [ Links ]
Ge, Z., Du, H., Gao, Y., & Qiu, W. (2018). Analysis on metabolic functions of stored rice microbial communities by Biolog EcoPlate microplates. Frontiers in microbiology, 9, 1375. doi: 10.3389/fmicb.2018.01375 [ Links ]
Gryta, A., Frąc, M., & Oszust, K. (2014). The application of the Biolog EcoPlate approach in ecotoxicological evaluation of dairy sewage sludge. Applied Biochemistry and Biotechnology, 174, 1434-1443. doi: 10.1007/s12010-014-1131-8 [ Links ]
Huang, L. F., Song, L. X., Xia, X. J., Mao, W. H., Shi, K., Zhou, Y. H., & Yu, J. Q. (2013). Plant-soil feedbacks and soil sickness: from mechanisms to application in agriculture. Journal of Chemical Ecology, 39, 232-242. doi: 10.1007/s10886-013-0244-9 [ Links ]
Jangid, K., Williams, M. A., Franzluebbers, A. J., Sanderlin, J. S., Reeves, J. H., Jenkins, M. B., Endale, D. M., Coleman, D. C., & Whitman, W. B. (2008). Relative impacts of land use, management intensity and fertilization upon soil microbial community structure in agricultural systems. Soil Biology and Biochemistry, 40(11), 2843-2853. doi: 10.1016/j.soilbio.2008.07.030 [ Links ]
Karangwa, P., Blomme, G., Beedd, F., Niyongere, C., & Viljoen, A. (2016). The distribution and incidence of banana Fusarium wilt in subsistence farming systems in east and central Africa. Crop Protection, 84, 132-140. doi: 10.1016/j.cropro.2016.03.003 [ Links ]
Kenarova, A., Radeva, G., Traykov, I., & Boteva, D. (2014). Community level physiological profiles of bacterial communities inhabiting uranium mining impacted sites. Ecotoxicology and Environmental Safety, 100, 226-232. doi: 10.1016/j.ecoenv.2013.11.012 [ Links ]
Liu, B., Tu, C., Hu, S., Gumpertz, M., & Beagle-Ristaino, J. (2006). Effect of organic, sustainable and conventional management strategies in grower fields on soil physical, chemical and biological factors and the incidence of Southern blight. Applied Soil Ecology, 37(3), 202-214. doi: 10.1016/j.apsoil.2007.06.007 [ Links ]
Lopes, A. R., Faria, C., Prieto-Fernández, A., Trasar-Cepeda, C., Manaia, C. M., & Nunes, O. C. (2010). Comparative study of the microbial diversity of bulk paddy soil of two rice fields subject to organic and conventional farming. Soil Biology and Biochemistry , 43(1), 115-125. doi: 10.1016/j.soilbio.2010.09.021 [ Links ]
López-Reyes, L., Hernández-Espinosa, M. A., Ruiz-Careaga, J., Carcaño-Montiel, M. G., Medina-de la Rosa, G., Portillo-Reyes, R., & Muñoz-Rojas, J. (2012). Adsorción de ácidos carboxílicos de origen vegetal y bacteriano en un suelo agrícola. Terra Latinoamericana, 30(3), 261-270. Retrieved from http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0187-57792012000300261&lng=es&tlng=es [ Links ]
Mariotte, P., Mehrabi, Z., Bezemer, M. de Deyn, G. B., Kulmatiski, A., Drigo, B., Veen, G. F., van der Heijden, M., & Kardol, P. (2018). Plant-soil feedback: bridging natural and agricultural sciences. Trends in Ecology and Evolution, 33(2), 129-142. doi: 10.1016/j.tree.2017.11.005 [ Links ]
Méndez-Gómez, M., Castro-Mercado, E., & García-Pineda, E. (2014). Azospirillum una rizobacteria con uso potencial en la agricultura. Biológicas, 16(1), 11-18. Retrieved from https://www.biologicas.umich.mx/index.php?journal=biologicas&page=article&op=view&path%5B%5D=172&path%5B%5D=pdf [ Links ]
Obana, S., Miyamoto, K., Morita, S., Ohmori, M., & Inubushi, K. (2007). Effect of Nostoc sp. on soil characteristics, plant growth and nutrient uptake. Journal of Applied Phycology, 19, 641-646. doi: 10.1007/s10811-007-9193-4 [ Links ]
Ploetz, R. (2006). Panama disease: an old nemesis rears its ugly: head part 2. The cavendish era and beyond. Plant Health Progress, 7(1), 1-19. doi: 10.1094/PHP-2006-0308-01-RV [ Links ]
Sadzawka, A. (2011.). Cero labranza y características químicas del suelo. In: Rouanet, J. L. (Ed.), Cero Labranza (pp. 1-12). Chile: Carillanca. Retrieved from http://biblioteca.inia.cl/medios/biblioteca/seriesinia/NR16733.pdf [ Links ]
Schmidt, M. W., Torn, M. S., Abiven, S., Dittmar, T., Guggenberger, G., Janssens, I. A., Trumbore, S. E. (2011). Persistence of soil organic matter as an ecosystem property. Nature, 478, 49-56. doi: 10.1038/nature10386 [ Links ]
Shen, Z., Xue, C., Penton, C. R., Thomashow, L. S., Zhang, N., Wang, B., Ruan, Y., Li, R., & Shen, Q. (2019). Suppression of banana Panama disease induced by soil microbiome reconstruction through an integrated agricultural strategy. Soil Biology and Biochemistry , 128, 164-174. doi: 10.1016/j.soilbio.2018.10.016 [ Links ]
Shi, Y., Lalande, R., Hamel, C., Ziadi, N., Gagnon, B., & Hu, Z. (2013). Seasonal variation of microbial biomass, activity, and community structure in soil under different tillage and phosphorus management practices. Biology and Fertility of Soils , 49, 803-818. doi: 10.1007/s00374-013-0773-y [ Links ]
Siamak, S. B., & Zheng, S. (2018). Banana fusarium wilt (Fusarium oxysporum f. sp. cubense) control and resistance, in the context of developing wilt-resistant bananas within sustainable production systems. Horticultural Plant Journal, 4(5), 208-2018. doi: 10.1016/j.hpj.2018.08.001 [ Links ]
Stavi, I., & Lal, R. (2015). Achieving zero net land degradation: challenges and. Journal of Arid Environments, 112, 44-51. doi: 10.1016/j.jaridenv.2014.01.016 [ Links ]
Thangavelu, R., & Gopi, M. (2015). Field suppression of Fusarium wilt disease in banana by the combined application of native endophytic and rhizospheric bacterial isolates possessing multiple functions. Phytopathologia Mediterranea, 54(2), 241-252. doi: 10.14601/Phytopathol_Mediterr-15160 [ Links ]
Tsiafouli, M. A., Thébault, E., Sgardelis, S. P., de Ruiter, P. C., van der Putten, W. H., Birkhofer, K., Hedlund, K. (2015). Intensive agriculture reduces soil biodiversity across Europe. Global Change Biology, 21(2), 973-985. doi: 10.1111/gcb.12752 [ Links ]
Velkeneers, E. (2013). Suppression of Fusarium oxysporum f.sp cubense on banana in an agroforestry system in Brasil (Master’s dissertation). Universidad de Gante, Brasil. Retrieved from https://lib.ugent.be/fulltxt/RUG01/002/063/695/RUG01-002063695_2013_0001_AC.pdf [ Links ]
Wang, Z., Zhang, J., Jia, C., Liu, J., Li, Y., Yin, X., Xu, B., & Jin, Z. (2012). De novo characterization of the banana root transcriptome and analysis of gene expression under Fusarium oxysporum f. sp. Cubense tropical race 4 infection. BMC Genomics, 13, 650. doi: 10.1186/1471-2164-13-650 [ Links ]
Wessén, E., Hallin, S., & Philippot, L. (2010). Differential responses of bacterial and archaeal groups at high taxonomical ranks to soil management. Soil Biology and Biochemistry , 42(10), 1759-1765. doi: 10.1016/j.soilbio.2010.06.013 [ Links ]
Wuyts, N., Lognay, G., Verscheure, M., Marlier, M., de Waele, D., & Swennen, R. (2007). Potential physical and chemical barriers to infection by the burrowing nematode Radopholus similis in roots of susceptible and resistant banana (Musa spp.). Plant Pathology, 56(5), 878-890. doi: 10.1111/j.1365-3059.2007.01607.x [ Links ]
Xinqi, H., Liangliang, L., Teng, W., Rui, Z., Jinbo, Z., & Zucong, C. (2015). Illumina MiSeq investigations on the changes of microbial community in the Fusarium oxysporum f. sp. Cubense infected soil during and after reductive soil disinfestation. Microbial Research, 181, 33-42. doi: 10.1016/j.micres.2015.08.004 [ Links ]
Recibido: 23 de Junio de 2020; Aprobado: 30 de Noviembre de 2020











 text in
text in 



