Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo. Serie horticultura
On-line version ISSN 2007-4034Print version ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.26 n.1 Chapingo Jan./Apr. 2020 Epub June 15, 2020
https://doi.org/10.5154/r.rchsh.2019.08.012
Artículo científico
Respuesta a la salinidad del pasto azul de Kentucky (Poa pratensis L.) tratado con ácido salicílico y progesterona
1Islamic Azad University, Rasht Branch, Rasht, Iran.
El objetivo del presente estudio fue evaluar el efecto del ácido salicílico (AS) y la progesterona (P4) sobre los parámetros fisiológicos y bioquímicos en pasto azul de Kentucky sometido a estrés por salinidad. Se estableció un experimento factorial basado en un diseño de bloques completos al azar con cuatro repeticiones, en condiciones de invernadero. Los tratamientos experimentales incluyeron cuatro niveles de salinidad (0, 2, 4 y 6 dS·m-1) y dos reguladores de crecimiento vegetal (P4 y AS) en seis niveles, incluyendo el control (1 y 10 mg·L-1 de P4, 1 y 3 mM de AS, y 1 mg·L-1 de P4 + 1 mM de AS). El aumento de la salinidad dañó la calidad del pasto, pero la aplicación de AS y P4 alivió los impactos de la salinidad y mejoró la calidad del pasto. La mayor pérdida de electrolitos se observó con 6 dS·m-1 de salinidad y 3 mM de AS. La aplicación de AS y P4 mejoró el contenido de carotenoides en pasto azul sometido a estrés salino en comparación con las plantas no tratadas con reguladores de crecimiento. El mayor contenido total de clorofila se obtuvo con 2 dS·m-1 de salinidad y 10 mg·L-1 de P4. El contenido foliar de prolina se incrementó con el nivel de salinidad; sin embargo, se presentaron pequeñas diferencias entre los distintos niveles de los reguladores de crecimiento. El AS y la P4 aumentaron el contenido de prolina. La salinidad incrementó la concentración de malondialdehido (MDA) en el pasto de un 12 a 50 %, y los reguladores de crecimiento ayudaron a reducir dicha concentración. También, se observó un aumento en la actividad de la peroxidasa con 6 dS·m-1 de salinidad cuando el AS y la P4 se aplicaron simultáneamente. En general, se observó que el AS y la P4 aumentaron la tolerancia a la salinidad al incrementar la calidad del pasto, la clorofila y el contenido de carotenoides, y al eliminar radicales libres de oxígeno, al influir en las enzimas antioxidantes.
Palabras clave Poa pratensis; clorofila; malondialdehido; estrés ambiental
The effect of salicylic acid (SA) and progesterone (P4) on physiological and biochemical parameters of Kentucky bluegrass under salinity stress was assessed. A factorial experiment was established based on a randomized complete block design with four replications, under greenhouse conditions. The experimental treatments included four levels of salinity (0, 2, 4 and 6 dS·m-1) and two plant growth regulators (P4 and SA) at six levels including the control (1 and 10 mg·L-1 P4, 1 and 3 mM SA, and 1 mg·L-1 P4 + 1 mM SA). The increase in salinity impaired the quality of grass, but SA and P4 application alleviated the impacts of salinity and ameliorated the quality of grasses under salinity. The highest electrolyte leakage was observed under 6 dS.m-1 salinity and 3 mM SA. The application of SA and P4 improved the carotenoid content in bluegrass subjected to saline stress compared to plants not treated with growth regulators. The highest total chlorophyll content was obtained from 2 dS·m-1 salinity and 10 mg·L-1 P4. Leaf proline content was increased with salinity level. However, slight differences existed between different levels of growth regulators. The SA and P4 increased proline content. Salinity increased the concentration of malondialdehyde (MDA) in the grass from 12 to 50 %, and growth regulators helped to reduce this concentration. Also, an increase in peroxidase activity with 6 dS·m-1 salinity was observed when SA and P4 were applied simultaneously. Overall, it was observed that SA and P4 increased salinity tolerance through enhancing grass quality, chlorophyll, and carotenoid content and scavenging free oxygen radicals through influencing antioxidant enzymes.
Keywords Poa pratensis; chlorophyll; malondialdehyde; environmental stress
Introducción
El estrés por salinidad es un factor ambiental determinante que limita el crecimiento y el desarrollo de las plantas, y que puede ocasionar otros factores de estrés como la toxicidad iónica, el estrés osmótico y el estrés oxidativo (Gezi, Peng, Wei, & Kang, 2013). Los pastos constituyen una parte importante de los espacios verdes en las zonas urbanas y, en la mayoría de los casos, no pueden ser sustituidos por otras especies vegetales debido a su alta tolerancia al tránsito pesado (Torgeon, 2008). El pasto azul de Kentucky (Poa pratensis L.) es uno de los más utilizados en los paisajes, debido a su belleza, resistencia y estabilidad, especialmente en regiones con climas fríos y húmedos (Bushman, Amundsen, Warnke, Robins, & Johnson, 2016).
El estrés salino es un factor importante que limita a la industria de los pastos y deteriora su calidad, por lo que es una preocupación clave en la protección de los pastos. Por ello, las investigaciones exhaustivas se han centrado en reguladores de crecimiento que puedan aliviar los daños por estrés con el fin de generar resistencia. Entre estos compuestos, el ácido salicílico (AS) es un regulador del crecimiento vegetal que pertenece a la familia de los fenoles, y juega un papel esencial en el crecimiento de las plantas, la respiración y la resistencia a los patógenos (Janda, Hidog, Szalai, Kovacs & Janda, 2012). Se ha documentado que el AS mejora el crecimiento de las plantas expuestas al frío, a altas temperaturas, a la salinidad, al estrés osmótico, al estrés por ozono o ultravioleta, a la sequía o a los herbicidas (Belkhadi et al., 2010). Asimismo, el AS puede inducir tolerancia en planta a diferentes tensiones a través de moléculas de señalización (Loutfy, El-Tayeb, Hassanen, Sakuma, & Inouhe, 2012).
Las plantas y los animales contienen muchos esteroides que actúan como moléculas de señalización durante procesos complicados de crecimiento y desarrollo (Erdal, Genisel, Turk, & Gorcek, 2012). Las hormonas sexuales de mamíferos (HSM), incluyendo la progesterona (P4), el estrógeno y la testosterona, constituyen otro grupo de esteroides. Estas hormonas tienen roles trascendentales en el proceso de desarrollo y la propagación, así como en el metabolismo de minerales y proteínas de los mamíferos (Erdal & Dumlupinar, 2010; 2011). Las hormonas esteroideas sexuales, como la P4, la estrona, el β-estradiol y la testosterona, estimulan el crecimiento, el desarrollo, la división celular, el alargamiento de raíces y tallos, y la polinización en las plantas, y tienen efectos deseables para hacer frente al estrés salino (Genisel, Turk, & Erdal, 2013; Metwally, Awad, Abou-Leila, Tayeb, & Habba, 2015; Rojek, Pawełko, Kapusta, Naczk, & Bohdanowicz, 2015).
Una función interesante de las HSM es su capacidad para mejorar la resistencia de las plantas a diversas tensiones abióticas (Erdal et al., 2012). Erdal y Dumlupinar (2011) informaron que el tratamiento con HSM alivió significativamente los impactos negativos del estrés salino al estimular la actividad de enzimas antioxidantes, como la superóxido dismutasa (SOD), peroxidasa y catalasa, y al aumentar el contenido de prolina. En otro estudio, se reveló que el tratamiento con HSM indujo sistemas antioxidantes y reacciones de síntesis, y redujo las especies reactivas de oxígeno (EOR) en plántulas de trigo (Erdal & Dumlupinar, 2011).
Dada la función especial del pasto azul de Kentucky en los paisajes y el impacto positivo del AS y la P4 en los daños por estrés salino en la mayoría de los trabajos experimentales, el objetivo del presente estudio fue evaluar el efecto del AS y la P4 sobre los parámetros fisiológicos y bioquímicos en pasto azul de Kentucky sometido a estrés por salinidad.
Materiales y métodos
El experimento se llevó a cabo en un invernadero (temperatura media día/noche de 25 °C, fotoperíodo de 16 h, radiación fotosintéticamente activa de 1,470 ± 11 μmol·m-2·s-1; humedad relativa de 50 %) ubicado en Chaharbagh, Karaj, Irán. Para ello, se estableció un experimento factorial, basado en un diseño de bloques completos al azar con cuatro repeticiones. Los tratamientos fueron salinidad en cuatro niveles (0, 2, 4 y 6 dS·m-1) y dos reguladores del crecimiento vegetal (P4 y AS) en seis niveles (control, 1 mg·L-1 de P4, 10 mg·L-1 de P4, 1 mM de AS, 3 mM de AS y 1 mg·L-1 de P4 + 1 mM de AS). El AS se obtuvo de Merck Group, Alemania, y los tratamientos con P4 se aplicaron sobre la base de pregnano-4-diona-3,20 (Sigma-Aldrich Corp., EUA).
Las semillas del pasto azul de Kentucky se obtuvieron de Iran Bazr Company y se sembraron en macetas de plástico de 25 × 35 cm. El sustrato fue una mezcla de 49 % de arena, 12 % de arcilla y 39 % de limo. La conductividad eléctrica (CE) en el tratamiento control (agua convencional) fue de 1,200 µS·cm-1. Dos meses después de la siembra y con riegos convencionales, se aplicaron los tratamientos de salinidad en un período de 40 días. Por su parte, los tratamientos con AS y P4 se aplicaron en tres fases (dos semanas antes de iniciar el estrés salino, dos semanas después de iniciar el estrés y cuatro semanas después del inicio del estrés).
Dentro de las variables evaluadas se determinó la calidad del pasto considerando su color, densidad y textura mediante el contenido de clorofila, así como la pérdida de electrolitos (PE). El contenido total de clorofila y los carotenoides foliares (Car) se determinaron a partir de la metodología propuesta por Arnof (1946) para muestras frescas y con ayuda de las siguientes ecuaciones:
donde V es el volumen de la solución infiltrada (sobrenadante tomado de la centrífuga), A es la absorción a 663, 645 y 470 nm y W es el peso fresco de la muestra (g). La tasa de absorción se registró con un lector de microplacas (ELX808, BioTek, EUA) a 663, 645, 470 y 520 nm.
El contenido de prolina (μM·g-1 de peso fresco) de las muestras de plantas se estimó por el método de Bates, Waldren, y Teare (1973), usando un espectrofotómetro (Z-2000, Hitachi Ltd., Japón) a 520 nm.
El malondialdehido (MDA) se determinó con el procedimiento descrito por Huang y Xu (2008), utilizando un lector de placa. La actividad enzimática de la ascorbato peroxidasa (APX) se estimó mediante la síntesis de formazán descrita por Mittler y Zilinskas (1993), con ligeras modificaciones; en la cual se determinó la capacidad de la APX para suprimir el ascorbato correspondiente mediante reducción de nitroazul de tetrazolio (NBT) en presencia de peróxido de hidrógeno (H2O2). Finalmente, para cuantificar la enzima superóxido dismutasa (SOD) se utilizó el método descrito por Beauchamp y Fridovich (1970), con algunas modificaciones.
Todas las variables se analizaron cada semana durante siete semanas y los resultados obtenidos se sometieron a un análisis de varianza y a una prueba de diferencias mínimas significativas de Fisher (P ≤ 0.05).
Resultados y discusión
Color y calidad aparente del pasto
El análisis de varianza mostró que los efectos simples y de interacción, del estrés salino y los reguladores del crecimiento vegetal (RCV), fueron significativos en el color y la calidad aparente del pasto en todos los momentos de medición (Cuadro 1). Bajo la influencia tanto de la salinidad como de los RCV, la calidad aparente se perdió con el tiempo (Cuadro 2). La comparación de medias reveló que la calidad aparente alcanzó su máximo en las semanas dos y siete, bajo la interacción del tratamiento de salinidad control (es decir, sin salinidad) con todos los niveles de tratamiento de los RCV, y su mínimo fue con la salinidad de 6 dS·m-1 y sin aplicación de RCV.
Cuadro 1 Análisis de varianza de la calidad aparente del pasto azul de Kentucky.
| Fuentes de variación | GL1 | Semana | ||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
| Réplica | 3 | 0.40* | 0.19 ns | 0.09 ns | 0.17 ns | 0.53 ns | 0.21 ns | 0.26 ns |
| Salinidad (A) | 3 | 5.90** | 15.36** | 24.79** | 34.69** | 48.36** | 76.96** | 100.39** |
| RCV (B) | 5 | 0.34* | 1.97** | 2.92** | 3.95** | 3.34** | 1.97** | 1.99** |
| AB | 15 | 0.30* | 0.49** | 0.59** | 0.94** | 0.74** | 1.45* | 0.39** |
| Error | 69 | 0.14 | 0.11 | 0.16 | 0.17 | 0.25 | 0.20 | 0.16 |
| Coeficiente de variación (%) | 4.55 | 4.19 | 5.25 | 5.63 | 7.16 | 7.01 | 6.59 | |
1GL = grados de libertad; * = significativo a P < 0.05; ** = significativo a P < 0.01; ns = no significativo.
Cuadro 2 Comparación de medias del efecto de la intereacción de la salinidad y los reguladores de crecimiento vegetal (RCV) sobre la calidad aparente del pasto.
| Salinidad | RCV | Semana | ||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
| Testigo | Testigo (sin RCV) | 9 az | 9 a | 9 a | 9 a | 9 a | 9 a | 9 a |
| 1 mg·L-1 P41 | 8.75 ab | 9 a | 9 a | 9 a | 9 a | 9 a | 9 a | |
| 10 mg·L-1 P4 | 9 a | 9 a | 9 a | 9 a | 9 a | 9 a | 9 a | |
| 1 mM AS | 9 a | 9 a | 9 a | 9 a | 9 a | 9 a | 9 a | |
| 3 mM AS | 9 a | 9 a | 9 a | 9 a | 9 a | 9 a | 9 a | |
| P4 + AS | 9 a | 9 a | 9 a | 9 a | 9 a | 9 a | 9 a | |
| 2 dS·m-1 | Testigo (sin RCV) | 8 cd | 7 e | 6.75 e-g | 6 f | 6 b-e | 5 ef | 5 c |
| 1 mg·L-1 P4 | 8.50 a-c | 7.75 bc | 7.75 bc | 7 c-e | 6 d-f | 5 ef | 5 c | |
| 10 mg·L-1 P4 | 8 cd | 7.50 cd | 7.25 c-e | 7.25 cd | 7 b | 6 bc | 6 b | |
| 1 mM AS | 8.50 a-c | 8 b | 8 b | 8 b | 7 b | 6 bc | 6 b | |
| 3 mM AS | 8.25 bc | 7.75 bc | 7.75 bc | 6.75 de | 6.25 c-e | 5.75 cd | 5.75 b | |
| P4 + AS | 8.50 a-c | 8 b | 8 b | 7.25 cd | 7 b | 6 bc | 6 b | |
| 4 dS·m-1 | Testigo (sin RCV) | 8 cd | 7 e | 6 hi | 5.25 g | 5 gh | 4.75 fg | 4.50 cd |
| 1 mg·L-1 P4 | 8 cd | 7.25 de | 7 d-f | 6.50 ef | 6.25 c-e | 5.50 c-e | 5 c | |
| 10 mg·L-1 P4 | 8.25 bc | 7.50 cd | 7.50 b-d | 7 c-e | 7 b | 6.50 b | 5.75 b | |
| 1 mM AS | 7.50 de | 7 e | 7 d-f | 6.50 ef | 6 d-f | 5.50 c-e | 5 c | |
| 3 mM AS | 8 cd | 7 b | 7.50 b-d | 7 c-e | 6.75 bc | 6 bc | 5.75 b | |
| P4 + AS | 8.25 bc | 7 b | 8 b | 7.50 bc | 6.75 bc | 5.75 cd | 5.75 b | |
| 6 dS·m-1 | Testigo (sin RCV) | 7 e | 6 f | 5.50 i | 5 g | 4.50 h | 4.25 g | 3.50 e |
| 1 mg·L-1 P4 | 8 cd | 7 e | 6.25 gh | 6 f | 5.75 ef | 5.25 e-f | 4.25 d | |
| 10 mg·L-1 P4 | 8 cd | 7.50 cd | 7.25 c-e | 7 c-e | 6.50 b-d | 5.50 c-e | 5 c | |
| 1 mM AS | 8 cd | 7 e | 6.50 f-h | 6 f | 5.50 fg | 4.75 fg | 4 de | |
| 3 mM AS | 8 cd | 7.75 bc | 7 d-f | 7 c-e | 6.25 c-e | 5.25 d-f | 4.50 cd | |
| P4 + AS | 8 cd | 8 b | 7.25 c-e | 7 c-e | 6.50 b-d | 5.50 c-e | 4.50 cd | |
1P4 = progesterona; AS = ácido salicílico. zMedias con la misma letra dentro de cada columna no difieren estadísticamente (Fisher, P ≤ 0.05).
El efecto negativo de la salinidad sobre la calidad del pasto se mostró a través de la pérdida del contenido de clorofila en hojas, como se ha informado en otras investigaciones (Borowski, 2018; Uddin & Juraimi, 2013). El efecto positivo del uso simultáneo de P4 y AS fue evidente en todas las semanas. Cuando estos reguladores de crecimiento se aplicaron simultáneamente, la calidad aparente del pasto se redujo con una pendiente más sutil (Cuadro 2). El aumento del color y verdor de las hojas puede atribuirse al incremento de densidad de células mesofílicas de las hojas y al mayor contenido de clorofila derivado de la aplicación de AS + P4. En otro estudio, la aplicación de AS alivió parcialmente los efectos negativos de la salinidad sobre la calidad aparente del pasto (Kurepin et al., 2017).
Se ha informado que la aplicación exógena de AS puede influir en un conjunto de procesos diferentes en las plantas, como la fotosíntesis y la tasa de crecimiento; además, puede mejorar la absorción de nutrientes bajo condiciones de salinidad, y esto puede incrementar el crecimiento (Arghavani, Savadkoohi, & Mortazavi, 2017). Por otro lado, Beiraghdar, Yazdanpoor, Naderi, y Zakerin (2014) mencionan que es posible que el AS aumente el contenido de clorofila en las hojas que están en el inicio de la senescencia.
Pérdida de electrolitos
La PE fue influenciada significativamente por los efectos tanto simples como de interacción de la salinidad y los RCV (Cuadro 3). De acuerdo con los resultados de la comparación de medias, la mayor PE se observó en el tratamiento con 6 dS·m-1 de salinidad y 3 mM de AS, mientras que la menor PE se obtuvo con el tratamiento de salinidad control y 10 mg·L-1 de P4, así como con el tratamiento de salinidad control y la combinación de ambos RCV (Figura 1). Estos resultados coinciden con los reportados por Lu et al. (2017) y Zhang, Wu, Ervin, Shang, y Harich (2018) en pastos y otras especies vegetales. En condiciones de estrés salino, la síntesis de radicales libres de oxígeno, que provoca la peroxidación de los ácidos grasos de la membrana y la sustitución del Na+ por Ca2+ en la membrana celular, incrementa la permeabilidad de la membrana y reduce su estabilidad, por lo que aumenta la PE. Es probable que el AS y la P4, que actúan como moléculas de señalización, mejoren la capacidad defensiva antioxidante de las plantas contra los daños de las EOR, lo que incrementa la estabilidad de la membrana y reduce la PE (Ahemad & Kibert, 2014). El leve o nulo efecto de los RCV sobre la PE bajo 6 dS·m-1 de salinidad puede atribuirse a que la tasa de pérdida fue demasiado alta.
Cuadro 3 Análisis de varianza de las características fisiológicas estudiadas en pasto azul de Kentucky.
| Fuentes de variación | GL1 | Pérdida de electrolitos | Carotenoides foliares | Clorofila total | Prolina | MDA | SOD | APX |
|---|---|---|---|---|---|---|---|---|
| Réplica | 3 | 3.61 ns | 0.004 ns | 0.140 ns | 27.44 ns | 11.99 ns | 2.82 ns | 0.53 ns |
| Salinidad (A) | 3 | 4011.84** | 0.241v** | 2.736** | 13146.94** | 1895.06** | 98.06** | 145.9** |
| RCV (B) | 5 | 60.91** | 0.007ns | 0.156* | 464.43** | 178.01** | 30.81** | 4.91** |
| AB | 15 | 14.43** | 0.010* | 0.123* | 860.01** | 51.91* | 36.49** | 9.29** |
| Error | 69 | 1.59 | 0.005 | 0.066 | 86.43 | 28.07 | 1.75 | 0.45 |
| Coeficiente de variación (%) | 3.17 | 17.03 | 15.08 | 11.12 | 11.18 | 14.66 | 11.83 |
1GL = grados de libertad; MDA = malondialdehido; SOD = superóxido dismutasa; APX = ascorbato peroxidasa. * = significativa a P < 0.05; ** = significativa a P < 0.01; ns = no significativa.

Figura 1 Comparación de medias del efecto de la interacción de la salinidad y los reguladores del crecimiento vegetal sobre la pérdida de electrolitos. P4 = progesterona; AS = ácido salicílico. zMedias con la misma letra entre tratamientos de salinidad no difieren estadísticamente (Fisher, P ≤ 0.05).
Carotenoides foliares
El análisis de varianza reveló que el efecto simple de la salinidad y su interacción con los RCV indujo diferencias significativas en el contenido de carotenoides foliares (Cuadro 3). Los datos de la comparación de medias de la interacción salinidad × RCV indicaron que el tratamiento con 6 dS·m-1 de salinidad y sin RCV causó el menor contenido de carotenoides foliares, y el tratamiento sin salinidad y con AS + P4 presentó el mayor contenido de carotenoides foliares. La aplicación de AS y P4 en pastos expuestos a salinidad incrementó significativamente el contenido de carotenoides en comparación con las plantas no tratadas con estos reguladores (Figura 2). Taibi et al. (2016) mencionan que la salinidad reduce el contenido de carotenoides en 20 %. Asimismo, Idrees, Khan, Aftab, Naeem, y Hashmi (2010) señalan que la aplicación de reguladores de crecimiento incrementa los pigmentos de las plantas, tanto bajo condiciones estresantes como normales. De acuerdo con Chaparzadeh y Hosseinzad-Behboud (2015), la aplicación de AS bajo estrés por salinidad incrementa los carotenoides foliares.

Figura 2 Comparación de medias del efecto de la interacción de la salinidad y los reguladores del crecimiento vegetal sobre los carotenoides foliares. P4 = progesterona; AS = ácido salicílico. zMedias con la misma letra entre tratamientos de salinidad no difieren estadísticamente (Fisher, P ≤ 0.05).
Clorofila total
El contenido total de clorofila fue influenciado significativamente por los efectos simples y de interacción de la salinidad y de los RCV (Cuadro 3). La comparación de medias reveló que el contenido total de clorofila más alto y más bajo se observó en las plantas tratadas con 2 dS·m-1 de salinidad y 10 mg·L-1 de P4, y en aquellas tratadas con 6 dS·m-1 de salinidad y sin reguladores de crecimiento, respectivamente (Figura 3), aunque no difirieron significativamente de otros tratamientos. En general, el estrés salino redujo el contenido total de clorofila. La pérdida de pigmentos fotosintéticos en plantas con estrés por salinidad podría estar asociada, principalmente, con la degradación de la estructura del cloroplasto y del sistema de fotosíntesis, la foto-oxidación de las clorofilas y su reacción con radicales de oxígeno, la destrucción de precursores de la síntesis de clorofila, la inhibición de la biosíntesis de nuevas clorofilas, la activación de enzimas oxidantes de la clorofila (como la clorofilasa) y los trastornos hormonales (Grzeszczuk, Salachna, & Meller, 2018; Stepien & Klobus, 2006; Taiz & Zeiger, 2009). No obstante, la acumulación de Na+ y Cl- en las hojas bajo estrés salino tiene algún impacto negativo en el contenido de clorofila (Stepien & Klobus, 2006). Arghavani et al. (2017) mencionan que la aplicación de AS mejora el contenido total de clorofila bajo salinidad, y este efecto fue más evidente con 80 mM de salinidad.
Prolina
El análisis de varianza mostró un efecto altamente significativo entre los tratamientos simples y de interacción de la salinidad y los RCV sobre el contenido de prolina (Cuadro 3). La comparación de medias sugirió que la salinidad a 6 dS·m-1 y AS + P4 resultó en el contenido más alto de prolina, mientras que el nulo estrés por salinidad (testigo) y la aplicación de AS + P4 resultó en el contenido más bajo (Figura 4). El contenido de prolina foliar incrementó con el nivel de salinidad; sin embargo, existieron diferencias leves entre los diferentes niveles de RCV. El incremento en el nivel de prolina bajo estrés por salinidad está relacionado con que la prolina es un osmolito compatible que elimina el oxígeno libre sintetizado durante el estrés ambiental y protege las macromoléculas (Rahdari, Tavakoli, & Hosseini, 2012). Los resultados del presente trabajo mostraron que con altos niveles de salinidad, la aplicación simultánea de AS y P4 fue la más efectiva en el contenido de prolina, lo cual coincide con otras investigaciones (Abdul-Qados, 2015; Agamy, Hafez, & Taha, 2013). El impacto de los RCV sobre la acumulación de prolina puede aumentar el metabolismo de la prolina. Se ha observado que bajo condiciones de salinidad existe un aumento en la actividad de las enzimas biosintéticas de prolina, pirrolina5-carboxilato reductasa y gamma-glutamil quinasa, lo que resulta en un alto contenido de prolina (Misra, Misra, & Singh, 2010).
Malondialdehido
De acuerdo con los resultados del análisis de varianza, el efecto simple de la salinidad y los RCV, así como su interacción, tuvieron un efecto significativo sobre el MDA (Cuadro 3). El mayor MDA se obtuvo con 6 dS·m-1 de salinidad y sin aplicación de RCV, y el menor MDA, con la nula salinidad (testigo) y la aplicación simultánea de AS y P4. Los diferentes niveles de estrés salino aumentaron el MDA entre un 12 y 50 % (Figura 5). Li et al. (2014) reportaron un aumento de entre 13 y 45 % en el MDA con el incremento en la salinidad. Asimismo, los resultados mostraron que los RCV redujeron el MDA de pastos expuestos a salinidad (Figura 5); es decir, los RCV aliviaron el daño causado por la salinidad en las células, lo cual puede deberse a la reducción de los efectos destructivos de los radicales libres por parte del AS. Estos resultados son consistentes con los reportados por Wang, Yang, Zhang, y Li (2009). En todos los niveles de estrés salino, el contenido de MDA fue menor con 10 mM de P4 que con 1 mM de P4, lo cual indica el efecto deseable de la P4 en la reducción de los efectos destructivos del estrés salino (Figura 5). Al parecer, la P4 obstaculiza la oxidación de la grasa al eliminar los radicales libres, lo que inhibe el incremento del MDA. Erdal et al. (2012) mostraron que la aplicación de P4 en condiciones de salinidad redujo el contenido de MDA en semillas de frijol.
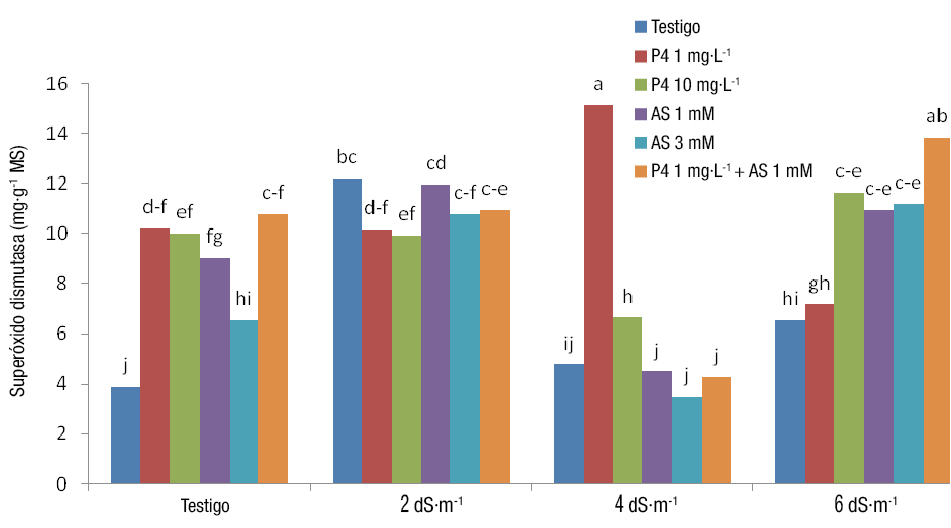
Superóxido dismutasa
El análisis de varianza mostró que los efectos simples y de interacción, de la salinidad y los RCV, fueron significativos en la actividad de la SOD (Cuadro 3). La mayor actividad de la SOD (15.14 mg·g-1 de proteína en base seca) se obtuvo en plantas expuestas a 4 dS·m-1 de salinidad y 1 mg·L-1 de P4, mientras que la menor actividad se observó con la exposición a 4 dS·m-1 de salinidad y 3 mM de AS (Figura 6). Los aniones superóxido sintetizados por las plantas bajo salinidad aumentan la respiración celular y la producción de iones destructivos en la mitocondria. En estas condiciones, la enzima SOD, como una enzima de destrucción de iones superóxido, presenta un incremento (Fikret, Manar, Şebnem, Şebnem, Şebnem, & Ozlem, 2013). En el presente trabajo se observó que la aplicación foliar de AS y P4 incrementó la actividad de la SOD, lo cual resulta en una mayor desintoxicación de superóxidos y alivia los daños en las plantas. Al parecer, la P4 y el AS están involucrados en la reducción de los efectos destructivos de la salinidad, de modo que mejoran la resistencia a la salinidad al aumentar la actividad enzimática. Shahmoradi y Naderi (2018) informaron que la aplicación de AS moderó los efectos negativos de la salinidad al reducir el estrés oxidativo que se genera mediante el incremento de la actividad de las enzimas antioxidantes. Erdal y Dumlupinar (2010) reportaron que la aplicación de P4 resultó en una alta actividad de la SOD en chícharos.
Ascorbato peroxidasa
Los efectos simples y de interacción, de la salinidad y los RCV, fueron significativos en la APX (Cuadro 3). La APX más alta se obtuvo con el uso simultáneo de AS y P4 más 6 dS·m-1 de salinidad, mientras que la actividad más baja se presentó con el tratamiento control y 1 mg de P4 (Figura 7). El AS y la P4 estimulan, directa o indirectamente, la síntesis de enzimas antioxidantes como la peroxidasa, lo que contribuye a la eliminación de las EOR sintetizadas durante el estrés. Lo anterior debido a que dichas enzimas pueden actuar como sustrato del donador de electrones para la peroxidasa y desempeñar un papel en la mitigación del estrés (Erdal & Dumlupinar, 2010; Shahmoradi & Naderi, 2018). Es evidente, a partir de estos resultados, que el estrés salino conduce al estrés oxidativo, el cual es responsable del incremento de la actividad de las enzimas antioxidantes. Estas enzimas desintoxicantes mitigan el estrés y eliminan las cantidades excesivas de H2O2. Asimismo, al estimular las enzimas antioxidantes en condiciones de estrés, el AS crea un sistema de alivio del estrés en las plantas (Morsi, Abdelmigid, & Aljoudi, 2018). El estrés salino provocó el aumento de la actividad de la APX, lo cual coincide con lo reportado por Ma, Zheng, Zhang, Hu, y Qian (2017), quienes obtuvieron un incremento de entre 8 y 50 % en la actividad de la APX bajo salinidad.
Conclusiones
El estrés salino en la primera semana no tuvo un efecto significativo sobre los rasgos cualitativos del pasto; sin embargo, en las semanas posteriores se observó un impacto visible en la calidad aparente de los pastos. La mayor salinidad redujo la calidad del pasto en un 60 % en comparación con la primera semana. El incremento de la salinidad (6 dS·m-1) implicó una notable pérdida de calidad del pasto, la cual disminuyó entre 10 y 55 % en comparación con el testigo. No obstante, la aplicación de AS y P4 fue útil para la supervivencia del pasto y la mejora de su calidad bajo estrés salino. La mayoría de los rasgos fisiológicos registrados fueron influenciados por la aplicación simultánea del AS y la P4, los cuales tienen efectos distintos. Con base en estos resultados, el pasto azul de Kentucky se puede cultivar en condiciones salinas, pero su crecimiento y desarrollo serán disminuidos. Sin embargo, los efectos perjudiciales pueden aminorarse, en gran medida, con la aplicación de P4 y AS. La aplicación de estos compuestos no implica una pesada carga financiera.
References
Abdul-Qados, A. M. S. (2015). Effects of salicylic acid on growth, yield and chemical contents of pepper (Capsicum annuum L.) plants grown under salt stress conditions. International Journal of Agriculture and Crop Science, 8(2), 107-113. Retrieved from https://pdfs.semanticscholar.org/3523/5c256f66b2413e94493d6ab5c575cfc8caca.pdf [ Links ]
Agamy, R. A., Hafez, E. E., & Taha, T. H. (2013). Acquired resistant motivated by salicylic acid applications on salt stressed tomato (Lycopersicon esculentum Mill.). American-Eurasian Journal of Agricultural and Environmental Sciences, 13(1), 50-57. doi: 10.5829/idosi.aejaes.2013.13.01.1881 [ Links ]
Ahemad, M., & Kibert, M. (2014). Mechanisms and applications of plant growth promoting rhizobacteria: current perspective. Journal of King Saud University-Science, 26(1), 1-20. doi: 10.1016/j.jksus.2013.05.001 [ Links ]
Arghavani, M., Savadkoohi, S., & Mortazavi, N. (2017). Salinity tolerance of Kentucky bluegrass as affected by salicylic acid. Journal of Ornamental Plants, 7(4), 237-245. Retrieved from http://jornamental.iaurasht.ac.ir/article_537041.html [ Links ]
Arnof, S. (1946). Photochemical reduction of chloroplast grana. Plant Physiology, 21(4), 393-409. doi: 10.1104/pp.21.4.393 [ Links ]
Bates, L. S., Waldren, R. P., & Teare, I. D. (1973). Rapid determination of free proline for water stress studies. Plant and Soil, 39(1), 205-207. doi: 10.1007/bf00018060 [ Links ]
Beauchamp, C., & Fridovich, I. (1970). Superoxide dismutase: improved assays and an assay applicable to acrylamide gels. Analytical Biochemistry, 44(1), 276-287. doi: 10.1016/0003-2697(71)90370-8 [ Links ]
Beiraghdar, M., Yazdanpoor, S., Naderi, D., & Zakerin, A. (2014). The effects of various salicylic acid treatments on morphological and physiological features of zoysia grass (Zoysia species). Journal of Novel Applied Sciences, 3(9), 984-987. Retrieved from http://jnasci.org/wp-content/uploads/2014/09/984-987.pdf [ Links ]
Belkhadi, A., Hediji, H., Abbes, Z., Nouari, I., Barhoumi, Z., & Zarrouk, M. (2010). Effects of exgenous salicylic acid pre-treatment on cadmium toxicity and leaf lipid content in Linum usitatissimum L. Ecotoxicology and Environmental Safety, 73(5), 1004-1011. doi: 10.1016/j.ecoenv.2010.03.009 [ Links ]
Borowski, E. (2018). Studies on the sensitivity of some species and cultivars of lawn grasses on salinity with sodium chloride during the seed germination and first year of growth. Folia Horticulturae, 20(1), 81-98. doi: 10.2478/fhort-2013-0108 [ Links ]
Bushman, B. S., Amundsen, K. L., Warnke, S. E., Robins, J. G., & Johnson, P. G. (2016). Transcriptome profiling of Kentucky bluegrass (Poa pratensis L.) accessions in response to salt stress. BMC Genomics, 17(1), 48-60. doi: 10.1186/s12864-016-2379-x [ Links ]
Chaparzadeh, N., & Hosseinzad-Behboud, E. (2015). Evidence for enhancement of salinity induced oxidative damages by salicylic acid in radish (Raphanus sativus L.). Journal of Plant Physiology and Breeding, 5(1), 23-33. Retrieved from https://journals.tabrizu.ac.ir/article_3794_1cc35ce46ec0178153a6cbb690b4f927.pdf [ Links ]
Erdal, S., & Dumlupinar, R. (2010). Progesterone and β-estradiol stimulate seed germination in chickpea by causing important changes in biochemical parameters. Zeitschrift für Naturforschung C, 65(3-4), 239-244. doi: 10.1515/znc-2010-3-412 [ Links ]
Erdal, S., & Dumlupinar, R. (2011). Mammalian sex hormones stimulate antioxidant system and enhance growth of chickpea plants. Acta Physiologiae Plantarum, 33(3), 1011-1017. doi: 10.1007/s11738-010-0634-3 [ Links ]
Erdal, S., Genisel, M., Turk, H., & Gorcek, Z. (2012). Effects of progesterone application on antioxidant enzyme activities and K+/Na+ ratio in bean seeds exposed to salt stress. Toxicology and Industrial Health, 28(10), 942-946. doi: 10.1177/0748233711430975 [ Links ]
Fikret, Y., Manar T., Şebnem, E., Şebnem, K., & Ozlem U. (2013). SOD, CAT, GR and APX enzyme activities in callus tissues of susceptible and tolerant eggplant varieties under salt stress. Research Journal of Biotechnology, 8(11), 45-51. Retrieved from https://www.researchgate.net/publication/262335700_SOD_CAT_GR_and_APX_Enzyme_Activities_in_Callus_Tissues_of_Susceptible_and_Tolerant_Eggplant_Varieties_under_Salt_Stress [ Links ]
Genisel, M., Turk, H., & Erdal, S. (2013). Exogenous progesterone application protects chickpea seedlings against chilling-induced oxidative stress. Acta Physiologiae Plantarum, 35(1), 241-251. doi: 10.1007/s11738-012-1070-3 [ Links ]
Gezi, L., Peng, X., Wei, L., & Kang, G. (2013). Salicylic acid increases the contents of glutathione and ascorbate and temporally regulates the related gene expression in salt-stressed wheat seedlings. Gene, 529(2), 321-325. doi: 10.1016/j.gene.2013.07.093 [ Links ]
Grzeszczuk, M., Salachna, P., & Meller, E. (2018). Changes in photosynthetic pigments, total phenolic content, and antioxidant activity of salvia coccinea Buc'hoz ex Etl. induced by exogenous salicylic acid and soil salinity. Molecules, 23(6), 1296. doi: 10.3390/molecules23061296 [ Links ]
Huang, B., & Xu, C. (2008). Identification and characterization of proteins associated with plant tolerance to heat stress. Journal of Integrative Plant Biology, 50(10), 1230-1237. doi: 10.1111/j.1744-7909.2008.00735.x [ Links ]
Idrees, M., Khan, M. M., Aftab, T., Naeem, M., & Hashmi, N. (2010). Salicylic acid induced physiological and biochemical changes in lemongrass varieties under water stress. Journal of Plant Interactions, 5(4), 293-303. doi: 10.1080/17429145.2010.508566 [ Links ]
Janda, K., Hidog, E. Szalai, G., Kovacs, L., & Janda, T. (2012). Salicylic acid may indirectly influence the photosynthetic electron transport. Journal of Plant Physiology, 169(10), 971-978. doi: 10.1016/j.jplph.2012.02.020 [ Links ]
Kurepin, L. V., Ivanov, A. G., Zaman, M., Pharis, R. P., Hurry, V., & Hüner, N. P. (2017). Interaction of glycine betaine and plant hormones: protection of the photosynthetic apparatus during abiotic stress. In: Hou, H., Najafpour, M., Moore, G., & Allakhverdiev, S. (Eds), Photosynthesis: Structures, Mechanisms, and Applications (pp. 185-202). Cham: Springer. doi: 10.1007/978-3-319-48873-8_9 [ Links ]
Li, T., Hu, Y., Du, X., Tang, H., Shen, C., & Wu, J. (2014). Salicylic acid alleviates the adverse effects of salt stress in Torreya grandis cv. Merrillii seedlings by activating photosynthesis and enhancing antioxidant systems. PLoS ONE, 9(10), e109492. doi: 10.1371/journal.pone.0109492 [ Links ]
Loutfy, N., El-Tayeb, M. A., Hassanen, A. M., Sakuma, Y., & Inouhe, M. (2012). Changes in the water status and osmotic solute contents in response to drought and salicylic acid treatments in four different cultivars of wheat (Triticum aestivum). Journal of Plant Research, 125(1), 173-184. doi: 10.1007/s10265-011-0419-9 [ Links ]
Lu, S., Peng, X., Guo, Z., Wang, Z., Wang, C., Pang, C., Fan, Z., & Wang, J. (2007). In vitro selection of salinity tolerant variants from triploid bermudagrass (Cynodon transvaalensis × C. dactylon) and their physiological responses to salt and drought stress. Plant Cell Reports, 26(8), 1413-1420. doi: 10.1007/s00299-007-0339-2 [ Links ]
Ma, X., Zheng, J., Zhang, X., Hu, Q., & Qian, R. (2017). Salicylic acid alleviates the adverse effects of salt stress on Dianthus superbus (Caryophyllaceae) by activating photosynthesis, protecting morphological structure, and enhancing the antioxidant system. Frontiers in Plant Science, 8, 600. doi: 10.3389/fpls.2017.00600 [ Links ]
Metwally, M. A., Awad, A., Abou-Leila, B., Tayeb, T., & Habba, I. (2015). Studies on the effect of gamma, laser irradiation and progesterone treatments on gerbera leaves. European Biophysics Journal, 3(6), 43-50. doi: 10.11648/j.ejb.20150306.11 [ Links ]
Misra, N., Misra, R., & Singh, O. P. (2010). Effect of exogenous application of salicylic acid on proline metabolism in salt stressed Chamomile recutita. Nigerian Journal of Technological Research, 5, 30-45. doi: 10.4314/njtr.v5i0.90312 [ Links ]
Mittler, R., & Zilinskas, B. A. (1993). Detection of ascorbate peroxidase activity in native gels by inhibition of the ascorbate-dependent reduction of nitroblue tetrazolium. Analytical Biochemistry, 212(2), 540-546. doi: 10.1006/abio.1993.1366 [ Links ]
Morsi, M., Abdelmigid, H. M., & Aljoudi, N. G. (2018). Exogenous salicylic acid ameliorates the adverse effects of salt stress on antioxidant system in Rosmarinus officinalis L. Egyptian Journal of Botany, 58(2), 249-263. doi: 10.21608/ejbo.2018.1772.1124 [ Links ]
Rahdari, P., Tavakoli, S., & Hosseini, S. M. (2012). Studying of salinity stress effect on germination, proline, sugar, protein, lipid and chlorophyll content in purslane (Portulaca oleracea L.) leaves. Journal of Stress Physiology and Biochemistry, 8(1), 182-193. Retrieved from https://www.researchgate.net/publication/228453234_Studying_of_Salinity_Stress_Effect_on_Germination_Proline_Sugar_Protein_Lipid_and_Chlorophyll_Content_in_Purslane_Portulaca_oleracea_L_Leaves [ Links ]
Rojek, J., Pawełko, L., Kapusta, M., Naczk, A., & Bohdanowicz, J. (2015). Exogenous steroid hormones stimulate full development of autonomous endosperm in Arabidopsis thaliana. Acta Societatis Botanicorum Poloniae, 84(2), 287-301. doi: 10.5586/asbp.2015.022 [ Links ]
Shahmoradi, H., & Naderi, D. (2018). Improving effects of salicylic acid on morphological, physiological and biochemical responses of salt-imposed winter jasmine. International Journal of Horticultural Science and Technology, 5(2), 219-230. doi: 10.22059/IJHST.2018.259507.246 [ Links ]
Stepien, P., & Klobus, G. (2006). Water relations and photosynthesis in Cucumis sativus L. leaves under salt stress. Biologia Plantarum, 50, 610-616. doi: 10.1007/s10535-006-0096-z [ Links ]
Taibi, K., Taibi, F., Abderrahim, L. A., Ennajahb, A., Belkhodja, M., & Mulet, J. M. (2016). Effect of salt stress on growth, chlorophyll content, lipid peroxidation and antioxidant defense systems in Phaseolus vulgaris L. South African Journal of Botany, 105, 306-312. doi: 10.1016/j.sajb.2016.03.011 [ Links ]
Taiz, L., & Zeiger, E. (2009). Plant physiology. Massachusetts: Sinauer. [ Links ]
Torgeon, A. L. (2008). Turfgrass management. New Jersey: Prentice- Hall, Englewood Cliffs. [ Links ]
Uddin, M. D., & Juraimi, A. S. (2013). Salinity tolerance turfgrass: History and prospects. The Scientific World Journal, 2013, 1-6. doi: 10.1155/2013/409413 [ Links ]
Wang, Y., Yang, Z., Zhang, Q., & Li, J. (2009). Enhanced chilling tolerance in Zoysia matrella by pre-treatment with salicylic acid, calcium chloride, hydrogen peroxide or 6-benzylaminopurine. Biologia Plantarum, 53(1), 179-182. doi: 10.1007/s10535-009-0030-2 [ Links ]
Zhang, X., Wu, W., Ervin, E., Shang, C., & Harich, K. (2018). Salt stress-induced injury is associated with hormonal alteration in Kentucky bluegrass. HortScience, 53(1), 97-101. doi: 10.21273/hortsci12413-17 [ Links ]
Recibido: 11 de Julio de 2019; Aprobado: 07 de Diciembre de 2019











 text in
text in