Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo. Serie horticultura
On-line version ISSN 2007-4034Print version ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.24 n.3 Chapingo Sep./Dec. 2018
https://doi.org/10.5154/r.rchsh.2017.07.027
Fertilización mineral y biofertilización en parámetros fisiológicos de la orquídea Laelia anceps subesp. anceps
1Colegio de Postgraduados. Carretera México-Texcoco km 36.5, Montecillo, México, C. P. 56230, MÉXICO.
2Universidad Autónoma Chapingo, Departamento de Fitotecnia. Carretera México-Texcoco km 38.5, Chapingo, México, C. P. 56230, MÉXICO.
El uso de biofertilizantes en el cultivo de orquídeas puede ser una alternativa para reducir el impacto ambiental de la fertilización inorgánica tradicional. El objetivo de la presente investigación fue evaluar el efecto de la fertilización mineral y la biofertilización en algunos parámetros fisiológicos de plántulas de Laelia anceps Lindl. subesp. anceps en etapa vegetativa. Se evaluaron tres tratamientos de fertilización: 1) fertilización mineral (FM), 2) biofertilización (BFERT) y 3) fertilización mineral + biofertilización (FM + BFERT). Se midió la concentración y el contenido de clorofilas, la concentración de aminoácidos y de proteínas solubles totales. Ningún tratamiento afectó la concentración de clorofilas en hojas. De manera general, los tratamientos FM y BFERT incrementaron significativamente la concentración de clorofilas a, b y totales en pseudobulbo, y su contenido en hojas y en pseudobulbos. La concentración de aminoácidos en pseudobulbo fue mayor con FM, mientras que la concentración de proteínas en hoja fue mayor con FM + BFERT. La biofertilización promovió respuestas positivas en los parámetros fisiológicos evaluados en comparación con la fertilización mineral; por lo que se considera que tiene potencial de uso en la especie evaluada en este estudio.
Palabras clave: aminoácidos; clorofila; Orchidaceae; proteínas
The use of biofertilizers in orchid growing can be an alternative to reduce the environmental impact of traditional inorganic fertilization. The aim of this research was to evaluate the effect of mineral fertilization and biofertilization on some physiological parameters of Laelia anceps Lindl. subsp. anceps seedlings in vegetative stage. Three fertilization treatments were evaluated: 1) mineral fertilization (MF), 2) biofertilization (BFERT) and 3) mineral fertilization + biofertilization (MF + BFERT). The concentration and content of chlorophylls, and the concentration of amino acids and total soluble proteins were measured. No treatment affected the concentration of chlorophylls in leaves. In general, the MF and BFERT treatments significantly increased the concentration of chlorophylls a, b and total in pseudobulbs, and their content in leaves and pseudobulbs. The concentration of amino acids in pseudobulbs was higher with MF, while the concentration of proteins in leaves was greater with MF + BFERT. Biofertilization promoted positive responses in the physiological parameters evaluated in comparison with mineral fertilization; therefore, it is considered to have potential for use in the species evaluated in this study.
Keywords: amino acids; chlorophyll; Orchidaceae; proteins
Introducción
De las 25,000 especies de orquídeas en el mundo, México alberga alrededor de 1,260 pertenecientes a 170 géneros (Hágsater et al., 2005); no obstante, es necesario impulsar el conocimiento de su manejo para fomentar la introducción de estas plantas nativas en la floricultura mexicana.
Las orquídeas representan alrededor del 10 % del comercio internacional de flores, con un valor comercial, de 2007 a 2012, de US $483 millones; asimismo, en 2012 se registraron más de 40 países exportadores y 60 importadores de orquídeas con un valor global de US $504 millones (Lakshman, Pathak, Rao, & Rajeevan, 2014). Este volumen de producción implica costos de diversa índole, dentro de los que se encuentran los fertilizantes y los costos generados por su aplicación. Por ello, la horticultura ornamental, al igual que cualquier actividad agrícola, requiere del uso racional de fertilizantes químicos y el empleo de fuentes alternativas a éstos para hacerla más amigable con el ambiente (Daughtrey & Benson, 2005), como el caso de los biofertilizantes (Boraste et al., 2009).
Si bien existen estudios sobre el uso de los fertilizantes minerales en la nutrición de orquídeas (Bichsel & Starman, 2008; Wang, 2000; Wang, 1996; Zong-min, Ning, Shu-yun, & Hong, 2012), hay pocos específicos y se desconoce la forma de aplicación de muchos otros. Entre las ventajas del uso eficiente de los fertilizantes se encuentran la estimulación del crecimiento vegetativo, el aumento de la precocidad en la floración y la promoción de la relación simbiótica con hongos micorrízicos (Espinosa-Moreno, Gaytán-Acuña, Becerril-Román, Contreras, & Trejo-López, 2000).
Por otra parte, se ha reportado la efectividad del uso de biofertilizantes en plantas ornamentales (Abbasniayzare, Sedaghathoor, & Dahkaei, 2012; El-Sayed, Shahin, & Zaky, 2012; Scagel, 2003); sin embargo, la información acerca de su uso en orquídeas es escasa. Un biofertilizante se define como una sustancia que contiene organismos vivos, que cuando se aplica en la superficie de la planta o al suelo colonizan la rizósfera o el interior de los tejidos de la planta y promueven su crecimiento mediante el incremento de la oferta o disponibilidad de nutrimentos (Amanullah, Kurd, Khan, Ahmed, & Khan, 2012; Youssef & Eissa, 2014). Entre los microorganismos presentes en un biofertilizante destacan los hongos micorrízicos arbusculares (HMA) y las rizobacterias promotoras del crecimiento vegetal (PGPR) (Boraste et al., 2009).
Dentro de los factores que determinan la calidad fisiológica de las plantas se encuentran aquellos relacionados con la fotosíntesis (fluorescencia de pigmentos fotosintéticos, conductancia estomática, tasa de fotosíntesis, concentración de clorofilas, etc.), concentración de nutrimentos y azúcares de reserva, entre otros (Villar, 2003). Asimismo, algunos autores reportan que uno de los nutrimentos más importantes es el nitrógeno, ya que interviene en la formación de aminoácidos, proteínas y otros constituyentes celulares (Trejo-Téllez, Gómez, Rodríguez, & Alcántar, 2005). Ling y Subramaniam (2007) analizaron el contenido de clorofilas y proteínas en Phalaenopsis violacea (Orchidaceae) para determinar aspectos de calidad en el cultivo de tejidos, con propósitos de mejoramiento. Hew y Yong (1994) reportaron un análisis de crecimiento y fotosíntesis, en donde incluyeron contenido de clorofilas en Oncidium ‘Goldiana’, un híbrido usado para la industria de la flor de corte.
Por lo anterior, el objetivo del presente trabajo fue evaluar el efecto de la fertilización mineral y la biofertilización en algunos parámetros fisiológicos de plántulas de Laelia anceps Lindl. subesp. anceps en etapa vegetativa.
Materiales y métodos
La presente investigación se realizó en condiciones de invernadero en el Colegio de Posgraduados, Campus Montecillo. Se utilizaron plántulas de Laelia anceps Lindl. subesp. anceps de dos años de edad, a partir de su propagación in vitro por semilla, y con tamaño promedio de 8 cm de altura. El trasplante se realizó de charolas a contenedores de plástico opacos de 340 mL, que contenían una mezcla de corteza de pino y perlita, en proporción 75:25 (%, v/v) con tamaño de partícula de 4 a 6 y 2 a 3 mm, respectivamente.
Soluciones nutritivas. Se aplicaron diferentes soluciones nutritivas durante el riego, las cuales se formularon a partir de distintas fuentes de nutrimentos (Cuadro 1).
Cuadro 1 Fuentes de macronutrimentos usadas en la elaboración de soluciones nutritivas.
| Fertilización mineral | Biofertilización |
|---|---|
| Peters Proffesional® 30-10-10 CaSO4·2H2O MgSO4·7H2O |
Nutro nitrógeno® Nutro fósforo® Nutro potasio® Nutro calcio® |
Tratamientos. 1) Solución nutritiva formulada a partir de fertilización mineral (FM), 2) biofertilización (BFERT), 3) biofertilización como fuente principal de la solución complementada con minerales (FM + BFERT) y 4) plantas testigo regadas con agua destilada (TEA). Los tratamientos 1 a 3 se complementaron con micronutrimentos.
Los nutrimentos y su concentración (mg·L-1), en las soluciones de los tratamientos 1 a 3, fueron: N (225), P (75), K (75), Ca (25), Mg (12.5), Fe (1.9), Cu (0.375), Zn (0.75), Mn (0.37) y B (0.15). Adicionalmente, la biofertilización (tratamientos 2 y 3) contenía: ácidos húmicos (15 %), aminoácidos (0.64 %), ácido indol-3-butírico (98 mg·L-1), Bacillus subtilis (200 x 10⁵ UFC·L-1), Azospirillum brasilensis (40 x 10⁵ UFC·L-1) y Glomus intraradices (6,000 esporas·g-1).
El pH de las soluciones se ajustó a 5.5 con H2SO2 al 1 N, para lo cual se usó un potenciómetro portátil (PC18, Conductronic, México). La aplicación de las soluciones nutritivas (30 mL por contenedor) se realizó semanalmente a partir de la tercera semana del trasplante. La espacialidad de la aplicación se fundamentó en el tamaño de las plántulas en estudio, tamaño del contenedor, cantidad de N en las soluciones nutritivas, observaciones específicas de la especie (material silvestre, no adaptado a cultivo ornamental y raíces sensibles a la salinidad) y en recomendaciones de intervalos de fertilización en orquídeas (Chang, Wu, & Hsieh, 2010; Lima-do Amaral et al., 2010; Rodrigues, Ferreira-Novais, Alvarez, Moreira-Dias, & de Albuquerque-Villan, 2010; American Orchid Society, 2017). Posterior a cada fertilización, se hicieron tres riegos semanales con 200 mL de agua cada uno para evitar acumulación de sales y desecación en el sustrato.
Variables de estudio. Tanto en hojas como en pseudobulbos se evaluó la concentración y contenido de clorofilas, concentración de aminoácidos y proteínas solubles totales.
Concentración de clorofilas a, b y totales (mg·g-1 de peso fresco [PF]). Se determinó por el método de Harborne (1973). La lectura de las muestras se realizó en un espectrofotómetro (Genesys 10 UV, Thermo Fisher Scientific, USA) con una absorbancia de 663 y 645 nm.
Contenido de clorofila a, b y totales (mg·planta-1). Se estimó a partir de los valores de concentración obtenidos de cada biomolécula en hojas y pseudobulbos, y considerando los pesos de materia fresca de estos órganos por planta.
Concentración de aminoácidos solubles totales (μM·g-1 PF). Se determinaron mediante extracción etanólica (Geiger et al., 1998) con el método de la ninhidrina (Moore & Stein, 1954). Se utilizó leucina para elaborar la curva patrón a una concentración de 0 a 250 mM. Los extractos se leyeron en un espectrofotómetro (Genesys 10 UV, Thermo Fisher Scientific, USA) a 570 nm.
Concentración de proteínas solubles totales (μg·g-1 PF). La extracción de proteínas se realizó en hojas y pseudobulbos al momento del corte, de acuerdo con lo descrito por Höfner, Vázquez-Moreno, Abou-Mandour, Bohnert, y Schmitt (1989).
El experimento se estableció bajo un diseño completamente al azar con 15 repeticiones. La unidad experimental constó de un contenedor con una planta. Con los datos obtenidos se realizó un análisis de varianza con el paquete estadístico Statistical Analysis System (SAS Institute, 2010), y una comparación de medias de Tukey (P ≤ 0.05).
Resultados y discusión
Concentración y contenido de clorofilas
La concentración de clorofila a en pseudobulbo fue significativamente mayor (P = 0.007) en los tratamientos FM y BFERT, en comparación con FM + BFERT. Una tendencia similar se presentó en la clorofila b (P = 0.048) y clorofilas totales (P = 0.020) (Figura 1A). En hoja, los tratamientos de fertilización aplicados no presentaron diferencias estadísticas significativas entre tratamientos en los diferentes tipos de clorofila: a (P = 0.360), b (P = 0.125) y total (P = 0.161) (Figura 1A).
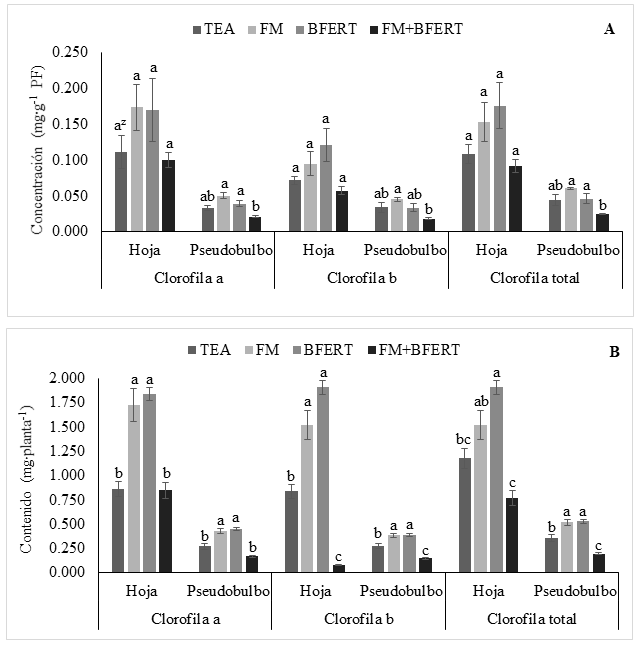
Figura 1 Concentración (A) y contenido (B) de clorofilas a, b y totales en hojas y pseudobulbos de Laelia anceps subesp. anceps al final del experimento, con diferentes tratamientos de fertilización: TEA = testigo, FM = fertilización mineral, BFERT = biofertilización y FM + BFERT = fertilización mineral complementado con biofertilización, PF = peso fresco. zMedias con letras iguales en cada órgano de la planta no difieren estadísticamente (Tukey, P ≤ 0.05).
En hojas y pseudobulbos, los contenidos de clorofila a y b fueron significativamente superiores (P ≤ 0.05) con FM y BFERT, en comparación con FM + BFERT y el TEA. Para el caso de clorofilas totales en hoja, únicamente el BFERT incrementó significativamente su contenido (P = 0.0009); mientras que en pseudobulbo, tanto el FM como el BFERT dieron valores estadísticamente superiores (P = 0.0002). En ambos órganos, los contenidos de clorofilas b y totales con FM + BFERT fueron significativamente inferiores al TEA (Figura 1B). Ling y Subramaniam (2007) encontraron concentraciones de clorofilas totales en Phalaenopsis violacea hasta de 0.448 mg·g-1, las cuales fueron superiores a las más altas encontradas con los tratamientos de FM y BFERT para L. anceps subesp. anceps (de 0.091 a 0.176 mg·g-1). Asimismo, Trelka, Włodzimierz, Jóźwiak, y Kozłowska (2010) reportaron concentraciones mayores de clorofila a (de 0.25 a 0.3 mg·g-1) y b (alrededor de 0.1 mg·g-1) en hojas de la orquídea Phalaneopsis ‘Sprigfield’. En Laelia anceps subesp. anceps, la concentración de clorofila a en hoja fue mayor a la reportada por Hew y Yong (1994) para Oncidium ‘Goldiana’ (0.071 mg·g-1).
Los resultados mostraron que los contenidos de clorofila a, b y totales en pseudobulbos de L. anceps subesp. anceps, si bien fueron menores que en hoja, incrementaron con la FM y la BFERT. Las hojas son los principales órganos fotosintéticos de las plantas, además, en orquídeas otros órganos no-foliares poseen clorofila y son capaces de fijar dióxido de carbono, tales como pseudobulbos, raíces, flores y cápsulas (Hew & Yong, 2004; Ng & Hew, 2000). La presencia de clorofilas en los diversos órganos de la planta indican que éstos también llevan a cabo la fotosíntesis (Vermaas, 1998). Adicionalmente, el contenido de clorofilas está estrechamente relacionado con el nitrógeno total presente en los tejidos vegetales, y por tanto, es un indicador indirecto del estado nutricional de la planta (Zarco-Tejada et al., 2004).
Concentración de aminoácidos
En pseudobulbo, la FM incrementó significativamente (P = 0.0001) la concentración de aminoácidos en relación con el resto de los tratamientos (Figura 2); mientras que en hoja, los tratamientos de fertilización no afectaron significativamente (P = 0.549) la concentración de aminoácidos.

Figura 2 Concentración de aminoácidos solubles totales en hojas y pseudobulbos de Laelia anceps subesp. anceps al final del experimento, con diferentes tratamientos de fertilización: TEA = testigo, FM = fertilización mineral, BFERT = biofertilización y FM + BFERT = fertilización mineral complementado con biofertilización, PF = peso fresco. zMedias con letras iguales en cada órgano de la planta no difieren estadísticamente (Tukey, P ≤ 0.05).
Concentración de proteínas
En hoja, la concentración de proteínas fue significativamente mayor (P = 0.058) con la FM + BFERT que con el testigo. En pseudobulbo, no hubo diferencias estadísticas por efecto de tratamientos (Figura 3). La concentración foliar de proteínas para Laelia anceps subesp. anceps fue menor a la reportada por Ling y Subramaniam (2007) para Phalaenopsis violacea (55 µg·g-1 PF). En diversos estudios se ha observado el aumento de proteínas totales como respuesta a tratamientos de inoculación de microorganismos o productos derivados de éstos; lo que a su vez está relacionado con el crecimiento y desarrollo de los cultivos (González-Vega, Hernández-Rodríguez, Barrios-Alonso, Velázquez-del Valle, & Hernández-Lauzardo, 2007).

Figura 3 Concentración de proteínas solubles totales en hojas y pseudobulbo de Laelia anceps subesp. anceps al final del experimento, con diferentes tratamientos de fertilización: TEA = testigo, FM = fertilización mineral, BFERT = biofertilización y FM + BFERT = fertilización mineral complementado con biofertilización, PF = peso fresco. zMedias con letras iguales en cada órgano de la planta no difieren estadísticamente (Tukey, P ≤ 0.05).
En el presente trabajo, la concentración de proteínas en hoja con la BFERT mostró un efecto similar al de la FM. Dichos resultados contrastan con lo encontrado por González, Cabrera, y Hernández (2002), quienes emplearon como biorfertilizante microorganismos RIZOBAC® en plántulas de cafeto, y encontraron que éstas presentaron mayor concentración de proteínas totales con respecto al testigo.
Conclusiones
La fertilización mineral y biofertilización aplicadas de manera individual incrementaron la concentración de clorofilas a, b y total en pseudobulbos, y su contenido en hojas y pseudobulbos. La fertilización mineral aumentó significativamente la concentración de aminoácidos en pseudobulbos, y la combinación de ésta con la biofertilización incrementó la concentración foliar de proteínas. El incremento de la concentración de biomoléculas como clorofilas, aminoácidos y proteínas se relacionan de manera directa con el crecimiento de la planta; que a su vez es un indicador de procesos básicos de las plantas entre los que se encuentran la fotosíntesis, respiración y transpiración. En este sentido, se detecta potencial en el uso de biofertilizantes para Laelia anceps subesp. anceps.
Agradecimiento
Los autores agradecen al Fideicomiso Revocable de Administración e Inversión núm. 167304 del Colegio de Postgraduados por el financiamiento parcial otorgado para la realización del presente trabajo.
REFERENCIAS
Abbasniayzare, S. K., Sedaghathoor, S., & Dahkaei, M. N. P. (2012). Effect of biofertilizer application on growth parameters of Spathiphyllum illusion. American-Eurasian Journal of Agricultural & Environmental Sciences, 12(5), 669-673. Retrieved from https://www.idosi.org/aejaes/jaes12(5)12/18.pdf [ Links ]
Amanullah, Kurd, A. A., Khan, S., Ahmed, M., & Khan, J. (2012). Biofertilizer -A possible substitute of fertilizers in production of wheat variety Zardana in Balochistan. Pakistan Journal of Agricultural Research, 25(1), 44-49. Retrieved from https://www.cabi.org/gara/FullTextPDF/2013/20133358795.pdf [ Links ]
American Orchid Society (AOS). American Orchid Society (AOS) (22 de junio de 2017). http://www.aos.org [ Links ]
Bichsel, R. G., & Starman, T. W. (2008). Nitrogen, phosphorus, and potassium requirements for optimizing growth and flowering of the Nobile Dendrobium as a potted orchid. HortScience, 43(2), 328-332. Retrieved from http://hortsci.ashspublications.org/content/43/2/328.full [ Links ]
Boraste, A., Vamsi, K. K., Jhadav, A., Khairnar, Y., Gupta, N., Trivedi, S., Patil, P., Gupta, P., Gupta, M., Mujapara, A. K., & Joshi, B. (2009). Biofertilizers: A novel tool for agriculture. International Journal of Microbiology Research, 1(2), 23-31. doi: 10.9735/0975-5276.1.2.23-31 [ Links ]
Chang, K. H., Wu, R. Y., & Hsieh, T. F. (2010). Effects of fertilizer formulations on flowering of Doritaenopsis ‘I-Hsin Madame’ in gradational nutrition management. Acta Horticulturae, 878, 347-354. doi: 10.17660/ActaHortic.2010.878.43 [ Links ]
Daughtrey, M. L., & Benson, D. M. (2005). Principles of plant health management for ornamental plants. Annual Review of Phytopathology, 43, 41-69. doi: 10.1146/annurev.phyto.43.040204.140007 [ Links ]
El-Sayed, B. A., Shahin, M., & Zaky, A. A. (2012). Effect of biofertilization on growth and chemical composition of Gardenia augusta Ellis. Plant Journal of Horticultural Science & Ornamental Plants, 4(3), 340-344. doi: 10.5829/idosi.jhsop.2012.4.3.265 [ Links ]
Espinosa-Moreno, J. A., Gaytán-Acuña, E. A., Becerril-Román, A. E., Contreras, D. J., & Trejo-López, C. (2000). Fertilización química y biológica de Phalaenopsis (Orchidaceae) en condiciones de invernadero. Terra Latinoamericana, 18(2), 125-131. Retrieved from http://www.redalyc.org/articulo.oa?id=57318204 [ Links ]
Geiger, M., Walch-liu, P., Engels, C., Harnecker, J., Schulze, E. D., Ludewing, F., Sonnewald, U., Scheible, W. R., & Stitt, M. (1998). Enhanced carbon dioxide leads to a modified diurnal rhythm of nitrate reductase activity and higher levels of amino acids in young tobacco plants. Plant, Cell & Environment, 21(3), 253-268. doi: 10.1046/j.1365-3040.1998.00277.x [ Links ]
González, E. M., Cabrera, M., & Hernández, A. (2002). Efecto del biopreparado Rizobac sobre el crecimiento y desarrollo de plántulas de cafeto (Coffea canephora P. var. Robusta). Cultivos Tropicales, 23(2), 11-14. Retrieved from http://www.redalyc.org/articulo.oa?id=193218114002 [ Links ]
González-Vega, M. E., Hernández-Rodríguez, A., Barrios-Alonso, L. M., Velázquez-del Valle, M. G., & Hernández-Lauzardo, A. N. (2007) Efecto antagónico de un producto biológico obtenido de Burkholderia cepacia Palleroni y Holmes contra Capnodium spp. en plántulas de café (Coffea canephora P.) crecidas in vitro e in vivo. Revista Mexicana de Fitopatología, 25(2), 120-126. Retrieved from http://www.redalyc.org/articulo.oa?id=61225205 [ Links ]
Hágsater, E., Soto-Arenas, M. A., Salazar-Chávez, G. A., Jiménez-Machorro, R., López-Rosas, M. A., & Dressler, R. L. (2005). Las Orquídeas de México. México: Instituto Chinoín. [ Links ]
Harborne, J. B. (1973). Chlorophyll extraction. In: Harbone, J. B. (Ed.), Phytochemical Methods Recommended technique (pp. 205-207). London: Chapman and Hall. [ Links ]
Hew, C. S., & Yong, W. H. (2004). The physiology of tropical orchids in relation to the industry. Singapore: World Scientific. [ Links ]
Hew, C. S., & Yong, W. H. (1994). Growth and photosynthesis of Oncidium ‘Goldiana’. Journal of Horticultural Science, 69(5), 809-819. doi: 10.1080/14620316.1994.11516517 [ Links ]
Höfner, R., Vázquez-Moreno, L., Abou-Mandour, A. A., Bohnert, H. J., & Schmitt, J. M. (1989). Two isoforms of phosphoenolpyruvate carboxylase in the facultative CAM plant Mesembryanthemum crystallinum. Plant Physiology and Biochemistry, 27, 803-810. [ Links ]
Lakshman, C. D., Pathak, P., Rao, A. N., & Rajeevan, P. K. (2014). Commercial Orchids. Berlin, Germany: De Gruyter Open. [ Links ]
Lima-do Amaral, T., Mendes-Jasmim, J., de Paula-Araújo, J. S., Lima-Thiébaut, J. T., Cunha-Coelho, F., & Barreto-de Freitas, C. (2010). Adubação de orquídeas em substratos com fibra de coco. Ciência e Agrotecnologia, 34(1), 11-19. doi: 10.1590/S1413-70542010000100001 [ Links ]
Ling, L. F., & Subramaniam, S. (2007). Biochemical analyses of Phalaenopsis violacea orchids. Asian Journal of Biochemistry, 2(4), 237-246. doi: 10.3923/ajb.2007.237.246 [ Links ]
Moore, S., & Stein, H. (1954). Techniques of laboratories. Journal of Biological Chemistry, 38, 211-907. [ Links ]
Ng, C. K. Y., & Hew, C. S. (2000). Orchid pseudobulbs -‘false’ bulbs with a genuine importance in orchid growth and survival! Scientia Horticulturae, 83(3-4), 165-172. doi: 10.1016/S0304-4238(99)00084-9 [ Links ]
Rodrigues, D. T., Ferreira-Novais, R., Alvarez, V. H., Moreira-Dias, J. M., & de Albuquerque-Villani, E. M. (2010). Orchid growth and nutrition in response to mineral and organic fertilizers. Revista Brasileira de Ciência do Solo, 34(5), 1609-1616. Retrieved from http://sociales.redalyc.org/articulo.oa?id=180215650014 [ Links ]
Scagel, C. F. (2003) Soil pasteurization and inoculation with Glomus intraradices alters ower production and bulb composition of Zephyranthes spp. The Journal of Horticultural Science & Biotechnology, 8(6), 798-812. doi: 10.1080/14620316.2003.11511702 [ Links ]
Statistical Analysis System (SAS Institute). (2010). SAS/STAT user’s guide , version 9.2. Cary, USA: Author. [ Links ]
Trejo-Téllez, L. I., Gómez, F., Rodríguez, N., & Alcántar, G. (2005). Fertilización foliar con urea en la partición de nitrógeno en espinaca. Terra Latinoamericana, 23(4), 495-503. Retrieved from http://www.redalyc.org/articulo.oa?id=57311146008 [ Links ]
Trelka, T., Włodzimierz, B., Jóźwiak, A., & Kozłowska, A. (2010). Phalaenopsis cultivation in different media. Part II. Nutrients and chlorophyll concentration in leaves and roots. Acta Scientiarum Polonorum Hortorum Cultus, 9(3), 95-104. Retrieved from http://www.hortorumcultus.actapol.net/pub/9_3_95.pdf [ Links ]
Vermaas, W. (1998). An introduction to photosynthesis and its applications. USA: Arizona State University. [ Links ]
Villar, S. (2003). Importancia de la calidad de planta en los proyectos de revegetación. In: Rey-Benayas J. M., Espigares-Pinilla, T., & Nicolau-Ibarra, J. M. (Eds.), Restauración de Ecosistemas Mediterráneos. España: Universidad de Alcalá - Asociación Española de Ecología Terrestre. [ Links ]
Wang, Y. T. (2000). Impact of a high phosphorus fertilizer and timing of termination of fertilization on flowering of a hybrid moth orchid. HortScience, 35(1), 60-62. Retrieved from http://hortsci.ashspublications.org/content/35/1/60.abstract [ Links ]
Wang, Y. T. (1996). Effects of six fertilizers on vegetative growth and flowering of Phalaenopsis orchids. Scientia Horticulturae, 65(2-3), 191-197. doi: 10.1016/0304-4238(96)00875-8 [ Links ]
Youssef, M. M. A., & Eissa, M. F. M. (2014). Biofertilizers and their role in management of plant parasitic nematodes. A review. Journal of Biotechnology and Pharmaceutical Research, 5(1), 1-6. Retrieved from https://pdfs.semanticscholar.org/8235/d92b71cb553d9893475c2f76806c5ef181c7.pdf [ Links ]
Zarco-Tejada, P., Miller, J., Harron, J., Hu, B., Noland, T., Goel, N., Mohammed, G., & Sampson, P. (2004). Needle chlorophyll content estimation through model inversion using hyperspectral data from boreal conifer forest canopies. Remote Sensing of Environment, 89(2), 189-199. doi: 10.1016/j.rse.2002.06.002 [ Links ]
Zong-min, M., Ning, Y., Shu-yun, L., & Hong, H. (2012). Nitrogen requirements for vegetative growth, flowering, seed production, and ramet growth of Paphiopedilum armeniacum (Orchid). HortScience , 47(5), 585-588. Retrieved from http://hortsci.ashspublications.org/content/47/5/585.full [ Links ]
Recibido: 26 de Julio de 2017; Aprobado: 04 de Abril de 2018











 text in
text in 


