Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química de México
Print version ISSN 0583-7693
Rev. Soc. Quím. Méx vol.47 n.3 Ciudad de México Jul./Sep. 2003
Comunicación Técnica
Comportamiento isotérmico de la precipitación salina en un destilador solar experimental
Saúl I. Armendáriz,*a Miguel Ángel Porta-Gándara,b Robert E. Foster,c Petros G. Koutsoukos,d Raúl G. Bautista-Margulise and Gabriel Alonsoa
a Centro de Investigación en Materiales Avanzados S. C., Miguel de Cervantes Saavedra No. 120, Complejo Industrial Chihuahua, C. P. 31109, Chihuahua, México. Tel. 01-614-4-39-11-58. E-mail: saul.armendariz@cimav.edu.mx
b Centro de Investigaciones Biológicas del Noroeste, PO Box 128, La Paz 23000, BCS , México.
c Southwest Technology Development Institute, New Mexico State University, MSC 3 SOLAR, P. O. Box 30001, Las Cruces, New Mexico, 88003-8001 USA.
d Department of Chemical Engineering, University of Patras, University Campus GR 26500 Patras, Greece.
e Universidad Juárez Autónoma de Tabasco, División Académica de Ciencias Biológicas, C. P. 86039.
Recibido el 5 de diciembre del 2002
Aceptado el 3 de julio del 2003
Resumen
Se presenta un estudio isotérmico de la precipitación de CaCO3 en un destilador solar experimental, utilizando como afluente agua subterránea con alto contenido de calcio, bicarbonatos y sulfatos solubles. Se efectuaron tres experimentos de la reacción entre el calcio con los iones bicarbonato. El primer experimento se siguió durante 5 h con el destilador libre de incrustaciones, el segundo, durante 12 h con incrustaciones y el tercer experimento por un periodo de 8 h con un tiempo previo de 72 h de contacto entre el precipitado y la solución. Durante las dos primeras horas en los tres experimentos precipitó 95.52, 145.37 y 444.44 mg de CaCO3, respectivamente. En el precipitado se encontró calcita como única fase cristalina.
Palabras clave: Carbonato de calcio, precipitado, incrustaciones, calcio soluble, calcita, sulfatos solubles.
Abstract
A isothermic precipitation of CaCO3 in a experimental solar still using groundwater as water supply with high concentrations of soluble calcium and sulfates is presented. Three experiments of calcium and bicarbonates reaction were performed. The first experiment was followed during 5 h with incrustations free still, the second, during 12 h with incrustations and the third experiment in a 8 h period with 72 hours of previous contact between the solution and the precipitate. During the first two h in the three experiments, 95.52, 145.37 and 444.4 mg of CaCO3 were formed respectively. In the precipitate was found calcite as the only crystalline phase.
Keywords: Calcium carbonate, precipitate, incrustation, soluble calcium, calcite, soluble sulfates.
Introducción
El agua es una necesidad básica para la existencia de la vida, como la producción de alimentos y la conservación del medio ambiente. El hombre ha sido dependiente de los ríos, lagos y depósitos de agua subterránea para sus requerimientos de agua de calidad aceptable para consumo, tareas domésticas, agricultura e industria. Sin embargo, el uso de agua de tales fuentes no es siempre posible, debido a la presencia de altas concentraciones de sales y/o microorganismos patógenos. El impacto de muchas enfermedades que sufre la humanidad debido al consumo de agua sin tratar, puede ser drásticamente reducido si se suministra agua apta para consumo humano [1]. Además, el rápido crecimiento de la industria, agricultura y la población en el mundo, ocasiona que exista una demanda cada vez más grande de agua, principalmente para consumo humano. Esto invariablemente ocasionará una escasez a niveles críticos, debido a que las fuentes de agua naturales, pueden ofrecer solo una limitada cantidad a esta creciente demanda. Aunado a esto, se encuentra el problema de la contaminación de los ríos y lagos debido a los desechos de aguas residuales domésticas, industriales y agrícolas, por lo que, entonces habrá escasez de agua de buena calidad no sólo en zonas rurales sino también en zonas urbanas [1].
Uno de los esquemas atractivos para atacar el problema de la falta de agua apta para consumo humano es por medio de la destilación de aguas salinas, ya que éstas abundan en lagos extensos, mares intercontinentales y depósitos de agua subterránea. El agua destilada puede ser mezclada con agua salada (si es higiénica) para incrementar el rendimiento de agua y proporcionarle una concentración de dureza menor a 500 ppm. El problema principal, obviamente, es el alto grado de salinidad de tal agua. Los procesos convencionales de destilación, tales como de múltiples etapas, multi-efecto, de capa delgada, ósmosis inversa y electrodiálisis no sólo requieren de energía, sino que no son económicamente atractivos para pequeñas demandas de agua dulce. Sin embargo, los avances en el uso de la energía solar, han demostrado que ésta es adecuada para la desalación, siempre y cuando la demanda de agua no sea muy grande [1].
En el suroeste de los Estados Unidos y otras áreas del mundo (América Latina y África), pequeñas comunidades localizadas en áreas remotas tienen problemas críticos con suministros adecuados de agua apta para consumo. Problemas específicos en cuanto a la calidad pueden incluir salinidad excesiva, alta concentración de hierro, manganeso, fluoruros, presencia de metales pesados, contaminación por bacterias o virus y residuos de plaguicidas (herbicidas o fungicidas). Estas comunidades pueden depender de pozos de agua, cisternas o pueden obtener el suministro de fuentes que son inapropiadas o de calidad marginal. Las tecnologías convencionales para tratar estas aguas pueden consistir desde una simple desinfección con cloro o yodo, hasta ósmosis inversa e intercambio iónico [2]. La desinfección puede reducir bacterias nocivas, pero no puede hacer absolutamente nada para reducir la salinidad, remover metales pesados o sustancias tóxicas. Las unidades de ósmosis inversa pueden ser efectivas para los problemas relacionados con la salinidad, pero a un alto costo en su operación y generando, además, una gran cantidad de agua de desecho. Esta agua es concentrada en sales y puede ser de más del 50 % de la cantidad original de agua suministrada, además, no desinfecta y tampoco puede remover plaguicidas o metales pesados [2]. Los intercambiadores iónicos, reducen la dureza y eliminan problemas de coloración asociados con el hierro y manganeso, pero no remueven plaguicidas, metales pesados u organismos patógenos. La destilación solar es otra tecnología que puede ser empleada para generar agua con características aceptables para consumo. Ésta puede eliminar sales, bacterias, metales pesados u organismos patógenos, así como plaguicidas a un bajo costo. Sin embargo, esta cantidad se restringe a la producción de pequeñas cantidades de agua potable, ya que un destilador de un área superficial de 2 m2 proporciona de entre 15 y 20 litros de agua diarios, dependiendo de época del año, intensidad de la radiación solar, velocidad del viento, temperatura ambiental y altura de la lámina de agua, por lo que se emplea en localidades rurales de pocos habitantes [2].
La destilación solar para producción de agua potable a partir de agua salada ha sido utilizada en varias partes del mundo por muchos años y se han realizado extensos estudios de la mayoría de los factores que afectan el desempeño de los destiladores solares [3-10].
El uso de agua subterránea con alta concentración de calcio, bicarbonatos y/o sulfatos (como afluente en estos dispositivos), ocasiona que a través del tiempo, las sales que se van removiendo del proceso de destilación, comienzan a formar rápidamente cristales en la base del evaporador [11], esto ocasiona que el color de la base cambie de negro a blanco. Por lo tanto, la energía que proviene del sol en forma de luz no es aprovechada y usada para calentar el agua, es decir, aumenta la reflectividad cada vez que se van acumulando cristales en la base del destilador. Así, desde el punto de vista de la eficiencia térmica, éste es un factor limitante en la producción de agua purificada en destiladores solares [11].
Kemmer [12], ha señalado que para transferir calor de manera eficiente con bajos gradientes de temperatura, las superficies del evaporador deberán mantenerse libres de depósitos, los cuales producen un efecto aislante. Asimismo, puntualiza que la precipitación tiene lugar en forma de incrustaciones (sales de calcio, magnesio y sílice) sobre las superficies de transferencia de calor, las cuales ocasionan una disminución de la velocidad de transferencia de calor, retardo en la evaporación y, por consiguiente, una reducción de la eficiencia térmica [12]. Por lo anterior, es importante considerar una limpieza programada en estos sistemas, sin embargo, esto implica discontinuidad en el funcionamiento debido al tiempo utilizado en el autolavado y curado del silicón para hermetizar el destilador.
En la literatura, pocas investigaciones han tratado esta problemática. Entre los más importantes: Cabanillas et al. [13], Cabanillas y Montaño [14], y Thomas [15], mencionan que uno de los problemas críticos en la operación de los destiladores solares de Puerto Lobos, Sonora, fueron las incrustaciones de sales y el crecimiento de las mismas, a pesar de un adecuado lavado de la salmuera. Ojinaga y Foster [16], han puntualizado que una de las principales características en la zona de Matehuala, el agua presentó un alto contenido en sales disueltas. Debido a eso, se formaron incrustaciones en la base del evaporador, por lo que fue necesario un servicio de mantenimiento para limpiar tales sales acumuladas. Sin embargo, se observó que las incrustaciones se formaron rápidamente. Por esto, se ha recomendado a los usuarios lavar diariamente el destilador con agua. Recientemente, Zachritz et al. [2], mencionan que durante el transcurso del tiempo y especialmente cuando se usa agua con alta concentración de iones en los destiladores, los minerales empiezan a despositarse en la base, durante el proceso de destilación. Esto generalmente cambia el color de la base de un color negro brillante a un blanco mate. Por tanto, la energía solar usada para evaporar el agua, no se absorbe eficientemente. Observaciones hechas por Zachritz [2], mostraron que un destilador con gran cantidad de sedimento de sales refleja cerca del 39 % de energía, mientras que una base negra y limpia, refleja sólo el 6 %. Este fenómeno afecta en la disminución de la producción en aproximadamente un 20 % [2]. De ahí que sea necesario estudiar alternativas de solución al problema de la formación de incrustaciones en la base del evaporador. El uso de un pretratamiento en cualquier sistema para eliminar dureza, implicaría costos adicionales y mantenimiento de equipo. Foster y Cormier [17], sugieren lavar con suficiente agua para limpiar el destilador del agua salina concentrada en el depósito. Éste procedimiento no es suficiente, ya que una vez formadas las sales en el evaporador, éstas no se disuelven al ser de naturaleza insoluble. McCracken [18], sugiere que agregando limaduras de óxido de hierro, se puede regenerar el color negro de la base. No obstante, existen problemas para homogeneizar la coloración en todo el destilador, además las incrustaciones van aumentando en grosor, afectando con el tiempo la distancia media (distancia entre el evaporador y la base cuando la longitud del destilador es 0.5) justa para la máxima eficiencia del sistema. Zachrytz et al. [2], limpió varios de los alambiques solares con ácido muriático mezclado con el afluente. Esta mezcla elimina con facilidad las sales depositadas en el fondo del evaporador. Sin embargo, el problema es que causa un sabor desagradable en el agua destilada por varias semanas después de la limpieza, por lo que tiene que lavar con mayores volúmenes de agua para eliminar residuos, esto, involucra costos debido a la necesidad de usar ácido sulfúrico.
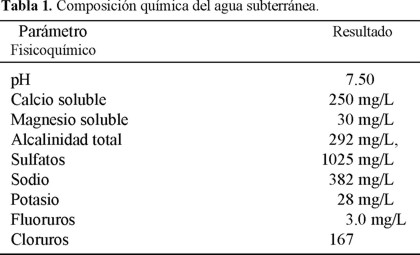
Este trabajo tiene como objetivo principal comprender el comportamiento de la reacción de precipitación del CaCO3 en un destilador solar somero a escala experimental, bajo condiciones isotérmicas a 50 °C. En éstos experimentos se utilizó agua subterránea como afluente. Ésta se obtuvo de la red de suministro de agua potable en Ojinaga, Chihuahua. La temperatura de operación fue establecida considerando que la producción importante de los destiladores someros comienza a 50 °C [2,17]. De acuerdo a estudios realizados por Koutsoukos et al. [19], en este trabajo se determina en que punto se estabiliza la reacción de los iones calcio con los iones bicarbonato en soluciones acuosas supersaturadas de calcio soluble, bicarbonatos y sulfatos. Asimismo, se puede determinar experimentalmente cual de los dos aniones (bicarbonatos o sulfatos), reaccionará primero con el calcio. Se presentan tres tipos de experimentos para conocer la influencia del precipitado previamente formado en el destilador, comparado con el uso de un evaporador limpio de incrustaciones sobre la cantidad de CaCO3 precipitado. También se presenta un estudio teórico con el programa PHREEQC, usando los datos de la composición química del agua subterránea, mostrados en la Tabla 1.
Por otra parte, las cinéticas de precipitación de CaCO3, han estado bajo intensa investigación por más de tres décadas, sin embargo, aún existen varios aspectos que necesitan ser investigados. El análisis de la precipitación de calcio con otras sales solubles es un aspecto muy importante, del cual se sabe poco, más aún, en agua subterránea, donde existen varios iones en solución [20]. El efecto de éstos en la precipitación y en su cinética es desconocido. Se pueden hacer aproximaciones teóricas mediante el uso de sistemas de equilibrio termodinámico entre especies [21], pero la interrogante es conocer que tan reales serían tales cálculos, especialmente en sistemas donde el polimorfismo es un importante factor, como es el caso del carbonato de calcio [22].
Parte experimental
Diseño del prototipo
El prototipo experimental que se muestra en la Fig. 1, se basó en un destilador solar de una pendiente. Ésta, tiene un ángulo de inclinación de 4 grados. El evaporador es de acero inoxidable (0.61 m de largo, 0.32 m de ancho y 0.055 m de altura media), alcanzando un área superficial de 0.195 m2. El condensador es vidrio comercial de 3 mm de espesor. El destilador experimental fue calentado con una parrilla eléctrica marca Thermolyne de 0.33 m × 0.61 m con el fin de mantener constante la temperatura en la salmuera. La parrilla y la base del evaporador están aislados por una caja de policarbonato transparente.

Material de trabajo
En este estudio se utilizó agua subterránea que se emplea como suministro de agua potable a la ciudad de Ojinaga, Chihuahua. Las características de la composición química del agua utilizada en estos experimentos se muestra en la Tabla 1. Esta ciudad está localizada en el noreste del estado de Chihuahua en una zona semidesértica y tiene las condiciones climáticas ideales para la implementación de la tecnología de destilación solar, ya que en verano las temperaturas fluctúan entre los 20 y 50 °C y la intensidad de la radiación solar llega hasta 900 W/m2 [11].
Metodología
De acuerdo a trabajos efectuados por Mc Cracken [18], y Almanza [23], la máxima producción de destilado se obtiene empleando una altura de agua no mayor de 1 cm en el evaporador. En este trabajo se utilizan 2 litros de salmuera para cubrir un espesor de 1 cm de altura en este prototipo. Luego, se elevó la temperatura de la salmuera con la parrilla eléctrica, desde la temperatura ambiente hasta alcanzar la temperatura de trabajo.
Se llevaron a cabo tres tipos de experimentos a condiciones isotérmicas de 50 °C. Cada uno fue repetido 6 veces con el propósito de determinar la confiabilidad de los resultados y obtener un promedio de éstos. El primer experimento se llevó a cabo con el evaporador libre de incrustaciones por un periodo de 5 h. El segundo experimento se llevó a cabo por un periodo de 12 h en el evaporador con incrustaciones formadas previamente. El tercer experimento se realizó por un periodo de 8 h, después de 72 h de contacto entre la solución y la incrustación previamente formada.
Para determinar el avance de la reacción de precipitación de CaCO3 a través del tiempo, se colectaron muestras de salmuera de 15 mL cada hora. Este volumen se suma al volumen de destilado correspondiente.
Medición de la concentración de calcio
Las muestras de salmuera fueron digeridas con 5.5 mL de HCl concentrado (grado analítico) en la parrilla eléctrica a 65 °C por 1 h. Después la solución se llevó a un matraz aforado de 100 mL y se le adicionó 0.3 g de KCl a cada una de las muestras. Por último, la concentración de calcio soluble fue medida en un Espectrofotómetro de Absorción Atómica (EAA) y se realizaron tres repeticiones por muestra, de las cuales se obtuvo un promedio de cada una.
Determinación de las cantidades de CaCO3 precipitado
Tomando en cuenta que el destilado presenta < 1 ppm de calcio soluble, entonces se realizó un balance de calcio precipitado mediante la ecuación 1.

donde Cap es la cantidad de calcio precipitado a un tiempo t; Cai es la cantidad inicial de calcio soluble y Cat es la cantidad de calcio en solución El balance de calcio proporciona la cantidad precipitada como calcio iónico, pero éste se puede transformar a carbonato de calcio, por medio de la ecuación 2:
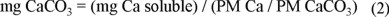
Desviación estándar de los datos experimentales. La desviación estándar media, σn, para tres experimentos (5, 12 y 8 h) fueron calculadas usando la ecuación (3), con los datos de 6 corridas independientes, tal y como se describe en la literatura [24]:

donde x son datos y n es el número de muestras analizadas. La desviación estándar media de las mediciones de calcio fueron ±2 %.
Las técnicas empleadas en la fase experimental para la interpretación de los resultados, se muestran a continuación:
Determinación de Cat. La concentración de calcio soluble a través del tiempo fue medida con un Espectrofotómetro de Absorción Atómica marca Avanta GBC, mediante la flama de óxido nitroso-acetileno.
Se resta Cat de Cai y se determina la cantidad de calcio precipitado Cap.
Identificación del precipitado y de los cristales depositados sobre la solución. Para identificar las especies precipitadas y su fase cristalina, se utilizó la técnica de DRX, con un difractómetro Siemens D5000, equipado con un monocromador curvado de grafito que emplea radiación CuKa de λ = 1.54056 Å, el cual opera a 43 kV y 30 mA.
Morfología del precipitado y de los cristales depositados sobre la solución. La morfología del precipitado y de los cristales establecidos sobre la salmuera fueron observadas mediante un microscopio electrónico de barrido (MEB) modelo JEOL JSM5800 LV.
Predicción teórica de los sólidos termodinámicamente más estables. Se empleó el programa de cómputo PHREEQC (Versión 2), el cual es un programa escrito en lenguaje de programación C y está diseñado para desarrollar una amplia variedad de cálculos geoquímicos a bajas temperaturas. Se basa en un modelo de asociación de iones en soluciones acuosas. Para esto, se utilizaron los datos de la composición química del agua utilizada en este trabajo (Tabla 1).
Resultados
Caracterización del precipitado por DRX
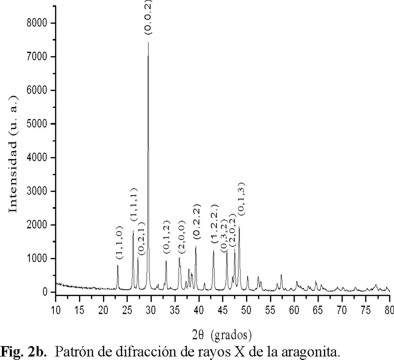
En el patrón de difracción que se muestra en la Fig. 2a, presenta la fase cristalina de carbonato de calcio correspondiente a calcita. Ésta fase aparece tanto en el precipitado que se formó en la base del destilador, como en el depósito sobre la solución y la misma en los tres experimentos (5, 12 y 8 horas). Esta fase del CaCO3, fue la única encontrada en esta investigación. En la Fig. 2b se presenta el patrón de difracción de rayos X de la fase aragonita tomada de Kontoyannis [25], esto con el propósito de mostrar las diferencias entre las fases cristalinas del CaCO3.

Morfología de los cristales por MEB
En la Fig. 3a se muestra la micrografía de una muestra de los cristales de calcita depositados sobre la salmuera. En ésta se muestra el crecimiento cristalino en dirección longitudinal. En la micrografía de la Fig. 3b se observa con mayor acercamiento la nucleación de los mismos cristales formados. En los tres experimentos se observó la misma morfología de los cristales. Asimismo, una observación a los cristales en las primeras etapas de la precipitación, mostró la misma morfología y dimensiones de la calcita.


Comportamiento de la precipitación de calcio
Las Tablas 2-4 (3) muestran la variación de la concentración de calcio soluble en la salmuera, así como las cantidades remanentes de calcio soluble, las cantidades precipitadas como carbonato de calcio y el porcentaje precipitado en cada hora, el cual se determinó dividiendo la cantidad precipitada en cada hora entre la cantidad total precipitada. Cada Tabla resultó de promediar 6 corridas bajo las mismas condiciones de trabajo. Los cálculos de las cantidades precipitadas están en función del volumen del afluente y por lo tanto del área del destilador; es decir por dos litros de agua y en 0.195 m2 de superficie.
Discusión
Investigaciones realizadas por Koutsoukos y Kontoyannis [26], con el programa WATEQ4F diseñado por Ball and Nordstrom [27] y usando agua equivalente a la de mar, demostraron que a temperaturas entre 50 y 90 °C se forma aragonita como única fase cristalina. Por otro lado, Dana [29], menciona que la aragonita cristaliza a temperaturas por debajo de los 90 °C y que por arriba de ésta, se forma calcita. Lo anterior, concuerda con los resultados encontrados por Koutsoukos y Kontoyannis [26]. De acuerdo a lo anterior, en este trabajo también se realizó un estudio teórico con los datos de la composición química de la Tabla 1 para predecir los sólidos termodinámicamente más estables mediante el programa de cómputo PREEQC (Versión 2) diseñado por Parkhurst y Appelo [21]. Con este programa se encontró calcita, aragonita y fluorita. Es importante señalar que los precipitados de las fases cristalinas que se obtienen dependen fuertemente del tipo de afluente, ya que la composición química del agua es diferente entre un afluente y otro.
Por otro lado, en este estudio experimental, el único precipitado obtenido tanto en la incrustación como en los cristales depositados en la solución, fue el CaCO3 en forma de calcita, tal como se muestra en el patrón de difracción de rayos X de la Figura 2a. Asimismo, un estudio anterior, pero a temperatura de 75 °C [29] utilizando el mismo afluente de la presente investigación, se encontró la misma fase y morfología del CaCO3. Con estos estudios, se demuestra experimentalmente que se puede seleccionar la formación de CaCO3 en forma de calcita a temperaturas entre 50 °C y 75 °C.
El magnesio en solución es uno de los factores que afectan la precipitación de las fases cristalinas del CaCO3. Si la relación molar Ca / Mg > 4, se favorece la formación de calcita [20]. En el afluente utilizado en este trabajo, la relación molar de Ca / Mg = 8.3, por lo que está de acuerdo con los resultados encontrados en estudios anteriores [20].
El hecho de que la calcita se deposite sobre la solución es un problema desde el punto de vista de la eficiencia, debido a que en operación real (utilizando energía solar como fuente de energía), la reflectividad de la radiación solar comienza aún antes de llegar al fondo del evaporador. Esto, aunado a la formación de incrustaciones en el fondo del evaporador, ocasiona que se disminuya considerablemente la absorción de la radiación en la base del evaporador.
La solución al inicio del experimento presenta un pH de 7.2. De acuerdo a Snoeynik [30], a este pH la especie aniónica predominante son los bicarbonatos (HCO3−1). Al aumentar la temperatura de la salmuera, se altera el equilibrio y reaccionan los iones calcio con los bicarbonatos, de acuerdo a la siguiente ecuación química:

Cuando el evaporador está libre de incrustaciones (experimento 1, Tabla 2), la cantidad total precipitada como carbonato de calcio es de 198.93 mg, de los cuales, el 22.15 %, se forma al alcanzar la temperatura de trabajo (50 °C), es decir, en la primera hora de tratamiento térmico. A la segunda hora de operación se alcanza el 48 % de la reacción. Como se observa, la mayor cantidad de precipitado se presenta en las dos primeras horas de operación. Al término del experimento, el 15.78 % de los iones totales de calcio reaccionaron.
En el experimento 2 (Tabla 3), se muestra que en total se formaron 484.37 mg de CaCO3, de los cuales 145.37 mg (30 %), precipita después de la segunda hora de tratamiento térmico, por lo que se sugiere que la reacción de precipitación entre el calcio y los bicarbonatos es rápida. La mayor parte de la reacción, sucede hasta la sexta hora, sin embargo, la reacción prosigue hasta el final del tratamiento térmico. Al final del experimento reaccionan el 38.4 % del total de los iones de calcio.
A diferencia de los resultados obtenidos a 75 °C [29], donde la reacción se estabiliza a la tercera hora de tratamiento, en este trabajo a 50 °C, la reacción continúa por lo menos hasta el término del experimento.
En el experimento 3 (Tabla 4), se muestra el promedio de los resultados del experimento a 72 h de contacto entre la solución y el precipitado. Se observa que el 81.37 % del CaCO3 precipita justo al alcanzar la temperatura de operación, esto es, una cantidad de 425.77 mg de CaCO3 formados en 2 h de operación. Sin embargo, la reacción se estabiliza hasta la sexta hora de operación. En este caso, el 41.52 % de los iones de calcio totales reaccionaron hasta el término del experimento.
Las cantidad total precipitada de CaCO3 de los experimentos sin incrustaciones (Tabla 2) fue de 199 mg, mientras que en el experimento con precipitado en el evaporador (Tabla 3) la cantidad de CaCO3 fue de 321 mg de la Tabla 2, por lo que las cantidad aumentó aproximadamente en un 62 %, atribuyendo este incremento a la formación de los primeros cristales en el fondo del evaporador, los cuales, actúan como semillas de crecimiento. En las corridas de las pruebas sin precipitado en el evaporador (Tabla 2), sólo el 15.78 % de los iones totales reaccionaron, mientras que en los experimentos con incrustaciones (Tabla 3), reacciona el 25.47 %, aumentando en un 10 % la cantidad de iones de calcio totales reaccionados para el mismo tiempo de operación.
Comparando los experimentos 2 y 3, se observa una diferencia importante en las cantidades precipitadas de CaCO3. En el experimento 2, se forman 60.30 mg de CaCO3 justo al alcanzar los 50 °C, es decir en la primera hora, mientras que en el experimento 3, se forman a este mismo tiempo 425.77 mg de CaCO3, esto es, un incremento de 365.02 mg. Con esto se demuestra que el mayor porcentaje de la reacción de precipitación, se lleva a cabo a temperatura ambiente, ya que el efecto del contacto entre la solución y el precipitado durante 72 h, es más importante en la precipitación del CaCO3 que la temperatura isotérmica de 50 °C.
Conclusiones
En los tres experimentos de 50 °C, se encontró solamente CaCO3 en el precipitado, por lo que en la reacción sólo participan los iones calcio y bicarbonatos. La única fase cristalina formada fue calcita.
En las dos primeras horas de operación se formó la mayor cantidad de CaCO3, esto es; en el experimento 1 se formaron 95.52 mg, en el experimento 2, 145.37 mg y en el experimento 3, 444.44 mg, por lo que se sugiere que la reacción es rápida.
En este tipo de afluente, la reacción entre los iones Ca++ y los HCO3−1, se lleva a cabo en mayor porcentaje a temperatura ambiente, ya que el efecto del contacto entre la solución y el precipitado durante 72 h (tercer experimento), es más importante en la precipitación del CaCO3 que la temperatura isotérmica de 50 °C.
En el experimento 2, la reacción de precipitación de CaCO3 no se estabiliza en 12 h de tratamiento térmico, mientras que en el experimento 3, se estabiliza hasta la sexta hora.
En este estudio se encontró que la alta concentración de magnesio en solución favorece la formación de calcita.
Los experimentos demuestran que se puede seleccionar la precipitación de calcita a 50 °C.
Agradecimientos
Los autores agradecen la asistencia técnica a Silvia Miranda, Miriam Moreno, Obed Chimal, Luis de la Torre, Hilda Esparza, Armando Reyes y Enrique Torres para la realización de este estudio.
Referencias
1. Mowla D.; Karimi, G. Solar Energy. 1995, 55, 389-393. [ Links ]
2. Zachritz, H.; Mimbela, L.; Polka, R.; Stevens, K.; Cisneros, L.; Floyd, H.; Hanson, A. Application of solar stills for drinking water in border colonias, SWTDI-NMSU, EDA Project No. 08-39-03086, Austin, Texas, April, 2000. [ Links ]
3. Malik, M. A. S., Tiwari, G. N., Kumar, A.; Sodha, M. S. 1982. Solar Distillation, Pergamon Press, Oxford. [ Links ]
4. Dunkle, R. V. "Solar water distillation: the roof type still and a multiple effect diffusion still". International Heat Transfer Conference. Part V, Boulder, CO, 1961, pp. 895-902. [ Links ]
5. Lof, G. O. G.; Eibling, J. A.; Bloemes, J. W. AIChE Journal, 1961, 7, 641-649. [ Links ]
6. Baum V. A.; Bairanov R. B. Solar Energy 1964, 8, 78-64. [ Links ]
7. Cooper, P. I. Solar Energy, 1969, 12, 313 - 331. [ Links ]
8. Cooper, P. I. Solar Energy, 1973, 15, 205-217. [ Links ]
9. Maalej, A. Y. Desalination, 1991, 82, 207- 219. [ Links ]
10. Dickinson W. C. and Cheremisinoff P. N. Solar Energy. Technical handbook. Marcel Dekker, New York, 1980, pp. 208-213. [ Links ]
11. Armendáriz, S. I., Desalinización de agua subterránea con alto contenido iónico, mediante un sistema piloto de destilación solar, Congreso de Investigadores del Estado de Chihuahua, abril de 1999, Chihuahua, México. [ Links ]
12. Kemmer, F. N. The Nalco Water Handbook. Cap. 10. Mc Graw-Hill Book Co., 1994. [ Links ]
13. Cabanillas, R. E.; Montaño, J. Planta de Destilación Solar en Puerto Lobos, Sonora, Memorias del XIX Congreso de ANES, La Paz, Baja California, México, 1995. [ Links ]
14. Cabanillas, R. E.; Montaño, J. Seguimiento Técnico de la Planta Desaladora Solar de Puerto Lobos, Reporte Técnico. Grupo de Energía, División de Ingeniería, Universidad de Sonora, Hermosillo, 1995. [ Links ]
15. Thomas, E. K. Overview of village scale, renewable energy powered desalination, Internal Report of National Renewable Energy Laboratory (NREL), April 1997. [ Links ]
16. Ojinaga, L.; Foster, R. E. Experiencias en el uso de destiladores solares en San Luis Potosí y Chihuahua, México, Memorias del XXV Congreso de ANES, octubre de 2001. San Luis Potosí, México. [ Links ]
17. Foster, R. E.; Cormier, M. Solar Still Construction and Operation Manual. El Paso Solar Energy Association. Texas State Energy Conservation Office. El Paso, Texas. June, 1999. [ Links ]
18. McCracken, H. SunWorld, 1990, 14, 83-87. [ Links ]
19. Koutsoukos, P.; Spanos N. J. Phys. Chem. 1998, 102, 6679-6684. [ Links ]
20. Kladi, A.; Pavlos G.; Kepletsanis, P.; Ostvold, G.; Kontoyiannis, G.C.; Koutsoukos, P. "Crystal Growth of Calcium Carbonate in Seawater. The Effect of Temperature and of the Presence of Inhibitors". Advances in Crystal Growth Inhibition Technologies. (2000). Kluwer Academic/Plenum Publishers. New York. [ Links ]
21. Parkhurst, D.; Appelo, C. A. J. PHREEQC. Version 2. A Computer program for Speciation, Batch-Reaction, One Dimensional Transport, and Inverse Geochemical Calculations. [ Links ]
22. Xyla, A.; Klepetsanis, P.; Koutsoukos P.G. "Calcium carbonate -calcium sulfate scale formation at elevated temperatures". Corrosion, April 17-21. 1989. Paper No. 177. [ Links ]
23. Almanza, R.; Muñoz, F. Ingeniería de la Energía Solar, Primera edición, El Colegio Nacional, México D. F., 1994, pág. 163. [ Links ]
24. Brownlee, K. Statistical Theory and Methodolgy in Science and Engineering, 2nd Edition, Wiley New York, 1965, 590 pp. [ Links ]
25. Kontoyannis, G. C.; Orkoula G. M.; Koutsoukos P.G. Quantitative Analysis of Sulfated Calcium Carbonates Using Raman Spectroscopy and X-ray Powder Diffraction. Analyst., 122, January 1997, pp 33-38. [ Links ]
26. Koutsoukos, P.; Kontoyannis, C. J. Chem. Soc., Faraday Trans. 1, 1984, 80, 1181-1192. [ Links ]
27. Ball, J.W.; D. K. Nordstrom, D.K. WATEQ 4F. Program for Calculation of Species Concentration in Seawater. USGS: Washington, DC, 1987. [ Links ]
28. Dana, W.; Ford, E. Tratado de Mineralogía. CECSA, 1981. pp. 560. [ Links ]
29. Armendáriz, S. I.; Alonso, G.; Bautista, R.; Foster, R.; Koutsoukos, P. Behaviour of salts precipitation in a single solar basin distiller, Congreso Mundial de Energía Solar, noviembre del 2001, Adelaide, Australia. [ Links ]
30. Snoeynik V. L.; Jenkins, D. Química del Agua, Editorial Limusa, 1995, pp. 183-205. [ Links ]














