Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química de México
Print version ISSN 0583-7693
Rev. Soc. Quím. Méx vol.46 n.1 Ciudad de México Jan./Mar. 2002
Revisión
Tendencias en la síntesis de herbicidas
Artemisa Romero-Martínez,*1 Guillermo James-Molina,1 Jorge A. Haro-Castellanos2
1 Departamento de Sistemas Biológicos, Universidad Autónoma Metropolitana, Unidad Xochimilco, Calzada del Hueso # 1100, Col. Villa Quietud, México, D. F. Tel: 5483-7259, Fax: 5483-7237. E-mail: roma47@cueyatl.uam.mx
2 Departamento de Biología de la Reproducción, Universidad Autónoma Metropolitana, Unidad Iztapalapa.
Recibido el 20 de julio del 2001.
Aceptado el 22 de enero del 2002.
Resumen
Se presentan las síntesis de algunos nuevos herbicidas, para lo cual se consultaron diferentes fuentes, de 1994 al 2000, excepto patentes. El objeto de esta revisión no es agotar el tema, sino mostrar el estado del arte de la síntesis y modificaciones de los herbicidas. En esta revisión los herbicidas sintetizados se agruparon según las familias químicas a que pertenecen.
Palabras clave: Herbicidas, síntesis de herbicidas, modificaciones a herbicidas.
Abtract
The synthesis of some new herbicides taken from different sources covering the period 1994-2000, are presented (patents excluded). We have not attempted to present a thorough review of the topic but just to show the state of the art on the synthesis and modifications of herbicides. In this review, the synthesized herbicides were grouped according to the chemical families to which they belong.
Keywords: Herbicides, synthesis of herbicides, modifications to herbicides.
Introducción
La necesidad de incrementar la producción de alimentos, en el campo de la agricultura, ha llevado a los investigadores a desarrollar nuevas sustancias con mejores propiedades para proteger a los cultivos de la acción de las malezas y cuya actividad, selectividad y seguridad ambiental, proporcionen el auxilio adecuado a los agricultores.
En este documento se presentan las síntesis de algunos nuevos herbicidas, para lo cual se recopiló información de libros, bancos de datos, revistas y resúmenes presentados en simposios, de 1994 al 2000.
Nuestra revisión sobre el tema no es completa, ya que la información contenida en patentes no está incluida, pero aún así creemos que será útil para conocer el estado del arte de la síntesis de nuevos herbicidas y la modificación a estructuras ya existentes.
Antecedentes
Desde el inicio de la agricultura, el hombre ha utilizado diferentes métodos para proteger los cultivos de las malezas. Con el descubrimiento de las propiedades herbicidas del ácido 2,4-diclorofenoxiacético (2,4-D) y debido a su alta efectividad y bajo costo, este compuesto y los análogos que contienen el grupo fenoxi, fueron los más utilizados y dominaron el mercado hasta finales de los años 60 [1, 2] del siglo pasado.
En la actualidad, la búsqueda de nuevas y mejores formas para combatir las hierbas, ha llevado a los científicos a probar herbicidas mejorados, insectos que matan las hierbas, nuevas técnicas de aplicación y nuevos métodos de labranza. Adicionalmente, se ha desplegado un gran esfuerzo para encontrar nuevos usos a los herbicidas ya existentes, o en la creación de otros superiores a los actuales y aunque muy pocos herbicidas se han introducido en el mercado en los últimos años, debido principalmente al alto costo para desarrollarlos, algunos de ellos son extraordinariamente importantes [3]. Se estima que aproximadamente tienen que investigarse 20,000 compuestos antes de obtener un herbicida o medicamento comercial [4].
Los criterios para la síntesis de nuevos herbicidas han cambiado dramáticamente y en la medida que se conoce con más precisión su forma de actuar se desarrollan herbicidas mucho más activos. Este es el caso de las sulfonilureas y las imidazolinonas que interfieren en la síntesis de las cadenas de los aminoácidos y que se usan en gramos por hectárea, mientras que, los herbicidas de generaciones previas, se requerían en kilos por hectárea. De igual forma, los métodos actuales permiten una rápida identificación del potencial como herbicidas de los compuestos nuevos y la optimización de sus propiedades deseables, tales como la actividad, la selectividad y la seguridad ambiental [5].
Para la síntesis de nuevos herbicidas, los investigadores han basado sus experimentos en el arte y la intuición, en experiencias de científicos dedicados al campo de los pesticidas, en hipótesis químicas acerca del mecanismo de acción del compuesto, en estudios de la relación estructura-actividad y en modelos estadísticos y factoriales [5].
Uno de los problemas que han enfrentado los diseñadores de moléculas con actividad biológica es cómo expresar cuantitativamente los diferentes factores que contribuyen a dicha actividad. Fujita y Hansch [4, 5] desarrollaron una técnica basada en factores fisicoquímicos para estimar el efecto de cambios en la estructura química que recibe el nombre de Relaciones Actividad-Estructura Cuantitativas (QSAR por sus siglas en inglés). Dicha técnica, que es aplicable en la investigación de nuevos agroquímicos, en teoría significa que si se puede determinar cuantitativamente la relación entre la estructura química y las propiedades biológicas de una molécula, se pueden diseñar otras moléculas con las propiedades necesarias de un compuesto ideal [6-9].
Fujita [10] considera que el diseño de compuestos con actividad biológica podría definirse como la construcción de modelos con el uso de información basada en estudios sobre la relación actividad-estructura y de mecanismos de acción molecular. La construcción de estos modelos por síntesis, permite la identificación y determinación de la actividad para decidir cuáles son los mejores compuestos. Por otro lado, para los biólogos, los modelos pueden sugerir mecanismos para gobernar la actividad herbicida y una guía sobre el modo de acción [11]. Existen en la literatura infinidad de ejemplos de trabajos que se han basado en el empleo del modelo de Fujita y Hansch para dirigir sus investigaciones en el campo de la síntesis de nuevas estructuras [12-17], pero todavía son muchos los investigadores que no recurren a este modelo [18-22].
Síntesis de nuevos herbicidas
Las síntesis de los nuevos herbicidas que ha continuación se presentan se hizo basándose en la familia química a la cual pertenecen.
Alquinos
Investigadores del grupo Monsanto desarrollaron un programa que incluyó la preparación de 56 compuestos derivados del alcohol fenilpropargílico como herbicidas potenciales [23]. La secuencia de reacciones (Esquema 1) involucró la producción inicial de la acetofenona (2), cuyo tratamiento con diisopropilamiduro de litio (LDA) y clorofosfato de dietilo produjo el fosfato de enol (3), el cual con dos equivalentes de LDA (para generar el anión fenilacetiluro) y la 2-metilciclohexanona (4) como electrófilo, condujo al alcohol fenilpropargílico (5) con propiedades herbicidas.

A pesar de que a través de un modelo QSAR se encontró que el compuesto 5 se acercaba al ideal, la compañía suspendió el proyecto por considerar que no era factible comercialmente.
Benzodiazepindionas
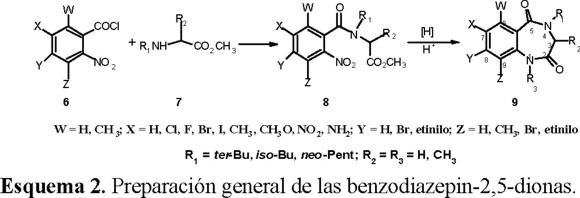
Las benzodiazepinas han sido utilizadas como medicamentos por sus diferentes tipos de actividad (ansiolítico, anticonvulsivo y antitumoral) y en años recientes Karp y sus colaboradores [22, 24] descubrieron la actividad herbicida pre y postemergente de las benzodiazepin-2,5-dionas, la cual se manifiesta por inhibir el transporte de electrones en el fotosistema II. Estos compuestos se obtuvieron (Esquema 2) a partir de cloruros de o-nitrobenzoilo sustituidos 6, los que se hicieron reaccionar con glicinas sustituidas 7, para producir los ésteres o-nitrohipúricos 8; la ciclización final se logró por medio de la reducción del grupo nitro en medio ácido para producir derivados de 9. Los autores obtuvieron 37 derivados al efectuar modificaciones sobre el anillo bencénico y sobre el heterociclo, 16 de los cuales presentaron actividad herbicida de buena a moderada.
Derivados del ácido benzoico
El herbicida KIH-6127, cuyo nombre químico es 2-[(4,6-dimetoxipirimidin-2-il)oxi]-6[1E-(metoxiimino)etil]benzoato de metilo inhibe la enzima acetolactato sintetasa (ALS) y por lo tanto bloquea las biosíntesis de aminoácidos ramificados [25]. La síntesis de este nuevo herbicida, utilizado contra Echinocloa oryzicola, se describe en el Esquema 3.

El 6-acetilsalicilato de metilo 15 se obtuvo a partir de m-hidroxiacetofenona 10, a través de una secuencia de reacciones convencionales [26, 27]. El compuesto 15 se hizo reaccionar con la 2-metilsulfonil-4,6-dimetoxipirimidina para producir el éter pirimidinfenílico 16, y este se trató con la O-metilhidroxilamina para producir el herbicida KIH-6127 (17).
También se sintetizaron análogos de 17 [28, 29], usando diferentes grupos acilo y éster en una secuencia de síntesis similar.
Las modificaciones funcionales simples del grupo carboxilo en el herbicida comercial Dicamba (ácido 2-metoxi-3,6-diclorobenzoico) dieron origen a derivados (alcohol, aldehído, oxima) que también poseen actividad herbicida [30].
Éteres bifenílicos
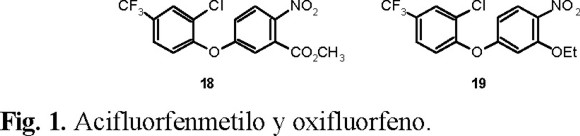
Al modificar la estructura química de derivados de éteres bifenílicos, como el acifluorfenmetilo 18 y el oxifluorfeno 19 (Fig. 1) se obtuvo una nueva familia de herbicidas derivados de las benzoxazinonas [31].
Por ejemplo, para obtener el herbicida 23 se efectuaron modificaciones sobre el éter bifenílico 20 (Esquema 4).

El mismo grupo de investigadores también sintetizó la tetrahidroquinolinona 28 (Esquema 5) para determinar su actividad como herbicida.

En la síntesis de una serie de fenoxifenoxitriazinas y pirimidinas [32] con actividad herbicida potencial, se tomó como modelo el herbicida Clorosulfurón 29 que es una sulfonilurea. Una de estas modificaciones consistió en introducir un grupo fenoxifenoxi en la posición 6 del anillo heterocíclico 30 (Fig. 2), pero este nuevo compuesto no presentó actividad herbicida.
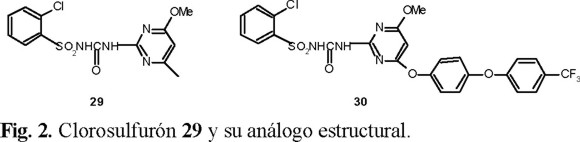
Por otro lado, el cambio del grupo arilsulfonilurea en 30 por metoxi si dio productos con alta actividad herbicida, entre los que destaca el 34 cuya preparación se muestra en el esquema 6.

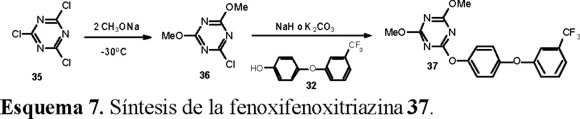
También las triazinas presentaron alta actividad herbicida y una síntesis representativa de este tipo de compuestos se presenta en la Esquema 7.
Karp y colaboradores [33] efectuaron una síntesis de indolinonas con éteres fenólicos en el anillo bencénico, por medio de la reacción de Fischer, como paso clave. A partir de las metoxifenilhidrazonas adecuadas, se obtuvieron las indoleninas 40 que fueron N-alquiladas 41 y oxidadas en medio básico para producir las indolín-2-onas correspondientes 42 (Esquema 8). La preparación del éter fenílico 45 se logró al tratar las metoxiindolinonas con HBr concentrado y el fenol resultante 43 fue arilado con el 2-cloro-4-trifluorometil-5-(X)-fluorobenceno 44 en medio básico.
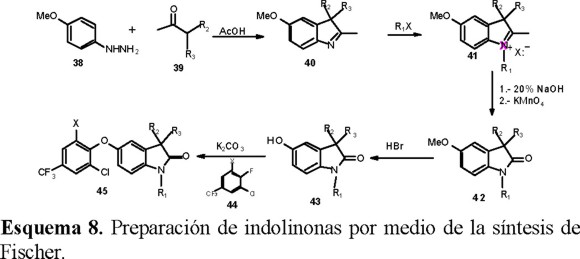
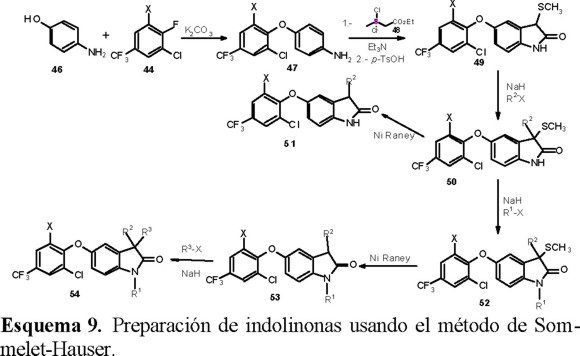
Debido a las drásticas condiciones de la síntesis de Fischer, no fue posible preparar muchos análogos por esta ruta. Por lo tanto, los autores cambiaron la estrategia por otra basada en una ciclización tipo Sommelet-Hauser (Esquema 9) lo que les permitió incorporar varios sustituyentes en el anillo heterocíclico e introducir un sustituyente ariloxi en diferentes posiciones del anillo bencénico.
Una forma interesante de abordar la síntesis de compuestos con actividad biológica fue utilizada por Theodoridis y col. [21], quienes diseñaron una ruta sintética para obtener compuestos que imitan la porción del tetrapirrol (55) en la biosíntesis de la clorofila y por lo tanto podrían actuar como inhibidores de la misma (Esquema 10).

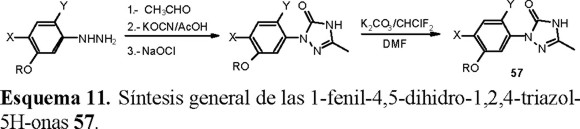
La síntesis general de las 1-fenil-4,5-dihidro-1,2,4-triazol-5H-onas utilizadas como materia prima, se describe en el esquema 11 [34].
A partir de los compuestos 57 se prepararon los herbicidas 58 como se muestra en el Esquema 12.
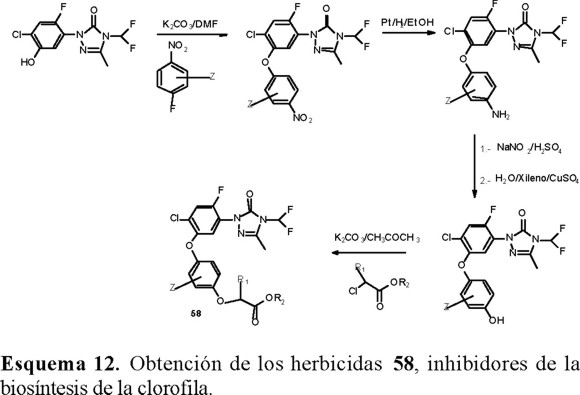
En la práctica, las 1-(2,4-dihalo-5-fenoxifenil)-4-difluorometil-4,5-dihidro-3-metil-1,2,4-triazolin-5(1H)-onas 58, resultaron ser una nueva clase de herbicidas postemergentes altamente activos.
Otros compuestos relacionados, sintetizados por Thedoridis y colaboradores, que presentaron alta actividad herbicida postemergente, fueron los éteres bencílicos que se presentan en el esquema 13 [35, 36]. Nótese que el grupo etéreo en estos compuestos se encuentra en una posición distinta a la de los compuestos del esquema 12.

Éteres bicíclicos
Usando materias primas de fácil acceso, se sintetizaron éteres oxabicíclicos [37], con propiedades herbicidas que se pueden considerar análogos del Cinmetilino 65 (Fig. 3).
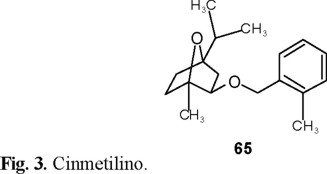
La reacción de Diels-Alder entre el 2-etilbutadieno 66 (Esquema 14) y el anhídrido maleico produjo un aducto que por medio de posteriores reducciones y oxidaciones dio lugar a los herbicidas 71.

Isoxazoles y benzoisoxazoles
Durante la síntesis [38] de isoxazoles sustituidos en 3, 4 y 5, se encontró una nueva clase de herbicidas, los cuales se pueden preparar fácilmente por reacciones de cicloadición 1,3-dipolar, entre cloruros de benzohidroximinoílo y ésteres acetilénicos. Los ésteres intermediarios son fácilmente convertidos a carboxamidas y también a las aminas correspondientes, de acuerdo al esquema sintético 15. Los productos tienen actividad herbicida pre- y postemergente sobre una amplia variedad de malezas.


Wepplo y colaboradores [18] sintetizaron una serie de ésteres de los ácidos 5-ariloxibenzoisoxazol-3-ilacéticos 84 y 5-ariloxibenzoisoxazolil-3-oxi-2-propiónicos, sustancias con alta actividad herbicida pre- y postemergente. En el primer caso, el núcleo básico (Esquema 17) fue obtenido a partir de la 4,6-dihidroxicumarina 82.

Los derivados del ácido propiónico fueron obtenidos a partir del ácido 2,5-dihidroxibenzoico 85 como se muestra en el Esquema 17.
El paso clave es la formación del ácido hidroxámico 86 y su posterior ciclización al benzoisoxazol 87. Las sustancias presentaron tanto una alta actividad herbicida, como una falta de selectividad con los cultivos.
Oxazinas
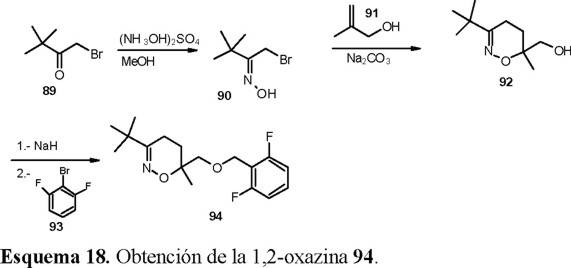
Tomando en cuenta los antecedentes de que las 1,2-oxazolinas presentan actividad herbicida y que los heterociclos con oxígeno de 5 y 6 miembros presentan la misma actividad, se sintetizaron heterociclos de 6 miembros del tipo de las 1,2-oxazinas [39]. A partir de las oximas de α-halocetonas 90 se produjeron in situ los correspondientes nitrosoalquenos que se hicieron reaccionar con alcoholes alílicos, por una reacción de dihetero Diels-Alder para obtener los 1,2-oxazin-6-metanoles 92, los cuales se transformaron a los herbicidas (Esquema 18).
Piridinas
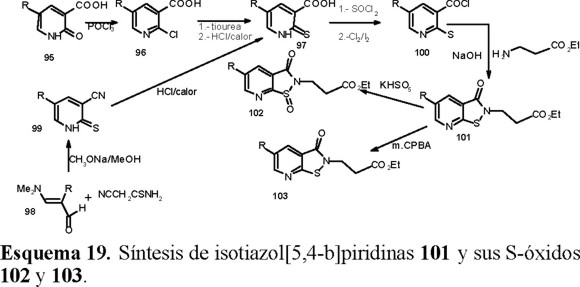
Por medio de programas de computación se determinó que los derivados del 2,3-dihidro-3-oxoisotiazol[5,4-b]piridin-2-alcanoato de etilo 101, sistema poco estudiado como agroquímico, podrían presentar actividad como herbicidas auxínicos [40, 41]. Los compuestos fueron sintetizados como se aprecia en el Esquema 19. Los intermediarios clave, los ácidos 1,2-dihidro-2-tioxo-3-piridincarboxílicos 97, se prepararon por dos caminos; en uno de ellos a partir de los ácidos 1,2-dihidro-2-oxo-3-piridincarboxílicos 5-sustituidos 95 y en el otro se usaron las 3-dimetilaminoacroleínas 2-sustituidas 98.
Hegde y colaboradores [42], descubrieron una nueva familia de herbicidas piridínicos altamente activos que son imidatos cíclicos del 5-amino-2,6-bis(polifluoroalquil)4-isobutilpiridin-3-carboxilato de metilo 106. Estos fueron obtenidos a partir de γ-butirolactonas 104 sustituidas adecuadamente (Esquema 20).

También obtuvieron los tioimidatos cíclicos correspondientes 109 (Esquema 21) al tratar las 4-bromobutiramidas 107 con pentacloruro de fósforo y posterior ciclización con sulfuro de litio.

Una de las modificaciones que se hizo a la estructura del herbicida comercial Benazolín (Fig. 4), consistió en sustituir el anillo bencénico por el de piridina [43].
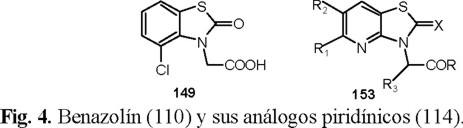
Para la preparación de 114, el anillo de piridina se obtuvo mediante la ciclocondensación de la β-etoxienona 111 con el 4-imino-2-tioxo-3-tiazolidinacetato de metilo 112 para dar 113 (Esquema 22).
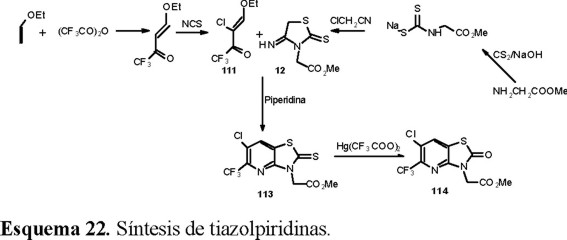
Finalmente la monodesulfuración de 113 se logró en buen rendimiento con trifluoroacetato de mercurio, obteniéndose el 2-oxotiazo[4,5-b]piridin-3(2H)-acetato de metilo 114.
Otras piridinas con actividad herbicida fueron obtenidas por Gajare y sus colaboradores [44], al hacer reaccionar la sal de sodio de la 3,5,6-tricloro-2-hidroxipiridina con 2,4-diarilamino-6-cloro-1,3,5-triazinas.
Quinolinas y quinazolinas
Según Selby y colaboradores [45], ciertos derivados de heteroarenos 115 (Fig. 5) reúnen las características estructurales necesarias para presentar una óptima actividad herbicida.
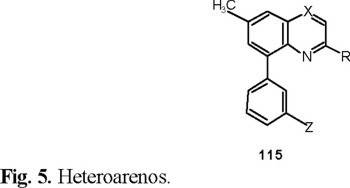
Cuando el átomo X es carbono, la estructura del heteroareno corresponde a la serie de las quinolinas que se pueden sintetizar de acuerdo con el Esquema 23.
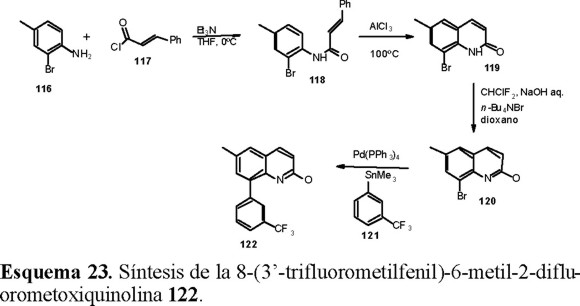
La introducción del grupo fenilo en la quinolina 120 para dar el herbicida 122 se hizo por una reacción de Stille con el derivado arilestánico 121 en presencia de catalizador de paladio(0).
Cuando X es nitrógeno se tienen los derivados de la quinazolina (Esquema 24). El paso clave de la síntesis es una vez más la introducción del grupo trifluorometilarilo, por la reacción de Stille, o por la reacción de Susuki con el correspondiente ácido arilborónico. En este caso se obtuvo una mezcla que se separó para producir los herbicidas 145 y 146.

Sulfonilureas
Las sulfonilureas son compuestos con actividad herbicida y varias de estas sustancias con anillos heterocíclicos fusionados han sido sintetizadas [20] por la reacción entre una sulfonamida y un carbamato de fenilo en presencia de una base (métodos A y B) o introduciendo el grupo sulfonilurea completo por una reacción tipo Friedel y Crafts (método C) (Esquema 25).

Anderson y colaboradores [46] sintetizaron una serie de 1,4-benzoxazin-3-onas con el grupo sulfonilurea en la posición 5 137 (Esquema 26), y otra de 1,4-benzotiazin-3-onas con el grupo sulfonilurea en la posición 8 141 (Esquema 27) y en ambas series encontraron actividad herbicida.


Tetrahidroindazoles
Lyga y colaboradores [47] optimizaron la actividad herbicida de los 2-aril-4,5,6,7-tetrahidroindazoles, modificando los sustituyentes en la posición 3 del heterociclo, por los grupos CH3, CF3, SCH3, OCH3, fenilo, CH3SO2, C≡CH, NH2, H, como se observa en el Esquema 28. Su estrategia sintética fue elaborada a partir de un modelo de QSAR que describe el efecto de dicha posición sobre la actividad herbicida. Sobresale la estrategia seguida para construir el heterociclo en el compuesto 156, en la cual se usa un alcohol protegido como éter de silicio y la posterior eliminación del grupo protector con NH4F. Los rendimientos informados van del 10 al 85 %.
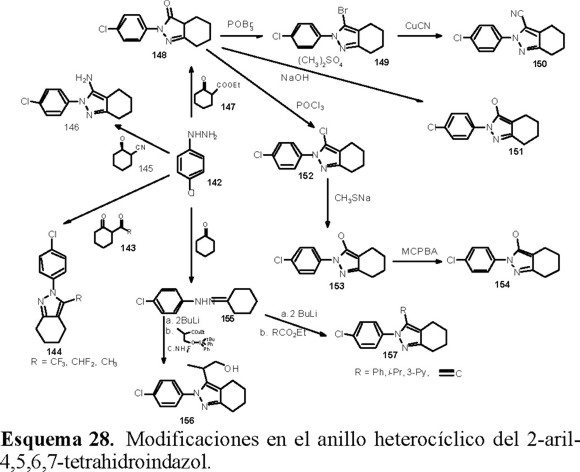
Usando semejanzas estructurales, Parlow [48] obtuvo nuevas sustancias inhibidoras de la síntesis de carotenos.
Tetralinas
Recientemente se informó la síntesis de nuevos tetrahidronaftalenos [49-51], con grupos funcionales en cada una de las posiciones del anillo aromático y con diferentes grupos alquilo en la posición 1 del anillo no aromático. Estos compuestos presentaron actividad herbicida preemergente, la cual está determinada por las características de sustitución antes mencionadas. La síntesis de una tetralina con actividad herbicida se presenta en el Esquema 29.

Ureas y tioureas
La hidantocidina 164 (Fig. 6) es un producto natural que contiene el anillo heterocíclico de hidantoina y que posee potente actividad herbicida sin ser tóxica para los mamíferos.

Sano y colaboradores [52-54] se han dedicado a la tarea de hacer modificaciones estructurales a este compuesto con la finalidad de encontrar los requerimientos mínimos para conservar la actividad herbicida. Por ejemplo, estos autores encontraron que los 3 grupos OH son indispensables para conservar la actividad, pero no así el oxígeno tetrahidrofuránico, que puede ser sustituido por carbono. Con el fin de determinar el papel del anillo de hidantoina en la actividad herbicida, Sano y colaboradores eliminaron el grupo carbonilo de la posición 9 (Esquema 30), o bien, modificaron el carbonilo de la posición 2 (Esquema 31), para transformarlo en la acilguanidina cíclica 166.


Otras modificaciones [55], consistieron en abrir el anillo de hidantoina para obtener un ureido, un derivado del alofano y una ureidoamida para probar sus actividades herbicidas.
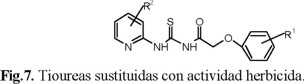
Otros autores [56] sintetizaron 15 derivados de la aciltiourea con actividad herbicida, cuya estructura general es la indicada en la figura 7.
Conclusiones
Las síntesis revisadas mostraron el uso de reacciones tradicionales, aunque en algunas de ellas se aplican otras más modernas, tales como los acoplamientos con paladio o las litiaciones. En lo que se refiere a la química heterocíclica en algunos casos se observaron métodos muy ingeniosos para la construcción de los anillos.
Aunque la aplicación de estudios de QSAR va en aumento, en términos generales se puede decir que no siempre las ecuaciones matemáticas conducen a las síntesis de los compuestos adecuados. En muchos casos el diseño de la síntesis está basado en copiar parte de la estructura de herbicidas naturales, o bien, son producto del azar.
La forma de comunicar los resultados de la parte química algunas veces resulta confusa, ya que no siempre se presentan reacciones químicas, por lo que es difícil interpretar las técnicas cuando estas se incluyen.
Aun cuando existen limitaciones para obtener información acerca de la obtención de nuevos herbicidas, esperamos que esta revisión permita conocer el estado actual en el campo de la síntesis de dichos compuestos, los cuales siguen siendo el mejor método para el control de las malezas.
Referencias
1. Sanders, H. J. Chem. Eng. News 1981, 59, 20-36. [ Links ]
2. Colvin, D. L. Florida's Organo-Auxin Herbicide Rule , Agronomy Department, Florida Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida, 1996. [ Links ]
3. Cremlyn, R. Plaguicidas modernos y su acción bioquímica . Editorial Limusa, México, 1992, 11-26. [ Links ]
4. Takayama, C. H.; Kamoshita, K.; Fujinami, A.; Kirino, O. in: Rational Approaches to Structure, Activity and Ecotoxicology of Agrochemicals. Draber, W.; Fujita, T., Eds., CRC Press; Boca Raton, 1992, 315-330. [ Links ]
5. Plummer, E. L., in: Rational Approaches to Structure, Activity and Ecotoxicology of Agrochemicals, Draber, W.; Fujita, T., Eds., CRC Press; Boca Raton, 1992. 3-39. [ Links ]
6. Hansch, C.; Fujita, T., in: Classical and three-dimensional QSAR in Agrochemistry, Hansch, C.; Fujita, T., Eds., ACS Symposium Series 606, 1995, 1-12. [ Links ]
7. Clark, R. D.; Parlow, J. J.; Brannigan, L. H.; Schnur, D. M.; Duewer, D. L., in: Classical and three-dimensional QSAR in Agrochemistry, Hansch, C.; Fujita, T., Eds., ACS Symposium Series 606. 1995, 264-281. [ Links ]
8. Andrea, T.A., in: Classical and three-dimensional QSAR in Agrochemistry, Hansch, C.; Fujita, T., Eds., ACS Symposium Series 606, 1995, 282-287. [ Links ]
9. Cross, B.; Ladner, D. W., in: Rational Approaches to Structure, Activity and Ecotoxicology of Agrochemicals, Draber, W.; Fujita, T., Eds., CRC Press; Boca Raton, 1992, 331-355.
10. Fujita, T., in: Classical and three-dimensional QSAR in Agrochemistry, Hansch, C.; Fujita, T., Eds., ACS Symposium Series 606, 1995, 13-34. [ Links ]
11. Little, D. L.; Shaner, D. L.; Ladner, D. W.; Tecle, B.; Ilnicki, R. D. Pestic. Sci. 1994, 41, 161-169. [ Links ]
12. Plummer, E. L., in: Classical and three-dimensional QSAR in Agrochemistry, Hansch, C.; Fujita, T., Eds., ACS Symposium Series 606, 1995, 240-253. [ Links ]
13. Hagiwara, K., Nakayama, A. Nippon Noyaku Gakkaishi. 1994, 19, 111-117. [ Links ]
14. Nakayama, A.; Hagiwara, K.; Hashimoto, S.; Hosaka, H., in: Classical and three-dimensional QSAR in Agrochemistry, Hansch, C.; Fujita, T., Eds., ACS Symposium Series No. 606, 1995, 213-228.
15. Iwataki, I., in: Rational Approaches to Structure, Activity and Ecotoxicology of Agrochemicals, Draber, W.; Fujita, T., Eds., CRC Press; Boca Raton, 1992, 397-426. [ Links ]
16. Soskic, M.; Sabljic, A. Pestic. Sci. 1995, 45, 133-141. [ Links ]
17. Reddy, K. N.; Locke, M. A. Weed Sci. 1994, 42, 453-461. [ Links ]
18. Wepplo, P.; Birk, J. H.; Lavanish, J. M.; Manfredi, M.; Nielsen, D. R., in: Synthesis and Chemistry of Agrochemicals IV, Baker, D. R.; Fenyes, J. G.; Bassarab, G. S., Eds., ACS Symposium Series 584, 1995, 148-160. [ Links ]
19. Maier, A.; Golz, A.; Lichtenthaler, H. K.; Meyer, N.; Retzlaff, G. Pestic. Sci. 1994, 42, 153-161. [ Links ]
20. Ohta, K.; Itoh, S.; Kandou, Y.; Yoshikawa, H.; Ishida, Y. Nippon Noyaku Gakkaishi 1994, 19, 137-141. [ Links ]
21. Theodoridis, G.; Poss, K. M.; Hotzman, F. W., in: Synthesis and Chemistry of Agrochemicals IV, Baker, D. R.; Fenyes, J. G.; Bassarab, G. S., Eds., ACS Symposium Series No. 584, 1995, 78-89. [ Links ]
22. Karp, G. M.; Manfredi, M. C.; Guaciaro, M. A.; Ortlip, Ch. L.; Marc, P.; Szamosi, I. T. J. Agric. Food Chem. 1997, 45, 493-500. [ Links ]
23. Parlow, J. J.; Clark, R. D. J. Agric. Food Chem. 1994, 42, 2600-2609. [ Links ]
24. Karp, G. M. J. Org. Chem. 1995, 60, 5814-5819. [ Links ]
25. Tamaru, M.; Saito, Y. Pestic. Sci. 1996, 47, 125-130. [ Links ]
26. Tamaru, M.; Umezu, K.; Maejima, Ch.; Kageyama, H.; Kimura Y. Synth. Comm. 1994, 24, 2749-2756. [ Links ]
27. Tamaru, M.; Takehi, T.; Masuyama, N.; Hanai, R. Pestic. Sci. 1996, 47, 327-335. [ Links ]
28. Tamaru, M.; Masuyama, N.; Sato, M.; Takabe, F.; Inoue, J. Pestic. Sci. 1997, 49, 76-84. [ Links ]
29. Tamaru, M.; Inoue, J.; Hanai, R.; Tachikawa, S. J. Agric. Food Chem. 1997, 45, 2777-2783. [ Links ]
30. Romero, M. A.; James, M. G.; Miramontes, F. B.; Haro, C. J. Rev. Soc. Quím. Mex. 1995, 39, 15-22 [ Links ]
31. Sumida, M.; Niwata, S.; Fukami, H.; Tanaka, T.; Wakabayashi, K.; Boeger, P. J. Agric. Food. Chem. 1995, 43, 1929-1934. [ Links ]
32. Nezu, Y.; Miyazaki, M.; Sugiyama, K.; Kajiwara I. Pestic. Sci. 1996, 47, 103-113. [ Links ]
33. Karp, G. M.; Condon, M. E.; Arthen, F. J.; Birk, J. H.; Marc, P. A.; Hunt, D. A.; Lavanish, J. M.; Schwindeman, J. A., in: Synthesis and Chemistry of Agrochemicals IV, Baker, D. R.; Fenyes, J. G.; Bassarab, G. S., Eds., ACS Symposium Series No. 584, 1995, 136-148. [ Links ]
34. Theodoridis, G.; Baum, J. S.; Hotzman, F. W.; Manfredi, M. C.; Maravetz, L. L.; Lyga, J. W.; Tymonko J. M.; Wilson, K. R.; Poss K. M.; Wyle, M. J., in: Synthesis and Chemistry of Agrochemicals III, Baker, D. R.; Fenyes, J. G.; Steffens, J. J., Eds., ACS Symposium Series No. 504, 1992, 134-146. [ Links ]
35. Theodoridis, G.; Bhar, J, T.; Davidson, B. L.; Hart, S. E.; Hotzman, F. W.; Poss, K. M.; Tutt, S. F., in: Synthesis and Chemistry of Agrochemicals IV, Baker, D. R.; Fenyes, J. G.; Bassarab, G. S., Eds., ACS Symposium Series 584, 1995, 90-99. [ Links ]
36. Theodoridis, G. Pestic. Sci. 1997, 50, 283-290. [ Links ]
37. Taylor, W. S.; Powell, J. E.; Marsilii, E. L.; Leep, K. J. Pestic. Sci. 1995, 44, 85-87. [ Links ]
38. Hamper, B. C.; Leschinsky, K. L.; Massey, S. S.; Bell, C. L.; Brannigan, L. H.; Prosch, S. D., in: Synthesis and Chemistry of Agrochemicals IV, Baker, D. R.; Fenyes, J. G.; Bassarab, G. S., Eds., ACS Symposium Series 584, 1995, 114-121. [ Links ]
39. Stevenson, T. M.; Patel, K. M.; Crouse, B. A; Folgar, M. P.; Hutchinson, C. D., Pine K. K., in: Synthesis and Chemistry of Agrochemicals IV, Baker, D. R.; Fenyes, J. G.; Bassarab, G. S., Eds., ACS Symposium Series 584, 1995, 197-205. [ Links ]
40. Martínez-Merino, V.; Gil, M. J.; González, A.; Zabalza, J. M.; Navarro, J.; Mañu, M. A. Heterocycles, 1994, 38, 333-344. [ Links ]
41. Gil, M. J.; Zabalza, J. M.; Navarro, J.; Mañú, M. A.; González, A.; Martínez-Merino, V.; Canal, A.; Royuela, M.; Aparicio-Tejo, P. M. Pestic. Sci. 1997, 49, 148-156. [ Links ]
42. Hegde, S G.; Bryant, R. D.; Lee, L. F.; Parrish, S. K.; Parker, W. B., in: Synthesis and Chemistry of Agrochemicals IV, Baker, D. R.; Fenyes, J. G.; Bassarab, G. S., Eds., ACS Symposium Series 584, 1995, 60-69. [ Links ]
43. Hegde, S. G.; Mahoney, M. D.; Jones, C. R., in: Synthesis and Chemistry of Agrochemicals IV, Baker, D. R.; Fenyes, J. G.; Bassarab, G. S., Eds., ACS Symposium Series 584, 1995, 70-77. [ Links ]
44. Gajare, A. S.; Bhawsar, S. B.; Shinde, D. B.; Shingare, M. S. Indian J. Chem. 1998, 37B, 510-513. [ Links ]
45. Selby, T. P.; Denes, R.; Kilama, J. J.; Smith, B. K., in: Synthesis and Chemistry of Agrochemicals IV, Baker, D. R.; Fenyes, J. G.; Bassarab, G. S., Eds., ACS Symposium Series 584, 1995, 171-185. [ Links ]
46. Anderson, J. E.; Bell, S.; Best, W. M.; Drygala, P. F.; Watson, K. G.; Bryan, I. B. Pestic. Sci. 1996, 46, 131-138. [ Links ]
47. Lyga, J. W.; Patera, R. M.; Plummer, M. J.; Halling, B. P.; Yuhas, D. A. Pestic. Sci. 1994, 42, 29-36. [ Links ]
48. Parlow, J. J. J. Heterocyclic Chem. 1998, 35, 1493-1499. [ Links ]
49. Parlow, J. J.; Mahoney, M. D. Pestic. Sci. 1996, 46, 227-235. [ Links ]
50. Parlow, J. J.; Mahoney, M. D. Pestic. Sci. 1995, 44, 137-144. [ Links ]
51. Parlow, J. J. Tetrahedron 1994, 50, 3297-3314. [ Links ]
52. Sano, H.; Mio, S.; Hamura, M.; Kitagawa, J.; Shindou, M.; Honma, T.; Sugai, S. Biosci. Biotechnol. Biochem. 1995, 59, 2247-2250. [ Links ]
53. Sano, H.; Sugai, S. Tetrahedron 1995, 51, 4635-4646. [ Links ]
54. Sano, H.; Sugai, S. Tetrahedron: Asymmetry, 1995, 6, 1143-1150. [ Links ]
55. Sano, H.; Mio, S.; Kumagawa, Y.; Kitagawa, J.; Shindou, M.; Honma, T.; Sugai, S. Biosci. Biotechnol. Biochem. 1996, 60, 1198-1200. [ Links ]
56. Xue, S. J.; Zou, J. S.; Yang, H. J. Chin. Chem. Lett. 2000, 11, 19-20, [ Links ] in: C.A. 2000, 132, 279179c. [ Links ]














