Services on Demand
Journal
Article
Indicators
Related links
Share
Revista de la Sociedad Química de México
Print version ISSN 0583-7693
Rev. Soc. Quím. Méx vol.45 n.1 Ciudad de México Jan./Mar. 2001
Investigación
Medición del contenido calórico de la mata de cobre (Cu2S-FeS) usando un calorímetro de gota
J. Manuel González, Francisco Patiño,* y Eleazar Salinas
Centro de Investigaciones en Materiales y Metalurgia. Universidad Autónoma del Estado de Hidalgo. Carretera Pachuca-Tulancingo km 4.5, Pachuca 42184, Hidalgo, México. Tel. y Fax: (01 7)7172-000 Ext. 6713; Fax: (01 7) 7172-000 Ext. 6713.
Recibido el 27 de junio del 2000.
Aceptado el 12 de marzo del 2001.
Resumen
El propósito de este trabajo fue determinar el contenido calórico de la mata de cobre (Cu2S-FeS) para evaluar el balance de calor en el convertidor de cobre. Los contenidos de calor de algunas matas (Cu2-FeS) fueron determinados en un intervalo de temperaturas de 1073 a 1473 K usando un calorímetro de gota.
Los contenidos de calor de 100 % FeS, 75 % FeS-25 % Cu2S, 50 % FeS-50 % Cu2S, 25 % FeS-75 % Cu2S y 100 % Cu2S a 1473 K son 1253, 1134, 1008, 879 y 756 J/g, respectivamente, disminuyendo cuando se incrementa el grado de la mata.
Palabras clave: Contenido calórico, mata de cobre, calorímetro.
Abstract
The purpose of this study was to find the heat content of the Cu2S-FeS matte for evaluating the heat balance in copper converting. The heat content of some Cu2S-FeS mattes were determined in a temperature interval from 1073 to 1473 K by using a drop calorimeter. The heat contents of 100 % FeS, 75 % FeS-25 % Cu2S, 50 % FeS-50 % Cu2S, 25 % FeS-75 % Cu2S and 100 % Cu2S at 1473 K are 1253, 1134, 1008, 879 and 756 J/g, respectively, decreasing with increasing matte grade.
Keywords: Heat content, Cu2S-FeS matte, calorimeter.
Introducción
La conversión es la segunda etapa del proceso de fusión-conversión mediante la cual la mayoría de los concentrados sulfurosos (Cu-Fe) se convierten en cobre metálico [1]. El proceso de oxidación de (Fe y S) en la mata fundida dentro del horno de fundición se realiza cuando se inyecta aire o aire enriquecido con oxígeno para producir cobre metálico fundido. Todo el calor necesario para mantener los líquidos del convertidor a la temperatura específica proviene de la oxidación del fierro y el azufre [2].
En la primera etapa (etapa de formación de escoria) [1, 3, 4] el FeS en la mata es oxidado y escoriado agregando un fundente base sílice, de la siguiente manera:
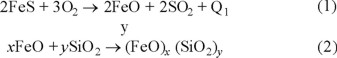
La segunda etapa (etapa de formación de blister) [1, 3, 4] comienza cuando el FeS casi se ha eliminado:
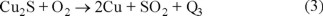
Las reacciones (1) y (3) son exotérmicas y producen los calores Q1 y Q3; por lo tanto, durante la etapa de conversión la temperatura en el convertidor se puede incrementar rápidamente siendo necesario agregar cobre frío [4], mata sólida, chatarra de retorno y desperdicios para enfriar el convertidor. Así pues, vemos que es muy importante en la operación de conversión evaluar el proceso de calentamiento.
Los contenidos calóricos de las fases mata y escoria, así como los gases de salida son esenciales para la evaluación del proceso de calentamiento; sin embargo, poco se conoce respecto al contenido calórico de la fase mata. El propósito de este estudio fue determinar el contenido calórico de la mata de cobre (Cu2S-FeS) a temperaturas elevadas, así como evaluar el proceso de calentamiento en la conversión, usando para este propósito la determinación del contenido calórico de la fase en cuestión.
Parte experimental
Las muestras de Cu2S y FeS fueron sintetizadas pirometalúrgicamente, usando cobre, fierro, así como polvo de azufre, todas éstas químicamente puras. La materia prima fue colocada en una ampolla de cuarzo sellada al vacío y calentada a 923 K durante una semana. Las muestras sinterizadas de sulfuro fueron analizadas por difracción de rayos-X, confirmando la presencia de calcosita (Cu2S) y pirrotita (FeS).
El calorímetro de gota [5] fue utilizado como el aparato experimental para determinar el contenido calórico, como se muestra en la Fig. 1. Está compuesto de un horno de calentamiento, un controlador de temperatura, un mecanismo de goteo y el cuerpo del calorímetro. El contenedor de la muestra es una ampolla de vidrio sellada al vacío para prevenir la oxidación y volatilización de la muestra. La ampolla fue colocada en un crisol de platino el cual fue mantenido a temperatura constante en la región del horno por medio de un alambre de kanthal.

El cuerpo del calorímetro está compuesto de un recipiente aislado térmicamente conteniendo 1530 mL de agua destilada a 287.4 K con un tubo cilíndrico de cobre fijado en el centro que funciona como una cámara de radiación mientras se agita a una frecuencia de 2.8 s−1. La temperatura del baño de agua se midió con un termómetro de resistencia de platino con una aproximación de ± 0.001 K.
Se colocaron aproximadamente 3.4 g de muestra en el contenedor y las mediciones fueron realizadas equilibrando la muestra en el horno a la temperatura deseada. Luego se abren las contraventanas de cobre y asbesto, dejando caer la muestra dentro de la cámara de radiación. El incremento en la temperatura del baño de agua fue registrado en función del tiempo hasta un máximo alcanzando el equilibrio constante en el calorímetro.
Las mediciones fueron obtenidas en un rango de temperatura de 1073 a 1473 K. El contenido calórico está definido por la ecuación 4, en donde la temperatura de referencia es de 298 K.

Resultados y discusión
Los puntos de fusión de cada sulfuro y las temperaturas de las mezclas de sulfuros líquidos son conocidos a partir de los diagramas de fase binarios del sistema Cu2S-FeS elaborados por Kopylov y Novoselov [6], como se muestra en la Fig. 2. De estos diagramas es posible conocer las temperaturas eutéctica y peritéctica, en las cuales se realizan las transformaciones de sólido a líquido de los diferentes sulfuros y sus mezclas. De acuerdo con la Fig. 2 los contenidos calóricos [HT-H298] (J/g) de la mata Cu2S-FeS fueron determinados para 100 % Cu2S, 75 % Cu2S-25 % FeS, 50 % Cu2S-50 % FeS, 25 % Cu2S-75 % FeS, y 100 % FeS.

Los resultados se muestran en la Fig. 3 en relación con la temperatura.
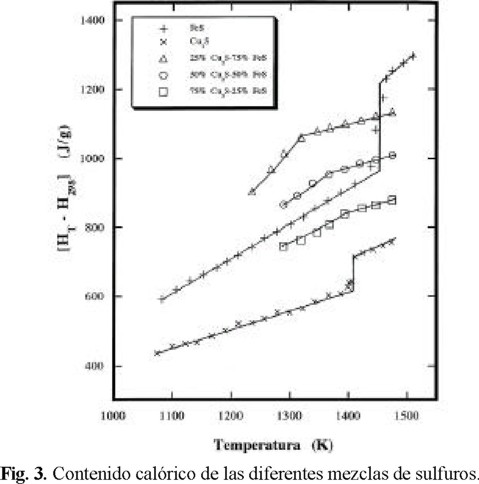
Como se muestra en la Fig. 3 los contenidos calóricos de FeS y Cu2S en el estado sólido se incrementan casi linealmente con la temperatura. Los contenidos calóricos de estos sulfuros también parecen cambiar linealmente con la temperatura en sus rangos líquidos. Los contenidos calóricos de las mezclas de sulfuros presentan puntos de deflexión correspondientes a las temperaturas eutéctica o peritéctica, y se incrementan casi linealmente en la región de líquido. Como se puede observar en la Fig. 3 el contenido calórico de la fase líquida representa el máximo de 100 % FeS, seguida por la mezcla de 75 %, 50 %, 25 % y 0 %, y representa el mínimo para Cu2S, (0 % FeS).
Los valores del contenido calorífico a 1473 K se muestran en la Fig. 4, en relación con el porcentaje de Cu en la mata (grado de mata), los cuales fueron obtenidos de la Fig. 3, se puede observar que [H1473-H298] (J/g) parece decrecer casi linealmente con el porcentaje de Cu en la mata.

Usando la relación dada en la Fig. 4, el balance de calor en el proceso de conversión (etapa de formación de escoria) fue calculado a 1473 K para producir 1000 kg de metal blanco (Cu2S), en base a la siguiente ecuación:
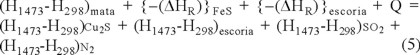
Las entradas del convertidor son mata a 1473 K, sílice (SiO2) a 298 K e inyección de gas a 298 K, las salidas son metal blanco a 1473 K, escoria a 1473 K y gases de salida de SO2 y N2 a 1473 K. En la ecuación (5) [H1473-H298] están los contenidos de las entradas y salidas del material, y (DHR) FeS y (DHR) escoria, son los calores de reacción dados en las ecuaciones (1) y (2).
Q es el calor que se requiere para hacer un balance de calor entre las entradas y salidas del convertidor. Cuando Q es positivo (+), se debe adicionar calor al convertidor. Cuando Q es negativo (−), el calor está en exceso y debe ser sustraído del convertidor. En este caso debe ser cargado material frío al convertidor.
Como se muestra en la Fig. 5, Q es negativo (−), esto significa que en el proceso existe exceso de calor. Q es más negativo (−) con inyección de oxígeno puro que con la inyección de aire, ya que el nitrógeno gaseoso no se agrega en la inyección de oxígeno puro, del cual el contenido calórico es alto a 1473 K, Q comienza a ser menos negativo cuando el grado de mata cargado en el convertidor se incrementa.

Conclusiones
1. Los valores del contenido calórico decrecen cuando el grado de la mata se incrementa, como se muestra en la Tabla 1.

2. En el proceso de calentamiento la cantidad de calor disminuye cuando el grado de la mata se incrementa.
3. Los valores calculados de calor en forma negativa, confirman que el proceso de conversión es exotérmico.
4. Los requerimiento de energía para el proceso de conversión son principalmente proporcionados por la oxidación de fierro y azufre.
Agradecimientos
Los autores agradecen al Dr. Kimio Itagaki por su invaluable enseñanza para desarrollar el presente trabajo de investigación realizado en el Instituto de Procesamiento de Materiales Avanzados de la Universidad de Tohoku en Sendai Miyagi, Japón y al Centro de Investigaciones en Materiales y Metalurgia de la Universidad Autónoma del Estado de Hidalgo.
Referencias
1. Biswas, A.; Davenport, W. Extractive Metallurgy of Copper, Pergamon, 3rd Ed., 1994, 1-22, 74-99, 194-223. [ Links ]
2. Burroughs, Ch. Non Ferrous Extractive Metalurgy, Limusa, 1a. Ed., 1989, 97-99. [ Links ]
3. Rosenqvist, T. Principles of Extractive Metallurgy, McGraw-Hill, 2nd Ed., 1983, 19-38, 324-44. [ Links ]
4. Newton, J.; Wilson, C. Metallurgy of Copper, John Wiley & Sons Inc., 1942, 76-187. [ Links ]
5. Hasegawa, H.; Kanda, M.; Itagaki, K. "Heat Content of Calcium Ferrite Slag" Metallurgical Review of MMIJ, Vol. 4, No. 2, 1987, 75-88. [ Links ]
6. Levin, E.; Robbins, C.; Murdie, H. Phase Diagrams for Ceramist, The American Ceramics Society Inc., 1969, 526. [ Links ]














