Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química de México
Print version ISSN 0583-7693
Rev. Soc. Quím. Méx vol.44 n.4 Ciudad de México Oct./Dec. 2000
Investigación
Estudio de la microporosidad de carbones activados por adsorción de benceno, ciclohexano y nitrógeno
Gelacio Aguilar Armenta* y Lourdes Díaz Jiménez
Centro de Investigación de la Facultad de Ciencias Químicas, Benemérita Universidad Autónoma de Puebla, Blvd. 14 Sur y Av. San Claudio, Ciudad Universitaria, Puebla 72570, Pue., México. Fax: 2 225 584. geaguila@siu.buap.mx
Recibido el 12 de mayo del 2000.
Aceptado el 12 de octubre del 2000.
Resumen
Se presentan los resultados del estudio de la porosidad de tres muestras de carbones activados comerciales a partir de las isotermas de adsorción de benceno y ciclohexano (295 K) y N2 (75.5 K), obtenidas en un sistema volumétrico de alto vacío, construido totalmente en vidrio Pyrex. Se puso especial atención a la medición de las isotermas en el rango de presiones relativas bajas (10−6) con el fin de caracterizar la microporosidad de estos carbones por distintos modelos: Dubinin-Radushkevich (D-R), Gráficas α, Plavnick. El 60% de benceno adsorbido corresponde a la adsorción irreversible y ésta puede ser desorbida sólo a T > 373 K al alto vacío. Se estableció que las tres muestras son principalmente microporosas con una heterogeneidad estructural bastante marcada.
Palabras clave: carbones activados, microporo, adsorción, benceno, nitrógeno.
Abstract
The results of the porosity study of three samples of commercial activated carbons, from adsorption isotherms of benzene (295 K) and N2 (75.5 K), using a high volumetric system, which was made of Pyrex glass, are presented. Special care was taken in the measurement of the isotherms in the range of low relative pressures (10−6) in order to characterize the microporosity of these carbons by different approaches: Dubinin-Radushkevich (D-R), α-plots, and Plavnick. 60% of the adsorbed benzene corresponds to irreversible adsorption, which can only be desorbed at T > 373 K in a high vacuum. It was established that the three samples are basically microporous, with a strongly pronounced structural heterogeneity.
Keywords: activated carbons, micropore, adsorption, benzene, and nitrogen.
Introducción
Desde hace mucho tiempo se conoce que los cuerpos porosos son capaces de retener en su estructura distintas sustancias gaseosas y líquidas. Fontana [1] observó en 1777 que el carbón calcinado adsorbe volúmenes de distintos gases, superiores a su propio volumen. Ese mismo año Scheele [2] reportaba que el "aire" desprendido por el carbón durante su calentamiento era captado de nuevo si el carbón se sometía a enfriamiento y describía este fenómeno con las siguientes palabras: "Yo llené hasta la mitad del volumen de una retorta con carbón seco muy fino y la conecté a un globo, del cual se le fue extraído previamente el aire. Cuando el fondo de la retorta se calentaba hasta el rojo vivo, el globo se expandía. Yo dejé que la retorta se enfriara y el aire regresaba de nuevo del globo al carbón. Yo de nuevo calentaba la retorta y observaba que el aire se desprendía del carbón; y cuando el carbón se enfriaba el aire de nuevo era captado por él". Esta fue, al parecer, la primera observación experimental, aunque cualitativa, reportada del fenómeno de adsorción. Posteriormente se aclaró que la cantidad de volumen retenido depende del tipo de carbón y de la naturaleza del gas. En 1814 De Saussure [3] estableció que la capacidad de un cuerpo sólido de adsorber gases depende de la superficie accesible a la molécula. Mitscherlich [4] en 1843 subrayaba el papel que juegan los poros del carbón en el proceso de la adsorción y estimó que el diámetro medio de poro es de ~ 0.005 mm.
Los adsorbentes microporosos se han utilizado ampliamente, desde hace más de medio siglo, en la resolución de problemas tecnológicos de gran importancia, tales como la separación, purificación y desecado profundo de líquidos y gases. La realización de estos procesos descansa en las propiedades de tamiz molecular y de adsorción selectiva que poseen algunos adsorbentes microporosos, como son los carbones activados y las zeolitas.
El objetivo del presente trabajo consiste en el estudio de las propiedades de la porosidad, principalmente de la microporosidad, de tres muestras de carbones activados (CG, C1 y C2) industriales preparados por la Empresa Nobrac, S. A., utilizando como materia prima la cáscara de coco. A partir de las isotermas de adsorción de benceno (295 K) y de N2 (77 K), medidas desde presiones relativas bajas, se evaluará la estructura porosa de estos adsorbentes por los métodos aproximados: Dubinin-Radushkevich, Plavnick y gráficas α. En la siguiente sección se presenta un breve resumen de los aspectos teóricos de cada uno de estos métodos.
Parte teórica
Las paredes que forman un microporo se encuentran tan cerca una de la otra, que los potenciales de adsorción de éstas se traslapan. Este traslapamiento del campo de fuerzas conduce a interacciones muy fuertes entre el adsorbente y adsorbato, conduciendo a que el proceso en los microporos sea altamente exotérmico y a que éstos sean ocupados totalmente a presiones muy bajas.
1. Modelo Dubinin-Radushkevich (D-R)
Dubinin y col. [5-7] postularon que a la ocupación de los microporos no le antecede la formación de policapas, como ocurre en el caso de los mesoporos, sino que el proceso de la adsorción se verifica por el mecanismo del llenado volumétrico instantáneo. De acuerdo con la Teoría de llenado volumétrico de los microporos de Dubinin, la propiedad fundamental que determina la capacidad que presenta un sólido microporoso de adsorber las moléculas de un gas o vapor no es la superficie específica, sino que el volumen de microporo V0, el cual se determina por la ecuación [8]:
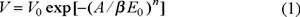
donde: V es el volumen de sustancia adsorbida a una determinada presión relativa P / Po; A = RT ln (Po / P) es el trabajo molar diferencial; n es una constante empírica (n = 1, 2, 3, 4); β es el coeficiente de afinidad del adsorbato y βE0 = E es la energía característica de adsorción del adsorbato dado y E0 es la energía característica del adsorbato estándar. Los valores de V0 y E son constantes (T = const.), y se encuentran a partir de los puntos de la isoterma de adsorción correspondiente: V = f(P / Po)T.
Para la adsorción de benceno y otros adsorbatos en carbones activados comúnmente n = 2, por lo que,

Al sustituir el trabajo molar diferencial de la adsorción A = RT ln (Po / P) en la ecuación (2), se obtiene la ecuación de Dubinin-Radushkevich [9].

El parámetro B refleja las particularidades de la estructura microporosa: cuanto más finos son los microporos, tanto más pequeño es el valor de B. Este parámetro, de acuerdo con la ecuación (3), está relacionado con la energía característica de la adsorción E de la siguiente manera:

Dubinin y Stoeckli [10] establecieron empíricamente que el tamaño de microporo (x) de los carbones activados (benceno-adsorbato estándar) es inversamente proporcional a E0,

donde el factor k aproximadamente depende de E0 según la ecuación

De las ecuaciones (4) y (5) se obtiene

donde M = (0.01915 / k)2
2. Gráficas α
La esencia de este método consiste en comparar la forma de la isoterma de adsorción del adsorbato dado en un adsorbente desconocido con la de la isoterma de adsorción de ese mismo adsorbato en un adsorbente conocido no poroso, siempre y cuando la temperatura a la cual se mida la adsorción en ambos adsorbentes sea la misma. Además, ambos adsorbentes deben ser de la misma naturaleza química. Al adsorbente conocido no poroso se le llama adsorbente de referencia y a la isoterma de adsorción respectiva se le dio el nombre de isoterma estándar. En el método α, desarrollado por Gregg y Sing [11], la isoterma original (a − P / Po) se transforma en la gráfica α de la siguiente manera: a) se obtiene la cantidad de sustancia adsorbida (a)i a determinados valores de presión relativa (P / Po)i; b) se encuentra la relación (ai / a0.4) = αi, es decir, los valores "reducidos" de cada ai, respecto a la cantidad adsorbida (a0.4) a P / Po = 0.4; c) posteriormente se regrafica la isoterma original en las coordenadas ai = f(αi).
Los puntos experimentales de la función ai = f(αi) deben someterse a la ecuación de una línea recta, con pendiente (bα) que pasa por el origen:

Para la comparación de la isoterma de adsorción del adsorbato en un adsorbente X, se encuentran gráficamente los valores de ai a las presiones relativas, correspondientes a αi y se regrafica esta isoterma en las coordenadas (ai − αi) para el adsorbente X.
Si el adsorbente X y el de referencia tienen el mismo tipo de porosidad (ambos son no microporosos), pero distinta superficie específica, la isoterma ai = f(αi) para el adsorbente X será una línea recta, cuya extrapolación pasa por el origen de coordenadas. En el caso de que en el adsorbente (X) haya microporos, se observará que a presiones relativamente bajas (P / Po < 0.4) la cantidad de sustancia adsorbida aumenta bruscamente y para presiones relativas altas (P / Po > 0.4) los puntos pueden ser sometidos a una línea recta, cuya extrapolación al eje de las ordenadas da un segmento α0α=0 proporcional al volumen de microporo:

La superficie específica del adsorbente X bajo estudio S(X) puede ser determinada por la relación de las pendientes de las gráficas de este adsorbente bα(X) y el de referencia bα(R):

donde: S(R) es la superficie específica del adsorbente de referencia.
3. Método de Plavnick
En la ecuación de Dubinin-Radushkevich (3) se supone que existe una distribución discreta del parámetro B. Sin embargo, Plavnick [12] estableció, basándose en investigaciones de rayos X de bajo ángulo, que la estructura microporosa de carbones puede ser representada por un sistema polidisperso con una distribución continua del tamaño de microporo. En concordancia con esto último, Huber y col. [13] hicieron la suposición de que para sistemas porosos heterogéneos la distribución f(B) es una función continua y se describe por la función de Gauss:

donde:

La solución de la ecuación (12) consiste en encontrar, basándose en la isoterma experimental a(y), los parámetros de la función de distribución f(B): B0 — es la posición del máximo de la función f(B); Δ — es la desviación cuadrática media.
Por medio de las expresiones (12) y (13) se puede encontrar también la función de distribución f(x), donde x es el tamaño de los microporos en "forma de rendija". Dubinin y Stoeckli [10] haciendo uso de las ecuaciones (4) y (5) para k ≈ 13 kJ nm / mol, encontraron:

donde: M = 2.17 × 10−6; y x0 es la posición del máximo de la función f(x).
Plavnick [12] propone una ecuación diferente a la (15), la cual relaciona directamente los puntos de la isoterma experimental con la distribución del tamaño de los microporos y que no está condicionada a un determinado tipo de distribución fijado a priori (función de Gauss).
"El radio de inercia — Ri" que se encuentra por "rayos X de bajo ángulo" está relacionado con los parámetros de la adsorción por la relación empírica siguiente [14];

o bien, de acuerdo con la ecuación (4),
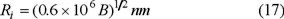
Al considerar una distribución continua del tamaño de microporo, así como, tomando en cuenta la ecuación (17), Plavnick expresa la ecuación de Dubinin-Radushkevich (3) en la forma siguiente:


donde: n(Ri) es la cantidad de microporos en un gramo de adsorbente, cuyos radios se encuentran en el intervalo desde Ri hasta Ri + dRi; V(Ri) es el volumen de microporo con radio de inercia Ri; donde V* — volumen molar del benceno a la temperatura T; k — factor de forma y  es su valor medio.
es su valor medio.
Para la resolución de la ecuación diferencial (18), Plavnick utilizó el método aproximado de Laplace, y llega a las ecuaciones para el cálculo de la distribución del tamaño de microporo:

Parte experimental
Las isotermas de adsorción fueron medidas en un sistema volumétrico de alto vacío, previamente calibrado con He, construido totalmente en vidrio Pyrex y equipado con válvulas de teflón libres de grasa, dos transductores de presión APR-017 Y TPR-017 (Balzers), que miden presiones, respectivamente, en los intervalos de (760-1) y (1-6 × 10−4) Torr. El vacío previo fue creado por una bomba mecánica convencional y el alto vacío por una bomba turbomolecular (Balzers), capaz de alcanzar vacíos del orden de que 10−7 Torr. Las muestras de carbón activado en estudio fueron preactivadas in situ a 280 °C hasta alcanzar una presión residual de 1 × 10−4 Torr. Las isotermas de adsorción de C6H6 y C6H12 se determinaron a 295 K y de N2 a 77 K. Para la preactivación térmica de los adsorbentes se utilizó un horno eléctrico de tipo isotérmico (no programable). La evaluación de la pérdida de peso por calentamiento de las muestras se hizo en un horno convencional a 573 K y presión atmosférica, registrándose periódicamente el peso en una balanza analítica de alta resolución.
Resultados y discusión
1. Adsorción de benceno y ciclohexano en carbón activado C1
El estudio de la adsorción de hidrocarburos, como el benceno y ciclohexano, en carbones activados puede revelar algunas peculiaridades de la estructura porosa. Una característica muy particular de los carbones activados es que sus capacidades de adsorción dependen principalmente de qué tan desarrollado sea su volumen de microporo. En la Fig. 1 se presentan las isotermas de la adsorción total (reversible + irreversible) y reversible del benceno y ciclohexano. Las isotermas de la adsorción total de los hidrocarburos corresponden al caso cuando el carbón activado fue previamente tratado a 280 °C al alto vacío y las de la adsorción reversible fueron obtenidas en el carbón que fue sometido a una preevacuación durante 2 h después de haber obtenido las isotermas de la adsorción total respectivas. Es obvio que la diferencia entre la adsorción total y la reversible representa la cantidad de adsorbato que permaneció en la porosidad del sólido después de que éste se hubo sometido a evacuación, es decir, refleja la cantidad adsorbida irreversiblemente. La evaluación de la adsorción irreversible se utiliza en la práctica para efectos de la etapa de regeneración de los adsorbentes. De acuerdo con los resultados obtenidos, la regeneración del carbón C1 debe hacerse a temperaturas superiores a la del ambiente. De la figura 1 se observa que las cuatro isotermas presentan un salto brusco a presiones relativas bajas (P / P0 < 0.10), por lo que se les puede clasificar como isotermas de tipo I (BDDT). Esto indica que la adsorción de benceno y ciclohexano se lleva a cabo en los microporos del adsorbente (diámetro de poro < 20 Å). Debido a que los diámetros cinéticos del benceno (5.85 Å) y del ciclohexano (6.0 Å) son muy similares, la diferencia bastante marcada entre las isotermas de la adsorción total probablemente no obedezca al efecto de tamiz molecular, sino que a la adsorción selectiva provocada por las interacciones específicas del enlace ϖ de la molécula de benceno con determinados centros activos de adsorción, que para el caso de los carbones activados generalmente son los "oxígenos superficiales" quimisorbidos en los microporos [15].

De acuerdo con los resultados de la figura 1, se establece que para P / P0 = 0.10 el 61 y 55 % de la adsorción total corresponde a la adsorción irreversible del benceno y ciclohexano, respectivamente. La suposición de que las isotermas de la adsorción reversible son de tipo I (BDDT), indica que la adsorción reversible también se lleva a cabo en los microporos, probablemente en los supermicroporos y/o mesoporos muy finos. Por lo tanto, la cantidad de adsorbato que no se desorbió por evacuación a T = 295 K, es decir, la adsorción irreversible, se encuentra ocupando los microporos más finos (ultramicroporos). La adsorción irreversible del benceno (61 %), ligeramente superior a la del ciclohexano (55 %), se debe a la participación de los enlaces ϖ en el proceso de adsorción.
El comportamiento de las isotermas de adsorción de C6H6 y C6H12, sugiere que el carbón activado C1 es un adsorbente con una estructura microporosa heterogénea. Es obvio que los microporos con diámetro menor que el diámetro cinético de los hidrocarburos utilizados (5.85 Å), aunque estuvieran presentes en la microporosidad del sólido no podrían tomar parte en el proceso por dificultades estéricas.
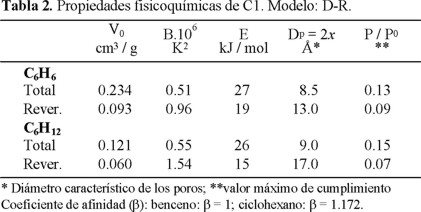
En la Tabla 1 están las características fisicoquímicas del carbón activado C1, encontradas por los modelos clásicos de BET y Langmuir. Los resultados de esta Tabla ratifican lo anteriormente afirmado, que la adsorción de ambos hidrocarburos se lleva a cabo en los microporos, pero ahora esta afirmación puede ser argumentada en forma más precisa. En primer lugar, el valor máximo del intervalo de P / P0 en el que se cumple el modelo BET (coeficiente de correlación: r > 0.99) es extremadamente bajo (< 0.10) en contraposición a lo establecido por la teoría de BET que este intervalo debe extenderse, para isotermas de tipo II y IV, hasta valores máximos de P / P0 = 0.30-0.40. Por otro lado, los valores altos de la constante C, principalmente para la adsorción total, indican que la interacción adsorbente-adsorbato es considerable. El hecho de que la constante C para la adsorción reversible sea mucho menor que la de la adsorción total, obedece a que la mayor energía de interacción adsorbente-adsorbato le corresponde a la adsorción irreversible en los microporos más finos.

El modelo Langmuir, para el tratamiento matemático de los puntos experimentales de las isotermas de la figura 1, mostró una descripción perfecta de las isotermas de la adsorción total hasta P / P0 = 0.465 (benceno) y P / P0 = 0.380 (ciclohexano), en cambio para la adsorción reversible se establece una descripción similar a la observada para el caso BET.
De acuerdo con ambos modelos, se establece que las isotermas de la adsorción total son de tipo I. Sin embargo, para el caso de las isotermas de la adsorción reversible no está tan clara la situación, ya que los dos modelos las describen sólo para valores de P / P0 < 0.10. Según Langmuir no son de tipo I, pero según BET se parecen más a las de tipo I que a las de tipo II o IV. Los datos de la Tabla 2, deducidos de las isotermas en cuestión por medio de su tratamiento por el modelo D-R (ecuaciones 3, 4 y 5), pueden proporcionar algunos criterios complementarios al respecto. La energía característica (E) de la adsorción total es considerablemente superior a la de la adsorción reversible. Los valores de la constante (B) indican que la adsorción reversible de ambos hidrocarburos se lleva a cabo en poros de mayor tamaño que la adsorción total respectiva, lo que provoca, consecuentemente, que el intervalo (P / P0) de cumplimiento se haga más angosto al pasar de la adsorción total a la reversible. El tamaño (5) de los microporos (x es la semianchura de los microporos en "forma de rendija") que participan en la adsorción reversible son microporos anchos, en los cuales pueden formarse como máximo dos y tres capas moleculares de benceno y ciclohexano, respectivamente. Por lo tanto, las isotermas de la adsorción reversible de la figura 1 no son las clásicas II y IV, es decir, la adsorción reversible de ambos hidrocarburos, principalmente del C6H12,en el carbón activado C1 se lleva a cabo en los poros de transición (supermicroporos), que se encuentran entre los microporos y mesoporos finos. Fue establecido que el comportamiento de la adsorción del benceno y ciclohexano para los carbones C2 y CG fue similar al observado para el carbón C1.
2 Adsorción de benceno en los carbones activados C1, C2 y CG
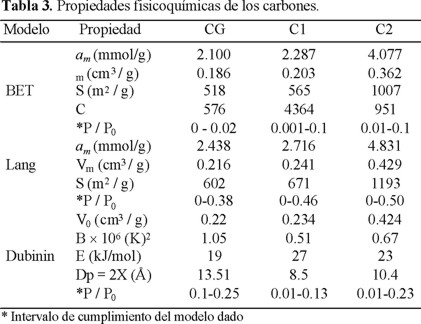
En la Fig.2 se presentan las isotermas de adsorción de benceno, estableciéndose que la cantidad de sustancia adsorbida aumenta en la secuencia CG < C1 << C2 y, además, que las tres isotermas son de tipo I. Es importante subrayar que los puntos de la isoterma para C1 corresponden a dos series de mediciones, utilizando muestras distintas de adsorbente del mismo lote, reflejándose un alto grado de reproducibilidad de los resultados experimentales. Debido a que las tres isotermas son de tipo I, el modelo BET se cumple sólo hasta P / P0 ≤ 0.10 (Tabla 3), mientras que el modelo Langmuir las describe en un amplio intervalo de presiones relativas, incluso hasta P / P0 = 0.50 para el caso del carbón C2. Los datos de esta tabla revelan, como era lógico de esperar por el comportamiento de las tres isotermas de la figura 2, que la superficie específica aumenta en el orden CG < C1 < C2. Se obseva, además, que existe muy buena concordancia entre el volumen de microporo (V0-Dubinin) y el volumen total adsorbido en la monocapa (Vm - Langmuir). La divergencia entre V0 y Vm es de 1.8; 2.9 y 1.2% para el CG, C1 y C2, respectivamente. Esto último indica que la adsorción de benceno se lleva a cabo exclusivamente en la microporosidad de los carbones, donde no existe la posibilidad de que se formen policapas en las paredes de los microporos.

A diferencia de las isotermas de la figura 1, las de la figura 2 fueron medidas en la zona de extremadamente bajas presiones relativas P / P0 ≥ 1 × 10−5. La obtención de los puntos experimentales en esta zona permite estudiar con mayor detalle la microporosidad, y por lo tanto, encontrar información complementaria a la deducida de las isotermas a presiones relativas comunes (P / P0 ≥ 0.01).
En la figura 3 están dibujadas las isotermas de la figura 2 a presiones relativas muy bajas (0.00001 ≤ P / P0 < 0.01). Fue establecido que el carbón activado C2 a presiones relativas P / P0 < 0.0003 adsorbe menores cantidades que CG y C1. En la figura 4 se encuentran las isotermas a presiones relativas aún más bajas (0.00001 ≤ P / P0 ≤ 0.003). Es importante informar que en esta zona la adsorción de benceno en las tres muestras fue extremadamente lenta, particularmente para la muestra C2.
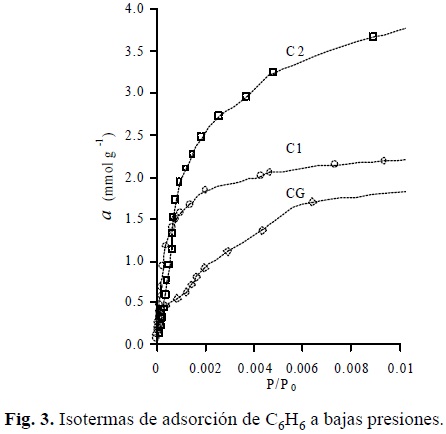
De acuerdo con los conceptos teóricos, la adsorción en cuerpos sólidos microporosos al inicio de la isoterma (P / P0 → 0) se lleva a cabo en los microporos más finos, siempre y cuando estos sean accesibles a las moléculas del adsorbato. En el caso de la adsorción de benceno sólo participan aquellos microporos con diámetros mayores a los 5.85 Å. Las isotermas para CG y C1 presentan dos escalones (Fig.4), mucho más marcado para CG, mientras que para C2 se observa claramente un periodo de inducción en el sentido de que la abscisa crece más rápido que la ordenada. Es muy probable que la presencia de escalones obedezca a que en el proceso participan microporos de distinto tamaño y que el periodo de inducción se deba a impedimentos o dificultades de penetración de la molécula de benceno a cavidades (poros) total o parcialmente inaccesibles. Es obvio que estas suposiciones deben ser verificadas por medio de la adsorción de moléculas de menor tamaño.
Con el fin de evaluar la probabilidad de la existencia de distintos tamaños de microporo se utilizó el método propuesto por Plavnick [12]. Las curvas de distribución encontradas por la expresión (19), se encuentran en la Fig. 5. El comportamiento de las isotermas de la Fig. 4 parece que está reflejado en las curvas de distribución. Los dos escalones de CG conducen a la aparición de dos máximos en las posiciones de 6.6 y 9.6 Å, mientras que en las curvas de distribución de C1 y C2 se dibujan máximos en la región de 7.5 y 8.5 Å, respectivamente, aunque para la muestra C1 se observa además, una especie de codo en la región de los 6 Å.

3. Adsorción del N2
3.1. Isotermas de adsorción
La aplicación del método clásico de la adsorción del N2 a su temperatura de ebullición (75.5 K en la ciudad de Puebla) puede proporcionar información valiosa, complementaria a la ya descrita en la sección anterior, sobre las características de la superficie y porosidad de los carbones activados en estudio, en virtud de que la molécula de N2, con diámetro cinético de 3.64 Å, puede penetrar a ultramicroporos inaccesibles a la molécula de benceno.
Como se esperaba, las isotermas de adsorción del N2 (Fig. 6) en las tres muestras son de tipo I (BDDT) y aparecen en la misma secuencia que las de la figura 2 (CG < C1 < C2), pero con la diferencia de que esta secuencia fue observada en todo el intervalo de presiones de equilibrio estudiado (1 × 10−6 ≤ P / P0 ≤ 0.99). Con fines de comparación, en la Fig.6 están incluidas también las isotermas de la figura 2 expresadas en volumen de líquido adsorbido, considerando que los volúmenes molares (VM) del N2 y benceno en el estado adsorbido, a las temperaturas experimentales, es igual a sus respectivos volúmenes molares en estado líquido: VM (N2) = 34.68 cm3 / mol; VM (C6H6) = 88.9 cm3 / mol. Se observa que en el carbón C2 ambos adsorbatos se adsorben prácticamente en las mismas cantidades, mientras que C1 y CG adsorben más nitrógeno que benceno. Así por ejemplo, a P / P0 = 0.10 el benceno se adsorbe en 2.9; 21.4 y 14.2 % menos que N2 en C2, C1 y CG, respectivamente. Para la muestra C2 la divergencia está dentro del límite de error (< 5.0 %), pero para C1 y CG es considerable. Es decir, la divergencia en la adsorción de ambos adsorbatos aumenta en la secuencia C2 < CG < C1.

Con base en la similitud existente entre las isotermas de adsorción de N2 y C6H6 (Fig. 6) para el carbón C2 se establece que las moléculas de este hidrocarburo penetran libremente a la microporosidad de C2 y que el periodo de inducción, observado para la adsorción de benceno en este carbón (Fig. 4), probablemente obedezca a que la adsorción a bajas presiones se lleva a cabo en centros de adsorción poco activos y en los cuales las interacciones colaterales entre las propias moléculas de adsorbato son significativas. Es hasta cierto punto lógico suponer que para el caso de CG y C1 existe, respectivamente, el 14 y 21 % de microporos que son inaccesibles a la molécula de benceno.
3.2. Gráficas α
Las isotermas de adsorción del N2 (Fig. 6) fueron transformadas en las gráficas α (Fig.7), tomando como isoterma estándar a la obtenida por Rodríguez Reinoso y col. [16] al adsorber nitrógeno (77 K) en un carbón no poroso (Tabla 4). Las gráficas α para las tres muestras de carbón presentan dos rectas localizadas a bajas y altas presiones relativas y una zona intermedia. Al extrapolar las rectas a altas presiones hasta el eje de las ordenadas, se encuentra el volumen total de microporo V0α por la ecuación (9) y utilizando la ecuación (11) se evalúa la superficie específica correspondiente a la mesoporosidad. De la figura 7, y Tabla 4, se establece que el aumento de la adsorción en el intervalo 0.005 ≤ P / P0 ≤ 0.94 es menor que el registrado en la zona 0 ≤ P / P0 ≤ 0.005, lo que significa que la ocupación principal de los microporos se lleva a cabo a presiones relativas muy bajas. Por otro lado, se observa claramente que la zona intermedia para C2 se extiende hasta P / P0 ≈ 0.70 y para C1 y CG, hasta P / P0 ≈0.50. Este hecho probablemente obedezca a que la muestra C2 posea, respecto a las otras dos, una distribución más ancha de tamaño de microporo, así como una superficie específica de la mesoporosidad mayor.

Los datos de la Tabla 5 indican que cuando la presión relativa alcanza el valor de 0.005 se encuentra ocupado alrededor del 80 % del volumen total de microporo y que el 20 % restante corresponde al llenado de microporos más anchos. Por lo tanto se está suponiendo, basándose en la existencia de la zona intermedia considerablemente extendida (Fig.7), que las tres muestras presentan una estructura microporosa marcadamente heterogénea.

En la Tabla 6 se reúnen las propiedades texturales de los carbones activados. Como consecuencia del tipo I de las isotermas (Fig. 6), el modelo Langmuir describió perfectamente bien los puntos experimentales hasta 0.35-0.40 de presión relativa, en cambio el modelo BET sólo lo hizo hasta P / P0 ≤ 0.10. De acuerdo con las dos últimas columnas de la Tabla 5 y la última de la Tabla 6, la muestra C1 posee una estructura microporosa ligeramente más homogénea y con microporos más finos que las otras dos. Tal vez con esto último esté relacionado el hecho de que la constante B de Dubinin (Tabla 3) adquiera el valor más bajo precisamente para C1. Los valores de la superficie específica encontrada por la adsorción de benceno (Tabla 3) y nitrógeno (Tabla 6) están en correspondencia con el comportamiento de las isotermas respectivas (Fig. 6) y llama la atención la coincidencia prácticamente total de la superficie específica (Langmuir) de C2 encontrada a partir de la adsorción de ambos adsorbatos: 1193 y 1197 (m2 / g) para benceno y nitrógeno respectivamente.

3.3. Modelo Dubinin-Radushkevich
La ecuación (1) de la teoría del llenado volumétrico de los microporos (TVFM) generalmente describe, en un amplio intervalo de P / P0, las isotermas de adsorción (n = 2) en adsorbentes con estructura microporosa homogénea, como la de los carbones activados con propiedades de tamiz molecular de la familia MSC. Sin embargo, para caracterizar los carbones activados con estructura microporosa heterogénea, es decir, con distribuciones anchas del tamaño de microporo, es necesario utilizar distribuciones de energía polimodal con i subestructuras [10]:
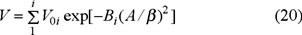
Así, para describir la adsorción en sólidos microporosos con estructura bimodal, la ecuación (20) toma la forma:

en la cual (V01, B1) y (V02, B2) son los parámetros correspondientes a los microporos y supermicroporos, es decir, a la primera y segunda subestructuras, respectivamente.
Las isotermas de adsorción de N2 a 77 K (Fig. 6) fueron tratadas por la ecuación clásica (20), obteniéndose dos rectas (Fig. 8): la primera en el intervalo de aproximadamente 10−4 ≤ P / P0 ≤ 0.01, y la segunda en la zona de 0.01 ≤ P / P0 ≤ 0.30. Para la muestra C1, este comportamiento no fue tan marcado como el observado para las otras dos muestras. En la Tabla 7 se presentan los volúmenes de microporo y, con fines de comparación, se incluyen también los deducidos de las gráficas α. La penúltima columna indica que el aporte (%) del volumen de microporo de la segunda subestructura en el volumen total de microporo V0D aumenta en el orden C1 < C2 < CG. Se establece, por otro lado, que entre los valores del volumen de microporo encontrado por ambos métodos existe una muy buena concordancia (última columna, Tabla 7). Sin embargo, los valores del volumen de microporo (D-R) encontrado por la adsorción de benceno (Tabla 3) prácticamente coinciden sólo para el carbón C2, mientras que para los otros dos la divergencia es del orden de 18 y 10 % para C1 y CG, respectivamente. Tal vez esto esté relacionado con la distribución ancha del tamaño de microporo de C2, en la cual se llevan a cabo los procesos de llenado primario y secundario de los microporos por las moléculas de benceno.


De la figura 8 fueron encontradas las constantes estructurales respectivas Bi (ecuación 21) y por la relación empírica Bi = c(xi)2, propuesta por Dubinin y Stoekli [10], se evaluó el tamaño de microporo xi, donde c = 0.01 (kJnm / mol)−2. En la Tabla 8 están los valores de las energías características de adsorción E0i, así como los de Bi y xi. Al comparar los datos encontrados por la adsorción de N2 a su temperatura de ebullición con los evaluados por la adsorción de benceno a 295 K (Tabla 3), se establece que la concordancia es aceptable para las muestras C1 y C2, mientras que para CG existen diferencias considerables. El método de la adsorción del CO2 a 0 y 20 °C, en carbones activados, se usa frecuentemente [16] para la caracterización de microporos más finos con diámetros de microporo en el intervalo de 3 a 5 Å (ultramicroporos), obteniéndose isotermas de tipo I. En un trabajo anterior [17] se estableció que la muestra CG presenta baja adsorción de este gas a 17 °C, especialmente a presiones de equilibrio bajas, lo cual significa que este carbón no es ultramicroporoso.

Conclusiones
El estudio de la adsorción de benceno a 295 K reveló que alrededor del 60 % de la cantidad total adsorbida de este hidrocarburo corresponde a la adsorción irreversible y que ésta sólo puede ser desorbida a T > 393 K. Aunque no hay una coincidencia cuantitativa total entre los valores del tamaño de microporo, evaluados a partir de las isotermas de adsorción a muy bajas presiones relativas por los distintos métodos aproximados utilizados, se pudo establecer que C1 es la muestra con una microporosidad más estrecha que C2 y CG y que las tres muestras son principalmente microporosas con una heterogeneidad estructural bastante marcada.
Referencias
1. Fontana, F. Memorie Mat. Fis. Soc. Ital. Sci. 1777, I, 679-691. [ Links ]
2. Scheele, C.W. Chemical Observations on Air and Fire, 1780, 182-197. [ Links ]
3. De Saussure, N.T. Gilbert's Ann. 1814, 47, 113-118. [ Links ]
4. Mitscherlich, E. Pogg. Ann. 1843, 59, 94-98. [ Links ]
5. Dubinin, M.M.; Zaverina E. D., Zh. Fiz. Khim. 1949, 23, 1129-1138. [ Links ]
6. Dubinin, M.M. Quart. Rev. Chem. Soc. 1955, 9, 101-112. [ Links ]
7. Dubinin, M.M. Zh. Fiz. Khim. 1960, 34, 959-968. [ Links ] Chem. Rev. 1960, 60, 235-241.
8. Dubinin, M.M.; Astakhov, V.A. Izvest. Akad. Nauk, SSSR, Ser. Khim. 1971, 1, 5-17. [ Links ]
9. Dubinin, M.M. Izvest. Akad. Nauk SSSR, Ser. Khim. 1980, 1, 18-22. [ Links ]
10. Dubinin, M.M; Stoeckli, H.F. J. Colloid and Interface Science, 1980, 75, 34-42. [ Links ]
11. Gregg, S. J.; Sing, K. S. W., in Adsorption, Surface Area and Porosity, 2nd Ed, Academic Press, Inc. New York 1982, 98-100. [ Links ]
12. Plavnick, G. M. Zh. Fiz. Khim. 1984, 58, 643-647. [ Links ]
13. Huber, U.; Stoeckli, F.; Houriet, J. P. J. Colloid Interf. Sci. 1978, 67, 195-203. [ Links ]
14. Plavnick, G.M.; Dubinin, M.M. Izv. Akad. Nauk S.S.S.R. Ser. Khim. 1966, No.4, 628-637. [ Links ]
15. Molina-Sabio, M.; Muñecas, M.A.; Rodríguez-Reinoso, F., in Characterization of Porous Solids II, F. Rodríguez-Reinoso, J. Rouquerol, K.S.W. Sing, and K.K. Unger Editors, 1991, Elsevier Science Publishers, Amsterdam, p. 329-339. [ Links ]
16. Rodríguez-Reinoso, F.; Martín-Martínez, J.M.; Prado-Burguete, C.; McEnaney, B. J. Phys. Chem. 1987, 91, 515-516. [ Links ]
17. Cazorla-Amorós, D.; Alcañiz-Monge, J.; Linares-Solano, A. Langmuir 1996, 12, 2820-2824. [ Links ]
18. Hernández-Huesca, R.; Díaz, L.; Aguilar-Armenta, G.; Separation and Purification Technology 1999, 15, 163-173. [ Links ]














