Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista latinoamericana de química
Print version ISSN 0370-5943
Rev. latinoam. quím vol.40 n.2 Naucalpan de Juárez Aug. 2012
Producción en cultivos in vitro de los componentes principales del aceite esencial de Lavandula Angustifolia
Berenice Guadarrama-Floresa, Leticia Buendía-Gonzálezb, Juan Orozco Villafuertec, María Elena Estrada Zúñigaa, Francisco Cruz-Sosaa*
a Departamento de Biotecnología, Universidad Autónoma Metropolitana-Iztapalapa, San Rafael Atlixco No. 186, Col. Vicentina, C.P. 09340 México, D.F., México.
b Facultad de Ciencias, Universidad Autónoma del Estado de México, Campus El Cerrillo, Piedras Blancas Carretera Toluca- Ixtlahauca km 15.5 C.P. 50200 Toluca Estado de México, México.
c Facultad de Química, Universidad Autónoma del Estado de México, Paseo Colón esq. Paseo Tollocan s/n, Col. Residencial Colón, C.P. 50120 Toluca Estado de México, México. *Autor para la correspondencia: cuhp@xanum.uam.mx.
Recibido Junio 2012
Aceptado Septiembre 2012
Resumen
Los principales constituyentes del aceite esencial de Lavandula angustifolia son los terpenoides linalol y acetato de linalilo. Estos compuestos tienen aplicaciones en la industria farmacéutica, cosmética y alimentaria. En este trabajo, para producir estos terpenoides, segmentos de hojas inmaduras de L. angustifolia fueron cultivadas en medio Murashige & Skoog a la mitad de su concentración, suplementado con diferentes concentraciones y combinaciones de 6-benciladenina (BA 0.00, 6.66, 8.88 µM) con ácido 2,4-diclorofenoxiacético (2,4-D; 0.00, 6.79, 9.05 µM) o BA (0.00, 6.66, 8.88 µM) con ácido naftalenacético (ANA; 0.00, 8.05, 10.74 µM). La mayor inducción de callo friable (87%) se obtuvo con el tratamiento conteniendo 6.79 µM de 2,4-D transcurridos 30 d de cultivo. Dos líneas celulares fueron establecidas: 1) callo blanco-grisáceo (GWCL) y 2) callo café (BCL). Se extrajeron muestras en fresco y en seco de ambas líneas celulares con n-hexano (100%) a temperatura ambiente durante 24 h y el contenido de los terpenoides se analizó por cromatografía de gases. Solo fue detectada producción de linalol y acetato de linalilo en la línea celular BCL. El linalol fue el terpenoide producido en mayor proporción (28.45 mg g−1 peso fresco, PF), mientras que el contenido de acetato de linalilo fue menor (11.58 mg g−1 PF).
Palabras clave: Lavandula angustifolia, cultivo in vitro, linalol, acetato de linalilo.
Abstract
The terpenoids linalool and linalyl acetate, are the major volatile constituents of Lavandula angustifolia essential oil, with a wide application in pharmaceutical, cosmetic and food industries. In order to produce these terpenoids, immature leaf explants of L. angustifolia were culture into half-strength Murashige and Skoog medium supplemented with different concentrations and combinations of 6-benzyladenine (BA 0.00, 6.66, 8.88 µM) with 2,4-dichlorophenoxyacetic acid (2,4-D 0.00, 6.79, 9.05 µM) or BA (0.00, 6.66, 8.88 µM) with naphthalene acetic acid (NAA 0.00, 8.05, 10.74 µM). Highest friable callus induction (87%) was obtained in treatment containing 6.79 µM (2,4-D) after 30 d of culture. The callus cultures produced two cellular lines: 1) grayish-white callus (GWCL) and 2) brown callus (BCL) that shows differences in the terpenoids production. Fresh and dry samples were extracted with n-hexane (100%) during 24 h at room temperature and then, the terpenoids content was determinate by gas chromatography. Linalool and linalyl acetate were only detected in BCL. The linalool was the major terpenoid produced in BCL (28.45 mg g−1 fresh weight, FS), while linalyl acetate content was lower (11.58 mg g−1 FS).
Keywords: Lavandula angustifolia, in vitro culture, linalool, linalyl acetate.
Introducción
Lavandula angustifolia Miller pertenece a la familia de las Lamiáceas, se le conoce comúnmente como lavanda. Contiene hasta un 3% de aceite esencial el cual se produce y almacena en los tricomas foliares y en menor proporción en las flores (Guitton et al., 2010a). La producción comercial del aceite de lavanda se inició en Francia y en 1937 Rene Gattefosse reporto en su obra Aromatherapy que las propiedades terapéuticas de la lavanda derivaban de sus aceites esenciales. Actualmente, L. angustifolia se usa en la medicina tradicional por sus propiedades sedantes, diuréticas, hipotensoras, antisépticas, cicatrizantes, antirreumáticas y antiinflamatorias (Cavanagh y Wilkinson, 2002; Cong et al., 2008).
El aceite esencial está constituido principalmente por linalol (20 - 40%) y por acetato de linalilo (30 - 50%) (Petriska et al., 2006). El linalol es un alcohol monoterpénico que tiene un átomo estereogénico en C3, por lo cual existe un par de enantiómeros ((S)-(+)-linalol y (R)-(−)-linalol). El isómero (S)-(+) llamado licareol tiene un olor a limón dulce y floral (umbral 7.4 ppb). El isómero R)-(−) coriandrol tiene un aroma a madera y lavanda (umbral 0.8 ppb) (Casabianca et al., 1997; Lewinshon et al., 2001). Por su olor floral con un toque mentolado y ser intermediario para producir sustancias como la vitamina E, al linalol se le ha conferido alto valor para su uso en las industrias farmacéutica, cosmética y alimentaria (Raguso y Pichersky, 1999). Mientras que al acetato de linalilo se le atribuyen varias actividades biológicas, entre ellas la antiinflamatoria (Peana et al., 2002).
El comercio mundial del aceite esencial de lavanda ascendía para el 2006 a 1000 millones de dólares al año, ya sea de fuentes silvestres o cultivadas, convirtiéndose así en el aceite esencial más popular y versátil del mundo. Cada año se siembran entre 7500 y 12000 plantas/ha, y por cada tonelada de biomasa vegetal procesada se obtienen tan solo nueve litros del aceite esencial, lo cual limita su obtención. Aunado a ello, el contenido de aceite esencial en la planta es variable durante sus seis años de vida productiva, su manejo agronómico aún no está bien establecido, por lo que los productores se enfrentan frecuentemente con la aparición de enfermedades, plagas y cambios climáticos que resultan en bajos rendimientos del aceite esencial (Lange, 2006).
Una alternativa biotecnológica al cultivo tradicional de lavanda para la obtención del aceite esencial, es el cultivo de tejidos vege tales (CTV). Esta herramienta consiste en el cultivo de fragmentos de tejidos u órganos vegetales en un medio nutritivo artificial aséptico y bajo condiciones ambientales controladas con lo que se eliminan proble mas de estacionalidad, variaciones geográficas y fluctuaciones en los rendimientos (Andrade et al., 1999; Muñoz de Malajovich, 2006;). Se han llevado a cabo diversas in vestigaciones sobre propagación de lavanda a través del CTV con la finalidad de obtener material vegetal homogéneo (Xiu-juan et al., 2006; Wang et al., 2007; Xu et al., 2005). No obstante, no existen reportes sobre la producción de linalol y acetato de linalilo en cultivos celulares de lavanda; la producción de metabolitos secundarios es otra aplicación del CTV que ha mostrado en algunas especies mejores rendimientos de producción de compuestos bioactivos al compararse con las plantas completas (Georgiev et al., 2009). El objetivo del presente trabajo fue producir los terpenoides principales del aceite esencial de Lavandula angustifolia (linalol y acetato de linalilo) en cultivos in vitro de callo.
Materiales y métodos
Material vegetal
Las plantas fueron colectadas en el estado de Querétaro, México en el mes de abril de 2010. Las plantas fueron fertilizadas y acondicionadas en el invernadero de la Universidad Autónoma Metropolitana-Iztapalapa. Hojas de 1 cm de longitud fueron removidas de plantas adultas, desinfestadas superficialmente con detergente en polvo al 1% durante 15 min seguido de una inmersión en etanol al 70% durante 30 s, posteriormente en una solución de hipoclorito de sodio al 1.8% con Tween-20 (tres gotas por cada 100 mL de solución) durante 10 min y finalmente bajo condiciones asépticas, lavadas tres veces con agua esterilizada. Segmentos de 0.5 cm fueron sembrados bajo condiciones asépticas en tubos de cultivo (25 X 150 mm) conteniendo 15 mL de medio Murashige & Skoog (MS, 1962) a la mitad de su concentración y suplementado con reguladores del crecimiento vegetal (RCV). Un explante fue sembrado asépticamente en cada tubo de cultivo y un lote de cinco tubos fue evaluado por cada tratamiento y se realizó por triplicado.
Medio de cultivo y condiciones de incubación
El medio de cultivo empleado fue MS a la mitad de su concentración suplementado con 30 g L−1 de sacarosa, 150 mg L−1 de ácido ascórbico, 100 mg L−1 de ácido cítrico y 2 g L−1 de phytagel (Sigma-Aldrich Co., EUA) como solidificante. Para evaluar la respuesta a callo en los explantes foliares inmaduros, los medios de inducción fueron enriquecidos con diferentes concentraciones y combinaciones de RCV: 6-benciladenina (BA; 0.00, 6.66 y 8.88 µM) con ácido 2,4-diclorofenoxiacético (2,4-D; 0.00, 6.79 y 9.065 µM) denominados con los códigos BxDy ó la combinación de BA (0.00, 6.66 y 8.88 µM) con ácido naftalenacético (ANA 0.00, 8.05 y 10.74 µM) representados por los códigos BxAy. Todos los medios de cultivo fueron ajustados a pH de 5.8 con NaOH y HCl 1N, posteriormente fueron esterilizados en autoclave a 121°C durante 18 min. Los cultivos fueron incubados bajo un fotoperíodo de 16 h luz fluorescente a una irradiancia de 50 µmol m−2 s−1 y una temperatura de 25 ± 2°C. La respuesta a callo, de los explantes foliares para cada uno de los tratamientos de inducción, fue expresada como el porcentaje del número de explantes formando callo respecto al total de explantes evaluados (5), el cual fue registrado a los 30 d de cultivo.
Propagación de las líneas celulares
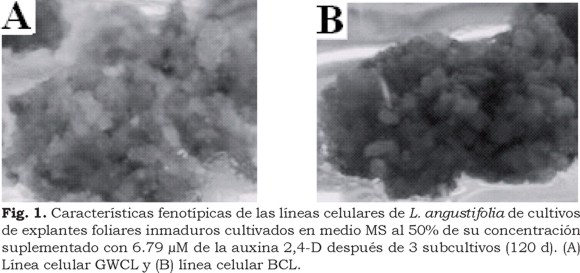
El tratamiento que registro los más altos porcentajes de inducción de callo y que exhibió mayor grado de disgregación (callo friable) fue seleccionado para su proliferación mediante subcultivos en medio fresco con la misma formulación del medio de inducción: 6.79 µM de 2,4-D, los cuales se llevaron a cabo cada 30 d durante seis ciclos de subcultivo. Con posterioridad al primer ciclo de subcultivo el callo generado en el medio de inducción B0D1.5 dio origen a dos líneas celulares: callo blanco-grisáceo (GWCL) y callo café (BCL), ambas líneas fueron propagadas.
Extracción de linalol y acetato de linalilo
Muestras frescas de biomasa de las dos líneas celulares (3 g), hojas y flores de la planta utilizadas como fuente de explantes, fueron sometidas por separado a dos procesos de extracción: 1) extracción con 50 mL de n-hexano (100%) a temperatura ambiente durante 24 h dos veces y 2) extracción con 50 mL de diclorometano (100%) a 45 °C durante 30 min tres veces. En ambos casos, los extractos obtenidos se filtraron y concentraron a presión reducida a un volumen final de 5 mL. Cada proceso de extracción se llevo a cabo por triplicado.
Determinación de linalol y acetato de linalilo en extractos por cromatografía de gases
Para determinar el contenido de los terpenoides se empleó un Cromatógrafo de Gases Autosystem XL (Perkin-Elmer, EUA) acoplado a un detector de ionización de llama, equipado con una columna capilar HP-5 (5% de siloxano, 30m x 0.32mm I.D., y 0.25µm de espesor, Agilent Technologies, EUA); el gas acarreador fue helio (1 mL min1). Las condiciones experimentales fueron: 100 - 210 °C (15° C min−1); temperatura del inyector y del detector 240 y 250 °C, respectivamente (Modificado de Javidnia et al., 2002). Inyección, split-splitless; split ratio, 1:10. El volumen de inyección de 1 µL de extracto. Soluciones stock de estándares de linalol y acetato de linalilo (50 mg mL−1; Sigma-Aldrich Co., EUA) fueron diluidas de manera independiente para obtener su correspondiente curva de calibración (100, 150, 200 y 300 µg mL−1; coeficiente de determinación [r2] = 0. 9785 y 0.9654 para linalol y acetato de linalilo, respectivamente). Los estándares fueron corridos bajo las mismas condiciones que las muestras. El software cromatográfico Total Chrom (Perkin-Elmer, versión 2004) fue empleado para la adquisición de datos del detector. El tiempo de retención (Tr) y el área obtenidos de la curva patrón de los estándares fueron empleados para identificar y cuantificar el contenido de linalol y acetato de linalilo (Tr de 5.03±0.07 y 6.25±0.06, respectivamente) en las muestras de extractos. Cada muestra fue inyectada al menos tres veces (n≥3).
Análisis estadístico
Todos los experimentos fueron realizados por triplicado. Todos los datos obtenidos experimentalmente fueron analizados estadísticamente utilizando el paquete estadístico SPSS versión 17 y la comparación de medias mediante una prueba de Tuckey estableciendo el nivel de significancia al 5% (P < 0.05).
Resultados y discusion
Inducción de callo en explantes foliares
En el presente estudio se observó que los tratamientos suplementados únicamente con ANA (B0A1 y B0A2) no indujeron la formación de callo (Tabla 1) en los explantes foliares inmaduros de L. angustifolia. Sin embargo, el tratamiento B0A2 indujo la formación de raíz (62.5 %) (Tabla 1) desarrollando un promedio de tres raíces adventicias por explante. Mientras que los tratamientos suplementados con ANA y BAP (B1A1; B2A1; B1A2; B2A2) registraron los más altos porcentajes de inducción de callo (100%) a los 30 d de cultivo (Tabla 1). La formación de callo en estos arreglos de los RCV se inició en los bordes del explante que estaban en contacto con el medio de cultivo, el callo caracterizado por una coloración amarillo-verdosa y exhibiendo una textura compacta.
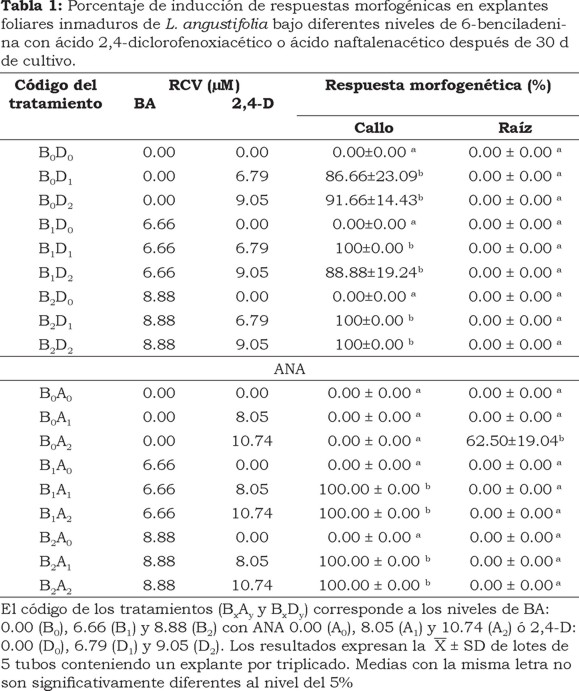
Por otro lado, los tratamientos BxDy, suplementados con diferentes concentraciones 2,4-D en combinación con BA registraron altos porcentajes de inducción de callo (86-100%) que no mostraron diferencias significativas con los tratamientos BxAy que indujeron el mismo tipo de respuesta morfogenética. Adicionalmente, los callos inducidos por estas combinaciones de RCV, registraron visualmente, mayor producción de biomasa caracterizada por una coloración café a los 30 d de cultivo. En particular, los tratamientos B1D1 (6.66 µM de BA y 6.79 µM de 2,4-D) y B2D2 (8.88 µM de BAP y 9.06 µM de 2,4-D) presentaron un callo con una textura compacta. Por el contrario, el tratamiento B0D1 (6.79 µM de 2,4-D) indujo la formación de callo (86.66 %) con una coloración café, apariencia hidratada y friable, por lo que, los cultivos generados por este tratamiento fueron seleccionados para su proliferación y posterior análisis de la producción de los terpenoides (Tabla 1).
Los resultados muestran que las auxinas sintéticas ANA y 2,4-D indujeron diferentes respuestas en los explantes foliares inmaduros de L. angustifolia. ANA favoreció la formación de raíz, mientras que 2,4-D promovió la formación de callo. Resultados similares fueron obtenidos por Medina et al., (2007) quienes demostraron que en Manihot esculenta, ANA es uno de los RCV que estimulan la formación de raíces adventicias en segmentos nodales en concentraciones superiores a 5.37 µM; mientras que los explantes tratados con 2,4-D (4.52 µM) indujeron la formación de callo. De manera similar, Campanoni y Nick, (2005) demostraron que ANA y 2,4-D promueven respuestas diferenciales con respecto a la división y elongación celular en cultivos en suspensión de Nicotiana tabacum, proveniente de callos inducidos en el segmento de tallo: 2,4-D (10 µM) estimuló la división celular e inhibió el alargamiento celular, ya que presenta un receptor de baja afinidad, mientras que ANA (10 µM) conduce a un aumento de la elongación celular puesto que se une a un receptor de alta afinidad a auxinas. Este efecto diferencial también pudiera asociarse a las propiedades de transporte de estas dos diferentes auxinas sintéticas a través de las células, donde 2,4-D se acumula con mayor velocidad con respecto a ANA (Delbarre et al., 1996).
Propagación de las líneas celulares
En el presente estudio, 2,4-D (6.79 µM) dio origen a dos líneas celulares (callo color blanco-grisáceo y callo color café) en explantes foliares inmaduros de L. angustifolia friable (Fig. 1A-B). La generación de las dos líneas celulares, bajo la influencia de la auxina 2,4-D a la misma concentración, en el mismo tipo de explantes y provenientes del mismo ejemplar adulto, probablemente se deba a que en el cultivo in vitro, durante la inducción de callo en las células vegetales se activan elementos transponibles que estimulan la inducción de enzimas y otros productos específicos en situaciones de estrés. Cuando se inicia la división celular a partir de tejidos diferenciados que darán origen a un callo, se incrementa el riesgo de inestabilidad cromosómica, pudiéndose generar considerables cambios en el fenotipo del tejido a consecuencia de una variación somaclonal (Larkin y Scowcroft, 1981; Freire-Seijo, 2006).
Contenido de linalol y acetato de linalilo en órganos y cultivos celulares
Los aceites esenciales son mezclas complejas de terpenoides volátiles, los cuales son extraídos de manera tradicional por el método de arrastre de vapor permitiendo su separación al ser éstos compuestos inmiscibles en agua. Sin embargo, diferentes métodos de extracción para compuestos volátiles han demostrado mejores rendimientos que el arrastre de vapor. Tal es el caso de la extracción líquido-líquido con solventes orgánicos no polares ya que los terpenoides son compuestos químicamente liposolubles (Sánchez-Palomo y col. 2009; Harbore, 1984). La extracción de los terpenoides, linalol y acetato de linalilo, fue eficiente empelando n-hexano como disolvente, tanto en las muestras de hoja y flor de la planta adulta como en la biomasa de la línea celular BCL, las cuales registraron significativamente mayores contenidos de linalol y del acetato de linalilo respecto a los contenidos detectados en los extractos con diclorometano (Tabla 2). En estos mismos extractos, la producción de linalilo en la línea celular BCL (28.45 mg g−1 PF) fue significativamente menor a lo registrado en la hoja (33.38 mg g−1 PF), pero significativamente mayor al contenido del terpenoide en la flor (21.41 mg g−1 PF). Destacando la producción de acetato de linalilo en la línea celular BCL (11.58 mg g−1 PF) y su nulo contenido en las muestras de hoja y flor. Por otro lado, en los extractos con diclorometano, el contenido de linalol en la línea celular y en la hoja no mostró diferencias significativas, pero fueron significativamente mayores los contenidos determinados en éstas muestras con respecto a los registrados en flor (Tabla 2). La producción de acetato de linalilo en los extractos hexánicos de la línea celular BCL (11.58 mg g−1 PF) fue significativamente mayor que lo detectado en los extractos con diclorometano de la misma línea celular BCL (2.95 mg g−1 PF), siendo casi cuatro veces mayor su contenido con respecto a lo detectado en el extracto hexánico (Tabla 2). Sin embargo, en la línea celular GWCL no se detectó la presencia de ninguno de los dos terpenoides.
De la misma forma, el rendimiento de linalol, en los extractos hexánicos fue significativamente mayor a los determinados para los extractos con diclorometano. En hoja registró un rendimiento de 6.76 %, 4.28 % en flor y 5.69 % en la línea celular BCL. Mientras que los rendimientos determinados para las muestras de los extractos con diclorometano fueron para hoja de 0.3 %, 0.09 % en flor y 0.3 % en la línea celular BCL. Los rendimientos reportados, por extracción por arrastre de vapor, para aceites esenciales, varían del 0.5 al 2 %. Para lavanda se ha reportado un rendimiento del 0.9 % en hoja y 0.6 % en flor (Basch et al., 2004). Los resultados del presente estudio concuerdan con lo reportado en la literatura. El aceite esencial de L. angustifolia se sintetiza y se almacena en mayor proporción entre la densa pilosidad de las hojas, donde se encuentran situadas una gran cantidad de tricomas; por ello la materia prima para extraer el aceite de L. angustifolia es el follaje de la planta y en menor proporción se ocupan las flores, secas o frescas (Guitton et al., 2010b).
Ante situaciones de estrés, el tejido vegetal recurre a la síntesis de linalol y acetato de linalilo, como mecanismo de defensa, ya que éstos metabolitos secundarios dentro de la planta funcionan en una variedad de contextos ecológicos: interacción planta-insecto, planta-patógeno y planta-planta (Pichersky y Gershenzon, 2002). Esto ha sido empleado en el cultivo de tejidos, existe una creciente evidencia de recurrir a la elicitación para optimizar la producción y acumulación de metabolitos secundarios en cultivos in vitro (Zhao et al., 2005). La producción de terpenos in vitro ha sido mejorada utilizando inductores y factores de estrés, dada la conocida actividad antimicrobiana y antifúngica de estos compuestos (Burt, 2004); tal es el caso de Lavandula vera, en donde se obtuvieron sesquiterpenos, al emplear L-cisteína variando la fuente de nitrógeno (Nakajima et al., 1989).
Conclusiones
Se establecieron dos líneas celulares de callo friable (GWCL y BCL) derivadas de cultivos de explantes foliares inmaduros de L. angustifolia, en medio MS al 50% de su concentración suplementado con 6.79 µM de 2,4-D. La línea celular BCL retuvo la capacidad de sintetizar linalol y acetato de linalilo, registrando los extractos hexánicos significativamente mayores contenidos de los terpenoides que los extractos con diclorometano (23.45 y 11.58 mg g−1 PF; 1.53 y 2.95 mg g−1 PF, respectivamente). Siendo significativamente mayor el contenido de linalol en la línea celular que en la flor y menor a lo registrado en la hoja. Destacando la síntesis del acetato de linalilo en la línea celular BCL, registrando hasta 11.58 mg g−1 PF, mientras que en las muestras de flor y hoja no fue detectado. Demostrando que el CTV es una alternativa para la producción de los componentes principales del aceite esencial de L. angustifolia
Referencias
Andrade, L.B., Echeverrigaray, S., Fracaro, F., Pauletti, G.F., Rota, L. (1999) The effect of growth regulators on shoot propagation and rooting of common lavander (Lavandula vera DC). Plant Cell, Tissue and Organ Culture 56: 79-83 [ Links ]
Basch, E., Foppa, I., Liebowitz, R., Nelson, J., Smith, M., Sollars, D., Ulbricht C. (2004) Lavender (Lavandula angustifolia Miller). Journal of Herbal Pharmacotherapy 4: 63-78 [ Links ]
Burt, S. (2004) Essential oils: their antibacterial properties and potential applications in foods: a review. International Journal of Food Microbiology 94: 223-253 [ Links ]
Campanoni, P., Nick. P. (2005) Auxin-dependent cell division and cell elongation.1-naphthaleneacetic acid and 2,4-dichlorophenoxyacetic acid activate different pathways. Plant Physiology 137: 939-948 [ Links ]
Casabianca, H., Graff, J.B., Faugier, V., Fleig, F., Grenier C. (1997) Enantiomeric distribution studies of linalool and linalyl acetate. A powerful tool for authenticity control of essential oils. Journal of High Resolution Chromatography 21: 107-112 [ Links ]
Cavanagh, H.M.A., Wilkinson J.M. (2002) Biological activities of Lavender essential oil. Phytotherapy Research 16: 301-308 [ Links ]
Cong, Y., Abuliziz, P., Zhi, L., Wang, X., Mirensha (2008) Chemical composition of the essential oil of Lavandula angustifolia from Xinjiang, China. Chemistry of Natural Compounds 44: 810 [ Links ]
Delbarre, A., Muller, P., Imhoff, V., Guern J. (1996) Comparison of mechanisms controlling uptake and accumulation of 2,4-dichlorophenoxy acetic acid, naphthalene-1-acetic acid, and indole-3-acetic acid in suspension-cultured tobacco cells. Planta 198: 532-541 [ Links ]
Freire-Seijo, M., Kosky, R.G., Herrera Ofarril, I., Reyes M. (2006) Formación de callos y establecimiento de suspensiones celulares embriogénicas de caña de azúcar a partir de segmentos de hojas de plantas in vitro. Biotecnología Vegetal 6: 51-57 [ Links ]
Gattefossé, R.M. (1993) Aromatherapy: Translated from Original 1937 French Text. R.B. Tisserand (Ed.). Saffron Walden: C.W. Daniel Co. [ Links ]
Georgiev, M.I., Weber, J., Maciuk, A. (2009) Bioprocessing of plant cell cultures for mass production of targeted compounds. Applied Microbiology and Biotechnology 83: 809-823 [ Links ]
Guitton, Y., Nicolè, F., Moja, S., Benabdelkader, T., Valot, N., Legrand, S., Jullien, F., Legendre, L. (2010a) Lavender inflorescence: A model to study regulation of terpenes synthesis. Plant Signaling & Behavior 5: 749-751. [ Links ]
Guitton, Y., Nicolè, F., Moja, S., Valot, N., Legrand, S., Jullien, F., Legendre L. (2010b) Differential accumulation of volatile terpene and terpene synthase mRNAs during lavender (Lavandula angustifolia and L. x intermedia) inflorescence development. Physiologia Plantarum 138: 150-163 [ Links ]
Harborne, J.B., Williams C.A. (2002) Phytochemistry of the genus Lavandula. In: M Lis-Balchim (Ed.) Lavender. Taylor & Francis, USA pp. 86-99 [ Links ]
Harbore, J.B. (1984) Phytochemical methods: a guide to modern techniques of plant analysis. 2ª ed., Chapman & Hall, London, Great Britain. [ Links ]
Javidnia, K., Miri, R., Kamalinejad, M., Nasiri A. (2002) Composition of the essential oil of Salvia mirzayanii Rech. F. & Esfan from Iran. Flavor and Fragrance Journal 17: 465- 467 [ Links ]
Lange, D. (2006). International trade in medicinal and aromatic plants. Medicinal and aromatic plants. Agricultural, commercial, ecological, legal, pharmacological and social aspects. Bogers, R., Craker, L, Lange, D. (Eds.). Springer, USA pp. 309 [ Links ]
Larkin, P.J., Scowcroft W.R. (1981) Somaclonal variation a novel source of variability from cells cultures from plant improvement. Theoretical and Applied Genetics 60: 197-214 [ Links ]
Lewinshon, E., Schalechet, F., Wilkinson, J., Matsui, K., Tadmor, Y., Nam, K.H., Amar, O., Lastochkin, E., Larkov, O., Ravid, U., Hiatt, W., Gepstein, S., Pichersky E. (2001) Enhanced levels of the aroma and flavor compound S-linalool by metabolic engineering of the terpenoid pathway in tomato fruits. Plant Physiology 127: 1256-1265 [ Links ]
Medina, R., Faloci, M., Gonzalez, A., Mroginski L.A. (2007) In vitro cultured primary roots derived from stem segments of cassava (Manihot esculenta) can behave like storage organs. Annals of Botany 99: 409-423 [ Links ]
Muñoz de Malajovich, M. A. (2006) Biotecnología. Editorial Universidad Nacional de Quilmes. Argentina. pp. 47-52 [ Links ]
Murashige, T., Skoog F. (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 15:473-497 [ Links ]
Nakajima, H., Sonomoto, K., Sato, F., Ichimura, K., Yamada, Y., Tanaka A. (1989) Enhancement of pigment productivity of immobilized cultured Lavandula vera cells by limitation of nitrogen sources. Journal of Fermentation and Bioengineering 67: 306-308 [ Links ]
Peana, A.T., D'Aquila, P.S. Panin, F., Serra, G., Moretti M.D. (2002). Anti-inflammatory activity of linalool and linalyl acetate constituents of essential oils. Phytomedicine 9: 721-726 [ Links ]
Petriska, I., Polásek, M., Sladkovský R. (2006) Assay of terpene alcohols in pharmacopoeial essential oils by micellar electrokinetic capillary chromatography (MEKC). Pharmazie 61: 989-993 [ Links ]
Pichersky, E., Gershenzon J. (2002) The formation and function of plant volatiles: perfumes for pollinator attraction and defense. Current Opinion in Plant Biology 5: 237-243 [ Links ]
Raguso, R.A., Pichersky E. (1995) Floral volatiles from Clarkia breweri and C. concinna (Onagraceae): recent evolution of floral scent and moth pollination. Plant Systematics and Evolution 194: 55-67 [ Links ]
Sánchez-Palomo, E., Alañón, M.E., Díaz-Maroto, M.C., González-Viñas, M.A., Pérez-Coello, M.S. (2009) Comparison of extraction methods for volatile compounds of Muscat grape juice. Talanta 79: 871-876 [ Links ]
Wang, X., Jin, L., Li, M., Zhao, M., Zhao, H., Xu, Y. (2007) Bioreactor culture and plant regeneration from cell clusters of the aromatic plant Lavandula angustifolia "Munstead". Journal of Horticultural Science & Biotechnology 82: 781-785 [ Links ]
Went, F.W., Thimann K.V. (1937) Phytohormones. The Macmillan Company New York: USA pp. 294 [ Links ]
Xiu-juan, S., Chen, Q., Ma, L., Yao, L., Ning, Y., Tao, H., Gulidasidan, Qu Y. (2006) Plant regeneration from leaf in Lavandula angustifolia. Journal of Xinjiang Agricultural University 29: 22-25 [ Links ]
Xu, Y.Z., Wang, X.J., Zhao, M.A., Zhao, H.Q. (2005) Effects of several biological factors on the growth of embryogenic callus suspension culture of Lavandula angustifolia, cv. Munstead. Letters in Biotechnology 16: 34-36 [ Links ]
Zhao, J., Davis, L.C., Verpoorte R. (2005) Elicitor signal transduction leading to production of plant secondary metabolites. Biotechnology Advances 23: 283-333 [ Links ]














