Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Veterinaria México
Print version ISSN 0301-5092
Vet. Méx vol.43 n.3 Ciudad de México Jul./Sep. 2012
Notas de Investigación
Presencia del virus de la diarrea viral bovina y su asociación con otros cuadros patológicos en ganado en corral de engorda
Presence of bovine virus diarrhea in association with other pathologies in feedlot cattle
Rafael Ramírez Romero* Bernabé Chavarría Martínez** Alfonso López Mayagoitia*** Luis Edgar Rodríguez Tovar* Alicia Magdalena Nevárez Garza*
* Cuerpo Académico de Patobiología, Facultad de Medicina Veterinaria y Zootecnia, Unidad de Ciencias Agropecuarias, Universidad Autónoma de Nuevo León, Av. Francisco Villa s/n, col. Ex Hacienda El Canadá, 66050, Escobedo, Nuevo León.
** MSD, Salud Animal, Santiago Tianguistenco, Estado de México.
*** Atlantic Veterinary College, University of Prince Edward Island, Charlottetown, PEI, Canadá.
Responsable de correspondencia:
Rafael Ramírez Romero, tel.: 81 13404390, ext. 3612,
correo electrónico: raramirez@prodigy.net.mx
Recibido el 25 de noviembre de 2011
Aceptado el 14 de mayo de 2012.
Abstract
Bovine feedlots are intensive production systems of significant importance in Mexico. The present study describes the presence of bovine virus diarrhea (BVD) causing subacute to chronic lesions in feedlot cattle, associated with other pathologies. Animals included in this study were discarded after they received therapy several times due to chronic pneumonia, or anaplamosis. Bovine virus diarrhea antigen was identified by immunohistochemistry in small intestine and myocardium in six cases of chronic suppurative bronchopneumonia with extensive areas of casseous necrotic bronchiectasis, previously diagnosed as Mycoplasma bovis pneumonias (retrospective group, n = 6). Furthermore, based on characteristic histopathologic lesions other nine cases were included (prospective group, n = 9). Bovine virus diarrhea antigen was recognized in two animals with pneumonic lesions, including a case with fibrinous bronchopneumonia as well as suggestive lesions of infectious bovine rinotracheitis (1/9), and another one with suppurative bronchopneumonia and myocarditis suggestive of Histophilus somni (1/9). In addition, one positive case was associated to anaplasmosis (1/9). Other two positive cases showed a conspicuous fibrinous peritonitis (2/9). The rest of the animals in this group resulted negative (4/9). Histopathological characteristics of the lesions and their association with the antigen in situ confirm the presence of BVD. This presentation is compatible with the acute infection syndrome. This is the first report of BVD infection and concomitant pathologies in feedlot cattle in Mexico.
Key words: Bovine virus diarrhea, acute infection, feedlot cattle, immunohistochemistry.
Resumen
El ganado en corral de engorda es un sistema de producción intensivo de gran importancia en México. En este trabajo se describe la infección por diarrea viral bovina (DVB), ocasionado por lesiones subagudas y crónicas en bovinos en corral de engorda, y su asociación con otras patologías. Los animales de este estudio fueron considerados de rechazo después de ser tratados en diferentes ocasiones por enfermedad respiratoria, o bien anaplasmosis. El antígeno de DVB fue identificado por inmunohistoquímica (IHQ) en intestino delgado y miocardio en seis casos de bronconeumonía supurativa crónica con extensas áreas de bronquiectasia con necrosis caseosa, los cuales habían sido previamente diagnosticados como neumonías por Mycoplasma bovis (grupo retrospectivo, n = 6). Además, se incluyeron otros nueve casos con base en las características histopatológicas de las lesiones (grupo prospectivo, n = 9). El antígeno de DVB se reconoció en dos animales con lesiones neumónicas, uno de ellos con bronconeumonía fibrinosa, incluyendo además lesiones probables de rinotraqueítis infecciosa bovina (1/9), y el otro con bronconeumonía supurativa y también miocarditis probable por Histophilus somni (1/9). Adicionalmente, un caso positivo estuvo asociado a anaplasmosis (1/9). Otros dos casos positivos presentaron una distintiva peritonitis fibrinosa (2/9). El resto de los animales de este grupo resultaron negativos a DVB (4/9). Las características histopatológicas de las lesiones y su asociación con el antígeno in situ, confirman la presencia de DVB. Esta presentación es compatible con el síndrome denominado infección aguda. Este es el primer informe de infección por DVB y otras patologías concomitantes en ganado de engorda en México.
Palabras clave: Diarrea viral bovina, infección aguda, ganado en corral de engorda, inmunohistoquímica.
Introducción
La diarrea viral bovina (DVB) es una infección viral del ganado que apareció como una enfermedad nueva hace más de 50 años. Desde entonces, la infección ha evolucionado hasta convertirse en una enfermedad multifacética con presentaciones clínicas variadas. De acuerdo con su patogenia, la DVB ha sido considerada la enfermedad viral más complicada en bovinos.1
El virus de la DVB pertenece al género Pestivirus dentro de la familia Flaviviridae.2 La comparación genómica de los virus de DVB ha dado como resultado el reconocimiento de dos genotipos, DVB 1 y DVB 2.2 Adicionalmente, cada uno de estos genotipos ocurren como biotipos citopáticos o no citopáticos.2
Para entender la patogénesis de la infección por la DVB se han propuesto cuatro síndromes principales: infección aguda, infección intrauterina, infección persistente y enfermedad de las mucosas.3 La infección intrauterina es causada por una infección aguda en una hembra gestante que infecta a su producto y puede parir un animal persistentemente infectado (PI). La mayor probabilidad de que se generen animales PI ocurre entre los meses uno y tres de gestación.3 A su vez, la infección persistente es la forma más importante de diseminación de la enfermedad, además de ser un factor relevante para el desarrollo de la enfermedad de las mucosas.3
La infección aguda ocurre como una infección temporal en animales susceptibles, inmunocompetentes y seronegativos al virus de la DVB.3 En este síndrome el término agudo no hace referencia al curso de la enfermedad sino a la infección viral inicial o primaria.3 Comúnmente, la fuente de infección son animales PI.3 En este caso, la infección transcurre a nivel subclínico o clínicamente en un nivel de poca gravedad al grado de ser muy difícil de reconocer.3,4 Por lo general, esta presentación acontece de manera concomitante con cuadros patológicos graves de neumonías, ya que provoca inmunosupresión en los animales infectados.3,4
Al considerar que la infección por el virus de DVB se encuentra ampliamente distribuida en México,5 y tomando en cuenta que el acopio de animales de alto riesgo es una de las condiciones más comunes en las engordas, es razonable esperar que la DVB pudiera ocurrir de manera subclínica, pero favoreciendo la presentación de otros cuadros patológicos como el de la neumonía.6 En este trabajo se presentan los antecedentes y los estudios de patología diagnóstica que se realizaron en varios corrales de engorda en México, que confirman, en parte, esta suposición original.
Durante 2009 y 2010 se realizaron varios estudios post mórtem de casos considerados representativos de problemas neumónicos crónicos en diferentes corrales de engorda en México. Además, también se registraron en estos corrales, brotes de anaplasmosis en diferentes etapas del proceso de engorda. Los corrales estudiados se localizan en Mexicali (Baja California), Culiacán (Sinaloa), Escobedo (Nuevo León) y Morelia (Michoacán). En estas explotaciones el número oscila entre 25,000 y 50,000 animales. El manejo de los animales a su arribo incluía la aplicación rutinaria de inmunógenos contra diferentes enfermedades clostridiales (Clostridium chauvoei, C. septicum, C. perfringens C y D con toxoides, C. sordellii, C. novyi, C. haemolyticum) y respiratorias virales (rinotraqueítis infecciosa bovina [RIB], parainfluenza-3 [PI3], diarrea viral bovina [DVB], virus respiratorio sincicial bovino [VRSB]). Además, en aquellos lotes considerados de riesgo por la diseminación de enfermedades respiratorias (con morbilidad superior a 25% a su arribo), se administraba parenteralmente una dosis de antibiótico con acción prolongada en dosis terapéutica (tilmicosina, 10 mg/kg, SC) a todos los animales del lote (metafilaxia, tratamiento masivo).
Después del tercer día, cuando no se apreciaba en los animales una respuesta clínica favorable y aún presentaban fiebre, tos, lasitud, secreción nasal, conjuntivitis y disnea, los bovinos eran trasladados a la enfermería en donde recibían el protocolo para animales recaídos. Este protocolo consistía en dos administraciones de antibióticos diferentes con intervalo de tres días. Se empleó oxitetraciclina (30 mg/kg, IM) y enrofloxacina (5 mg/kg, IM) como primer y segundo tratamiento, respectivamente. En el presente trabajo, se utilizaron animales de ambos sexos, cuyas edades oscilaban entre ocho y catorce meses de edad. Estos animales, además de recibir metafilaxia en recepción y posteriormente el protocolo para animales recaídos, no se recuperaron, por lo que se decidió practicarles eutanasia.
Las muestras incluidas pertenecían a dos grupos denominados retrospectivo y prospectivo. El grupo retrospectivo (n = 6) incluyó animales con lesiones neumónicas características de Mycoplasma bovis. Este agente etiológico fue posteriormente confirmado mediante inmunohistoquímica (IHQ).6 El grupo prospectivo (n = 9) fue conformado por animales que presentaban otras patologías, incluso neumonías, pero que no tenían las características particulares de las neumonías causadas por Mycoplasma. Las muestras para histopatología se mantuvieron en solución amortiguada de formaldehído al 10% para posteriormente incluirse en parafina, seccionarse a 4 µm de espesor y teñirse con H&E y la tinción del ácido peryódico de Schiff (PAS). El proceso se realizó en la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Autónoma de Nuevo León.
Considerando el valor de los hallazgos histopatológicos en ambos grupos, se decidió confirmar mediante IHQ la presencia de DVB. El procedimiento se realizó empleando nuevas secciones de los mismos bloques de parafina. Se incluyeron tejidos de intestino delgado (íleon) y miocardio. Las secciones se desparafinaron y se procesaron empleando anticuerpos monoclonales para DVB conjugados con el complejo avidina-biotina inmunoperoxidasa, empleando el cromógeno diaminobenzidina como sustrato. Posteriormente, fueron contrastados con hematoxilina.7 Este procedimiento se realizó en el laboratorio de diagnóstico Prairie Diagnostic Services en Saskatton, Saskatchewan, Canadá, dependiente del Western College of Veterinary Medicine, University of Saskatchewan, Canadá.
El diagnóstico post mortem de los seis casos del grupo retrospectivo fue: bronconeumonía supurativa y bronquiectasia severa y crónica, con extensiones de 50 a 80%. El exudado en bronquios abscedados era caseoso (6/6). Otros hallazgos fueron: pleuritis y grandes abscesos como resultado de lesiones necróticas secuestradas. Los estudios histopatológicos confirmaron las observaciones macroscópicas. La confirmación de Mycoplasma bovis se realizó mediante IHQ. Estos resultados han sido publicados anteriormente.6
Posteriormente, entre los nueve animales incluidos en el grupo prospectivo, los diagnósticos post mortem fueron: bronconeumonía fibrino supurativa, severa, subaguda, con una marcada traqueítis fibrino necrótica con placas diftéricas adheridas, por probable RIB (1/9). En otro caso se reconoció una bronconeumonía supurativa, severa y crónica y además, zonas pálidas (infartos) en el septo interventricular y los músculos papilares del corazón izquierdo, compatible con Histophilus somni (1/9). Otro animal presentó deshidratación, sangre acuosa en tejido subcutáneo, ictericia, hígado de color ladrillo, esplecnomegalia y plétora en vesícula biliar con una bilis espesa. En este animal se diagnosticó anaplasmosis mediante frotis sanguíneo (1/9). Cuatro animales presentaron peritonitis fibrino purulenta (4/9). En estos animales la lesión neumónica fue incipiente y el diagnóstico se atribuyó a la peritonitis. En estos casos, el exudado fibrinoso se encontraba adherido sobre la superficie de los ganglios mesentéricos y la serosa de intestino delgado. No se reconocieron úlceras perforadas. Finalmente, en otros dos casos, los cambios macroscópicos no fueron relevantes ni específicos (2/9). Microscópicamente, los diagnósticos morfológicos para el grupo prospectivo confirmaron los diagnósticos post mortem. Para los dos casos en los cuales no se reconocieron lesiones relevantes macroscópicamente se refirió lo siguiente: glomerulonefritis membrano proliferativa con vasculitis y nefritis intersticial, severa, crónica, y miocarditis linfoplasmocítica con necrosis fibrinoide y vasculitis moderada, crónica, multifocal.
En ambos grupos, retrospectivo y prospectivo, se apreciaron lesiones histológicas consistentes con DVB en intestino delgado. Estas lesiones justificaron la inclusión de todos los casos para el diagnóstico de DVB mediante IHQ. La descripción de estas lesiones fue: intestino delgado (íleon), marcada atrofia del tejido linfoide en submucosa con colapso de las estructuras foliculares, lo que provocó la proyección de las criptas sobre el tejido linfoide. En algunas áreas, las criptas se observaron desorganizadas y dilatadas con necrosis epitelial y detritus (daño radiomimético) (Figura 1), así como infiltrado linfoplasmocítico en lámina propia. En la submucosa se pudo apreciar edema, algunos vasos sanguíneos mostraron hialinización en su pared y vasculitis linfocítica. En intestino grueso (ciego), se observó marcado edema en submucosa. Los pequeños vasos de la submucosa presentaron infiltración linfoide adyacente. La lámina propia de la mucosa apareció infiltrada por linfocitos y células plasmáticas, así como necrosis epitelial de la base de las criptas con dilatación y presencia de detritus. El diagnóstico morfológico (jerarquizado por lo general en segundo o tercer lugar porque las lesiones neumónicas fueron priorizadas) fue: entero-colitis linfoplasmocítica con marcada atrofia del tejido linfoide asociado, necrosis del epitelio de criptas y vasculitis moderada, crónica, difusa.
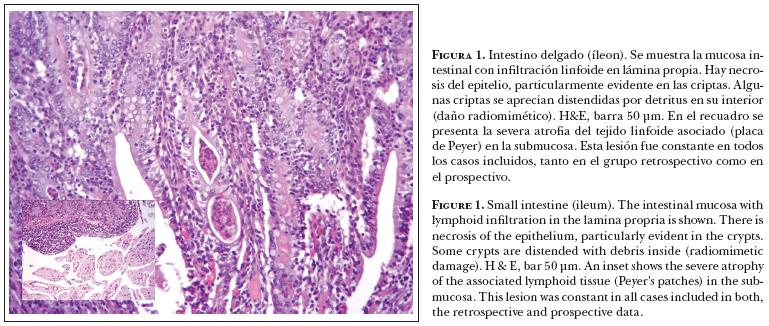
Los resultados de IHQ demostraron una inmuno reactividad a DVB en todos los animales del grupo retrospectivo y en cinco de nueve animales del grupo prospectivo. En este grupo los resultados negativos correspondieron a dos animales con peritonitis y a los dos animales que no presentaron lesiones relevantes en la necropsia. No obstante, en todos ellos se apreciaron lesiones microscópicas sugestivas de DVB.
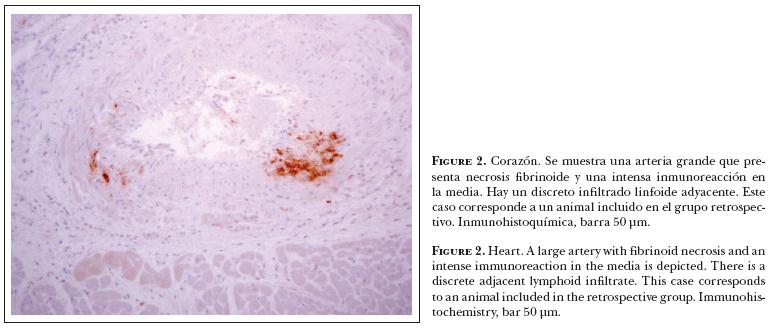
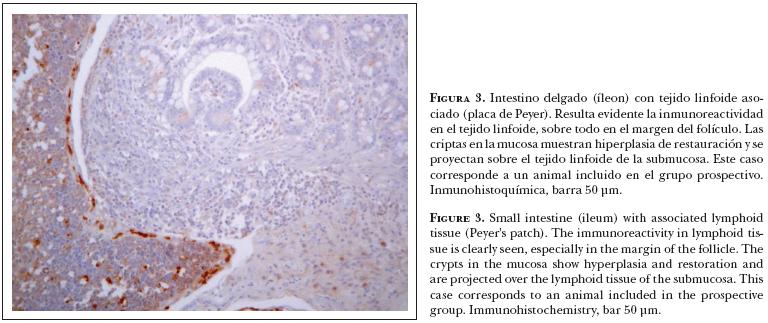
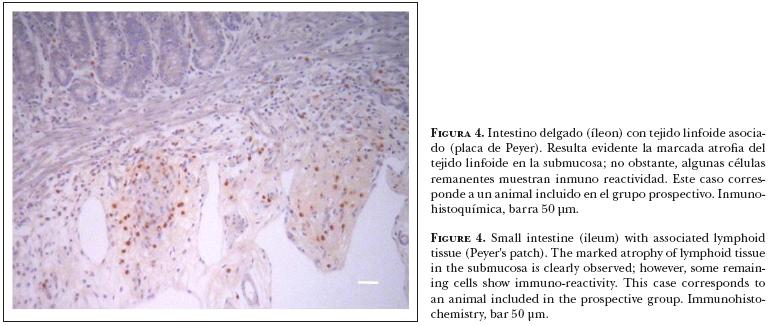
En los casos positivos la inmuno reactividad a DVB mostró diversos grados de intensidad, variando también la positividad de la reacción en los tejidos estudiados. Por ejemplo: en corazón, los focos de reactividad mayor se apreciaron sobre la túnica media de arterias y con menor intensidad en algunas células intersticiales y fibras de Purkinje (Figura 2). En intestino delgado, la positividad fue reconocida en las placas de Peyer (Figura 3) y la pared de vasos sanguíneos, y con menor intensidad en las células epiteliales de las criptas. Cuando la atrofia del tejido linfoide en las placas de Peyer fue muy marcada, la inmuno-reactividad se apreció individualmente en células remanentes de los folículos linfoides (Figura 4). La inmuno reactividad no se reconoció en bazo.
Se ha informado que los cuadros de enfermedad respiratoria en bovinos en corral de engorda ocurren con un curso más largo y se presentan más tardíamente, en comparación con lo observado hace 20 años en Estados Unidos de América y Canadá.8 Esta situación se vio relacionada con infecciones por Mycoplasma bovis y DVB.7-9 Se cree que la presencia de Mycoplasma en cuadros neumónicos subagudos y crónicos puede estar relacionada con la entrada de animales más jóvenes y, por ende, más susceptibles a padecer neumonía enzoótica.10 Al respecto, en todas las engordas revisadas se confirmó el riesgo a enfermedades respiratorias, incluyendo la entrada al corral de animales ligeros (≤ 180 kg), sin manejo preventivo, acopiados en centros con poca atención sanitaria y posteriormente transportados por largas distancias.
En algunos trabajos7-12 se ha demostrado la asociación de neumonías crónicas causadas por Mycoplasma y DVB, si bien se sabe que DVB puede potenciar cualquier neumonía e incluso otros problemas.12 Los autores del presente trabajo publicaron un informe sobre lesiones neumónicas crónicas y su inmuno reactividad a Mycoplasma bovis; seis animales que resultaron positivos entonces a Mycoplasma bovis6 también resultaron positivos a DVB aquí (grupo retrospectivo). Por otra parte, DVB se ha asociado con lesiones en miocardio causadas por Histophilus somni,13 y se sabe que también reactiva cuadros de RIB.3 Todo ello corresponde con la primo infección o infección aguda por DVB3 y concuerda con la información que aquí se presenta.
En el presente informe la asociación de DVB y anaplasmosis en un caso resulta importante. La anaplasmosis es una enfermedad enzoótica en México14 y es muy probable que muchos animales arriben a los corrales con cuadros subclínicos que, en presencia de una infección concomitante por DVB, puedan reactivarse y provocar enfermedad clínica. Esta asociación ha sido demostrada recientemente en Sudáfrica en un caso fatal de anaplasmosis congénita en un neonato que murió a los 10 días de edad y que además, resultó positivo a DVB, al igual que su madre.15
Previamente se ha referido en México la presentación de desmedro y cojeras en vacas Simmental de registro, importadas de Estados Unidos de América, con seropositividad hacia lengua azul y DVB.16 En este caso, se supuso que la concomitancia de DVB y lengua azul provocó un efecto sinérgico y causó emaciación y claudicación progresiva que obligó a desechar a los animales.16 También se ha referido el impacto negativo de DVB en los parámetros productivos de lotes de ganado de carne en el noreste de México.17
Por último, en los dos casos en los que la neumonía no fue una lesión importante y que presentaron una lesión predominante de peritonitis, no pudo establecerse una etiología concurrente definida. No obstante, se sabe que lesiones severas en intestino, causadas por el virus de DVB e infecciones bacterianas oportunistas, pueden provocar una exudación sobre la serosa intestinal y, en consecuencia, peritonitis.4 En una infección experimental de un bovino, la lesión predominante fue peritonitis.18
Para reconocer la presencia de animales persistentemente infectados se realizó, en un rastro de la Ciudad de México, un trabajo en el que se empleó IHQ en muestras de piel de orejas de animales sacrificados.19 No obstante, de acuerdo con la información recabada para la realización del presente informe, no se había demostrado que la presencia de DVB provocara lesiones en bovinos en México.
Tal y como se ha registrado en el presente trabajo, el síndrome denominado infección aguda se refiere a una primo infección en animales susceptibles, que evoluciona mayormente de manera subclínica y que acontece como factor predisponente o desencadenante de otras enfermedades.3,4 No obstante, en esta presentación de la enfermedad se han referido lesiones histológicas subagudas o crónicas, particularmente en vasos sanguíneos, atribuidas al virus,3,4,20 similares a las que aquí se describieron. En el presente informe la atrofia del tejido linfoide intestinal y finalmente el daño radiomimético en las criptas, fueron evidencias de la enfermedad.3,4,20 Sin embargo, la intensidad de las lesiones vasculares en miocardio fueron más obvias y resultaron en correspondencia con una mayor inmuno reactividad, como ya se ha señalado en casos naturales.3,4,11,13 Este patrón concordante de severidad e inmuno reactividad de las lesiones cardiacas, también se ha referido en becerros en los que se replicó experimentalmente la infección aguda con DVB.20
A pesar de las lesiones histológicas características no se reconoció inmuno reactividad en cuatro casos del grupo prospectivo. En trabajos anteriores se ha mencionado ausencia de inmuno reactividad en casos con lesiones histológicas típicas, tanto en casos naturales como en infecciones experimentales, pero no hay una explicación categórica para ello.7,20 Se ha mencionado simplemente que en estas lesiones ya no hay presencia de antígeno, quizá debido a la etapa de la infección viral y su eliminación por la respuesta inmune del animal.7,20 Debido a lo anterior, se recomienda tomar suficientes muestras para tener mayor oportunidad de reconocer la asociación entre lesiones e inmuno reactividad.7
La demostración del antígeno de DVB en lesiones características mediante IHQ, confirma la presencia de la enfermedad en bovinos en corral de engorda en México. Las neumonías por Mycoplasma bovis en el grupo retrospectivo correspondieron, en su totalidad (100%), a la presencia de DVB. Asimismo, se demuestra en el grupo prospectivo que DVB puede agravar o reactivar otros cuadros patológicos infecciosos.
Agradecimientos
El presente trabajo se realizó con recursos del Programa de Apoyo a la Investigación Científica y Tecnológica de la Universidad Autónoma de Nuevo León (PAICYT-UANL GCT027-10). Se contó también con el apoyo de MSD Salud Animal para el desarrollo de los trabajos de campo.
Referencias
1. DEREGT D. Introduction and history. In: GOYAL SM, RIDPATH JF, editors. Bovine Viral Diarrhea Virus. Diagnosis, Management and Control. Ames, Iowa: Blackwell Publishing Professional, 2005: 3-33. [ Links ]
2. RIDPATH JF. Classification and molecular biology. In: GOYAL SM, RIDPATH JF, editors. Bovine Viral Diarrhea Virus. Diagnosis, Management and Control. Ames, Iowa: Blackwell Publishing Professional, 2005: 65-80. [ Links ]
3. LIEBLER-TENORIO EM. Pathogenesis. In: GOYAL SM, RIDPATH JF, editors. Bovine Viral Diarrhea Virus. Diagnosis, Management and Control. Ames, Iowa: Blackwell Publishing Professional, 2005: 121-143. [ Links ]
4. BROWN CC, BAKER DC, BARKER IK. Alimentary system. In: MAXIE MG, editor. Jubb, Kennedy and Palmer's Pathology of Domestic Animals. 5th ed. Vol 2, Ch 1. St. Louis Missouri: Saunders Elsevier, 2007: 140-148. [ Links ]
5. SUZAN VM, ONUMA M, AGUILAR RE, MURAKAMI Y. Prevalence of bovine herpesvirus-1, parainfluenza-3, bovine rotavirus, bovine viral diarrhea, bovine adenovirus-7, bovine leukemia virus and bluetongue virus antibodies in cattle in Mexico. Jpn J Vet Res 1983; 31:125-132. [ Links ]
6. RAMÍREZ ROMERO R, CHAVARRÍA MARTÍNEZ B, NEVÁREZ GARZA AM, RODRÍGUEZ TOVAR LE, DÁVILA MARTÍNEZ C, HERNÁNDEZ VIDAL G et al. Demostración inmunohistoquímica de Mycoplasma bovis en lesiones neumónicas crónicas en ganado en corral de engorda. Vet Méx, 2010;41:289-296. [ Links ]
7. SHAHRIAR FM, CLARK EG, JANZEN E, WEST K, WOBESER G. Coinfection with bovine viral diarrhea virus and Mycoplasma bovis in feedlot cattle with chronic pneumonia. Can Vet J 2002; 43:863-868. [ Links ]
8. FULTON RW, BLOOD KS, PANCIERA RJ, PAYTON ME, RIDPATH JF, CONFER AW et al. Lung pathology and infectious agents in fatal feedlot pneumonias and relationship with mortality, disease onset, and treatments. J Vet Diagn Invest 2009; 21:464-77. [ Links ]
9. GAGEA MI, BATEMAN KG, SHANAHAN RA, VAN DREUMEL T, MCEWEN BJ, CARMAN S et al. Naturally occurring Mycoplasma bovis-associated pneumonia and polyarthritis in feedlot beef calves. J Vet Diagn Invest 2006;18:29-40. [ Links ]
10. GRIFFIN D. Bovine pasteurellosis and other bacterial infections of the respiratory tract. Vet Clin North Am Food Anim Pract 2010;26:57-71. [ Links ]
11. HAINES DM, MARTIN KM, CLARK EG, JIM GK, JANZEN ED. The immunohistochemical detection of Mycoplasma bovis and bovine viral diarrhea virus in tissues of feedlot cattle with chronic, unresponsive respiratory disease and/or arthritis. Can Vet J 2001; 42:857-860. [ Links ]
12. BOOKER CW, ABUTARBUSH SM, MORLEY PS, KEE JIM G, PITTMAN TJ, SCHUNICHT OC et al. Microbiological and histopathological findings in cases of fatal bovine respiratory disease of feedlot cattle in western Canada. Can Vet J 2008;49:473-481. [ Links ]
13. HAINES DM, MOLINE KM, SARGENT RA, CAMPBELL JR, MYERS DJ, DOIG PA. Immunohistochemical study of Hemophilus somnus, Mycoplasma bovis, Mannheimia hemolytica, and bovine viral diarrhea virus in death losses due to myocarditis in feedlot cattle. Can Vet J 2004; 45:231-234. [ Links ]
14. FIGUEROA MILLÁN JV, ROJAS RAMÍREZ EE, RAMOS ARAGÓN JA, GRANJENO COLÍN G, GARCÍA ORTÍZ MA, CANTO ALARCÓN GJ et al. Evaluación en condiciones de campo de la vacuna inactivada de Anaplasma marginale denominada Plazvax. Vet Méx 1999;30: 221-225. [ Links ]
15. PYPERS AR, HOLM DE, WILLIAMS JH. Fatal congenital anaplasmosis associated with bovine viral diarrhoea virus (BVDV) infection in a crossbred calf. J S Afr Vet Assoc 2011; 82:179-182. [ Links ]
16. RAMÍREZ-ROMERO R, AVALOS-RAMÍREZ R, SALINAS-MELÉNDEZ JA, ZÁRATE-RAMOS JJ. Descripción de un brote de claudicación en bovinos asociado con la seropositividad a los virus de la lengua azul y diarrea viral bovina. Memorias del XIX Congreso Nacional de Buiatría; 1995 agosto 24-26; Torreón Coahuila, México. México, DF: Asociación Mexicana de Médicos Veterinarios Especialistas en Bovinos, AC, 1995: 87-90. [ Links ]
17. MELLADO BM, GONZÁLEZ DH, UDAVE LM. Comportamiento reproductivo y peso de los becerros en un hato de bovinos productor de carne, infectado con diarrea viral bovina. Vet Méx 1996;27: 179-183. [ Links ]
18. TESSARO SV, CARMAN PS, DEREGT D. Viremia and virus shedding in elk infected with type 1 and virulent type 2 bovine viral diarrhea virus. J Wildl Dis 1999; 35:67-677. [ Links ]
19. VALENCIA-MORALES EV, MORALES-SALINAS E, SÁNCHEZ-GODOY FD, SALMERÓN-SOSA F. Detección del virus de diarrea viral bovina por inmunohistoquímica y ELISA de captura de antígeno en animales persistentemente infectados. Memorias del XV Congreso Nacional de Patología Veterinaria; 2006 junio 21-23; Zacatecas Zacatecas, México. Zacatecas, Zacatecas, México: Sociedad Mexicana de Patólogos Veterinarios, AC, 2006: 20-27. [ Links ]
20. LIEBLER-TENORIO EM, RIDPATH JF, NEILL JD. Distribution of viral antigen and tissue lesions in persistent and acute infection with the homologous strain of noncytopathic bovine viral diarrhea virus. J Vet Diagn Invest 2004; 16:388-396. [ Links ]














