ANTECEDENTES
El ácido úrico es el producto final del metabolismo de las purinas y se sintetiza, principalmente, en el hígado e intestino, a partir de las xantinas, por la acción de la xantina oxidorreductasa.1 La concentración sérica del ácido úrico es el resultado del equilibrio entre diversos factores: aporte de la dieta, síntesis endógena y excreción renal.2 Debido a que los seres humanos son incapaces de catabolizarlo en compuestos de mayor solubilidad, por carecer de las enzimas urato oxidasa o uricasa, su concentración es más elevada en comparación con otros mamíferos.3 Esta característica facilita sus propiedades antioxidantes porque neutraliza distintas moléculas prooxidantes: radicales hidroxilo, peróxido de hidrógeno y peroxinitrito. Sin embargo, en determinadas condiciones adquiere propiedades prooxidantes.2
Las concentraciones elevadas de ácido úrico y su baja solubilidad facilitan la formación de cristales en las articulaciones y, de esta manera, la aparición de gota, que se caracteriza por dolor e inflamación en el área afectada.4 La elevación sostenida de las concentraciones de ácido úrico puede inducir un daño renal.2 Las cifras incrementadas de ácido úrico se relacionan con diversos factores de riesgo de enfermedad cardiovascular: resistencia a la insulina, inflamación sistémica, estrés oxidativo, obesidad, hipertensión y dislipidemia.5 Se han publicado estudios prospectivos que demuestran la asociación entre la hiperuricemia basal y la mortalidad cardiovascular y mortalidad por todas las causas.6
Las concentraciones de ácido úrico son mayores en los hombres que en las mujeres; en ellos permanecen estables a lo largo de la vida. En la mujer se incrementan con la menopausia espontánea o quirúrgica de manera independiente a la edad.7 Todo parece indicar que los estrógenos promueven la depuración renal más eficiente de uratos que conduce a menor concentración sérica de ácido úrico.8 También se ha identificado que la mayoría de mujeres con gota son posmenopáusicas y que la terapia hormonal disminuye las concentraciones de ácido úrico.8
Con la menopausia sobrevienen cambios en la composición corporal que favorecen la acumulación de grasa en la región abdominal, circunstancia que incrementa el riesgo de enfermedad cardiovascular. Esta redistribución se acompaña de modificaciones en la secreción de diversas hormonas producidas en el tejido adiposo: leptina y adiponectina.9
Existe relación entre la grasa visceral intraabdominal y el ácido úrico.10 Los mecanismos que explican esta relación son: mayor producción de ácido úrico junto con mayor síntesis de triglicéridos y menor excreción por el efecto de la insulina en la vía urinaria.11,12
Con base en lo anterior, el objetivo de este estudio fue: evaluar la relación del ácido úrico con los parámetros metabólicos, antropométricos, leptina y adiponectina en mujeres posmenopáusicas en quienes se incrementa el riesgo de enfermedad cardiovascular.
MATERIALES Y MÉTODOS
Estudio transversal y descriptivo efectuado en mujeres posmenopáusicas. La posmenopausia se definió como: amenorrea de un año o más de duración y concentraciones de FSH mayores de 40 IU/L. Se excluyeron las pacientes con: enfermedad cardiovascular previa, hiperuricemia conocida, enfermedad renal, hepática, hipertensión arterial, diabetes mellitus tipo 2, consumidoras de alcohol y quienes recibían terapia hormonal. El protocolo fue autorizado por el Comité del Hospital Regional 251 del IMSS y todas las pacientes firmaron una carta de consentimiento informado.
Todas las pacientes se citaron a las 7 h, en ayuno de 10 h. A todas se les integró su historia clínica, se les efectuaron mediciones antropométricas mediante bioimpedancia eléctrica, con una báscula Tanita (Inner Scan Radio Wireless body composition platform BC-1000 plus); se determinaron: porcentaje de grasa corporal, masa muscular y rango de grasa visceral. Para esto se les solicitó vestir ropa ligera y no usar zapatos. Además, se utilizó una báscula y estadímetro Bame con una escala de precisión de 0.5 kg. El IMC se calculó mediante la división del peso (kg) entre la altura (m2).
Las muestras de sangre venosa antecubital se centrifugaron a 2000 rpm durante 20 minutos para separar el suero y preparar fracciones de 500 µL que permanecieron en congelación a -70 °C hasta la realización de los ensayos. La glucosa, colesterol total, colesterol HDL y los triglicéridos se determinaron por métodos enzimáticos en el equipo DXC-600 modelo Beckman Coulter. La fracción de colesterol LDL se calculó con la fórmula de Friedewald. Para medir las concentraciones de adiponectina, leptina e insulina se recurrió a la técnica de radioinmunoensayo con equipos comerciales de Millipore Corporation (MA, USA). La resistencia a la insulina se determinó con el modelo HOMA-IR y la fórmula: glucosa de ayuno (mmol/L) multiplicada por las concentraciones de insulina de ayuno (mU/L)/22.5.13
Los datos se muestran con media ± DE. Los valores mostraron una distribución normal, las correlaciones entre las variables se establecieron mediante una prueba de correlación de Pearson. Para determinar los parámetros con mayor influencia en el ácido úrico se obtuvo la regresión múltiple. Se consideró significativo un valor de p < 0.05. Los datos se analizaron con el programa estadístico SPSS versión 21.0.
RESULTADOS
Se estudiaron 90 mujeres posmenopáusicas de 55 a 84 años. La edad promedio de las participantes fue de 63.7 años. Las principales características se muestran en el Cuadro 1. Según su índice de masa corporal, 28 de 90 participantes tuvieron peso normal (IMC 18.5-24.9), 29 de 90 sobrepeso (IMC 25-29.9) y 33 de 90 obesidad (IMC 30). La concentración promedio de ácido úrico fue de 4.9 mg/dL y 14 de 90 participantes tuvieron hiperuricemia (más de 6 mg/dL de ácido úrico). Además, se detectó hipercolesterolemia (más de 200 mg/dL de colesterol) en 33 de 90 mujeres, hipertrigliceridemia (más de 150 mg/dL de triglicéridos) en 30 de 90 participantes y resistencia a la insulina (HOMA-IR >3.5) en 43 de 90 mujeres.
Cuadro 1 Variables antropométricas y metabólicas de la población de estudio (n = 90)
| Variable | Media ± DE |
|---|---|
| Edad (años) | 66.3 ± 8.3 |
| Peso (kg) | 65.7 ± 13.9 |
| IMC | 25.6 ± 5.0 |
| Grasa corporal (%) | 38.8 ± 6.3 |
| Masa corporal (kg) | 27.9 ± 13.3 |
| Grasa visceral | 10.0 ± 2.5 |
| Masa muscular | 36.5 ± 5.8 |
| Glucosa (mg/dL) | 88.3 ± 10.7 |
| Colesterol total (mg/dL) | 218.8 ± 44.0 |
| HDL-colesterol (mg/dL) | 55.0 ± 15.8 |
| LDL-colesterol (mg/dL) | 123.7 ± 34.3 |
| Triglicéridos (mg/dL) | 198.8 ± 99.0 |
| Ácido úrico (mg/dL) | 4.9 ± 1.0 |
| Leptina (ng/mL) | 33.9 ± 23.0 |
| Adiponectina (mg/mL) | 14.2 ± 9.2 |
| Insulina (mU/mL) | 16.5 ± 8.6 |
| HOMA-IR | 3.6 ± 1.9 |
IMC: Indice de masa corporal
HOMA-IR: resistencia a la insulina evaluada por el modelo HOMA
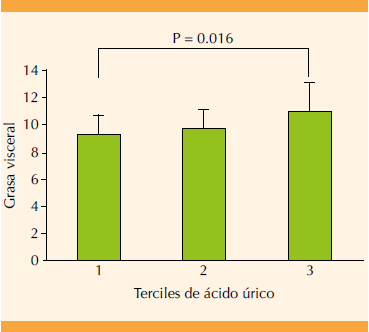
En el análisis de correlación de Pearson, el peso, el IMC, la grasa y masa corporal, la grasa visceral, la masa muscular, el colesterol LDL, los triglicéridos y la leptina se asociaron de forma positiva y significativa (p < 0.05) con el ácido úrico (Cuadro 2). Por el contrario, el colesterol HDL y la adiponectina se relacionaron negativamente con el ácido úrico de forma significativa (p < 0.05). En el análisis de regresión múltiple solo la grasa visceral se asoció con el ácido úrico, independientemente del peso corporal (beta = 0.592, p = 0.037). En la Figura 1 se muestra el promedio de grasa visceral en relación con el tercil de ácido úrico de las participantes. Se encontró que a mayores concentraciones séricas de ácido úrico, mayor grasa visceral, con una diferencia significativa entre la cantidad de grasa visceral de las pacientes del primer y tercer tercil de ácido úrico.
Cuadro 2 Correlaciones de los valores de ácido úrico con variables antropométricas y metabólicas
| Variable | Correlación | P |
|---|---|---|
| Peso (kg) | 0.353 | 0.001 |
| IMC | 0.303 | 0.003 |
| Grasa corporal (%) | 0.359 | <0.001 |
| Masa corporal (kg) | 0.269 | 0.009 |
| Grasa visceral | 0.304 | 0.003 |
| Masa muscular | 0.358 | <0.001 |
| Glucosa (mg/dL) | 0.044 | 0.674 |
| Colesterol total (mg/dL) | 0.195 | 0.062 |
| HDL-colesterol (mg/dL) | -0.275 | 0.008 |
| LDL-colesterol (mg/dL) | 0.214 | 0.039 |
| Triglicéridos (mg/dL) | 0.201 | 0.05 |
| Leptina (ng/mL) | 0.265 | 0.010 |
| Adiponectina (mg/mL) | -0.244 | 0.026 |
| Insulina (mU/mL) | 0.146 | 0.166 |
| HOMA-IR | 0.152 | 0.149 |
IMC: Indice de masa corporal
HOMA-IR: resistencia a la insulina evaluada por el modelo HOMA
DISCUSIÓN
Las mujeres premenopáusicas tienen menor riesgo de enfermedad cardiovascular que los hombres de la misma edad; sin embargo, la protección se pierde con la menopausia, debido a la disminución de la producción de hormonas sexuales.14 Durante esta etapa la mujer experimenta diversos cambios metabólicos: dislipidemia, resistencia a la insulina e incremento de las concentraciones de ácido úrico.7,15 En nuestro estudio se encontró una frecuencia baja de hiperuricemia (15%) en la posmenopausia, lo que coincide con una investigación efectuada en México en mujeres mayores de 18 años, aparentemente sanas, en 16% se reportaron elevadas las concentraciones de ácido úrico.16
Las concentraciones séricas de ácido úrico se han relacionado con la enfermedad cardiovascular y con diversos factores de riesgo: hipertensión, hiperlipidemia, obesidad y resistencia a la insulina. En nuestro estudio se encontró una asociación del ácido úrico con parámetros antropométricos. El peso, índice de masa corporal, grasa y masa corporal, grasa visceral y masa muscular se asociaron positivamente con concentraciones elevadas de ácido úrico. Esta asociación se explica por la mayor producción y excreción renal disminuida de ácido úrico en mujeres obsesas.17,18
Al analizar estas asociaciones, con ajuste del peso, solo permaneció la relación de ácido úrico con la grasa visceral. La obesidad visceral se asocia con sobreproducción de ácido úrico y la reducción de grasa visceral se acompaña de disminución en los valores de este compuesto.
Tsushima y sus colaboradores, en un estudio llevado a cabo en ratones, mostraron por primera vez que el tejido adiposo secretaba ácido úrico a través de la acción de la enzima xantina oxidorreductasa y que los ratones obesos tenían mayor secreción de ácido úrico que los ratones no obesos, la que disminuía cuando se les administraba un inhibidor de la xantina oxidorreductasa, como febuxostat. Asimismo, en cultivos celulares de adipocitos maduros 3T3-L1 demostraron secreción de ácido úrico al medio de cultivo.19 Diversos estudios epidemiológicos longitudinales también han demostrado que la obesidad predice la elevación de ácido úrico.20,21
Los estudios experimentales han demostrado que el alopurinol, un inhibidor de la enzima xantina oxidorreductasa, previene la ganancia de peso en ratas alimentadas con fructosa y que la xantina oxidorreductasa tiene participación decisiva en la diferenciación de los adipocitos.22,23 De la misma manera, un estudio longitudinal efectuado en hombres con peso normal encontró que los valores de ácido úrico al inicio del estudio predijeron la ganancia de peso en un periodo de 5 años.24 En un intento de aclarar la dirección de causalidad entre el ácido úrico y la obesidad, un estudio reciente con asignación al azar mendeliana demostró que las concentraciones elevadas de ácido úrico son una consecuencia de la obesidad.25
Otro mecanismo de la relación de la acumulación de grasa visceral con la sobreproducción de ácido úrico es el que describe que la expansión de grasa visceral aporta un exceso de ácidos grasos libres a la vena porta, lo que acelera la sobreproducción de lipoproteínas de muy baja densidad y, por lo tanto, de triglicéridos. Esta síntesis incrementada se relaciona con la activación en la síntesis de novo de purinas, a través de la activación de la ruta pentosa fosfato, e incremento de la producción de ácido úrico.26,27 En nuestro estudio el ácido úrico se asoció positivamente con los triglicéridos y el colesterol LDL y de forma negativa con el colesterol HDL.
Otro mecanismo que relaciona la grasa visceral con el ácido úrico es el que describe que a mayor cantidad de tejido adiposo visceral, mayor deterioro en la sensibilidad a la insulina, con la consecuente hiperinsulinemia compensatoria, que puede disminuir la excreción urinaria de uratos e incrementar las concentraciones de ácido úrico en circulación.11,12 En nuestra población no se encontró relación entre el ácido úrico y la insulina ni con resistencia a ésta.
El tejido adiposo visceral es metabólicamente muy activo y regula la secreción de diversas adipocinas: leptina y adiponectina, la primera relacionada con resistencia a la insulina y la segunda con sensibilidad a la insulina. Es así como queda clara la relación positiva entre ácido úrico y leptina y negativa con adiponectina. Estas asociaciones son dependientes de la obesidad. Estos datos son similares a los del estudio de Bedir y su grupo, quienes solo encontraron relación del ácido úrico con leptina en personas con sobrepeso u obesidad.28 Otros autores sugieren que la leptina puede ser un factor patogénico responsable de la hiperuricemia en la obesidad.29 En relación con la adiponectina, adipocina con actividad antiinflamatoria y antiaterogénica, Park y sus coautores al estudiar a cerca de mil mujeres posmenopáusicas identificaron una relación negativa de la adiponectina con el ácido úrico de manera independiente.30
La principal limitación de este estudio se relaciona con el diseño transversal, aunque es la base para la realización de futuras investigaciones. Otras limitantes son el tamaño de la muestra y el método para evaluar la resistencia a la insulina.31 A pesar de esto se consiguió evaluar la composición corporal de las participantes y, así, analizar de manera más específica la relación entre ácido úrico y la distribución de la grasa corporal.
Los hallazgos aquí encontrados muestran que la grasa visceral se asocia con el ácido úrico, independientemente del peso corporal. En la actualidad, México ocupa el segundo lugar a nivel mundial en sobrepeso y obesidad y, por tanto, es posible que también aumente la prevalencia de pacientes con hiperuricemia.32 Esto puede conducir a mayor frecuencia de enfermedad cardiovascular. Freedman y su grupo demostraron que en la mujer cada incremento de 1 mg/dL de ácido úrico se relaciona con aumento de 48% en el riesgo de enfermedad isquémica.33
La actual esperanza de vida de la mujer es de alrededor de tres décadas en la posmenopausia, lo que obliga a poner en práctica estrategias que disminuyan la frecuencia de disfunción cardiometabólica y que mejoren su calidad de vida.
CONCLUSIÓN
El ácido úrico se relaciona con un perfil cardiometabólico adverso en mujeres posmenopáusicas, se relaciona directamente con el peso, el IMC, la grasa y masa corporal, la grasa visceral, la masa muscular, el colesterol LDL, los triglicéridos y la leptina y muestra una relación inversa con el colesterol HDL y la adiponectina. La grasa visceral se asocia con el ácido úrico, independientemente del peso corporal, lo que sugiere que las intervenciones dirigidas a la disminución de grasa visceral y de las concentraciones ácido úrico pueden reducir el riesgo de enfermedad cardiovascular.











 text new page (beta)
text new page (beta)