ANTECEDENTES
En la actualidad, la integridad del ADN espermático es un parámetro ideal para evaluar la calidad seminal y un predictor del potencial de fertilidad.1 Aproximadamente de 10 a 15% de los varones infértiles tienen parámetros normales en espermiogramas, según lo establecido por la OMS. A pesar de que los varones tienen valores normales en el análisis morfológico seminal, la dificultad para lograr un embarazo conduce a la necesidad de evaluar el daño al ADN, las alteraciones meióticas o aneuploidias espermáticas.2 La capacidad del ovocito para reparar este daño depende de las condiciones citoplasmáticas y su calidad genómica, que disminuye conforme aumenta la edad de la mujer; aunque es un mecanismo difícil de evaluar, el estudio del factor seminal puede aportar mejor asesoramiento a los pacientes, al contar con la información completa de la pareja (daño del ADN espermático y capacidad de reparación por parte del ovocito).3
El ADN espermático dañado y no reparado se relaciona con la expresión tardía del genoma paterno y el bloqueo en el desarrollo postimplantatorio de embriones con cariotipo normal.4,5 Esto explica el bloqueo durante el desarrollo embrionario y la obtención de blastocistos, y el fracaso de las técnicas de reproducción asistida.
Existen varias pruebas para medir la fragmentación del ADN espermático: técnica de TUNEL, COMET, técnica de dispersión de cromatina y SCSA. En todas estas se reporta una correlación negativa con las tasas de fecundación o desarrollo embrionario.6,7 La técnica de dispersión de la cromatina, basada en una descondensación inducida del ADN, detecta la fragmentación del material genético espermático y resulta una técnica adecuada porque es más sencilla y eficaz para determinar este parámetro.8
La ventaja del diagnóstico de infertilidad masculina se observa cuando disminuye la ansiedad en los varones que desean conocer los motivos precisos de su infertilidad y una vez encaminados en un proceso de diagnóstico-tratamiento pueden implementarse estrategias clínicas que ayuden a la pareja.6,9
El estudio de la fragmentación del ADN espermático, mediante la técnica de dispersión de cromatina, cumple con el objetivo de ofrecer una mejor evaluación del factor masculino en el contexto de cada grupo de diagnóstico de infertilidad, para ayudar a brindar una orientación más precisa en la terapéutica seleccionada. El objetivo de este estudio fue: determinar las repercusiones del daño al ADN espermático en los parámetros seminales más estudiados en diagnóstico clínico de varones infértiles.
MATERIALES Y MÉTODOS
Estudio de casos y controles, prospectivo y comparativo efectuado en pacientes masculinos atendidos en el Centro Integral de la Mujer y Reproducción Asistida de Puebla, México (CREAFAM). Mediante la técnica de dispersión de cromatina a las muestras de semen de los pacientes se aplicó una prueba. Para fines de ensayo, los sujetos de estudio se dividieron en dos grupos según el porcentaje de fragmentación del ADN espermático: grupo 1 con mala integridad del ADN espermático (≥ 30% de espermatozoides con fragmentación del ADN) y grupo 2 con buena integridad del ADN espermático (< 30% de fragmentación del ADN).
Se analizaron la integridad del ADN espermático y su repercusión en diferentes variables: edad del varón, movilidad tipo A+B, morfología espermática y diagnóstico seminal. Para el análisis de la edad del varón los pacientes se subestratificaron en dos grupos: menores de 40 años y mayores de esta edad.
Evaluación morfológica y de la movilidad espermática
La recolección y análisis básico de las muestras seminales se efectuaron de acuerdo con los parámetros del Manual de la OMS para examen y procesamiento de semen humano, con los criterios de morfología estricta de Kruger.11 En un portaobjetos rotulado con los datos del paciente se tomaron 6 µL de semen y se efectuó un barrido con un cubreobjetos. Se colocaron otros 10 µL de semen en una tira reactiva de pH (Merck, Darmstdat, Alemania) para determinar si existía infección o proceso de inflamación. Se aplicó una tinción hematológica (Hycel, México) y se observó al microscopio óptico (Olympus CH-2, Japón) con un objetivo 100X). Para el análisis de movilidad y concentración espermática se tomaron 6 µL de semen previamente licuado en una cámara Makler (Sefimedical Instruments, Boston MA) y se observó con el objetivo de 20X. Después de evaluar la muestra, el eyaculado total se depositó en un tubo de fondo cónico NUNC de 14 mL (Thermo Fisher Scientific, Marietta, Ohio) y se realizó un lavado con HTF-HEPES (Irvine Scientific Santa Ana, CA) a 18000 rpm en una centrífuga Zeigen CH90-1A. El botón de células se aforó a 0.4-0.5 mL en medio HTF-HEPES según su concentración.
Evaluación de la integridad espermática mediante el análisis de dispersión de la cromatina
El análisis de fragmentación se llevó a cabo con el equipo Halosperm ADN (Halotech, Madrid, España). El fundamento de esta técnica implica una respuesta diferencial del núcleo de los espermatozoides con ADN fragmentado y de los que poseen ADN intacto en donde los núcleos espermáticos con fragmentación de las cadenas de ADN generan halos muy pequeños o inexistentes.8 Se preparó una alícuota de semen diluido en medio HTF-HEPES (Irvine Scientific Santa Ana, CA); la dilución del semen se calculó según la concentración de espermatozoides por mililitro. Las laminillas se colocaron durante 7 minutos en el refrigerador a 4°C para permitir que la agarosa formara un microgel con los espermatozoides.
Enseguida, las laminillas se sumergieron horizontalmente durante 7 minutos en una matriz en la solución ácida (Halotech, Madrid, España) para romper la membrana espermática. Luego se incubaron durante 25 minutos en el acelerador de lisis (Halotech, Madrid, España) para desnaturalizar las membranas celulares, proteínas y material genético y liberar los nucleótidos a partir de un halo de dispersión de ADN. Por último, se aplicó una tinción hematológica (Hycel, Ciudad de México) para poder visualizar los halos de dispersión con un microscopio óptico (Olympus CH-2, Japón) con un objetivo de 100X.
Diagnóstico seminal
Con base en los criterios del Manual de la OMS para examen y procesamiento de semen humano (5a edición, 2010), los dos grupos de integridad espermática se dividieron conforme a su diagnóstico: teratozoospermia, astenozoospermia, oligoastenoteratozoospermia, astenoteratozoospermia y normozoospermia. Los criterios utilizados para este diagnóstico fueron los convencionales.
Análisis estadístico
Los datos se analizaron con el programa Prisma 5.0 (Graphpad Software, San Diego CA). Se efectuó una prueba de normalidad con el análisis D'Agostino y Pearson omnibus normality test. En el análisis de integridad por edad y el diagnóstico seminal se integró una tabla de contingencia y la prueba exacta de Fisher y χ2, respectivamente. Para los análisis de movilidad A+B, morfología y leucocitos se aplicó la prueba t de Student para datos no pareados. Para el análisis de la movilidad C y D se utilizó la prueba de Mann Withney. El programa de cómputo calculó los valores de probabilidad, los resultados se consideraron estadísticamente significativos con una p < 0.005.
RESULTADOS
De 110 pacientes estudiados, 33 tuvieron mala integridad del ADN espermático y 77 buena. Las características demográficas de ambos grupos fueron similares. La concentración espermática en el grupo de pacientes con buena integridad del ADN fue significativamente más alta que en el grupo de mala integridad (media 69.2 ± 34.79 vs 37.47 ± 40.65, p < 0.0001) (Figura 1A). La movilidad A + B fue significativamente más alta en el grupo de buena integridad (media 50.92 ± 12.72 vs 30.30 ± 15.53, p < 0.0001) respecto del grupo de mala integridad. La movilidad tipo C fue significativamente mayor en el grupo de mala integridad (media 20.73 ± 9.59 vs 25.48 ± 13.83, p = 0.0436) y el porcentaje de inmovilidad fue notoriamente más alto en el grupo de mala integridad (media 28.40 ± 12.48 vs 42.12 ± 20.86, p < 0.0001) comparado con el grupo de buena integridad (Figuras 1B,CyD). El porcentaje de morfología normal fue mucho más alto en el grupo de buena integridad (5.93 ± 3.32 vs 4.24 ± 2.04, 0.0063) (Figura 1E). El análisis de integridad del ADN por edad del varón demostró que en los menores de 40 años se registran muchos más casos de buena integridad espermática (p = 0.013) (Figura 1F). Por lo que se refiere al diagnóstico seminal en el grupo de buena integridad se registró un número y porcentaje significativamente más alto de pacientes con normozoospermia comparado con el grupo de mala integridad. En el caso de teratozoospermia y astenozoospermia se observó que significativamente más pacientes del grupo de buena integridad lo tuvieron (p < 0.0001), y los pacientes con mala integridad reportaron alteraciones espermáticas más severas. Figura 2A
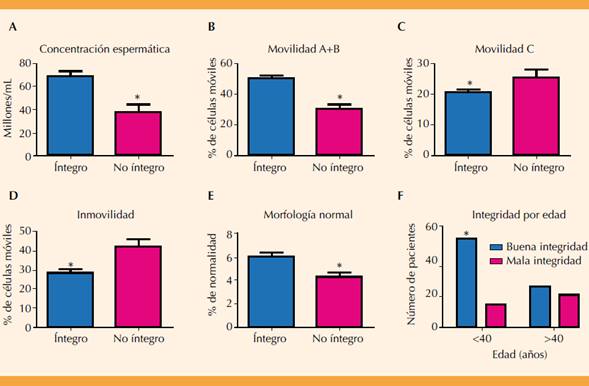
Figura 1 Comparación de las características seminales más importantes en los grupos de varones con un porcentaje elevado de fragmentación espermática vs varones con ADN íntegro. A) Evaluación de la concentración espermática, B) Movilidad progresiva, C) Movilidad no progresiva, D) Inmovilidad, E) Morfología, F) Integridad del ADN espermático por edad del varón (las gráficas representan la media ± desviación estándar; *= resultado significativo en prueba de t de student o χ2; p<0.05).

Figura 2 Distribución de las alteraciones espermáticas y factores de infertilidad según la integridad del ADN espermático. A) Porcentaje de varones según su diagnóstico seminal. B) Concentración de leucocitos en el semen. C) Porcentaje del factor de infertilidad de acuerdo con la integridad del ADN espermático (las gráficas representan la media ± desviación estándar; *= resultado significativo en prueba t de Student o χ2; p<0.05).
El análisis de la cantidad de leucocitos por campo demostró que no existen diferencias significativas entre los grupos (p = 0.3529) (Figura 2B). Los factores de infertilidad más frecuentes implicados en ambos grupos de integridad espermática fueron: aborto de repetición, edad de la pareja, falla previa en la técnica de reproducción asistida, factor masculino severo y factor tubárico. En el grupo de buena integridad espermática, el factor aborto de repetición coexistió en 23% de los casos, mientras que en el grupo de mala integridad se registró en 12%. El factor edad prevaleció en 32% de los pacientes del grupo de buena integridad y en 39% de mala integridad. El factor de falla previa en la técnica de reproducción asistida fue de 10% en el grupo de buena integridad espermática y 15% en el de mala. Por último, los factores masculino y tubárico coexistieron en 7% en el grupo de buena integridad y 12% en el de mala, mientras que el tubárico se encontró en 10% del grupo de buena integridad y en 6% del de mala integridad espermática. Figura 2C
DISCUSIÓN
En los tratamientos de reproducción asistida el éxito clínico se asocia, normalmente, con múltiples factores femeninos y masculinos. El factor masculino más importante es la integridad estructural y funcional del espermatozoide.10 Está demostrado que existe una relación entre un porcentaje elevado de espermatozoides con alteraciones en la cromatina y los resultados no exitosos de las técnicas de reproducción asistida. Por ejemplo, está reportado que disminuyen las tasas de fertilización e implantación en tratamientos de alta complejidad que originan mala calidad embrionaria, bloqueo embrionario y abortos.11
Durante la selección de los mejores espermatozoides que se utilizarán para llevar a cabo la fecundación, se toman en cuenta parámetros morfológicos, como movilidad y morfología, cualidades que han demostrado ser insuficientes para seleccionar los gametos más competentes. Los ensayos de fragmentación del ADN espermático han permitido analizar al espermatozoide de una manera integral. Los datos obtenidos de este ensayo aún suscitan controversia aunque la mayor parte de los estudios reporta una correlación inversa entre la fragmentación del ADN y la calidad espermática evaluada por la concentración, movilidad y morfología, sin tomar en cuenta la edad de los varones.12
En nuestro estudio, el análisis de la concentración y movilidad espermática demostró que en las muestras de semen que contenían espermatozoides de buena integridad, la concentración espermática fue significativamente más alta respecto de las muestras de mala integridad.
La movilidad progresiva también fue significativamente más alta en el grupo de buena integridad, así como la morfología normal también fue mucho más alta en las muestras seminales de pacientes con buena integridad espermática, lo que concuerda con lo reportado previamente.12,13 Estos resultados deben tomarse con precaución debido a que no siempre puede predecirse qué índice de fragmentación tiene un paciente de acuerdo con solo la evaluación de movilidad, morfología y concentración espermática. Algunos estudios han demostrado que existe una correlación entre la fragmentación del ADN y morfología anormal, como la megalocefalia, múltiples colas con disomia o globosospermia que ha incrementado las tasas de aneuploidia embrionaria y pérdidas recurrentes del embarazo.14,15
En este estudio se observó que los varones mayores de 40 años tuvieron un índice de fragmentación del ADN espermático más alto que los varones más jóvenes. Esto coincide con lo reportado por diversos autores.8,16,17 Algunos estudios apoyan la evidencia de la disminución de los parámetros seminales convencionales con la edad.18,19 La fragmentación del ADN espermático como marcador de fertilidad masculina ha permitido establecer la relación entre la fragmentación y la edad del varón.20 Varios autores observaron, mediante el ensayo COMETA, que la fragmentación aumentaba con la edad.21,22 En otro estudio no se demostró que hubiera una correlación entre ambos parámetros obtenidos por TUNEL.23 Se evaluó la fragmentación mediante SCSA junto con otros parámetros seminales en grupos de varones de diferentes edades. Cuando las muestras del grupo de varones mayores de 45 años se compararon con las de otros grupos se observó una diferencia significativa en tres parámetros: motilidad, vitalidad, fragmentación. Los varones de 45 años o mayores tenían menor motilidad espermática que los varones más jóvenes, mientras que el índice de fragmentación era significativamente mayor. El índice de fragmentación en el grupo de mayor edad era superior a 30%, lo que corresponde a un bajo potencial fertilizante; en los grupos de varones más jóvenes el índice de fragmentación estaba por debajo de ese valor.24,25,26 Entonces, la edad del varón sigue siendo un tema discutido por lo que requiere mayor investigación que permita demostrar si la discrepancia entre los resultados se debe a la técnica empleada en el estudio de la fragmentación y así determinar la repercusión real de la edad del varón en los diferentes parámetros estudiados en el diagnóstico clínico de la pareja infértil.
El análisis del diagnóstico seminal demostró que los varones con buena integridad espermática tuvieron mayor porcentaje de normozoospermia y, de forma complementaria, los varones con mala integridad espermática reportaron mayor porcentaje de alteraciones espermáticas más severas. Ya está reportada la estrecha asociación entre diagnóstico seminal con alteraciones y los índices de fragmentación del ADN. Por ejemplo, se ha observado que la fragmentación es mayor en pacientes con diagnóstico de oligoastenozoospermia,27,28 lo que se relaciona con el bajo potencial fertilizante de estos espermatozoides. Está demostrado que el índice de fragmentación espermática no siempre se relaciona con los parámetros seminales, en este caso solo se observó en 30% de los varones con una fragmentación superior a 27% que tuvieron astenozoospermia u oligozoospermia.29,30
El conteo de leucocitos en una muestra seminal es un proceso rutinario en la evaluación andrológica. La existencia de estas células se ha asociado con infecciones que pueden afectar el potencial reproductivo del varón.31 En el estudio aquí comunicado no se encontró diferencia significativa entre el número de células por campo en las muestras de pacientes con buena integridad y mala integridad del ADN espermático. Esto indica que no existe una relación entre estas variables y podría no tomarse en cuenta durante una evaluación de la fragmentación del ADN espermático. En un estudio reciente se demostró que a pesar de que las infecciones puedan alterar algunos parámetros seminales como la movilidad y condensación de la cromatina, la integridad del ADN no se afecta de manera significativa.32
El análisis del diagnóstico de la pareja demostró que los factores de infertilidad más frecuentes asociados con la integridad espermática fueron el aborto de repetición, la edad de la pareja, falla previa en la técnica de reproducción asistida, factor masculino severo y factor tubárico. En el caso del aborto de repetición se ha demostrado que la expresión tardía del factor paterno podría explicar esta situación, donde hay ovocitos que fecundan pero, posteriormente, hay una detención del desarrollo embrionario lo que explica los resultados negativos en parejas donde la técnica de reproducción asistida empleada debería haber resuelto el problema.33
La expresión tardía del factor masculino en el desarrollo embrionario también determina la detención de su desarrollo antes de la implantación, lo que se relaciona con los resultados obtenidos en los grupos de falla previa de técnicas de reproducción asistida, y con todos los parámetros seminales estudiados. En estos casos se sugiere efectuar a las parejas el estudio de integridad del ADN espermático mediante la técnica de dispersión de cromatina antes de intentar un nuevo embarazo.34 Se ha señalado que el origen de la fragmentación del ADN espermático puede ocurrir en diferentes estadios del desarrollo de los espermatozoides, es decir, tanto a nivel testicular durante la espermatogénesis como durante el tránsito por los conductos eyaculadores, en cuyo caso los daños generados postesticularmente podrían tener un mejor pronóstico de tratamiento exógeno con antioxidantes y de reparación por parte del ovocito.35
CONCLUSIONES
La mala integridad del ADN espermático tiene un efecto significativo en la concentración espermática, la movilidad y la morfología pues hay alteraciones en estos parámetros en varones con alta fragmentación del ADN espermático. La mala integridad de ADN también altera el diagnóstico seminal, pues los varones tuvieron alteraciones más severas cuando la integridad espermática fue más baja. No se observó algún factor de infertilidad que describiera un comportamiento específico relacionado con la mala integridad espermática.
Los resultados de este estudio ayudarán a identificar entre los diagnósticos de factor masculino severo más frecuentes cuáles son los que tienen un pronóstico menos exitoso y que se afronta en la consulta del varón infértil con una prueba sencilla de realizar, pues es posible ofrecer una respuesta a los pacientes desde el punto de vista diagnóstico, y orientación terapéutica posterior con expectativas reales de tratamiento.











 text new page (beta)
text new page (beta)



