INTRODUCCIÓN
La enfermedad vascular cerebral (EVC) se encuentra entre las primeras causas de discapacidad en adultos a nivel mundial [1]. Además, la demanda por servicios de rehabilitación posterior a una EVC está aumentando [1]. Sin embargo, recientemente se ha reportado que países en vías de desarrollo, como México, muestran una falta de progreso en el tratamiento de esta enfermedad en los últimos años [2]. Esto se refleja en métricas como la mortalidad y la prevalencia de la EVC, las cuales se han mantenido constantes desde hace 15 años en lugar de mostrar una tendencia en decremento [1][2]. En la actualidad, se cuenta con más información acerca de las causas que producen una EVC, como un coágulo en un vaso sanguíneo o la ruptura de éste, que acerca de los factores que promueven la recuperación funcional de los pacientes [3]. Comprender los procesos fisiológicos que se encuentran detrás del proceso de recuperación tras una EVC es de gran importancia, ya que esto permitiría desarrollar nuevos y mejores procedimientos de neurorrehabilitación.
La consecuencia con mayor impacto de la EVC es la pérdida de la función motora, conocida como hemiparesia [4]. Las deficiencias funcionales motoras que presentan los pacientes con EVC pueden ser tratadas con terapia física o con terapias experimentales como aquellas que utilizan un sistema de interfaz cerebro-computadora (ICC) [5][6]. No obstante, el grado de efectividad de la terapia es diferente entre pacientes debido a distintos factores que afectan el proceso de rehabilitación, tales como la extensión y ubicación de la EVC, y el grado de discapacidad motora inicial [5][6]. Por lo tanto, resultaría benéfico entender de mejor manera cómo ocurre la recuperación funcional y qué factores la afectan a favor o en contra.
La recuperación de los pacientes posterior a la EVC, en términos de la función cerebral y la conectividad, se ha atribuido principalmente al mecanismo de neuroplasticidad [7][8]. La neuroplasticidad se define como la habilidad del sistema nervioso a responder a estímulos intrínsecos o extrínsecos al reorganizar su estructura, función y sus conexiones [9]. Estos cambios están asociados con el desarrollo y el aprendizaje [10][11][12]. Además, ocurren a lo largo de la vida y pueden incrementar posterior a una lesión o afección [13][14].
Los cambios en neuroplasticidad pueden observarse en varios niveles, tales como cambios celulares o sinápticos, cambios en la función y estructura de regiones cerebrales, y cambios de comportamiento como adaptabilidad o el mejorar alguna habilidad [15][16]. Estos cambios pueden mantenerse a largo plazo mediante dos mecanismos. El primero, es la potenciación a largo plazo (PLP), que involucra un refuerzo constante en las sinapsis que produce un incremento de larga duración en la transmisión de señales entre neuronas [17][18]. Y, el segundo, es la depresión a largo plazo (DLP), que produce un efecto opuesto a la PLP en la excitabilidad de la sinapsis [19]. Ambos mecanismos juegan roles importantes en la modulación bidireccional a largo plazo de las conexiones neuronales, la cual es la base biológica del aprendizaje y la memoria [20]. Por otra parte, se han definido mecanismos de neuroplasticidad estructurales involucrados en la recuperación motora de pacientes con EVC, como un aumento en la proliferación axonal, ramificación de dendritas, sinaptogénesis, neurogénesis y gliogénesis [21][22][23].
Estudiar los efectos funcionales o estructurales que producen los mecanismos de neuroplasticidad en pacientes con EVC podría esclarecer el proceso de recuperación motora en esta población. Por esto, se han propuesto distintos métodos que ofrecen una gran variedad de información acerca de los mecanismos patológicos y de recuperación producidos tras una EVC [24][25]. Entre estos métodos se encuentran las técnicas de neuroimagenología, las cuales tienen la habilidad de mostrar los procesos neuronales encargados de la recuperación funcional en pacientes de manera no invasiva [26].
La resonancia magnética funcional (RMF) es una de estas técnicas que se ha utilizado ampliamente para conocer aquellos mecanismos neuronales responsables de la reorganización cerebral después de una EVC [3]. La RMF se basa en las propiedades magnéticas de la oxihemoglobina y de la desoxihemoglobina para detectar cambios locales en el flujo cerebral debido a la actividad neuronal en esa zona [27]. Debido a la alta demanda de oxígeno de las neuronas activas, el flujo sanguíneo de la región se incrementa por medio de un acoplamiento neurovascular [28]. Este incremento local de oxígeno en sangre permite, cuando el paciente ejecuta una tarea, localizar y cuantificar la respuesta de la actividad neuronal a dicha tarea. Además, la RMF es una técnica que no utiliza radiación ionizante o rastreadores químicos, por lo que es ideal para estudios clínicos de patologías neurovasculares como la EVC [29].
La RMF se ha empleado en varios estudios con pacientes con EVC cuya función motora de extremidad superior está afectada. En estos trabajos se ha reportado que la actividad cerebral está alterada tanto en el hemisferio lesionado (ipsilesional) como en el no afectado (contralesional) [30][31][32]. Por ejemplo, en pacientes con discapacidades motrices iniciales más severas, es más probable que ocurra un reclutamiento importante del hemisferio contralesional y una atenuación en la actividad del hemisferio ipsilesional [33][34]. Por otra parte, una mejor recuperación motora de los pacientes ha sido asociada a una reconfiguración lateralizada hacia el hemisferio ipsilesional de la red de conectividad neuronal, lo que asemeja el comportamiento observado en sujetos sanos [35][36].
Asimismo, estudiar la estructura de comunicación en el cerebro también resulta de gran importancia para entender la función cerebral y, por lo tanto, su recuperación. El cerebro humano contiene un gran número de neuronas que se comunican entre ellas por medio de axones, formando así redes complejas de neuronas. La imagenología por tensor de difusión (ITD) es una técnica de neuroimagenología no invasiva por resonancia magnética de difusión que puede medir la organización axonal macroscópica en tejidos del sistema nervioso [37]. Una EVC puede afectar directamente tractos de materia blanca y causar una degeneración Walleriana, la cual consiste en la desmielinización y degeneración distal de axones afectados [38].
En distintos estudios se ha observado que métricas obtenidas a partir de la ITD, referentes a la integridad de la materia blanca, pueden servir como biomarcadores de recuperación o respuesta a programas de rehabilitación para extremidad superior [39][40][41]. La mayoría de los estudios de ITD se enfocan al análisis del tracto corticoespinal (TCE) debido a su importancia en la ejecución motora, en la recuperación funcional y a que frecuentemente se ve afectado por lesiones causadas por una EVC [39][42]. Además, se han reportado asociaciones entre métricas de la ITD y la recuperación motora de extremidad superior en pacientes con EVC en algunos meta-análisis [43][44].
La información obtenida de RMF o ITD puede proporcionar una medición cuantitativa de la neuroplasticidad de pacientes con EVC, quienes pueden presentar cambios en ambos hemisferios cerebrales tras un programa de neurorrehabilitación [7]. Una forma de cuantificar estas diferencias inter-hemisféricas, las cuales se presentan a lo largo del programa de terapia proporcionado, es mediante índices de asimetría. Estos índices permiten interpretar la diferencia de una métrica definida en ambos hemisferios [45]. Por ejemplo, si I y C representan una métrica en el hemisferio ipsilesional y contralesional, respectivamente, se puede calcular un índice de asimetría de dicha métrica mediante I/C o mediante (I-C)/(I+C) [45]. Sin embargo, uno de los aspectos importantes en el cálculo de los índices de asimetría es la métrica a utilizar [46]. En RMF, comúnmente se utiliza como métrica el número de vóxeles que muestren actividad neuronal significativa dado un umbral estadístico [46][47][48]. En cambio, en la ITD se han utilizado métricas de difusión para el cálculo de índices de asimetría [39][49].
Las técnicas de RMF y de ITD representan, respectivamente, métodos no invasivos de neuroimagenología funcional y estructural que otorgan información relevante acerca del estado y la evolución de pacientes con EVC. Además, éstas permiten analizar cambios en neuroplasticidad como la reorganización neuronal y la formación de nuevas conexiones en compensación por el daño causado por la lesión cerebral [7]. El objetivo de esta revisión narrativa es presentar las bases del funcionamiento de la RMF y de la ITD, así como estudios que utilizan estas técnicas para estimar neuroplasticidad en pacientes con EVC y, finalmente, ilustrar cómo se cuantifican los cambios asociados a la rehabilitación motora para la extremidad superior con ambas técnicas de neuroimagenología. Esto permitirá sintetizar los avances en el campo y establecer la utilidad de la RMF y la ITD en la cuantificación de la neuroplasticidad en pacientes con EVC tras recibir programas de terapia para extremidad superior.
MATERIALES Y MÉTODOS
Se realizó una revisión de la literatura para identificar trabajos donde se utilizó la RMF, la ITD o ambas, como herramientas para la cuantificación de neuroplasticidad en pacientes con EVC tras recibir un programa de neurorrehabilitación para extremidad superior. Los artículos incluidos en esta revisión narrativa fueron publicados previo a enero de 2023 y cumplieron los siguientes criterios: 1) publicados en revistas revisadas por pares; 2) publicados en inglés; 3) estudios en pacientes con EVC; 4) estudios que proporcionaron programas de neurorrehabilitación motora para extremidad superior; 5) que hayan realizado estudios de neuroimagenología a los pacientes, ya sea RMF, ITD o ambas, en distintos momentos del programa de neurorrehabilitación proporcionado; y 6) que hayan estimado cuantitativamente la neuroplasticidad de los pacientes con EVC debida al programa de neurorrehabilitación usando los estudios de neuroimagen. La búsqueda de trabajos se realizó en PubMed y Google Scholar, utilizando los siguientes términos y/o combinaciones de estos: analysis, bci, diffusion tensor imaging, dti, functional magnetic resonance imaging, fmri, hemiparesis, neuroimaging, neuroplasticity, neurorehabilitation, principles, rehabilitation, stroke, upper-extremity.
RESULTADOS Y DISCUSIÓN
Resonancia magnética funcional
En esta sección se abordan las bases del funcionamiento de la RMF, seguidas por métodos de análisis de lateralidad de las activaciones neuronales y, finalmente, se discuten los trabajos encontrados en la literatura que cuantifican la neuroplasticidad con esta técnica. En total, se incluyeron cinco trabajos en este apartado, los cuales se muestran en la Tabla 1.
Tabla 1 Resumen de los trabajos incluidos en esta revisión que utilizaron la RMF para cuantificar cambios de neuroplasticidad en pacientes con EVC tras recibir un programa de neurorrehabilitación para extremidad superior.
| Trabajos | Número de pacientes con EVC | Tipo de terapia proporcionada | Índice utilizado | Resultados relacionados a neuroplasticidad |
|---|---|---|---|---|
| Caria et al. (2011) [58] | 1 | ICC | IL | Lateralización de las activaciones hacia las regiones motoras ipsilesionales posterior a la terapia ICC, especialmente en la región premotora dorsal y en el área motora suplementaria, de acuerdo con cambios en el IL. |
| Young et al. (2015) [59] | 16 | ICC | IL | Correlación del IL con el número de sesiones de terapia proporcionadas, lo que indica un mayor reclutamiento contralesional a mayor número de sesiones de terapia proporcionadas. El IL se calculó en las cortezas motora primaria y premotora, el tálamo y el cerebelo. |
| Ramos-Murguialday et al. (2019) [60] | 28 | ICC | IL | Cambios significativos en el IL lateralizados hacia el hemisferio ipsilesional en las cortezas motora, premotora y somatosensorial posterior a la terapia ICC. No se encontraron diferencias significativas entre el IL preterapia y el IL en la sesión de seguimiento. |
| Yuan et al. (2020) [61] | 12 | ICC | IL | Lateralización de las activaciones hacia las cortezas motora, premotora y somatosensorial ipsilesionales posterior a la terapia ICC de acuerdo con el IL. |
| Demers et al. (2022) [62] | 13 | TMIR | IL | Cambios significativos del IL post-terapia entre el grupo experimental (n = 7) y el control. El IL mostró una lateralización hacia el hemisferio ipsilesional en la corteza premotora dorsal en el grupo experimental. |
*ICC: Interfaz cerebro computadora, IL: Índice de lateralidad, TMIR: terapia de movimiento inducido por restricción
La RMF es realizada comúnmente con la técnica dependiente del nivel de oxígeno en sangre, o blood oxygen level-dependent (BOLD), la cual aprovecha las diferentes propiedades magnéticas intrínsecas de la oxihemoglobina y la desoxihemoglobina [50][51]. Las sustancias diamagnéticas, como la oxihemoglobina, poseen electrones apareados en todos los subniveles de energía, lo que ocasiona que se produzca una magnetización extremadamente débil y en dirección opuesta (antiparalela) ante la presencia de un campo magnético externo [52]. Por otra parte, las sustancias paramagnéticas, como la desoxihemoglobina, contienen electrones de valencia no apareados, lo cual produce una magnetización importante en la misma dirección (paralela) que un campo magnético externo aplicado [52]. En particular, las propiedades paramagnéticas de la desoxihemoglobina en sangre causan un desfasamiento en los protones de los tejidos, lo que ocasiona una pérdida local de señal tanto en sangre como en tejidos cercanos [50][53]. Además, la afluencia de sangre oxigenada local es producto de un incremento neto en el balance de sangre arterial oxigenada y la sangre venosa desoxigenada [54][55]. Por lo tanto, la señal local de la RMF aumentará conforme la proporción local de oxi/desoxihemoglobina incremente, indicando así un aumento en la actividad neuronal en esa zona [27][56].
Otro aspecto importante para determinar las activaciones presentes en alguna región del cerebro es definir adecuadamente el diseño experimental de un estudio de RMF. Un diseño apropiado del estudio permite tener una potencia estadística adecuada en el experimento, i.e., una mejor capacidad para detectar señales relevantes en un análisis grupal [57].
En la RMF basada en tareas, donde es de gran importancia la manera en que los estímulos son presentados como una función del tiempo, se pueden utilizar diseños en bloques o diseños relacionados a eventos [54][55]. Ejemplos de estos diseños, y la comparación visual entre ellos, se muestran en la Figura 1. El diseño en bloques (Figura 1a) es el más simple y consiste en presentar estímulos consecutivos como una serie de bloques, donde los estímulos de distintas condiciones se presentan en bloques alternados [55]. Estas condiciones alternantes pueden ser, por ejemplo, un bloque de reposo seguido por un bloque de alguna tarea motora o mental. La duración específica de cada bloque depende del tipo del estímulo, siendo el rango de 15 a 30 s el más común [55]. En un bloque en particular, la respuesta hemodinámica al consumo local de oxígeno se mantiene y no regresa al estado inicial hasta el final de dicho bloque. Asimismo, este diseño en bloques permite obtener una buena potencia estadística, amplitud de la señal y robustez en el estudio [54][55]. Por otra parte, en el diseño relacionado a eventos (Figura 1b), las tareas son presentadas en orden aleatorio, lo que permite observar cambios en la respuesta hemodinámica “momento a momento” [55]. Este tipo de diseño considera cada ejecución de la tarea como un evento individual, lo que se traduce a una menor potencia estadística [54][55].
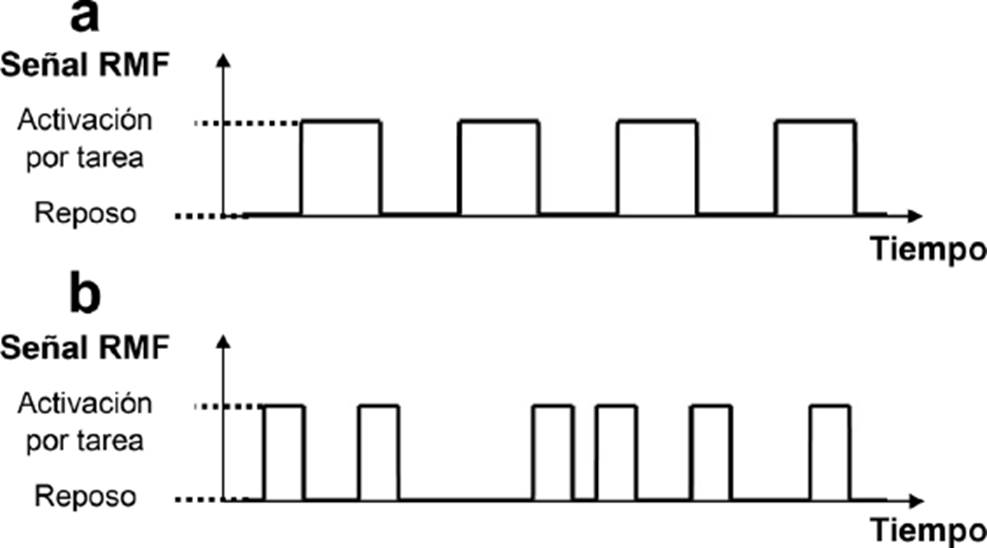
Figura 1 Ejemplos de diseños en la RMF basada en tareas. (a) Diseño en bloques. (b) Diseño relacionado a evento. Figura de elaboración propia.
Sin embargo, el diseño relacionado a eventos ofrece una mayor flexibilidad y un análisis temporal más preciso de la actividad cerebral [54][55]. Además, es posible combinar los diseños en bloques con los relacionados a eventos en un diseño mixto. Esto proporciona información de activaciones funcionales tanto mantenidas como esporádicas y, además, ofrece simultáneamente las ventajas de los diseños en bloque y de los relacionados a eventos [54][63]. Sin embargo, el diseño mixto sufre de una peor estimación de la respuesta hemodinámica y una menor fortaleza estadística de la señal mantenida (i.e., a lo largo del bloque) [63]. Además, requiere de más sujetos de estudio para detectar efectos estadísticamente significativos en la señal mantenida [54][63].
En la RMF basada en tareas y, particularmente, en estudios con pacientes con EVC, el diseño en bloques es de los más utilizados debido a su sencillez y a la alta potencia estadística que puede proporcionar [64][65][66][67][68][69].
En los estudios de RMF con pacientes con EVC es común utilizar reposo y tareas motoras como condiciones en el diseño en bloques. Este diseño permite evaluar el estado físico y cognitivo de los pacientes al momento del estudio, así como observar cambios en la actividad cerebral al realizar tareas motoras [29]. Además, algunos estudios sugieren que la actividad neuronal observada mediante la técnica BOLD es importante para el pronóstico de la recuperación funcional motora de la extremidad superior de los pacientes. Por ejemplo, Lasek-Bal et al. realizaron un estudio de RMF a 13 pacientes con EVC de tipo isquémico en los primeros 4 días desde el inicio de la patología [70]. En su diseño en bloques, los pacientes realizaron un movimiento de pianista con la mano afectada. En este experimento, la señal BOLD mostró que la actividad neuronal producida al realizar la tarea motora se localiza principalmente en las regiones ipsilesionales de la corteza motora primaria, la corteza motora suplementaria y en la corteza premotora en pacientes con menor grado de discapacidad [70]. A su vez, se reportó una tendencia a una mayor recuperación motora de la extremidad superior si los pacientes mostraban activaciones en el área motora suplementaria ipsilesional [70].
Además de auxiliar en el pronóstico, la RMF también ha sido utilizada en estudios con pacientes con EVC para analizar cambios de neuroplasticidad tras recibir un programa de rehabilitación para extremidad superior. En la literatura se pueden encontrar principalmente ejemplos con terapias experimentales basadas en sistemas ICC (terapias ICC), tales como los artículos presentados en la Tabla 1[58][59][60][61].
Las secuencias BOLD que se utilizaron en los programas de terapias siguen un diseño en bloques, en donde se alternan bloques de reposo con bloques de tareas motoras. Estas tareas incluyeron la ejecución e imaginación de flexión y extensión de los dedos de ambas manos [58][60], pulsar botones secuencialmente con los dedos de la mano afectada [59], y comprimir un tubo de plástico con los dedos índice, medio y pulgar de ambas manos [62]. Estos estudios muestran que los pacientes con EVC que reciben terapias de neurorrehabilitación alcanzan distintos grados de mejora en la función motora de extremidad superior. Además, se determinaron como factores que afectan en la recuperación el tipo de paradigma ICC utilizado, el número de sesiones de terapia y la intensidad de éstas. Asimismo, señalan la relevancia de analizar los cambios en la lateralización de la activación neuronal como parte del proceso de neurorrehabilitación, particularmente cuando los pacientes intentan mover la extremidad superior afectada.
En la Figura 2 se muestra un ejemplo de cómo las activaciones significativas (p<0.05, corregida por family-wise error (FWE)) de un paciente con EVC pueden cambiar antes (2a) y después (2b) de recibir una terapia ICC para extremidad superior. Estos mapas de activaciones significativas fueron obtenidos tras el procesamiento de las correspondientes secuencias BOLD en la interfaz gráfica de usuario del software SPM12 [71], siguiendo la metodología ejemplo del análisis de primer nivel descrita en su manual de usuario, incluyendo el preprocesamiento espacial, la especificación del modelo y la inferencia [72]. En estas secuencias BOLD, el paciente intentó realizar flexión y extensión continua de los dedos de la mano afectada (izquierda). Esta tarea motora se alternó con reposo, siguiendo un diseño en bloques. Aquí, se observa que las activaciones neuronales significativas muestran una tendencia bilateral pre-terapia y que éstas cambian hacia una lateralización sobre el hemisferio ipsilesional post-terapia. Sin embargo, esta interpretación es subjetiva al basarse en un análisis visual de los resultados. Por lo tanto, utilizar una métrica que permita una evaluación cuantitativa de estos cambios de lateralización, producidos por mecanismos de neuroplasticidad, resultará de gran importancia para comprender y puntualizar los cambios clínicos producidos en pacientes con EVC tras recibir una terapia ICC, o una terapia convencional, para extremidad superior.
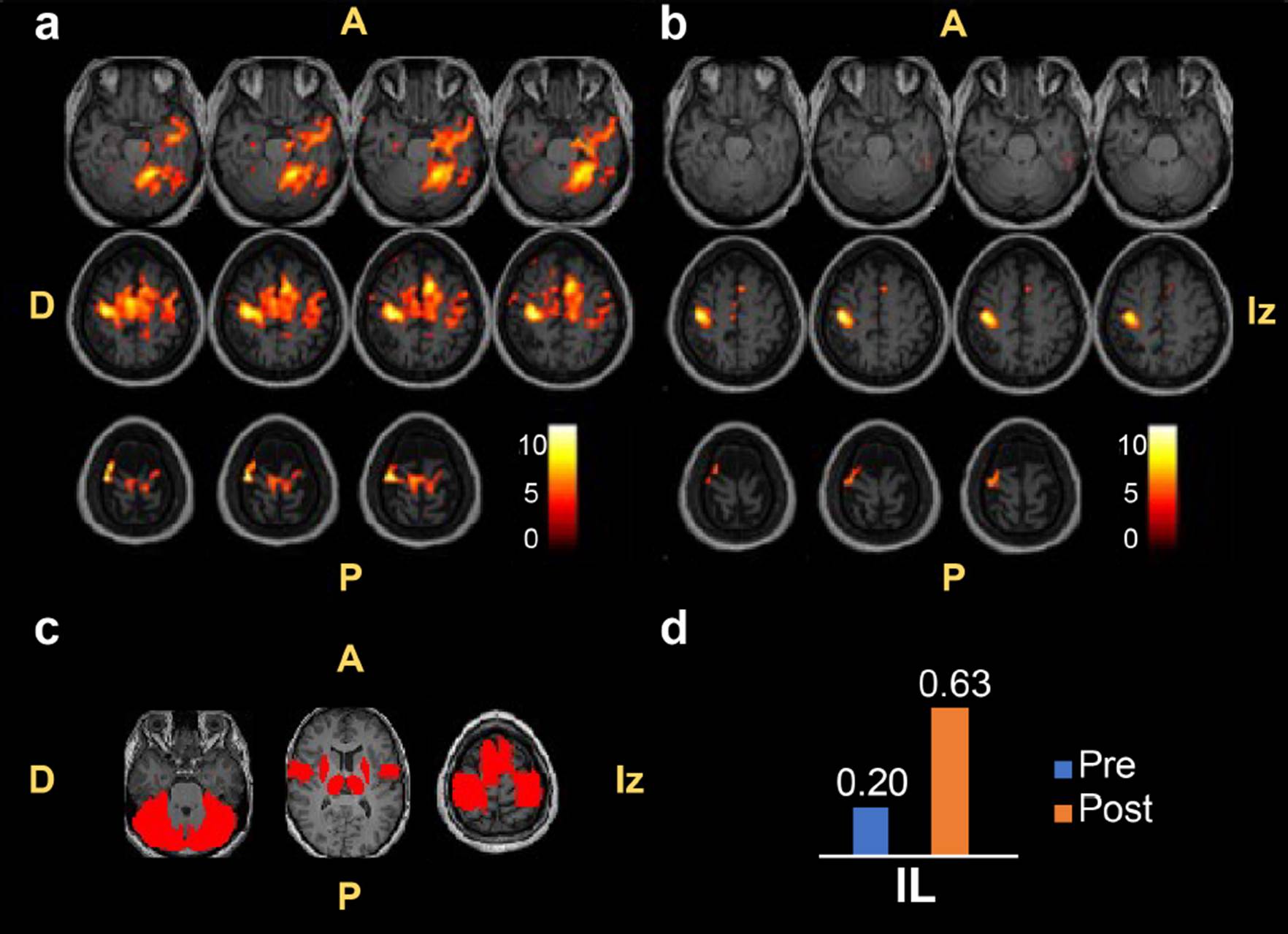
Figura 2 Imágenes por RMF de un paciente con EVC que recibió una terapia ICC para extremidad superior. La secuencia BOLD realizada involucra intención de movimiento de la mano afectada (izquierda). (a) Cortes axiales de activaciones significativas (p<0.05, FWE) sobre imágenes estructurales T1 pre-terapia. (b) Cortes axiales de activaciones significativas (p<0.05, FWE) sobre imágenes estructurales T1 post-terapia. (c) Vista axial de las RI ejemplo montadas sobre imágenes estructurales T1. (d) IL de las secuencias BOLD pre-terapia (azul) y post-terapia (anaranjado). Figura de elaboración propia. A: anterior, P: posterior, D: derecha, Iz: izquierda.
Una de las propuestas más utilizadas en la literatura para cuantificar las activaciones presentes en las secuencias BOLD es el índice de lateralidad (IL), como se resume en la Tabla 1. El IL es un índice de asimetría que permite la interpretación más directa de las asimetrías hemisféricas [45]. Además, el IL permite evaluar la dominancia hemisférica al realizar la tarea definida en la secuencia BOLD. Al ser un índice de asimetría, la ecuación para calcular el IL está dada por: IL=(R-L)/ (R+L), donde R y L representan una métrica en el hemisferio derecho e izquierdo, respectivamente [46][47][48].
En estudios con pacientes con EVC, esta fórmula puede adaptarse para comparar la misma métrica en el hemisferio ipsilesional (I) y contralesional (C) de la siguiente manera: IL=(I-C)/(I+C) [61][73]. Esto permite mantener la información de la ubicación de la lesión en la comparación inter-hemisférica [61][73]. Como se mencionó anteriormente, la métrica utilizada es comúnmente la cantidad de vóxeles que muestran activaciones significativas, dado un umbral estadístico, en cada hemisferio cerebral tras comparar los bloques de tarea con los bloques de reposo de la secuencia BOLD realizada [58][59][61][67][73][74][75]. El número de vóxeles con activaciones significativas en cada hemisferio se cuantifica dentro de regiones de interés (RI) definidas con un atlas anatómico [61][67], con un estudio previo [59], o con una selección manual de estas regiones [58][74]. En la Figura 2c se presenta un ejemplo de un conjunto de RI que pueden ser utilizadas para el cálculo del IL. Las RI mostradas se encuentran descritas en el atlas anatómico AAL3 [76] incluido en el software SPM12 [71] e incluyen el opérculo rolándico, el área motora suplementaria, los giros pre- y post-centrales, el núcleo lenticular (putamen y globo pálido), el cerebelo y el tálamo.
La selección de la métrica a utilizar y la definición de las RI representan los puntos más importantes en el cálculo del IL [46][75]. Este índice puede tomar valores desde -1 hasta 1, correspondientes a una activación neuronal completamente lateralizada hacia el hemisferio contralesional o ipsilesional, respectivamente. Por otra parte, un valor de IL igual a 0 indicaría una distribución simétrica de las activaciones significativas entre ambos hemisferios. Además, algunos trabajos han definido un umbral para caracterizar el IL calculado: un valor de |IL|≤0.2 indica actividad bilateral, mientras que un IL>0.2 o un IL<-0.2 representa actividad lateralizada hacia el hemisferio ipsilesional o contralesional, respectivamente [75][77]. Un ejemplo del uso e interpretación de este índice se encuentra en la Figura 2d. Aquí, se muestran los IL calculados en la plataforma MATLAB [78] mediante la fórmula aritmética mencionada anteriormente con las activaciones significativas de los hemisferios ipsilesional y contralesional presentadas en las Figuras 2a y 2b sobre el grupo ejemplo de RI de la Figura 2c. Las activaciones del cerebelo ipsilesional y contralesional fueron contabilizadas dentro de las activaciones del hemisferio opuesto debido a la decusación del tracto piramidal a nivel cerebelar [79].
Como se mencionó anteriormente, estas activaciones significativas son producidas en una secuencia BOLD cuando el paciente con EVC intenta flexionar y extender los dedos de la mano afectada (izquierda) previo (Figura 2a) y posterior (Figura 2b) a recibir una terapia ICC para extremidad superior. El aumento en el IL indica una lateralización de las activaciones neuronales hacia el hemisferio ipsilesional al finalizar el programa de terapia proporcionado. Esto refleja que las activaciones generadas post-terapia en el hemisferio ipsilesional del paciente al mover la mano afectada tienen una mayor semejanza con las activaciones contralaterales esperadas de un sujeto sano [35][36].
El IL ha sido utilizado en los estudios con pacientes con EVC para caracterizar la lateralidad de su actividad neuronal tras recibir algún programa de rehabilitación para extremidad superior. Por ejemplo, Demers et al. proporcionaron una terapia de movimiento inducido por restricción (TMIR) a 7 pacientes con EVC durante 2 semanas, donde observaron un aumento en el IL en la corteza premotora dorsal al finalizar el programa de terapias [62]. La tarea realizada por los pacientes durante la RMF consistía en sujetar repetitivamente un tubo de plástico con los dedos pulgar, índice y medio de su mano afectada [62]. Esta tarea se realizó en bloques, alternándose con una condición de reposo. El incremento en el IL indica una mayor lateralización de las activaciones neuronales hacia la corteza premotora dorsal ipsilesional en los pacientes tras recibir la TMIR [62].
Además, el IL también ha sido reportado en los estudios donde se proporcionan terapias ICC para extremidad superior a pacientes con EVC. Caria et al. reportaron un caso de estudio donde se emplearon 3 sesiones de RMF para observar cambios en la lateralización de la actividad neuronal al recibir dos tipos de terapia ICC [58]. Los autores indicaron que conforme avanzó el proceso de terapia, el IL calculado en cada estudio de RMF mostraba una lateralización cada vez más pronunciada hacia el hemisferio ipsilesional durante la flexión y extensión de los dedos de la mano afectada, especialmente en la región premotora dorsal y en el área motora suplementaria [58]. En un estudio posterior, RamosMurguialday et al. proporcionaron un programa de terapia ICC a 28 pacientes con EVC, donde encontraron un cambio significativo entre el IL calculado pre-terapia y el IL calculado al finalizar la terapia en las cortezas motora, premotora y somatosensorial, indicando un cambio en la activación hacia el hemisferio ipsilesional al flexionar y extender los dedos de la mano afectada [60].
Por otra parte, Young et al. reportaron un mayor reclutamiento del hemisferio contralesional al pulsar botones con la mano afectada en su grupo experimental ( n =16) de pacientes con EVC tras recibir terapia ICC [59]. Este reclutamiento se encontró en la red motora contralesional, definida como el conjunto de las cortezas motora primaria y premotora, el tálamo y el cerebelo [59]. Esta actividad lateralizada hacia el hemisferio no afectado es atribuida por los autores a que la lesión por EVC de los pacientes incluidos en este estudio se encontraba principalmente a nivel cortical, afectando directamente la corteza motora ipsilesional [59]. Además, reportaron una correlación significativa entre el número de terapias proporcionadas a los pacientes con los cambios reflejados en el IL post-terapia con respecto al IL pre-terapia [59]. Esto indica que un mayor número de terapias recibidas por el paciente corresponden a un mayor reclutamiento de la red motora contralesional. En el trabajo de Yuan et al., se reportó que los pacientes con EVC ( n =12) mostraron un cambio significativo en el IL entre la RMF pre-terapia con los estudios post-terapia y de seguimiento [61]. El IL calculado en las cortezas motora, premotora y somatosensorial en la sesión de pre-terapia indicó una activación bilateral cuando los pacientes imaginaban abrir y cerrar la mano afectada. Por otra parte, en las sesiones de post-terapia y seguimiento, este índice señaló un cambio en la lateralización de las activaciones neuronales hacia el hemisferio ipsilesional en las mismas regiones anatómicas al realizar la tarea motora [61].
Estos trabajos indican una lateralización de las activaciones neuronales post-terapia tanto al hemisferio ipsilesional como al contralesional. Una posible explicación de esta diferencia son los criterios de inclusión o exclusión definidos en cada uno de los trabajos. Demers et al. reclutaron pacientes con EVC con deficiencias motoras moderadas [62]. Por otra parte, la mayoría de los pacientes reclutados por Caria et al., RamosMurguialday et al. y Yuan presentan la lesión por EVC a nivel subcortical, lo que sugiere un daño mínimo o indirecto a nivel cortical [58][60][61]. Estos trabajos señalan una lateralización de las activaciones neuronales hacia el hemisferio ipsilesional posterior al programa de neurorrehabilitación. En cambio, la mayoría de los pacientes reclutados por Young et al. presentan la EVC a nivel cortical y una lateralización contralesional post-terapia de las activaciones [59]. Además, los autores señalan que el área de la lesión es relativamente grande en la mayor parte de estos pacientes [59]. Esta diferencia sugiere que pacientes con una lesión cortical extensa requieren de un mayor reclutamiento del hemisferio contralesional para propiciar mejoras funcionales posterior a una EVC [80][81][82]. Asimismo, se ha reportado que pacientes con disfunciones motoras más severas, usualmente relacionadas a una lesión extensa, tienden a un mayor reclutamiento del hemisferio contralesional al intentar mover la extremidad superior afectada [80][82].
Por otra parte, distintos estudios han sugerido una relación entre el reclutamiento de un hemisferio cerebral, la neuromodulación y la recuperación funcional tras una EVC. La activación repetitiva de las sinapsis puede propiciar un refuerzo (PLP) o una reducción (DLP) de la eficacia en las conexiones sinápticas [83][84] [85]. Estas activaciones repetitivas pueden ser propiciadas dentro de un programa de neurorrehabilitación, como una terapia ICC. Por ejemplo, se ha reportado que un buen pronóstico en la recuperación motora está asociado a aumentos en plasticidad por mecanismos similares a la PLP en el hemisferio ipsilesional y similares a la DLP en el hemisferio contralesional [82]. Además, se ha visto que el balance de la plasticidad por PLP en el hemisferio ipsilesional y de la plasticidad por DLP en el hemisferio contralesional puede predecir la recuperación motora 6 meses después del inicio de la EVC [86]. Este mecanismo podría explicar que pacientes con afectaciones motoras severas, usualmente con reclutamiento contralesional post-terapia, tienden a una menor recuperación funcional de extremidad superior que pacientes con deficiencias motoras moderadas [5]. Sin embargo, debido a la heterogeneidad de las poblaciones de pacientes con EVC estudiadas y a los resultados reportados, es necesario continuar investigando la relación de los mecanismos de neuroplasticidad con la recuperación funcional motora.
En conjunto, estos estudios muestran la relevancia de analizar cuantitativamente los cambios producidos por mecanismos de neuroplasticidad. Este análisis permite entender en mejor medida los efectos que las terapias convencionales o ICC para extremidad superior tienen en la neurorrehabilitación de los pacientes con EVC. Por esto, es de interés que este campo de investigación continúe desarrollándose.
Imagenología por tensor de difusión
En esta sección se presentan las bases teóricas de la ITD, métodos de análisis y métricas de integridad estructural de la neuroanatomía. Por último, se discuten los trabajos que cuantifican la neuroplasticidad, mediante métricas provenientes de la ITD, en pacientes con EVC posterior a un programa de rehabilitación para extremidad superior. En la Tabla 2 se muestra un resumen de los cuatro artículos incluidos en este apartado.
Tabla 2 Resumen de los trabajos incluidos en esta revisión que utilizaron la ITD para cuantificar cambios de neuroplasticidad en pacientes con EVC tras recibir un programa de neurorrehabilitación.
| Trabajos | Número de pacientes con EVC | Tipo de terapia proporcionada | Índice utilizado | Resultados relacionados a neuroplasticidad |
|---|---|---|---|---|
| Young et al. (2016) [88] | 19 | ICC | aAF | Correlación entre cambios en la aAF sobre una estimación del TCE con mejoras en la escala Action Research Arm Test (ARAT). |
| Caria et al. (2020) [73] | 29 | ICC | AF | Correlación entre mejoras en la escala clínica de FuglMeyer para extremidad superior y una disminución de la AF en la radiación talámica posterior contralesional y el esplenio del cuerpo calloso en el grupo experimental (n = 16). |
| Yuan et al. (2020) [61] | 12 | ICC | rAF | La rAF, calculada en un templete del TCE, fue correlacionada con aumentos en el puntaje de la escala clínica de Fugl-Meyer para extremidad superior. |
| Bhasin et al. (2021) [89] | 20 | Fisioterapia | rAF | Incrementos en la rAF sobre el área de la lesión correlacionados con el puntaje de la escala de Fugl-Meyer. |
*aAF: Asimetría de anisotropía fraccional, AF: Anisotropía fraccional, ICC: Interfaz cerebro computadora, rAF: Proporción de AF, TCE: Tracto corticoespinal.
La ITD es una técnica ampliamente utilizada en la práctica clínica y brinda información acerca de la neuroanatomía [87]. Además, es susceptible al desplazamiento de moléculas de agua [87]. La difusión del agua no es aleatoria en tejidos humanos debido a las membranas celulares y otras barreras que impiden su libre movimiento. Por lo tanto, la ITD puede proveer información acerca de la magnitud y de la orientación del movimiento de agua [50]. Las membranas celulares de los axones y la mielina, orientadas de manera regular, actúan como barreras microestructurales a la difusión de agua. Esto genera una dependencia de orientación del movimiento de las moléculas de agua paralela a la orientación de las fibras de la materia blanca [37].
En la literatura, se han reportado parámetros necesarios en la adquisición de la ITD para describir adecuadamente el desplazamiento del agua. Por ejemplo, durante la adquisición se aplican dos gradientes magnéticos de amplitud alta. El valor b es un escalar que refleja el gradiente de difusión y está influenciado por la duración, la amplitud y el intervalo entre los gradientes magnéticos aplicados [90][91]. Mientras más altos sean los valores b, mayor resolución tendrá el muestreo de la difusión de las moléculas de agua [91]. Comúnmente, en estudios con ITD se utiliza un valor b en el rango de 400 a 1500 s/mm2, siendo el valor b de 1000 s/mm2 el más utilizado [61][73][88][90][92]. Además, se necesita al menos una adquisición sin gradiente de difusión (b=0 s/mm2) y seis adquisiciones (direcciones) no colineales de imágenes con gradiente de difusión [91][93]. Generalmente, un mayor número de direcciones con gradiente de difusión produce una mejor representación del desplazamiento del agua [90]. Sin embargo, esto conlleva un aumento en el tiempo de adquisición [94].
La ITD utiliza el desplazamiento medido de las moléculas de agua como un sondeo que permite hacer inferencias de la neuroanatomía. Además, la información que produce la ITD es dominada por la anatomía y poco influenciada por la fisiología [37]. Cuando el agua se mueve libremente a lo largo de los axones, debido a la escasez de obstáculos contra su flujo, se produce una difusión anisotrópica, indicando una alta densidad de fibras orientadas en una misma dirección [37]. Las difusiones con mayor grado de anisotropía se encuentran en presencia de fibras altamente orientadas, como es el caso de los tractos [90]. Sin embargo, este flujo de agua se ve afectado en patologías como la EVC que, como se mencionó anteriormente, puede dañar directamente tractos de materia blanca además de causar degeneración Walleriana [38]. La información que otorga la ITD proporciona representaciones y métricas asociadas a las propiedades microestructurales de la materia blanca, lo que ayuda a comprender de mejor manera la extensión del daño producido por la EVC y su asociación con la pérdida (o posible recuperación) de la función motora de los pacientes [93].
Una forma de analizar la información proporcionada por la resonancia magnética de difusión es mediante la tractografía, la cual es la reconstrucción por computadora de los tractos de materia blanca [95]. Es posible rastrear los tractos de manera no invasiva al seguir la dirección de flujo favorecida por las moléculas de agua vóxel a vóxel [90][96]. Esta reconstrucción se realiza mediante dos métodos principales [90]: 1) el determinístico, donde se estima la orientación más probable de las fibras en cada vóxel, y 2) el probabilístico, el cual se basa en la estimación de la incertidumbre de la orientación de las fibras. El método probabilístico es considerado como el más robusto, sin embargo, es computacionalmente exigente y requiere un alto tiempo de procesamiento [90][97]. La reconstrucción de un tracto inicia desde un punto de origen determinado ya sea por una RI predefinida para guiar el camino de la reconstrucción, o a nivel de vóxel para hacer una tractografía en todo el cerebro [98]. La reconstrucción se detiene mediante parámetros como umbrales de anisotropía (entre 0.1 y 0.3 para adultos) y de ángulo de giro (entre 40 y 70º), o al llegar a vóxeles de materia gris o líquido cefalorraquídeo [99].
En las Figuras 3a y 3b se muestran ejemplos de tractografías determinísticas, realizadas en el software del fabricante (Philips) del equipo de resonancia magnética utilizado en la adquisición, de los TCE de un paciente con EVC sobre un corte coronal de una imagen estructural T2-flair. La reconstrucción de los tractos tiene como origen una selección manual de RI en cada hemisferio y no cuenta con restricciones de término por ángulo o por tipo de tejido. En esta reconstrucción se pueden distinguir visualmente las diferencias morfológicas del TCE en el hemisferio ipsilesional (rojo) y contralesional (azul). La tractografía permite un análisis cualitativo y cuantitativo a lo largo del tracto reconstruido, sin embargo, no hay un método establecido para validar los resultados de la reconstrucción, la cual se ve afectada por ruido y artefactos en las imágenes [90] [96]. Por otra parte, cabe mencionar que las Figuras 2 y 3 fueron generadas a partir de estudios de neuroimagen adquiridos de pacientes con EVC, quienes leyeron y firmaron un consentimiento informado previo a los estudios.

Figura 3 Imágenes por ITD de un paciente con EVC que recibió una terapia ICC para extremidad superior. (a) Corte coronal de tractografía previo al inicio de la terapia sobre una imagen estructural T2-flair. (b) Corte coronal de tractografía post-terapia sobre una imagen estructural T2-flair. (c) Corte axial de un mapa de anisotropía fraccional (AF) pre-terapia. (d) Corte axial de un mapa de AF post-terapia. (e) Vista coronal de las RI utilizadas para el cálculo de la proporción de AF (rAF) y de la asimetría de AF (aAF) sobre un mapa de AF. (f) Resultados de rAF y aAF pre-terapia (azul) y post-terapia (anaranjado). Figura de elaboración propia. S: superior, In: inferior, D: derecha, Iz: izquierda, A: anterior, P: posterior.
Otro método utilizado para cuantificar la información estructural brindada por la ITD es mediante el cálculo de métricas asociadas con propiedades de difusión en el tejido cerebral. El tensor de difusión (TD) es el método más utilizado para modelar la señal de difusión al descomponerla en eigenvalores y eigenvectores, lo que permite determinar la señal de desplazamiento de agua en un vóxel. Cada eigenvector representa un eje principal de difusión donde el eigenvalor correspondiente proporciona la magnitud de la difusión [90].
Entre las métricas que se pueden obtener a partir de la descomposición del TD se encuentran [90][99]: 1) la anisotropía fraccional (AF), representando el grado de anisotropía en la difusión [99]; 2) la difusividad media, la cual describe la magnitud de la difusión [99]; 3) la difusividad radial, representativa de la difusividad promedio perpendicular al primer eigenvector [100][101]; y 4) la difusividad axial, indicativa de la difusividad sobre la dirección dominante de difusión [100][101]. La mayor parte de los estudios se enfocan en la AF debido a que se considera que refleja el nivel de integridad de la materia blanca [50][92]. Esto permite, por ejemplo, analizar la estructura anatómica cerebral en pacientes con neuropatologías.
En las Figuras 3c y 3d se muestran ejemplos de mapas de AF de un paciente con EVC en el hemisferio derecho obtenidos tras el procesamiento de datos de ITD en la interfaz gráfica de usuario del software FSL (v6.0.4) [102] siguiendo la metodología de procesamiento de imágenes descrita en la guía del toolbox de análisis de resonancia magnética de difusión [103]. Aquí, los vóxeles con valores altos de AF se muestran en tonos claros mientras que vóxeles con valores bajos de AF se muestran en tonos oscuros. En estos mapas se observan valores disminuidos de la AF alrededor de la corona radiada anterior (CRA) derecha, región afectada por la EVC en estos cortes axiales, con respecto a la CRA izquierda. Asimismo, se ha observado que valores disminuidos de la AF en el TCE están asociados a disfunciones motoras y que ésta es un buen predictor de la recuperación motora de extremidad superior de los pacientes con EVC en estudios clínicos [92][104]. Además, este índice es una métrica de alta sensibilidad [41][90]. La AF toma un valor de 0 cuando la difusión es completamente isotrópica y un valor de 1 cuando ésta es anisotrópica. La anisotropía incrementa en presencia de fibras altamente orientadas y disminuye en condiciones o patologías que afectan a la materia blanca, como en el caso de una EVC [90].
La AF, al igual que las otras métricas de difusión, se calcula sobre los tractos reconstruidos mediante tractografía, o en RI definidas ya sea por un experto clínico o en un atlas anatómico. Sin embargo, en estudios con pacientes con EVC es común hacer el cálculo de la AF basándose en RI preseleccionadas [89][104][105]. En la Figura 3e se muestra un ejemplo de RI definidas en el atlas anatómico JHU ICBM-DTI-81 White Matter labels [106], incluido en el software FSL [102], sobre un mapa de AF en vista coronal. Estas RI corresponden a las regiones cerebrales de la corona radiada superior, el brazo posterior de la cápsula interna (BPCI), el pedúnculo cerebral y las RI denominadas en el atlas como tracto corticoespinal [106]. Además, las RI pueden ser combinadas en cada hemisferio cerebral para formar una región objetivo de estudio. Por ejemplo, en la Figura 3e se muestra una combinación de las RI para crear una región representativa de cada TCE (TCERI).
Los resultados de AF suelen ser reportados como índices de asimetría, tales como la proporción entre la AF (rAF) en los hemisferios ipsilesional (AFipsi) y contralesional (AFcontra), calculada como AF=AF ipsi /AFcontra, o como la asimetría de AF (aAF), definida como aAF=(AFip-si-AFcontra)/(AFipsi+AFcontra) [90]. Estos índices son de gran utilidad para cuantificar las diferencias hemisféricas de la integridad de la materia blanca. Un valor de rAF de 1 representa una igualdad en la AF en ambos hemisferios, mientras que la aAF, de manera similar al IL, indica una mayor AF en el hemisferio ipsilesional o contralesional si ésta toma valores positivos o negativos, respectivamente [90].
En la Figura 3 se muestran ejemplos del uso e interpretación de estos índices de asimetría. En esta Figura se encuentran la tractografía (3a y 3b) y los mapas de AF (3c y 3d) de un paciente con EVC en el hemisferio derecho antes (3a y 3b) y después (3b y 3d) de recibir una terapia ICC para extremidad superior. El TCE ipsilesional reconstruido (rojo) muestra un aumento en grosor y longitud post-terapia, además de una mayor semejanza a la morfología del TCE contralesional (azul). Por otra parte, distinguir visualmente diferencias entre los mapas de AF pre-terapia y post-terapia representa un reto. De aquí la importancia del uso de los índices de rAF y aAF para cuantificar los posibles cambios en la integridad de la materia blanca posterior a una intervención. En la Figura 3f se encuentran los valores de rAF y aAF obtenidos con los mapas completos de AF del paciente con EVC pre-terapia (Figura 3c) y post-terapia (Figura 3d). Estos índices se calcularon en la plataforma MATLAB [78] con las fórmulas aritméticas presentadas anteriormente sobre las TCERI ejemplo de la Figura 3e, donde en ambas regiones se obtiene el valor promedio de AF para obtener así una métrica representativa en cada hemisferio. La rAF y la aAF muestran, respectivamente, un incremento y un decremento en magnitud post-terapia. Estos resultados indican que la integridad de la materia blanca del hemisferio ipsilesional sobre el TCERI se asemeja en mayor medida a aquella del hemisferio contralesional al finalizar la terapia ICC para extremidad superior. Esto sugiere un cambio neuroanatómico en el paciente con el programa de neurorrehabilitación.
Uno de los usos de los índices de asimetría de AF ha sido como herramienta de pronóstico. Okamoto et al. reportaron que mientras mayor sea la rAF en el BPCI al momento de admisión de pacientes con EVC, mayor podría ser el grado de recuperación en la función motora de extremidad superior [92]. De manera similar, Bhasin et al. indicaron que la rAF medida en la región de la lesión cerebral previo a recibir terapia física se correlacionó con el puntaje obtenido con la escala de Fugl-Meyer para extremidad superior (FM-ES) [89]. Sin embargo, hay pocos estudios que evalúan los cambios en la AF en pacientes con EVC a lo largo de un proceso de neurorrehabilitación para extremidad superior, lo cual podría proporcionar información relevante acerca de los cambios en neuroplasticidad de los pacientes.
En los estudios presentados en la Tabla 2 se empleó la AF como índice de neuroplasticidad en programas de terapia para extremidad superior tanto convencionales como experimentales que incorporan sistemas ICC. Bhasin et al. reportaron un aumento de la rAF en pacientes con EVC en etapa crónica tras recibir fisioterapia tradicional, indicando un aumento en la integridad de la materia blanca en el área de la lesión del hemisferio afectado [89]. Este incremento en la rAF se correlacionó significativamente con la mejora funcional de extremidad superior de los pacientes de acuerdo con las escalas clínicas de FM-ES y el índice de motricidad [89].
Tras proporcionar un programa de terapia ICC a 19 pacientes con EVC, Young et al. señalaron una correlación en el incremento de la AF del TCE contralesional con mejoras en la escala Nine-Hole Peg Test (9-HPT), además de una correlación entre cambios en la aAF, i.e. aumentos de la AF en el TCE contralesional con respecto a la AF del TCE ipsilesional, con mejoras en la escala Action Research Arm Test (ARAT) [88]. Caria et al. proporcionaron terapias ICC a 16 pacientes con EVC, conformando su grupo experimental, y reportaron una correlación del aumento en el puntaje de la escala FM-ES con una disminución de la AF en el esplenio del cuerpo calloso y en la radiación talámica posterior contralesional post-terapia [73]. Además, se encontró una correlación positiva entre los cambios post-terapia y pre-terapia del IL calculado sobre la corteza motora (incluyendo la corteza motora primaria, la corteza premotora y la corteza somatosensorial primaria) y los cambios post-terapia y pre-terapia de la AF en las regiones anatómicas mencionadas anteriormente, lo que indica que la disminución de los valores de la AF en el esplenio y en la radiación talámica posterior contralesional está asociada a una lateralización ipsilesional de la activación neuronal en la corteza motora al mover la mano afectada [73]. Asimismo, en el trabajo de Yuan et al. se observó que la integridad estructural del TCE, cuantificada con la rAF, tiene una correlación positiva con la recuperación de la función motora de extremidad superior según la escala de FM-ES en pacientes con EVC que recibieron terapias ICC [61].
Los cambios reportados de los índices de asimetría de AF difieren entre los trabajos. Los pacientes reclutados por Young et al. presentan principalmente lesiones corticales y una mayor integridad de la materia blanca en el hemisferio contralesional post-terapia [88]. Esto ha sido asociado con una menor recuperación funcional de extremidad superior [80]. Sin embargo, Young et al. reportaron una correlación positiva del incremento de AF contralesional con una mejora funcional de extremidad superior con base en distintas escalas clínicas [88]. Esto sugiere que los cambios estructurales de neuroplasticidad generados en el hemisferio contralesional posterior a una terapia ICC, están relacionados con la mejora funcional en pacientes con lesiones corticales o severas. Por otra parte, Bhasin et al., Caria et al. y Yuan et al. reclutaron pacientes con discapacidades motrices moderadas de extremidad superior o pacientes cuya lesión se encuentra principalmente a nivel subcortical [61][73][89].
Los resultados de estos trabajos sugieren que un programa de neurorrehabilitación proporcionado a este tipo de población puede propiciar un aumento en la integridad estructural ipsilesional, la cual fue asociada a una recuperación funcional de extremidad superior. Además, se ha reportado que el aumento de la integridad estructural del hemisferio ipsilesional produce una mayor recuperación motora que una mayor integridad estructural contralesional [7][80]. Los resultados presentados sugieren que los mecanismos de neuroplasticidad estructurales, como la proliferación axonal, sinaptogénesis o neurogénesis, propician un aumento en la integridad estructural de la materia blanca, lo que juega un rol en la recuperación motora de pacientes con EVC [21][22][23]. Además, el hemisferio cerebral principal sobre el cual estos mecanismos actúan podría estar definido por la ubicación y severidad de la lesión por la EVC [7]. Estos resultados muestran que la AF es una métrica de los mecanismos de neuroplasticidad en la recuperación motora de pacientes con EVC posterior a un proceso de neurorrehabilitación. Sin embargo, es necesario continuar estudiando estos mecanismos con distintas poblaciones de pacientes con EVC para comprender mejor el proceso de recuperación funcional.
Los trabajos incluidos en esta revisión indican que los pacientes con EVC muestran cambios neuroanatómicos tras recibir programas de terapia para extremidad superior como parte del proceso de neuroplasticidad que se produce. Además, estos cambios se han asociado a una mejora funcional motora de extremidad superior. Esto indica que es relevante continuar explorando la información proporcionada por la ITD para comprender el proceso de recuperación de los pacientes con EVC.
Limitaciones
La información que otorgan estas técnicas de neuroimagenología es relevante, sin embargo, existen ciertas limitaciones que son importantes de mencionar. Por ejemplo, el tiempo de escaneo puede ser largo en estudios con pacientes con EVC. Entre las secuencias realizadas a pacientes con esta patología se encuentran la RMF, la ITD, secuencias estructurales, espectroscopía por resonancia magnética (RM), imagenología de perfusión y angiografía por RM [25][94] [107][108]. En promedio, estas secuencias tienen una duración aproximada de 15.5 min tanto en resonadores de 1.5-T como de 3-T, por lo que, un estudio que abarque 3 o 4 de estas secuencias podría tender a una duración de 1 hora [109]. Además, se ha reportado que pacientes con EVC presentan mayores movimientos de cabeza que sujetos sanos en estudios de RMF de 6 min de duración [110]. Esto produce una mayor cantidad de artefactos en las imágenes adquiridas que deben removerse. Por lo tanto, la duración total del estudio de imagenología debe mantenerse limitado para evitar fatiga y molestias en los pacientes [50][90][111].
Por otra parte, los estudios de RMF son comúnmente caracterizados por baja potencia estadística debido al tamaño limitado de la muestra y al gran número de comparaciones que se realizan [55][112]. Una forma de contrarrestar esto es mediante un diseño en bloques del paradigma de la RMF, el cual se ha utilizado ampliamente en estudios con pacientes con EVC. Además, el IL también tiene algunas limitaciones. La variabilidad existente en la fórmula utilizada en el cálculo del IL, particularmente la definición de lo que constituye un vóxel con activación significativa, dificulta la comparación de resultados entre distintos estudios con respecto a la lateralización de la actividad cerebral [46][75][77]. Sin embargo, se ha observado una tendencia en estudios que involucran lesiones cerebrales a utilizar el número de vóxeles que superan un umbral estadístico como métrica para el cálculo del IL debido a la robustez mostrada por este método [67][75].
Entre las limitaciones de la ITD se encuentra la estimación del TD donde se asume que la difusión asociada a las fibras dentro de un vóxel sigue una distribución gaussiana, representada por una sola dirección [41][90]. Sin embargo, esto no se cumple por la presencia de fibras cruzadas y múltiples orientaciones axonales [41] [90]. A pesar de esto, las métricas de la ITD, particularmente la AF, tienen alta sensibilidad a cambios provocados por una EVC [89]. Además, múltiples estudios han utilizado esta técnica para tener una mejor comprensión y caracterizar los cambios que se producen posterior a la EVC, permitiendo medir los efectos de distintos protocolos de terapia [41]. La aAF, al igual que el IL, sufre de la variabilidad existente en la literatura en el cálculo de este índice [46]. Sin embargo, distintos estudios han asociado la aAF, al igual que la rAF, a cambios en escalas clínicas que reflejan la mejora funcional motora de extremidad superior de los pacientes con EVC [88][89].
Finalmente, la RMF y la ITD requieren de equipo y software especializados [71][102]. En general, estos estudios utilizan resonadores de 3-T, mientras que el software requerido para la adquisición y el procesamiento de imágenes tiene, usualmente, un costo elevado, especialmente las licencias propias del fabricante del equipo de resonancia [59][60][61][73][88][109]. En conjunto, estas limitaciones hacen que la RMF y la ITD se usen principalmente con fines de investigación.
Los detalles de los métodos de procesamiento de los estudios de neuroimagen y del cálculo de los índices están fuera del tópico de la presente revisión, lo cual se considerará para un trabajo futuro.
CONCLUSIONES
Las técnicas de RMF y de ITD se han posicionado como herramientas útiles en el estudio de la enfermedad vascular cerebral. Distintos estudios muestran que la RMF permite el análisis de las activaciones neuronales de los pacientes con EVC cuando éstos intentan mover su extremidad superior afectada. Además, el IL permite cuantificar los cambios producidos por mecanismos de neuroplasticidad que se presenten en la lateralización de estas activaciones tras un proceso de neurorrehabilitación. Por otra parte, la ITD es capaz de otorgar información relevante acerca de la neuroanatomía de los pacientes con EVC y la asociación que ésta tiene con la posible recuperación funcional de los pacientes. La AF, al igual que los índices derivados de rAF y aAF, han probado ser métricas de alta sensibilidad a los cambios en la integridad de la materia blanca tras la EVC y posterior a un proceso de rehabilitación. La RMF y la ITD son de gran importancia en la investigación de los mecanismos de neuroplasticidad funcionales y estructurales involucrados en la recuperación de los pacientes con EVC. Ambas técnicas de neuroimagenología permiten comprender en mejor medida este proceso. De esta forma, se podrán diseñar y proporcionar mejores programas de neurorrehabilitación que beneficien a los pacientes con EVC.











 text new page (beta)
text new page (beta)



