Introducción
Los macrófagos son células fagocíticas efectoras de la respuesta inmune y entre sus acciones destacan: la eliminación de la infección, erradicación de restos y resorción en tejidos durante la homeostasis, además de participar de manera importante en el inicio, desarrollo y mantenimiento del proceso inflamatorio.[1, 2]
Estas células poseen una marcada plasticidad que les permite responder a los estímulos del microambiente en el que se encuentren y así modificar su fenotipo [3, 4].
Los macrófagos son capaces de ingerir restos celulares o células apoptóticas, así como patógenos, con el objetivo de eliminarlos, para lo cual es necesario que estos sean reconocidos por receptores de membrana. Es así que una vez que son activados a través de los receptores acoplados a proteínas G, inducen la producción de sustancias microbicidas en las que se incluyen a las especies reactivas de oxígeno (ERO) y especies reactivas de nitrógeno (ERN) [2, 5, 6]. Existen numerosas funciones fisiológicas que se controlan por vías de señalización que desencadenan reacciones tipo redox, reguladas principalmente por la sintasa de óxido nítrico (SON) y la NADPH oxidasa.
En estudios in vitro de líneas celulares de macrófagos de ratón, se ha demostrado el efecto del estradiol (E2) para inducir el fenotipo antiinflamatorio de esta célula. Además, en estudios con líneas celulares humanas se ha demostrado que E2 disminuye la actividad del complejo enzimático NADPH oxidasa en el macrófago a través de la activación del receptor expresado en estas células, lo cual contribuye a disminuir el riesgo cardiovascular al prolongar la vida del óxido nítrico (NO) [7].
Tibolona es un fármaco que tiene principalmente tres metabolitos: 3alfa-hidroxi-tibolona (3α-OH) y 3beta-hidroxi-tibolona (3β-OH) con actividad estrogénica; y el isómero delta 4-tibolona, con efectos progestagénicos y androgénicos. Es por esa versatilidad de efectos que actualmente se utiliza como una alternativa a la terapia hormonal de la menopausia. Si bien, en un principio este fármaco se prescribía para el tratamiento de la osteoporosis, existen estudios clínicos que han demostrado que en mujeres en posmenopausia con tratamiento con Tb disminuye los marcadores de la enfermedad cardiovascular [8, 9]. En diferentes estudios clínicos se ha demostrado que Tb tiene efectos benéficos sobre el perfil lipídico, al disminuir los niveles de colesterol, triglicéridos y HDL [8, 10]. Además, se ha asociado con la disminución de la incidencia de cáncer [11]. También se han reportado que Tb induce la isoforma endotelial de la SON (SONe), lo cual contribuye con su efecto protector cardiovascular al aumentar las concentraciones de NO en endotelio [12, 13].
Asimismo, existen estudios realizados en diferentes líneas celulares que explican los efectos observados en los estudios clínicos, es así como, se ha reportado que Tb tiene efectos estrogénicos al disminuir la síntesis de moléculas de adhesión en la placa ateromatosa [14]. Por otro lado, en líneas celulares de cáncer endometrial, se ha demostrado que Tb inhibe la proliferación celular a través de su efecto progestagénico [15].
Sin embargo, los estudios no son suficientes para explicar los efectos de Tb en la disminución del proceso inflamatorio. El objetivo de este trabajo fue evaluar el efecto de Tb sobre la actividad de NADPH oxidasa en células THP-1 diferenciadas a macrófagos, así como su efecto en la modulación de la síntesis de algunas citocinas (IL-1β, IL-6, IL-10, y TNF-α).
Metodología
Muestras y reactivos
Medio modificado de Dulbecco F12 con L-glutamina, 15Mm HEPES, rojo fenol (Caisson Laboratories, EE. UU.); Suero fetal bovino (HyClone, EE. UU.); tibolona, 1-forbol, 12-miristato, 13-acetato (PMA) (Cayman, EE. UU.); dimetilsulfóxido (DMSO); dimetilformamida (DMF) (Caledon Laboratories, Canadá); bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio (MTT); cloruro de tetrazolio p-nitro-azul (NBT), N, N, dimetilformamida (Sigma-aldrich, EE. UU.); alamarBlue (Thermo Fisher Scientific); PBS contiene NaCl (137 mmol / l), KCl (2,7 mmol / l).
Cultivo y diferenciación celular
Se cultivaron monocitos THP-1 humanos en medio DMEM/F12 suplementado con suero fetal bovino al 10% (SFB) en una atmósfera humidificada de 5% de CO2 a 37ºC. Se añadió medio fresco cada 3 días. La diferenciación a macrófagos se obtuvo tratando monocitos de THP-1 durante 48 horas con 60 ng/ml de PMA en placas de cultivo celular de 48 pozos con 1x105 células en cada uno de ellos. Las células adherentes diferenciadas se lavaron dos veces con medio de cultivo DEMEM/F12 sin PMA, pero que contenían 10% de SFB y se dejaron reposar durante otras 72 h. La diferenciación celular se observó mediante microscopia (microscopio invertido, marca Lauca) a un aumento 40X. Los controles consistieron en: control negativo (Ctrl-), células diferenciadas sin Tb y sin PMA; control positivo (Ctrl+), células diferenciadas sin fármaco, pero estimuladas con PMA (100 ng/ml); mientras que las condiciones a probar fueron: células preincubadas durante 24h con Tb a una concentración de 10 y 1 uM, respectivamente; células co-incubadas durante 24h con Tb a una concentración de 10 y 1 uM respectivamente y que además fueron estimuladas con PMA (100 ng/ml) durante 24h. Para graficar la expresión relativa del mensajero de cada gen, inicialmente se normalizaron con los genes endógenos de cada grupo, donde éstos valores de expresión estuvieron en referencia a la expresión de GAPDH de cada grupo. A estos controles GAPDH se les asignó el valor de 1 para que fueran comparables a la baja o a la alta de las expresiones en todos los tratamientos para cada uno de los genes evaluados. Cabe mencionar que para los controles internos, se desarrolló la reacción sin muestra, la cual fue negativa a la expresión (datos no mostrados).
Ensayo con NBT
Los macrófagos se cultivaron en placas de 48 pozos (1x105 por pozo) y se preincubaron con Tb durante 24 y 48 h. A continuación, las células se trataron con 500 ng/ml de PMA para activar el sistema enzimático NADPH oxidasas. 24h después de la estimulación anterior, se evaluó la actividad de las oxidasas, añadiendo 100 μl de solución de NBT e incubando durante 1,5 h. Al finalizar, las células se lavaron dos veces con PBS, secadas al aire. El NBT precipitado dentro de las células, se disolvió; primero añadiendo 100 μl de KOH 2M para solubilizar las membranas celulares, y luego añadiendo 70 μl de DMSO para disolver el formazán azul con agitación suave durante 10 minutos a temperatura ambiente. La solución de NBT obtenida se transfirió luego a una placa de 96 pozos y se leyó la absorbancia en un lector de microplacas a 620 nm (Whym201, Poweam, lector de microplacas).
Extracción y cuantificación de RNA
Para la extracción del RNA, las células THP-1, se cultivaron y diferenciaron en una placa de 6 pozos (1x106 cel/pozo) y se utilizó el método de tiocinato de guanidina Trizol (Invitrogen, Carlsbad, CA) de acuerdo con las instrucciones del fabricante. Se agregaron 500 µl de Trizol a cada pozo (placa de 6) para el lisado de las células y se transfirió a un tubo de 1.5 ml, al cual se agregaron 100 µl de cloroformo, se agitó con el vortex y se dejó incubar a temperatura ambiente de 2 a 3 minutos. Después se centrifugó a 12.000 rpm por 15 min a 4ºC, la fase acuosa se separó y colocó en un tubo de 1.5 mL, al cual se le agregaron 250 µl de isopropanol, se mezcló por inversión y se incubó durante 10 minutos a temperatura ambiente, posteriormente se centrifugó a 12.000 rpm por 10 min a 4ºC. En el fondo del tubo se observó un pellet (RNA) y el sobrenadante fue decantado, se colocaron 500 µl de etanol al 75%, se resuspendió el pellet se centrifugó a 12.000 rpm por 10 min a 4ºC (dos veces). Finalmente, el RNA se dejó secar durante 1 hora, posteriormente y se resuspendió en DEPC. La integridad del RNA se determinó observando la subunidad 18s y 28s mediante electroforesis en gel de agarosa (2%), la concentración y la pureza del RNA se cuantificó a través de la medición de la densidad óptica 260/280 (proteínas) y 260/230 (solventes) en un rango de 1.8-2.2. Nanofotometro NP80 (Implen, Germany).
Expresión génica de citocinas
Se llevó a cabo la síntesis de cDNA a partir del RNA total (500 ng), utilizando transcriptasa reversa M-MVL (Thermo Fisher Scientific) de acuerdo a las condiciones del fabricante.
El cDNA obtenido se utilizó para llevar a cabo la amplificación mediante RT-qPCR en el equipo Real Time PCR Pro qPCR 48 (TECHNE, Burlington, NJ), usando SyberGreen como marcador de fluorescencia (FastStar SYBER Green Master, Roche). La reacción se llevó a cabo en un volumen final de 10 μl, colocando 2.5 μl de buffer de reacción (amortiguador y enzima), 0.3 μl de primer sentido, 0.3 μl de primer antisentido, 0.2 μl de SyberGreen, 5.7 μl de H2O grado PCR y 1 μl (500 ng) de muestra. Los primers usados para la amplificación de los genes fueron los siguientes:
IL-1β, sentido 5´-AGTTGACGGACCCCAAAAG-3´ y antisentido 5´-AGCTGGATGCTCTCATCAGG-3´;
IL-6, sentido 5´- GCTACCAAACTGGATATAATCAGGA-3´ y antisentido 5´- CCAGGTAGCTATGGTACTCCAGAA-3´;
IL-10; sentido 5´- CAGAGCCACATGCTCCTAGA -3´ y antisentido 5´- TGTCCAGCTGGTCCTTTGTT-3´;
TNF-α sentido 5´-CAGCCTCTTCTCCTTCCTGAT-3´ y antisentido 5´-GCCAGAGGGCTGATTAGAGA-3´;
y para el housekeeping, GAPDH, sentido 5´-GACTAACCCTGCGCTCCTG-3´ y antisentido 5´-GCCCAATACGACCAAATCAG-3´.
La reacción de PCR se inició con un precalentamiento a 90°C durante 10 minutos, seguida de 35 ciclos de amplificación (desnaturalización por 60 segundos a 94ºC; alineamiento a 60°C durante 10 segundos y extensión a 72º C durante 60 segundos). La expresión relativa se calculó empleando el método 2-ΔΔCT[16].
Resultados y discusión
Diferenciación de células THP-1 a macrófagos
Las células THP-1, se diferenciaron a macrófagos utilizando forbol-12-miristato-13-acetato (PMA). Se sembraron 16x104 células por pozo en placas de 48 pozos y se agregó a cada uno PMA a una concentración de 60 ng/ml. Posterior a 48h, se cambió el medio a las células y se dejaron durante 72h con medio fresco (DEMEM/F12 + 10% SFB). La diferenciación se confirmó al observar a un aumento 40X que las células se encontraban adheridas a la placa, aumento en la granularidad de la célula y se observaron cambios en la morfología, ya que las células diferenciadas presentan una membrana con bordes irregulares en comparación con las células no diferenciadas que son totalmente esféricas y que además se encuentran en suspensión (Figura 1) [17].
Disminución de la actividad NADPH oxidasa por la acción de tibolona
Los macrófagos son células del sistema inmune que participan en el proceso inflamatorio y entre sus funciones principales se encuentra la fagocitosis, actividad que consiste en la eliminación de microorganismos, principalmente a través de la activación de un complejo enzimático conocido como NADPH oxidasa que promueve la producción de ERO y ERN [18]. La activación se caracteriza por un aumento en el consumo de oxígeno molecular y tiene como objetivo la liberación del radical anión superóxido dentro de la vacuola fagocítica o al medio extracelular utilizando como sustrato a NADPH [19]. Aunque este sistema es relevante como mecanismo de defensa del organismo, la desregulación de la actividad de la NADPH oxidasa desempeña un papel importante en el desarrollo de diversas enfermedades, particularmente las asociadas con estrés oxidativo como las enfermedades cardiovasculares [20]. Tb es un esteroide sintético prescrito para el tratamiento de los síntomas vasomotores y osteoporosis en la mujer en posmenopausia, actúa como regulador de la actividad estrogénica tejido específico, que además ha demostrado tener efectos antiaterogénicos [14].
La actividad de NADPH oxidasa fue evaluada a través del ensayo con NBT (Figura 2), para lo cual se sembraron 8x104 cel/pozo en una placa de 96 pozos.
En el grupo control positivo Ctrl(+), se observó un incremento en la actividad de NADPH oxidasa, con respecto al grupo control negativo Ctrl(-), a las 24 h (p<0.05) y 48h (p<0.01), lo cual indica que el modelo de activación enzimática con PMA (100 ng/ml) es adecuado para estudiar efectos sobre este complejo (Figura 3 y 4).
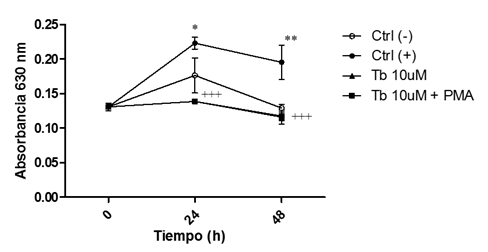
Figura 3 Disminución de la actividad NADPH oxidasa en macrófagos preincubados con tibolona. Los signos * y + indican diferencia estadísticamente significativa con respecto al grupo Ctrl (-) y al Ctrl (+), respectivamente.
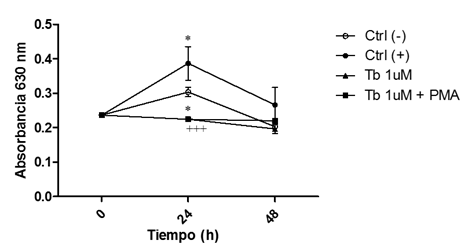
Figura 4 Disminución de la actividad NADPH oxidasa en macrófagos preincubados con tibolona. Los signos * y + indican diferencia estadísticamente significativa con respecto al grupo Ctrl (-) y al Ctrl (+), respectivamente.
En este estudio se observó que Tb mantiene la actividad enzimática similar a la obtenida en el grupo Ctrl (-), aún después de que las células han recibido estímulo con PMA, el cual es un activador del complejo enzimático antes mencionado [21] y no se encontró diferencia estadísticamente significativa entre el grupo Ctrl (-) y los grupos que se preincubaron con Tb a una concentración de 10μM. Sin embargo, si se evidenció una diferencia significativa cuando se compararon los grupos con tratamiento con el grupo Ctrl (+) a las 24h y 48h (p<0.001) (Figura 3). Lo cual sugiere que Tb regula la actividad del complejo enzimático NADPH oxidasa, posiblemente a través de la modulación del efecto estrogénico de sus metabolitos, lo cual concuerda con los estudios que reportaron una disminución de la actividad enzimática por los estrógenos [7].
En los grupos preincubados con Tb a una concentración de 1μM, la diferencia con respecto al grupo Ctrl (+) sólo se observó a las 24h, lo cual sugiere que el efecto del fármaco en la regulación de la actividad NADPH oxidasa es dependiente de la concentración del fármaco (Figura 4).
Cambios en la expresión génica de citocinas en el macrófago
Estudios en líneas celulares de macrófagos han demostrado el efecto regulador antiinflamatorio de los estrógenos vía activación de su receptor [22, 23], por lo que en este estudio se evaluó el efecto de Tb, un fármaco que actúa a través de la activación de los receptores de ER, en la actividad del macrófago, para lo cual se determinó la expresión de citocinas (IL-1β, IL-6, TNF-α e IL-10) a través de la técnica de RT-qPCR en macrófagos preincubados con Tb 10 y 1 μM durante 24h. Para realizar este ensayo se sembraron 1x105 cel/pozo en placas de 6 pozos. Los resultados de este estudio muestran que Tb tiene un efecto en la expresión de las citocinas en el macrófago y que ésta es dependiente de la concentración del fármaco.
En relación a la interleucina 1, se encontró que el grupo incubado con Tb-PMA 10uM hubo menor expresión de IL-1, con respecto al control en el tiempo 0 (estado basal), mientras que en el grupo con Tb a una concentración de 1uM, se mantiene sin cambios. Por otro lado, no se encontró diferencia estadísticamente significativa entre el grupo que solo se incubo con Tb (10uM) y el grupo que además del tratamiento a la misma concentración recibió el estímulo. Sin embargo, en el grupo que se preincubó con Tb 1uM y además recibió el estímulo con PMA, hubo menor expresión de IL-1, con respecto al grupo que sólo se incubó con el tratamiento (Figura 5).
En cuanto a la expresión de IL-6, en el grupo incubado solo con Tb (1uM) se observó mayor expresión de IL-6 con respecto al grupo Ctrl 0, sin encontrar cambios en el grupo con Tb 10uM.
Pero cuando Tb 1uM se preincubó con PMA, se observó menor expresión de esta citocina, en comparación con el grupo que sólo se preincubó con Tb (1uM). Sin embargo, no se encontró diferencia estadísticamente significativa con respecto a la expresión de IL-6 en los grupos con y sin estimulo, preincubado con Tb 10uM (Figura 6).
Se observó que hubo mayor expresión de TNF-α en el grupo preincubado con Tb 10 uM, con respecto al grupo preincubado con Tb más PMA. El mismo efecto se observó en los grupos que fueron tratados con Tb 1uM, con y sin estimulo (Figura 7).
Con respecto a la expresión de IL-10, se observó que en el grupo incubado con Tb 10uM, hubo menor expresión de la citocina con respecto al grupo Ctrl 0, mientras que en el grupo con la concentración menor (1uM), se observó una mayor expresión de IL-10. Además, se observó que en el grupo tratado con Tb 10uM la expresión de IL-10 fue menor en comparación con el grupo que recibió el tratamiento y el estímulo. Sin embargo, en el grupo tratado con Tb 1uM, el efecto observado fue contrario, ya que hubo mayor expresión de IL-10 en comparación con el que recibió tanto tratamiento como estímulo con PMA (Figura 8).
Existen estudios in vitro con células mononucleares obtenidas de sangre periférica de pacientes en posmenopausia en tratamiento con Tb, en donde no se han encontrado cambios en los niveles séricos de algunas citocinas [24], en este estudio (in vitro) con macrófagos, aunque no se encontraron cambios en la expresión de IL-6, si se observó menor expresión citocinas proinflamatorias (IL-1β y TNF-α), efecto observado también en un modelo animal (in vivo) en donde se redujeron las concentraciones séricas de TNF-α en grupos tratados con Tb [25]. Estos resultados sugieren que Tb tiene una actividad moduladora de la síntesis de citocinas, por lo que podría jugar un papel importante en la determinación del perfil de los macrófagos.
El presente estudio demostró que Tb tiene un efecto regulador de la actividad enzimática NADPH oxidasa del macrófago, lo cual podría favorecer la disminución de la producción de especies reactivas de Nitrógeno y Oxigeno, producto de la activación de este complejo enzimático. Además, se demostró que Tb también tiene efectos moduladores en la síntesis de citocinas (IL-1β, IL-6, TNF-α y IL-10); posiblemente como consecuencia de su actividad sobre el receptor de estrógenos, que se ha demostrado está involucrado en la regulación de la síntesis y expresión de citocinas a través de la vía NF-κB. Los resultados contribuyen a la descripción de la actividad de este fármaco, además se propone al macrófago como un posible blanco terapéutico en la regulación del proceso inflamatorio por la acción de Tb. Por lo que, se sugiere realizar la cuantificación de proteínas asociadas a las citocinas, así como la evaluación del óxido nítrico sintasa inducible (iSON), un complejo enzimático también involucrado en la producción de especies reactivas.











 text new page (beta)
text new page (beta)