INTRODUCCIÓN
Las microalgas han despertado especial interés en los últimos años por su particular manera de acumular aceites, en forma de triglicéridos y de ácidos grasos poliinsaturados, que están ubicados principalmente en la membrana celular o en las organelas en forma de glicolípidos, fosfolípidos, esfingolípidos y lipoproteínas (Canelli et al., 2020). Algunos de estos microorganismos pueden ser cultivados de forma autotrófica, mixotrófica y/o heterotrófica; los cultivos heterótrofos proveen ventajas competitivas ya que no se necesita luz, la luz es un factor limitante del cultivo debido a que no alcanza a llegar a las células que se encuentran en cultivos con altas densidades celulares (Singhasuwan et al., 2015; Zhang et al., 2020), adicionalmente, se utiliza una fuente de carbono orgánica lo que disminuye el tiempo de crecimiento y se obtienen altas concentraciones de biomasa logrando mejorar los rendimientos en la producción de lípidos totales hasta un 89% del peso seco de la biomasa (Safi et al., 2014; Shen et al., 2015; Wang et al., 2017).
El contenido de aceites en las microalgas puede aumentar o disminuir debido a cambios en los factores abióticos que tienen mayor relevancia en los cultivos microalgales entre los cuales se resaltan la deficiencia de nutrientes como nitrógeno y fósforo, intensidad de luz, fotoperiodo, salinidad, temperatura y pH (Paliwal et al., 2017; Singhasuwan et al., 2015). Cuando las células se enfrentan a alguna de estas condiciones se genera estrés ambiental causando disminución su división celular y cambiando su metabolismo hacia la producción y almacenamiento de lípidos como fuente de reserva de energía (Wang et al., 2017; Xin et al., 2010) como es el caso de la limitación de nitrógeno y fósforo, que puede causar disminución del contenido de proteínas en la célula, así como de tilacoides en la membrana y activar las enzimas que estimulan la hidrolisis de fosfolípidos y triglicéridos (Fu et al., 2017; Li et al., 2018; Singhasuwan et al., 2015).
La adecuada composición del medio de cultivo favorecerá entonces el crecimiento de las células, por esta razón muchos medios de cultivo comerciales han sido modificados y optimizados, a fin de establecer el efecto que tiene el aumento o la disminución de la concentración de algunos nutrientes sobre la producción de biomasa y lípidos (Singhasuwan et al., 2015). Para lograr buenos rendimientos de aceites en las microalgas se debe asegurar una alta concentración de biomasa con una adecuada concentración de nutrientes, los aceites, por ser metabolitos primarios, pueden ser inducidos al someter las microalgas a condiciones de estrés (Guedes et al., 2011; Wang et al., 2017) y estas condiciones de estrés dependen tanto de la especie como de los factores asociados a su crecimiento (Tonon et al., 2002).
Este trabajo muestra de qué manera la relación carbono/nitrógeno y carbono/ fósforo, favorecen la producción de biomasa y la síntesis de ácidos grasos totales en la microalga nativa Chlorella sorokiniana.
MATERIALES Y MÉTODOS
Microorganismo y medio de cultivo: La microalga Chlorella sorokiniana se aisló del lago del parque norte en la ciudad de Medellín, Colombia (2004), La cepa aislada se hizo axénica mediante subcultivo continuo utilizando medio basal Bold (BBM) en placas de agar suplementadas con ampicilina y kanamicina (10 y 50 μg mL-1 en el medio, respectivamente). La colonia aislada se identificó mediante análisis molecular del espaciador transcrito interno ribosómico (Ribosomal Internal Transcribed Spacer- ITS) y se conservó a 12 °C en medio de cultivo estándar modificado por Quevedo (2011) (Tabla 1). Para su mantenimiento, se realizan resiembras de la cepa cada 3 meses.
Tabla 1 Composición química del medio de cultivo estándar modificado por Quevedo (2011)
| Macronutrientes (gL-1) | Micronutrientes (mgL-1) | ||
| FeCl3 6H2O | 0,0073 | H3BO3 | 0,002859 |
| EDTA | 0,00916 | Na2MoO4 2H2O | 0,05 |
| K2HPO4 | 0,04 | ZnSO4 | 0,1234 |
| MgSO4 7H2O | 0,05 | CoCl2 2H2O | 0,05 |
| CaCl2 2H2O | 0,04 | MnCl2 | 1,146 |
| KNO3 | 0,1 | CuCl2 2H2O | 0,054 |
| Para medio sólido se adiciona agar-agar a 15gL-1 y NaHCO3 1gL-1 | |||
Preparación del inóculo: se preparó el medio de cultivo estándar modificado en un erlenmeyer de 250mL con 100mL de volumen efectivo. En otro recipiente se preparó 10ml de una solución de glucosa a 10gL-1. Estas soluciones se esterilizaron a 120°C/15min. Después de la esterilización se adicionó la solución de glucosa al medio de cultivo, se ajustó pH a 6.0 y se sembró la microalga Chlorella sorokiniana transfiriendo una colonia de un caja de petri con un asa de aro al medio líquido. El inóculo se dejó en incubación a 28°C bajo completa oscuridad en un agitador orbital a 120rpm/3días.
Diseño experimental para la Relación Carbono/Nitrógeno y relación Carbono/Fósforo: Con el fin de aumentar la producción de biomasa y el contenido de lípidos en la microalga nativa Chlorella sorokiniana se realizó una evaluación del comportamiento del cultivo heterotrófico de esta microalga con tres relaciones C/N (10/1, 25/1 y 50/1) manteniendo la concentración de glucosa inicial fija 20gL-1 y la relación C/P inicial (200/1) fija en todos los ensayos. Estos se llevaron a cabo en erlenmeyer de 250mL con 120mL de medio de cultivo (volumen de trabajo), cada experimento se realizó por triplicado. La microalga se inoculó al 5%v/v con respecto al volumen total del cultivo. Los cultivos se mantuvieron bajo completa oscuridad a 28°C en un agitador orbital a 120rpm/9días. Se tomaron 6mL de cultivo para realizar los métodos analíticos.
Una vez seleccionada la mejor relación C/N, se procedió a evaluar de la relación C/P (200/1, 300/1 y 400/1) en un medio de cultivo con 20 gL-1 de glucosa.
Análisis estadístico: Los resultados se analizaron por medio de un Análisis de Varianza (ANOVA) y análisis de comparaciones múltiples utilizando el software libre estadístico RStudio Version 0.99.902 - © 2009-2016 RStudio, Inc.
Concentración de biomasa: Se empleó la metodología de peso seco ligeramente modificada de Arredondo & Voltolina (2007). Se tomaron 2mL del cultivo en crecimiento en eppendorfs previamente secados y pesados, se centrifugó a 15000rpm/10min. El sobrenadante se descartó y el pellet se lavó con agua destilada, se llevó nuevamente a centrifugación bajo las mismas condiciones, se descartó el sobrenadante y el pellet con la biomasa se llevó a un horno a 105 °C/12 h. Finalmente se puso en un desecador hasta alcanzar un peso constante (Arredondo & Voltolina, 2007).
Concentración de nitratos: La concentración de nitratos fue cuantificada mediante el método del ácido salicílico. Las lecturas se realizaron en un lector de microplatos Synergy a 410 nm. La curva de calibración se construye a partir de una solución concentrada de KNO3 (Palomino et al., 1997)
Concentración de fosfatos: La concentración de fosfatos se determinó por el método del ácido ascórbico modificado (Baird & Bridgewater, 2017). Las lecturas se llevaron a cabo en un lector de microplatos Synergy a 880 nm. La curva de calibración se construyó a partir de una solución concentrada de K2HPO4.
Concentración de glucosa: La concentración de Glucosa se cuantificó por el método de la glucosa oxidasa, utilizando el kit Glucose de Biosystem. Las lecturas se llevaron a cabo en un lector de microplatos Synergy a 500 nm.
Extracción y contenido de lípidos: El contenido de lípidos (g lípidos/g biomasa seca*100) se determinó por la metodología gravimétrica, modificando el método de Bligh & Dyer (1959) y rompiendo las células por sonicación. Para esto, se tomaron 4ml de medio de cultivo, se separó la biomasa del medio de cultivo por centrifugación a 15000rpm/10min; esta se resuspendió en 1mL de solución cloroformo:metanol (relación 2:1) y se llevó a un ultrasonido por 2 horas a 30 hz, posteriormente se centrifugó a 15000rpm/10min separando la biomasa del solvente, se recuperó la fase del solvente con los aceites en un tubo eppendorf previamente pesado, se adicionó 1mL de solución salina (0.9%) para remover material no lipídico que se arrastró con el solvente y se centrifugó nuevamente bajo las mismas condiciones, la fase acuosa se descartó y el eppendorf con los solventes se llevó a una estufa para su evaporación a 80°C hasta tener peso constante.
RESULTADOS Y DISCUSIÓN
Evaluación de la Relación C/N: La Figura 1a representa las cinéticas de crecimiento y consumo de Glucosa de las 3 relaciones C/N evaluadas y la Figura 1b, muestra el consumo de nitratos. Las cinéticas con relación C/N 10/1 y 25/1 mostraron tendencias similares de consumo de glucosa, dándose un mayor consumo y posterior agotamiento de esta fuente de carbono a los 8 días de cultivo aproximadamente, además, tienen una mayor concentración de nitrógeno por lo tanto hay mayor producción de biomasa. Sin embargo, con la relación C/N 50/1 se observó un menor consumo de glucosa, quedando glucosa residual al final de la cinética, y la microalga alcanza más rápido la fase estacionaria debido a que se agota el nitrógeno en el medio de cultivo en el día 3 (Fig. 1b), siendo la cinética con menor concentración de biomasa 6.83±0.80gL-1. El nitrógeno, al igual que el carbono, son nutrientes limitantes del crecimiento de las microalgas y deben estar presentes en el cultivo para asegurar la producción de proteínas y ácidos nucleicos importantes para la división celular (Beuckels et al., 2015; Singhasuwan et al., 2015; Wang et al., 2017).
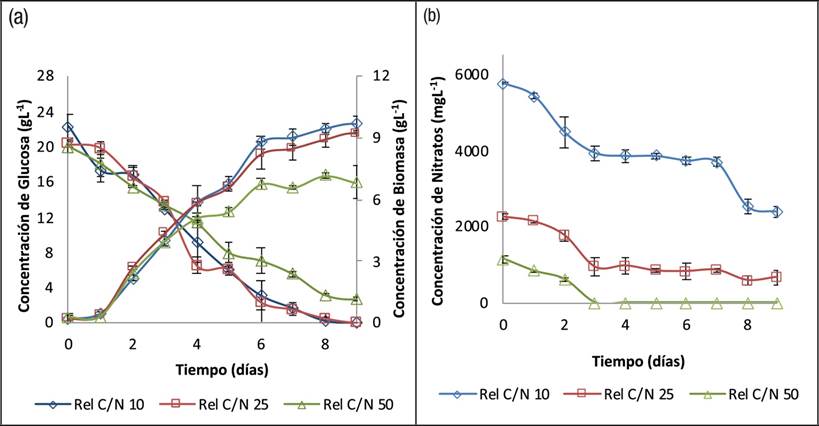
Figura 1 Curvas Cinéticas para el cultivo heterotrófico de Chlorella sorokiniana, a 28°C, 120rpm y pH inicial 6.0 con las diferentes relaciones C/N 10/1, 25/1 y 50/1. a) Producción de Biomasa y Consumo de Carbono. b) Consumo de Nitratos.
El análisis de varianza (ANOVA), para la variable respuesta concentración final de biomasa (a los 9 días de cultivo) mostró que hay diferencias estadísticamente significativas entre las tres relaciones C/N evaluadas (valor p=0.00027). A pesar de esto, el análisis de comparaciones múltiples realizado por el método de Tukey o método HSD, evidencia que no hay diferencias significativas en la concentración final de biomasa al utilizar las relaciones C/N 25/1 y 10/1.
En la Tabla 2 se resumen los parámetros de los cultivos evaluados al día 9. Las relaciones C/N 10/1 y 25/1 alcanzaron las mayores concentraciones de biomasa (9.70±0.33 gL-1 y 9.17±0.06 gL-1, respectivamente) y mayores productividades de biomasa (1.08±0.04 gL-1d-1 y 1.02±0.01 gL-1d-1, respectivamente) en comparación a la relación C/N 50/1 (6.83±0.80 gL-1 de biomasa y 0.76±0.09 gL-1d-1).
Tabla 2 Parámetros de cultivo: cultivos heterotróficos de Chlorella sorokiniana para las diferentes relaciones C/N evaluadas al día 9.
| Parámetros Cinéticos | Relación C/N 10/1 | Relación C/N 25/1 | Relación C/N 50/1 |
| Concentración final de biomasa (gL-1) | 9.70±0.33 | 9.17±0.06 | 6.83±0.80 |
| Rendimiento de biomasa en sustrato Yxs (gg-1) | 0.43±0.03 | 0.44±0.01 | 0.38±0.03 |
| Productividad de biomasa (gL-1d-1) | 1.08±0.04 | 1.02±0.01 | 0.76±0.09 |
| Contenido de lípidos (%) (g lípidos/g biomasa seca) | 15.65±0.85 | 18.82±1.63 | 24.27±0.33 |
| Productividad de lípidos (mgL-1d-1) | 17.39±0.94 | 20.92±1.82 | 26.97±0.36 |
| Rendimiento de lípidos en biomasa Ypx(gg-1) | 0.13±0.01 | 0.15±0.03 | 0.20±0.01 |
Los resultados obtenidos en este trabajo con una relación C/N 10/1 coinciden con los reportados por Wei et al. (2009), quienes evaluaron una concentración de glucosa inicial de 40 gL-1 de los cuales la microalga Chlorella protothecoides consumió 20 gL-1 de glucosa aproximadamente, obteniendo una concentración de biomasa de 10.7 gL-1, productividad de biomasa 1.07 gL-1d-1 y rendimiento de biomasa en sustrato de 0.5gg-1 aproximadamente en 10 días de cultivo, se observa que son resultados similares a los alcanzados por esta investigación a pesar de trabajar con especies de Chlorella diferente. Wei et al. (2009) también obtuvieron un efecto similar cuando sometieron las microalgas a relaciones de C/N altas (50/1), encontrando bajas concentraciones de biomasa. Por lo que se corrobora que el factor limitante del crecimiento de la biomasa microalgal de los cultivos con altas concentraciones de glucosa es el nitrógeno, si el nitrógeno se agota en muy poco tiempo la microalga no es capaz de seguir sintetizando proteínas, DNA y RNA, y entra en una etapa de estrés nutricional conduciendo su metabolismo a la producción de lípidos neutros y triglicéridos como almacenamiento de energía (Sakarika & Kornaros, 2017; Xin et al., 2010).
Singhasuwan et al. (2015) evaluaron 3 relaciones C/N 29/1, 63/1 y 95/1 para la microalga Chlorella sp. TISR8990, encontraron que con la relación menor 29/1 se obtienen mayores concentraciones de biomasa 2,7gL-1, y con la más alta relación C/N 95/1 encontraron la menor producción de biomasa 1.3 gL-1 la cuál es un 48% menor a la relación C/N 29/1, lo mismo ocurre con nuestro estudio en el cual con la más alta relación C/N se obtiene un 74% menos de biomasa, todo esto indica que altas relaciones C/N disminuyen la concentración de biomasa debido al rápido agotamiento de nitrógeno en el medio de cultivo.
El contenido de lípidos en la microalga Chlorella sorokiniana (Tabla 2), alcanzó un mayor porcentaje con la relación C/N 50/1 (24.27±0.33%) que con las relaciones C/N 10/1 y 25/1 (15.65±0.85% y 18.82±1.63% respectivamente). El ANOVA realizado para la variable respuesta contenido de lípidos (a los 9 días de cultivo) mostró en que hay diferencias estadísticamente significativas entre las tres relaciones carbono nitrógeno avaluadas (valor p=1.392e-05), esto se confirma con el análisis de comparaciones múltiples realizado el método de Tukey en el cual se evidencia diferencias significativas en las tres relaciones C/N en el día 9.
Este resultado confirma que la deficiencia de nitrógeno induce la producción de lípidos en la microalga Chlorella sorokiniana, como se observa en la curva cinética de consumo de Nitratos (Fig. 1b),en la cual, para la relación C/N 50/1 se agota este nutriente el día 3, por lo tanto la microalga comienza a almacenar lípidos de reserva, aumentando la productividad de lípidos intracelulares (26.97±0.36mgg-1d-1), esta productividad es mayor que la obtenida con las relaciones C/N 10/1 y 25/1 (17.39±0.94 mgg-1d-1 y 20.92±1.82 mgg-1d-1 respectivamente) (ver Tabla 2).
El estudio realizado por Wei et al. (2009), en el cual se obtuvo un contenido de lípidos de 28% con 20gL-1 de glucosa en 10 días de cultivo, utilizando urea como fuente de nitrógeno, es similar a lo encontrado en nuestro estudio con la microalga nativa Chlorella sorokiniana donde se obtuvo un contenido de lípidos de 24.27±0.33% con 20 gL-1 de Glucosa en 9 días de cultivo utilizando nitrato de potasio como fuente de nitrógeno. Otros autores como Wang et al. (2017) también han trabajado con limitación de nitrógeno en el medio de cultivo para evaluar el efecto de este nutriente en la acumulación de lípidos intracelulares en un cultivo en Batch con glucosa a 38 gL-1 y NaNO3, la fuente de nitrógeno es agotada aproximadamente a los 3 días de cultivo, obteniendo una mayor concentración de biomasa 18.38 gL-1 y mayor contenido de lípidos de 27.2% al igual que en nuestro estudio.
Singhasuwan et al. (2015) encontraron que la relación C/N 63/1 es la mejor para la producción de ácidos grasos totales en la microalga Chlorella sp TISR8990, obtuvieron un contenido de lípidos de 394 mgg-1 y una productividad de lípidos de 186mgL-1d-1. Este resultado es parecido a lo encontrado en nuestro trabajo con la relación C/N 50/1 (242.7 mgg-1 y 26.97±0.36 mgL-1d-1 respectivamente) y nos confirma que esta relación C/N es la mejor para inducir la producción de ácidos grasos totales en la microalga nativa Chlorella sorokiniana.
Evaluación de la Relación C/P: Los comportamientos cinéticos para todas las relaciones C/P evaluadas son similares en el crecimiento y consumo de glucosa (Fig. 2a), la cinética de consumo de fosfatos (Fig. 2b) es más lenta para la relación C/P 200/1 agotándose los fosfatos a los 5 días de cultivo, mientras que para las relaciones C/P 400/1 y 300/1 se agotan los fosfatos a los 3 y 4 días de cultivo respectivamente. Sin embargo, a pesar de la diferencia en el consumo de fósforo, la tendencia de crecimiento de la biomasa en las tres cinéticas es el mismo, esto se debe a que algunas microalgas pueden reducir su demanda de fósforo fisiológico en hasta un 50% en respuesta a la limitación de fósforo, por tanto, se disminuye la tasa de síntesis de ácidos nucleicos y fosfolípidos (Belotti et al., 2013) Otras microalgas también poseen la capacidad de almacenar fósforo en forma de polifosfatos como reserva de energía, que puede ser utilizada posteriormente por la célula debido a la limitación de nutriente en el medio de cultivo (Fu et al., 2017; Li et al., 2018). Es por esto que cuando encontramos una deficiencia de fósforo como la observada en nuestro trabajo, no se observa una marcada diferencia en la concentración final de biomasa.
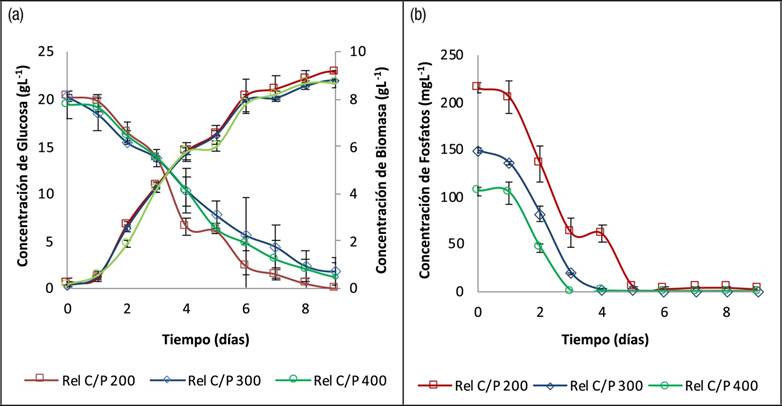
Figura 2 Curvas Cinéticas para el cultivo heterotrófico de Chlorella sorokiniana a 28°C, 120rpm y pH inicial 6.0, con las relaciones C/P 200/1, 300/1 y 400/1. a) Producción de Biomasa y Consumo de Carbono. b) Consumo de Fosfatos.
La Tabla 3 resume los parámetros de los cultivos evaluados al día 9. La relación C/P 200/1 alcanzó la mayor concentración de biomasa (9.17±0.06gL-1) en comparación a las relaciones C/P 300/1 y 400/1 (8.80±0.05 gL-1 y 8.70±0.17 gL-1 respectivamente). El análisis de varianza (ANOVA), para la variable respuesta concentración final de biomasa mostró que hay diferencias estadísticamente significativas entre las 3 relaciones C/P evaluadas (valor p= 0.002432). A pesar de esto el análisis de comparaciones múltiples realizado por el método de tukey evidenció que no hay diferencias significativas entre las relaciones C/P 300/1 y 400/1 para la concentración final de biomasa en el día 9.
Tabla 3 Parámetros de cultivo heterotrófico para Chlorella sorokiniana a diferentes relaciones C/P evaluadas al día 9.
| Parámetro | Relación C/P 200 | Relación C/P 300 | Relación C/P 400 |
| Concentración final de biomasa (gL-1) | 9.17±0.06 | 8.80±0.05 | 8.70±0.17 |
| Rendimiento de biomasa en sustrato Yxs (gg-1) | 0.44±0.01 | 0.44±0.06 | 0.43±0.03 |
| Productividad de biomasa (gL-1d-1) | 1.02±0.01 | 0.98±0.01 | 0.97±0.02 |
| Contenido de lípidos (%) (g lípidos/g biomasa seca) | 18.82±1.63 | 21.31±1.72 | 20.48±1.27 |
| Productividad de lípidos (mgL-1d-1) | 20.92±1.82 | 23.67±1.91 | 22.76±1.41 |
| Rendimiento de lípidos en biomasa Ypx(gg-1) | 0.15±0.03 | 0.17±0.02 | 0.16±0.02 |
La Tabla 3 muestra que el que contenido de lípidos en las relaciones C/P 200/1, 300/1 y 400/1 fue 18.82±1.63%, 21.31±1.72% y 20.48±1.27% respectivamente, este contenido de lípidos es prácticamente el mismo para las tres relaciones evaluadas, esto se confirma con el ANOVA, para la variable respuesta contenido de lípidos, mostró que no hay diferencia estadísticamente significativa entre las relaciones C/P evaluadas (valor p= 0.2686), por lo tanto la acumulación de lípidos en la microalgas nativa Chlorella sorokiniana bajo deficiencia de fósforo no es tan evidente como la acumulación de lípidos cuando hay deficiencia de nitrógeno, además, el contenido de lípidos de las tres relaciones C/P evaluadas están alrededor del 20% como se observa para la relación C/N 25/1 (20.92±1.82%).
En el estudio realizado por Rodolfi et al., (2009), la disminución de la concentración de fósforo en el medio de cultivo de la microalga Nannochloropsis sp., provocó un aumento en el contenido lipídico de 13,2 % a 50,1%, sin embargo no se presentó un efecto benéfico en la productividad de lípidos debido al bajo crecimiento celular, pues a medida que aumentó el tiempo de deficiencia de fósforo disminuyó la productividad de biomasa hasta 0.1gL-1d-1, en el presente estudio la evaluación de la relación C/P para Chlorella sorokiniana no mostró un notable aumento en el contenido de lípidos a pesar de haber deficiencia de fósforo en el medio de cultivo, sin embargo sí hay un aumento en la productividad de biomasa de hasta 1.02±0.01gL-1d-1 para la relación C/P 200/1 y un incremento en la productividad de lípidos, las cuales oscilan entre 20.92±1.82mgL-1d-1 y 23.67±1.91mgL-1d-1.
En la Tabla 4 se encuentran los perfiles de ácidos grasos obtenidos bajo las diferentes relaciones C/N y C/P evaluadas en la microalga Chlorella sorokiniana, se puede observar que bajo condiciones heterotróficas en general se obtiene muy buen perfil de ácidos grasos monoinsaturados y poliinsaturados de tipo omega 6 y omega 3.
Tabla 4 Perfil de ácidos grasos heterotrófico para la microalga Chlorella sorokiniana a diferentes relaciones C/N y C/P y comparación con otros estudios.
| Perfil de ácidos grasos (%) | Cultivo | Heterotrófico | Cultivo Autotrófico | |||||||
| C/N 10/1 | C/N 25/1 | C/N 50/1 | C/P 200/1 | C/P 300/1 | C/P 400/1 | Singhasuwan et al. 2015 | Quevedo 2011 | Arora et al., 2016 | ||
| Saturados | Miristico (C14:0) | 0.6 | 1 | |||||||
| Octanoico (C17:0) | 0.8 | 12.6 | ||||||||
| Octadecanoico (C18:0) | 2.9 | 9.4 | 2.6 | 3.9 | 2.7 | 1 | ||||
| Palmítico (C16:0) | 35.9 | 39.9 | 36.5 | 40.8 | 37.0 | 20.1 | 28.6 | 10 | ||
| Eicosanoico (C20:0) | 0.8 | |||||||||
| Pentadecanoico (C15:0) | 5.6 | |||||||||
| Monoinsaturados | Palmitoleico (C16:1) | 28.5 | 3.4 | 2.2 | ||||||
| Eicosenoico (C20:1) | 0.4 | |||||||||
| Oleico (C18:1, n-9) | 17.2 | 13.2 | 13.7 | 18.8 | 18.4 | 18.5 | 20.1 | 9.01 | 40 | |
| Poliinsaturados | Eicosapentaenoico (C20:5, n-3) | 13.6 | ||||||||
| Linoléico (C18:2, n-6) | 7.9 | 29.1 | 34.1 | 36.3 | 35.9 | 50.2 | 9.9 | 7 | ||
| Gama Linolénico (C18:3, n-6) | 39.9 | 4.3 | 4.0 | 26,1 | ||||||
Es importante resaltar que en el trabajo realizado bajo condiciones heterotróficas con la relación C/N 25/1 se obtiene un 13.6% de ácido eicosapentaenoico (EPA), y al compararlo con el trabajo realizado por Quevedo en el 2011 bajo condiciones autotróficas utilizando la misma microalga, vemos que ellos no reportan este ácido graso poliinsaturado.
Comparando el perfil heterotrófico obtenido en nuestro estudio con el perfil obtenido por Singhasuwan et al. (2015) con la microalga Chlorella sp. TISR8990 se observa que son bastante similares menos en el ácido linoleíco que es mayor para Chlorella sp. TISR8990 y no hay presencia de ácido eicosapentaenoico (EPA).
Los resultados obtenidos en este trabajo utilizando la microalga nativa Chlorella sorokiniana muestran que al tener una menor relación C/N y C/P aumenta la concentración de biomasa hasta 9.7gL-1 debido a que hay suficientes nutrientes para el apropiado crecimiento celular, y al tener altas relaciones C/N y C/P se obtienen mayores contenidos de lípidos 24.27% y productividades de lípidos de hasta 26.97mgL-1d-1. También se observó, que a pesar que el fósforo no haya mostrado una diferencia estadísticamente significativa para la producción de lípidos intracelulares, el Nitrógeno muestra ser un nutriente limitante tanto en la producción de biomasa como en la acumulación de lípidos en la microalga nativa Chlorella sorokiniana.
Lo anterior nos lleva a sugerir que realizar una estrategia de cultivo en dos etapas puede ser una opción para aumentar la productividad de lípidos totales en la microalga nativa Chlorella sorokiniana. Es evidente que al optimizar las condiciones de cultivo de la microalga Chlorella sorokiniana con suficientes nutrientes para su crecimiento se puede asegurar una alta producción de biomasa en poco tiempo, y en la segunda etapa donde habrá deficiencia de nutrientes como nitrógeno y fósforo, se puede alcanzar una alta productividad de lípidos totales como respuesta al estrés abiótico, pero se debe asegurar la presencia de fuente de carbono en el medio de cultivo para que se produzca la elongación de los ácidos grasos.











 text new page (beta)
text new page (beta)



