INTRODUCCIÓN
El arsénico (As), es un metaloide comúnmente presente en el ambiente (Coelho et al., 2012), en la naturaleza puede existir en su forma orgánica e inorgánica, siendo esta ultima la forma más toxica y acumulable en organismos expuestos (Liao et al., 2004). Por sus características fisicoquímicas, el As se clasifica como un elemento altamente tóxico, carcinogénico y se encuentra entre los principales contaminantes ambientales a escala global, esta problemática ha sido reportada en varias regiones del mundo (ATSDR, 2007; Iliná et al., 2009; Yamamura & Amachi, 2014). Estudios epidemiológicos han vinculado la exposición a altos niveles de arsénico a una mayor incidencia de cáncer, fibrosis, daño celular, melanosis e hiperqueratosis (Das et al., 2004; Erraguntla et al., 2012), además de daño cardiovascular, diabetes tipo 2 y otras enfermedades metabólicas (Del Razo et al., 2011).
La presencia de arsénico a altas concentraciones desde 50 a 2500 ppm en cuerpos de agua en distintas regiones del mundo, representa una amenaza para la biota y la salud humana (Carbonell-Barrachina et al., 2009), esto último está sustentado en estudios epidemiológicos alrededor del mundo en donde se evidencia la relación de la exposición a este metaloide y sus compuestos a los efectos reportados en humanos (Tchounwou et al., 2004; Li et al., 2009).
La comprensión del mecanismo de toxicidad por arsénico se ha visto obstaculizada por una serie de factores biológicos, químicos y/o situacionales, incluida la relación dosis respuesta, la especificidad y sensibilidad de los tejidos y especies utilizadas en bioensayos y como biomonitores en estudios toxicológicos para comprender su toxicodinámica (Vahter et al., 2007). Diversos estudios han investigado el efecto de este metaloide en organismos acuáticos, entre los que destacan los peces, algunas de las especies utilizadas en estos estudios incluyen a Oreochromis niloticus (Ahmed et al., 2011); Clarias batrachus (Datta et al., 2009); Fundulus heteroclitus (Gaworecki et al., 2012); Labeo rohita, Cirrhina mrigala, Catla catla y Ctenopharyngodon idella (Kousar & Javed, 2014). Estos organismos son sensibles para comprender los posibles efectos potenciales de compuestos químicos en los humanos e incluso en el ecosistema (Datta et al., 2009; Ghobadian et al., 2015).
En este contexto, el pez cebra (Danio rerio) provee un modelo ideal para estudiar y evaluar dichos efectos, debido a que se conoce ampliamente su fisiología, morfología y genoma, así como por su fácil mantenimiento y reproducción en condiciones de laboratorio y por la gran cantidad de trabajos publicados en revistas científicas y asociaciones especializadas en toxicología y otras áreas afines (Domingues et al., 2010). Sus características, como la fertilización externa, rápido desarrollo embrionario (Zhang et al., 2003; Lieschke & Currie, 2007), transparencia óptica de los embriones, así como por su alta sensibilidad permite la evaluación de riesgos a la salud de compuestos xenobióticos (Hill et al., 2005; Oliveira et al., 2009). Además, proveen información de los efectos genotóxicos y teratogénicos de los compuestos químicos (Zhu et al., 2004; Domingues et al., 2010; McCollum et al., 2011; Yang et al., 2011; Li et al., 2014; Van-Houcke et al., 2015).
Para comprender el potencial del arsénico de inducir efectos toxicológicos en el pez cebra, se utilizaron los biomarcadores de daño teratogénico a través de malformaciones en columna vertebral y la evaluación de daño genotóxico a través de la estimación de la frecuencia de micronúcleos en eritrocitos de sangre periférica del pez cebra adulto.
MATERIALES Y MÉTODOS
Mantenimiento del pez cebra
Se mantuvieron 200 peces cebra (Danio rerio) de una edad aproximada de 3 meses, en el Centro de Investigaciones Biológicas de la Universidad Autónoma del Estado de Hidalgo, México. Se aclimataron durante un periodo de dos semanas y se mantuvieron en peceras de 70 litros, con una temperatura de 27±1 °C, equipada con un calentador automático de 100 watts y un filtro de 10 watts con una capacidad de 480 L/h modelo AquaJet10F, y características fisicoquímicas óptimas para el desarrollo de los peces (Rivera, 2006), además de un fotoperiodo de 12 horas de luz y 12 horas de oscuridad. Durante el periodo de mantenimiento (2 semanas), fueron alimentados 3 veces al día con alimento seco, agregando hojuelas de alimento comercial (Lomas®) con un contenido de proteína cruda de 43%, grasa cruda 5%, fibra cruda 3%, vitamina C 200 mg/kg; eliminando el exceso de alimento para evitar contaminación de hongos y protozoarios (Oberamm, 2000).
Para la reproducción, los peces adultos se colocaron en una pecera de desove de 40 L en proporción 3:2 (48 machos y 32 hembras), equipada con una malla de maternidad. Se mantuvo un total de 48 machos y 32 hembras para inducir una cruza masiva de acuerdo al método de producción máxima de embriones (Westerfield, 2007). Los embriones fertilizados fueron transferidos a un cristalizador limpio para evitar la contaminación por heces y restos de alimentos (Gaytán et al., 2008). Los embriones se revisaron usando un microscopio estereoscópico para seleccionar los embriones no fecundados o muertos (Kimmel et al., 1995).
Prueba de embriotoxicidad y teratogenicidad
Se utilizó arsenito de sodio (NaAsO2) (Sigma-Aldrich, CAS: 7784-46-5) como fuente de arsénico para las pruebas de toxicidad, se preparó una solución stock de 10 g L-1 disolviendo arsenito de sodio en agua con temperatura de 27±1 °C, las soluciones de prueba fueron obtenidas a partir de la dilución de la solución stock, para ello se probaron 10 concentraciones de arsenito de sodio para la prueba de toxicidad: 0.0031, 0.0062, 0.0125, 0.0187, 0.0250, 0.0281, 0.0312, 0.0375, 0.0437 y 0.050 mg L-1.
La prueba de toxicidad fue diseñada de acuerdo a Gaytán et al. (2008) para establecer la concentración letal media (CL50), dicha concentración sirvió de criterio para seleccionar concentraciones subletales experimentales (CL6.25, CL12.5, CL25) para la prueba de teratogénesis sin que la toxicidad del compuesto enmascare dichos efectos.
Una vez que la CL50 y las concentraciones subletales fueron establecidas, el efecto teratogénico fue evaluado utilizando el biomarcador de daño en columna vertebral (González, 2005; Gaytán et al., 2008). Para ello, se utilizaron 450 embriones por concentración de entre aproximadamente 2-4 horas postfertilización (hpf). Los embriones fertilizados fueron seleccionados y distribuidos en 15 frascos de vidrio de 125 mL con 30 embriones por frasco (Rivera, 2006). Cada frasco contenía 100 mL de solución de arsenito de sodio, correspondiente a las concentraciones 0.007, 0.0015, 0.0023 y 0.039 mg L-1 que equivalen a las CL6.25, CL12.5, CL25, CL50 y un control negativo con 450 embriones en agua libre de contaminante. La exposición al compuesto químico duró hasta la eclosión de los embriones en peceras que se mantuvieron a una temperatura de 27°C±1 y un fotoperiodo de 12 horas de luz y 12 horas de oscuridad El desarrollo de los embriones fue observado directamente en cajas Petri utilizando un microscopio estereoscópico marca Olympus, modelo SD-ILK equipado con un lente auxiliar de 40x. Se analizaron 2250 embriones para la evaluación de la frecuencia de malformaciones.
Frecuencia de malformaciones en la columna vertebral
Para la evaluación de malformaciones, se clasificó de acuerdo al biomarcador de daño en columna vertebral, que consiste en dividir el cuerpo del organismo en tres zonas, para identificar la zona dañada (cefálica, central y caudal) (Fig. 1). El tipo de malformaciones fue clasificado de acuerdo al tiempo de expresión como tempranas (espiral, caudal espiral, escuadra, gancho y ausencia de cuerpo) y tardías (simple, doble, múltiple, curvas y aleta caudal) (González, 2005; Rivera, 2006; Gaytán et al., 2008). Además, se registraron alteraciones morfológicas a nivel cardiaco identificadas como edema del saco vitelino y edema pericárdico.
Prueba de toxicidad y genotoxicidad
La prueba de toxicidad de arsénico en peces cebra adultos se realizó a partir de arsenito de sodio como fuente de arsénico. La solución stock (10 g L-1) se preparó disolviendo arsenito de sodio en agua, las soluciones de prueba fueron obtenidas a partir de la dilución de la solución stock, para ello se utilizaron 10 concentraciones en la prueba de toxicidad en adultos 0.034, 0.035, 0.036, 0.037, 0.038, 0.039, 0.040, 0.041, 0.042, 0.043 y 0.044 mg L-1. En la prueba de toxicidad en adultos de pez cebra se expusieron 18 peces (6 peces en triplicado por concentración), durante 48 h en matraces Erlenmeyer de 1 L (Scotto et al., 2013), cada uno de los matraces contenía 500 mL de la solución de arsenito de sodio (27°C±1), la prueba de toxicidad se realizó para establecer la concentración letal media (CL50), y se seleccionaron tres concentraciones subletales (CL6.25, CL12.5, CL25), para la prueba de genotoxicidad.
Una vez determinada la CL50 y las concentraciones subletales experimentales, se evaluó el efecto genotóxico del arsénico a través de la inducción de micronúcleos en eritrocitos de sangre periférica. Para ello, 18 adultos (6 adultos en triplicado por concentración), fueron expuestos durante 48 h en matraces Erlenmeyer de 1 L (Scotto et al., 2013). Cada matraz contenía 500 mL de la solución de arsenito de sodio con temperaturas de 27°C±1, correspondiente a las concentraciones proximales de CL6.25 (0.007 mg L-1), CL12.5 (0.015 mg L-1), CL25 (0.023 mg L-1) y CL50 (0.039 mg L-1) y un grupo control en agua libre de contaminante.
Análisis de la frecuencia de micronúcleos en eritrocitos
La frecuencia de micronúcleos (FMN) en eritrocitos fue evaluada de acuerdo a la metodología sugerida por Scotto et al. (2013). La cual consistió en que posterior al periodo de exposición (48 h), los organismos fueron aletargados con 10 mL de solución de bicarbonato de sodio a una concentración de 300 mg L-1, posteriormente fueron sacrificados por decapitación y se colocó una gota de sangre en portaobjetos limpios, se extendió a manera de frotis con otro portaobjetos, y posteriormente se dejó secar a temperatura ambiente durante 15 minutos, posteriormente se fijaron en metanol absoluto durante 15 minutos y nuevamente se dejó secar a temperatura ambiente durante 15 minutos. Finalmente, las muestras fueron teñidas con solución de Giemsa al 10% por 10 minutos, posteriormente se eliminó el excedente por escurrimiento con agua destilada y se dejó secar a temperatura ambiente durante 60 minutos.
En cuanto al análisis, se revisaron un total de 1500 eritrocitos por concentración bajo un microscopio compuesto con aceite de inmersión a una magnificación de 1000x, registrando el número de micronúcleos observados tanto en el grupo control como en los experimentales.
La identificación de micronúcleos (MN) fue de acuerdo a los criterios establecidos por Palhares & Koppe (2002):
el diámetro de los MN debe ser de al menos un tercio del tamaño del núcleo principal
los MN deben estar separados del núcleo principal
el MN debe tener una tinción similar al núcleo principal
El cálculo de la frecuencia de micronúcleos se realizó mediante la siguiente fórmula:
FMN = Número de micronúcleos / Número de células analizadas
Análisis estadístico
Los valores de la CL50 para de las pruebas de teratogénesis y genotoxicidad fueron estimados mediante la prueba de Probit en el programa Statistica V10 (IBM Corp. Released, 2017). Mientras que, para el análisis de los efectos teratogénicos y genotóxicos, se realizó una prueba de X2 con los datos de frecuencia de malformaciones en columna vertebral y la frecuencia de micronúcleos en eritrocitos de sangre periférica para identificar diferencias significativas entre tratamientos.
RESULTADOS
Prueba de embriotoxicidad y teratogenicidad
La prueba Probit estimó la CL50 en 0.039 mg L-1 con límite inferior de 0.033 mg L-1 y límite superior de 0.046 mg L-1 para la prueba de embriotoxicidad, a partir de esta, se probaron tres concentraciones subletales experimentales para los tratamientos de teratogénesis CL25 (0.023 mg L-1), CL12.5 (0.015 mg L-1), CL6.25 (0.007 mg L-1). El porcentaje de mortalidad aumentó a medida que la concentración de arsenito de sodio incrementaba (Tabla 1). Para evaluar los efectos teratogénicos potenciales del arsenito de sodio en el desarrollo embrionario de Danio rerio, se examinó la morfología de los embriones con un microscopio estereoscópico a las 72 hpf. La morfología de los embriones en el grupo control mostró un desarrollo normal en la columna vertebral (Kimmel et al., 1995). Los embriones expuestos a concentraciones de 0.007 mg L-1 presentaron cuatro tipos de malformaciones identificadas como sencilla, doble, múltiple y curva, en un tiempo de expresión tardío. En la concentración 0.015 mg L-1 se observaron cinco tipos de malformaciones, en tiempo de expresión temprano (ausencia de cuerpo) y tardía (sencillas, dobles, curvas y aleta caudal). En la concentración 0.023 mg L-1, seis tipos de malformaciones fueron detectadas, en tiempo de expresión temprana se presentó la malformación de ausencia de cuerpo, mientras que en el tiempo de expresión tardía se presentaron las malformaciones sencillas, dobles, curvas, múltiples y de aleta caudal. En la concentración más alta de 0.039 mg L-1 se presentó la malformación en espiral en tiempo de expresión temprana, y en el tiempo de expresión tardía las malformaciones sencilla, doble, múltiple, curva y aleta caudal. Posterior a la exposición (72 horas), algunos embriones tuvieron otro tipo de anomalías identificadas como edema pericárdico y del saco vitelino (Fig. 2).
Tabla 1 Valores obtenidos de dosis-respuesta a partir de un ensayo de 72 horas con embriones de Danio rerio del pez cebra expuestos a diferentes concentraciones de arsenito de sodio. n: número de embriones, S: Desviación estándar.
| Concentración (mg L-1) | n | Mortalidad | Mortalidad% | Media ± S |
|---|---|---|---|---|
| 0.0500 | 60 | 41 | 68.33 | 13.66 ± 13.31 |
| 0.0437 | 60 | 42 | 70 | 14 ± 10.58 |
| 0.0375 | 60 | 28 | 46.67 | 9.33 ± 10.70 |
| 0.0312 | 60 | 30 | 50 | 10 ± 9.53 |
| 0.0281 | 60 | 24 | 40 | 8 ± 12.12 |
| 0.0250 | 60 | 27 | 45 | 9 ± 9.64 |
| 0.0187 | 60 | 16 | 26.67 | 5.33 ± 6.80 |
| 0.0125 | 60 | 13 | 21.67 | 4.33 ± 4.93 |
| 0.0062 | 60 | 9 | 15 | 3 ± 5.19 |
| 0.0031 | 60 | 8 | 13.33 | 2.66 ± 3.78 |
| Control | 60 | 1 | 1.66 | 0.33 ± 0.57 |
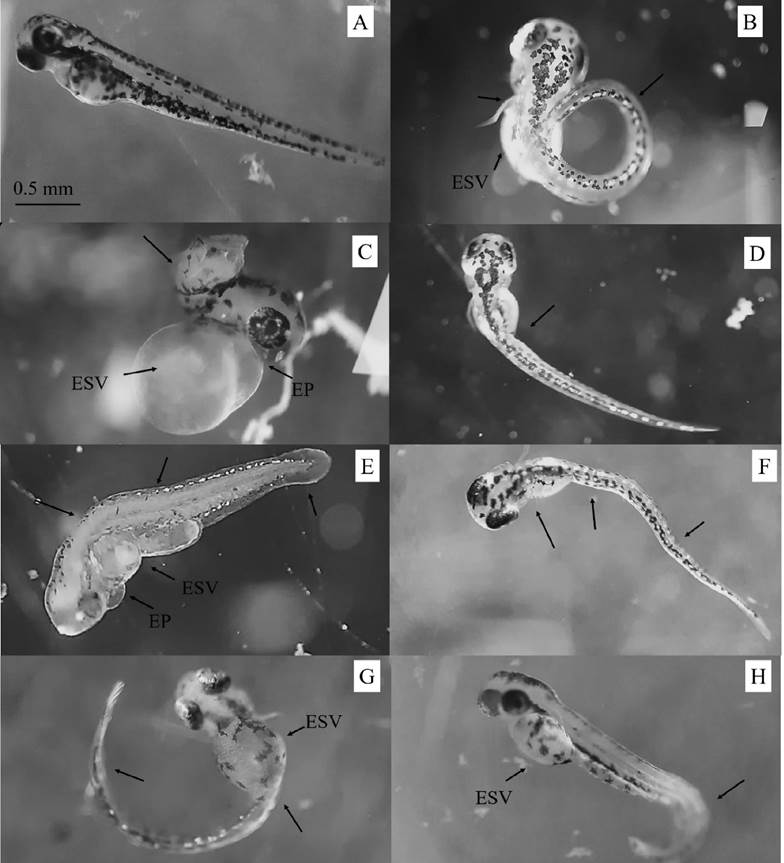
Figura 2 Malformaciones en columna vertebral en Danio rerio. EP: edema pericárdico; ESV: edema del saco vitelino; A) embrión con desarrollo normal; b) malformación en espiral (0.039 mg L-1); c) malformación de ausencia de cuerpo con edema pericárdico y del saco vitelino (0.023 mg L-1); d) malformación sencilla (0.007 mg L-1); E) malformación doble con edema pericárdico y del saco vitelino (0.023 mg L-1); F) malformación múltiple (0.007 mg L-1); G) malformación curva con edema del saco vitelino (0.015 mg L-1); H) malformación aleta caudal con edema del saco vitelino (0.015 mg L-1).
De acuerdo a la prueba de X2 , las concentraciones probadas CL50, CL25, CL12.5, CL6.25 en cada uno de los tratamientos, mostraron diferencias significativas (P < 0.001) entre los tratamientos y el grupo control, confirmando el efecto teratogénico del compuesto (Tabla 2). De acuerdo al tiempo de expresión de las malformaciones, las malformaciones tardías fueron más frecuentes en comparación con las malformaciones tempranas (Fig. 3)
Tabla 2 Frecuencia de malformaciones observadas en los tratamientos con arsenito de sodio. n: número de embriones; S: Desviación estándar; G: gancho; Esp: espiral; EC: espiral caudal; Esc: escuadra; Aus: ausencia de cuerpo; S: simple; D: doble; M: múltiple; C: curva; AC: aleta caudal. *X2 prueba corregida por Xi+1; (+) positivo.
| Concentración (mg L-1) | n | Media ± S | Malformaciones en la columna vertebral | ||||||||||
| Tempranas | Tardías | ||||||||||||
| G | Esp | EC | Esc | Aus | S | D | M | C | AC | Total | |||
| CL50 (0.039)* | 450 | 9 ± 4.66 | 0 | 6+ | 0 | 0 | 0 | 10+ | 5+ | 1+ | 13+ | 3+ | 74+ |
| CL25 (0.023)* | 450 | 4.4 ± 8.49 | 0 | 0 | 0 | 0 | 1+ | 27+ | 2+ | 2+ | 10+ | 2+ | 61+ |
| CL12.5 (0.015)* | 450 | 5.1 ± 11.37 | 0 | 0 | 0 | 0 | 1+ | 36+ | 2+ | 0 | 11+ | 1+ | 24+ |
| CL6.25 (0.007)* | 450 | 2.8 ± 6.83 | 0 | 0 | 0 | 0 | 0 | 22+ | 3+ | 2+ | 1+ | 0 | 16 |
| Control H2O | 450 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Total | 0 | 6 | 0 | 0 | 2 | 95 | 12 | 5 | 35 | 6 | 161 | ||

Figura 3 Frecuencia de malformaciones a las 72 hpf de exposición al arsenito de sodio. G: gancho; Esp: espiral; EC: espiral caudal; Esc: escuadra; Aus: ausencia de cuerpo; S: simple; D: doble; M: múltiple; C: curva; AC: aleta caudal.
El arsenito de sodio ocasionó un incremento en la frecuencia de malformaciones en los embriones de pez cebra con respecto a la dosis de exposición, mostrando una relación dosis-respuesta.
Prueba de toxicidad y genotoxicidad
La prueba de Probit estimó la CL50 en 0.040 mg L-1 con límite inferior de 0.039 mg L-1 y límite superior de 0.041 mg L-1 en la prueba de toxicidad en adultos de Danio rerio. En la prueba de genotoxicidad los resultados obtenidos revelaron que la frecuencia de micronúcleos se incrementó respecto a la concentración de arsenito de sodio, mostrando una relación dosis-respuesta (Fig. 3). Se observaron diferencias significativas en la prueba de X2 (P < 0.0001) (Tabla 3) entre el grupo control y los organismos expuestos al arsénico. En cada una de las concentraciones probadas, se registraron eritrocitos micronucleados, la frecuencia de micronúcleos en la concentración más alta (0.040 mg L-1), correspondiente a la CL50 fue de 0.035, mientras que en la concentración más baja (0.034 mg L-1) que corresponde a la CL6.25 se registró una frecuencia de micronúcleos de 0.008. Para las concentraciones 0.035 y 0.037 mg L-1 correspondientes a las CL12.5 y CL25, se obtuvo una frecuencia de micronúcleos de 0.014 y 0.02 respectivamente.
Tabla 3 Frecuencia de micronúcleos en eritrocitos de sangre periférica del pez cebra. FMN: frecuencia de micronúcleos; CL: concentración letal. *X2 prueba corregida por Xi+1; (+) positivo.
| Concentración (mg L-1) | CL | Media ± S | FMN |
| Control | - | 0 | 0 |
| *0.034 | CL6.25 | 4±1 | 0.008+ |
| *0.035 | CL12.5 | 7.3±0.57 | 0.014+ |
| *0.037 | CL25 | 10±1 | 0.020+ |
| *0.040 | CL50 | 17.66±6.11 | 0.035+ |
Como se muestra en la Tabla 3, la frecuencia de micronúcleos aumentó significativamente conforme se incrementó la concentración de arsenito de sodio (Fig. 4).
DISCUSIÓN
En el presente estudio, se evaluaron los efectos teratogénicos y genotóxicos del arsenito de sodio en el desarrollo embrionario y eritrocitos de sangre periférica del pez cebra (Danio rerio). El arsénico es un metaloide clasificado como teratógeno y carcinógeno que ocasiona efectos adversos en vertebrados. Los resultados del presente estudio corroboran lo establecido por investigaciones realizadas en las últimas dos décadas en la evaluación de efectos teratogénicos (Prieto-García et al., 2006; Li et al., 2009; Ahmed et al., 2011; Adeyemi et al., 2015) y efectos genotóxicos inducidos por la exposición a dicho metaloide (Yadav & Trivedi, 2009; Kummar et al., 2013; Kousar & Javed, 2014; Sayed et al., 2015).
En la prueba de embriotoxicidad, la mortalidad resultó ser proporcional al incremento en las concentraciones de prueba, corroborando lo establecido en estudios previos del efecto letal del arsénico en embriones de Danio rerio (Prieto-García et al., 2006; Li et al., 2009; Ahmed et al., 2011; Adeyemi et al., 2015). El valor de la CL50-72h para la prueba de teratogénesis se estableció en 0.039 mg L-1, y según los resultados de esta prueba, los embriones expuestos a concentraciones de 0.023 mg L-1, presentaron malformaciones como ausencia de cuerpo, sencilla, dobles, múltiples, curvas y de aleta caudal; en la concentración 0.039 mg L-1 se observaron las malformaciones espiral, sencillas, dobles, múltiples, curvas y de aleta caudal. Mientras que los embriones expuestos a 0.007 mg L-1 mostraron malformaciones sencillas, dobles, múltiples y curvas y en la concentración 0.015 mg L-1 se observaron las malformaciones de ausencia de cuerpo, sencillas, dobles, curvas y de aleta caudal con respecto a las establecidas en los tipos de daño en columna vertebral (Gaytán et al., 2008), las malformaciones fueron aún más severas en las concentraciones de prueba más altas de arsenito de sodio (0.039 mg L-1), corroborando lo establecido por Gaworecki et al. (2012) y Sfakianakis et al. (2015) quienes establecen que algunas de las anormalidades más comunes ocasionadas por sales de arsénico, ocurren en el desarrollo embrionario, afectando la formación de la columna vertebral. Así mismo, en cada una de las concentraciones de prueba se presentó una gran incidencia de edemas pericárdico y del saco vitelino.
De manera similar, Adeyemi et al. (2015), reporta anormalidades en columna como escoliosis, retardo en crecimiento, y la formación de edemas en pericárdico y en saco vitelino. Muchos estudios en pez cebra han reportado la presencia de edemas (pericárdico y en saco vitelino) en embriones expuestos a diferentes compuestos químicos (Hill et al. 2005; Raldúa et al., 2008; Ghobadian et al., 2015); estos compuestos pueden ocasionar fugas en los vasos endoteliales provocando disfunciones cardiovasculares derivando en edemas pericárdicos (Hallare et al., 2006; Yu et al., 2011). En el caso de los edemas del saco vitelino podrían ser ocasionados por un desarrollo anormal en el vitelo por un suministro nutricional deficiente en los embriones (Raldúa et al., 2008). En la evaluación de efectos teratogénicos la presencia de edemas pericárdicos y edemas del saco vitelino representan una asociación, ya que suelen ocurrir en estudios de exposición a compuestos químicos.
El potencial genotóxico del arsénico ha sido reportado anteriormente por diversos autores (Yadav & Trivedi, 2009; Ahmed et al., 2011; Kummar et al., 2013; Kousar & Javed, 2014; Sayed et al., 2015), y para determinar el efecto genotóxico, la prueba de micronúcleos (MN) es una herramienta sensible y muy utilizada para evaluar ruptura y daño cromosómico (Fenech, 2002), además pueden analizarse en diferentes tipos de células, entre los que se encuentran los eritrocitos (Bolognesi & Hayashi, 2011; Bolognesi et al., 2006). En este estudio, se evaluó el efecto genotóxico del arsenito de sodio sobre eritrocitos de sangre periférica del pez cebra (Danio rerio) y se demostró que la frecuencia de micronúcleos se incrementó de manera proporcional a la concentración de arsenito de sodio suministrado (Tabla 3). Del mismo modo, Kousar & Javed (2014), determinaron el efecto genotóxico del arsénico en eritrocitos de sangre periférica en cuatro especies de peces: Labeo rohita, Cirrhina mrigala, Catla catla y Ctenopharyngodon idella, y observaron un aumento significativo en el daño al ADN dependiente de la concentración de arsénico suministrado.
Durante el presente estudio, en la concentración experimental más alta de arsenito de sodio correspondiente a la CL50 (0.040 mg L-1) se presentó una FMN de 0.035/1500 eritrocitos. De manera similar, Yadav & Trivedi (2009) reportaron una FMN de 8.83-10.33/1000 células en una concentración de 6.936 mg L-1 de trióxido de arsénico. Las concentraciones de prueba en el presente estudio son inferiores a las reportadas por Yadav & Trivedi (2009), sin embargo, estos autores establecen que la formación de micronúcleos en pez cebra se induce significativamente incluso a bajas concentraciones.
CONCLUSIÓN
En este estudio, se demostró que en el pez cebra el arsenito de sodio a las concentraciones experimentales de 0.007, 0.0015, 0.0023 y 0.039 mg L-1, ocasiona embriotoxicidad, anomalías en columna vertebral durante el desarrollo embrionario, incluyendo efectos edemas pericárdicos, en saco vitelino y daño en el material génetico, ya sea por efectos clastogénicos o aneuploidegénos (micronúcleos). Estos resultados demuestran la sensibilidad del pez cebra como un modelo experimental sensible y excelente en la evaluación del efecto teratogénico y genotóxico en la exposición al arsénico. El presente estudio provee datos para comprender efectos del arsénico, pero se requiere mayor énfasis en su toxicocinética y toxicodinámica en futuras investigaciones.











 text new page (beta)
text new page (beta)





