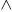INTRODUCCIÓN
Existen 23 Sistemas Lagunares en el Golfo de México, entre los cuales destaca el Sistema Lagunar de Alvarado (SLA) como uno de los más importantes por su diversidad biológica, dimensiones (26 km de longitud aproximada, 5 km amplitud y un área de 80.6 km2) y actividades pesqueras (De la Lanza-Espino y Lozano, 1999). Este sistema, presenta alto grado de heterogeneidad ambiental con condiciones que permiten la riqueza de hábitats y nichos ecológicos para diferentes especies terrestres y acuáticas. El SLA está considerado en varias categorías de conservación: Región Marina Prioritaria, Área de Importancia para la Conservación de Aves y Humedales, y está incluida en la lista de humedales de importancia internacional o como sitio Ramsar (CONABIO, 2000; De la Lanza-Espino, 2017; Ramsar, 2019).
El SLA cuenta con registros de plantas, hongos, vertebrados e invertebrados como crustáceos y moluscos (Flores-Coto y Mendez-Vargas, 1981; CONABIO, 2000; Cruz-Escalona et al., 2018). Se han registrado sus características fisicoquímicas, identificando el SLA como un sistema heterotrófico (De la Lanza-Espino y Lozano, 1999; De la Lanza-Espino, 2017), donde la variación espacio temporal de los nutrientes se relaciona con la descarga de los ríos distinguiendo tres zonas (Morán-Silva et al., 2005). También, se ha descrito la composición y distribución de bacterias sulfato reductoras en relación con las características de los sedimentos (Torres-Alvarado, 2007). Así como el contenido de clorofila “a” y su relación con el nitrógeno, fósforo y otros parámetros fisicoquímicos (Morán-Silva et al., 2005; De la Lanza-Espino, 2017). Sin embargo, los estudios sobre composición planctónica en lagunas costeras del Golfo de México son escasos, a pesar de que la complejidad natural de las cadenas tróficas entre la comunidad del fitoplancton y zooplancton es de interés para la comunidad científica (Murrell y Lores, 2004).
Margalef (1975) reportó por primera vez la productividad primaria y composición fitoplanctónica del SLA, mencionando dominancia de fitoplancton marino a mesohalino excepto donde desemboca el río Papaloapan. Además, reportó algunos géneros zooplanctónicos como el copépodo Acartia sp., los cladóceros Bosmina sp. y Ceriodaphnia sp., y el rotífero Testudinella sp. También, Álvarez-Silva y Gómez-Aguirre (2000) analizaron copépodos en seis lagunas costeras del Golfo de México incluyendo 13 especies para el SLA, siendo las más comunes Acartia lilljeborgii, Acartia tonsa, Pseudodiaptomus pelagicus y Temora turbinata. Sin embargo, la información planctónica del SLA está limitada a los estudios mencionados. El conocimiento sobre la variación en la composición de la comunidad zooplanctónica es fundamental, pues está vinculada con la transferencia de materia y energía entre microorganismos y los siguientes niveles tróficos en ecosistemas acuáticos (Murrell y Lores, 2004; Jeyaraj et al., 2014; Pérez-Legaspi et al., 2015, 2019; Rico-Martínez et al., 2016). Entre los grupos más abundantes en sistemas lagunares estuarinos se encuentran los copépodos y rotíferos (Pantaleón-López et al., 2005; Almeida et al., 2012; Jeyaraj et al., 2014). Mientras que los cladóceros son considerados componentes esenciales en lagos dulceacuícolas (Dodson y Hanazato, 1995; José de Paggi et al., 2012; Pérez-Legaspi et al., 2015), su presencia es rara en zonas tropicales y subtropicales con pocas especies representativas (Villalobos y González, 2006), siendo típicamente pequeñas y poco abundantes (José de Paggi et al., 2012).
Los rotíferos pueden encontrarse en ambientes acuáticos marinos, dulceacuícolas y salobres (Pennak, 1989, Wallace et al., 2006; Rico-Martínez et al., 2016); su importancia en ecosistemas acuáticos reside en conseguir altas densidades poblacionales en poco tiempo, alcanzando a dominar la producción de la comunidad planctónica (Wallace et al., 2006; José de Paggi et al., 2012; Rico-Martínez et al., 2016). La diversidad funcional de rotíferos es mayor que otros grupos del zooplancton debido a su amplio rango de alimentación donde su papel ecológico puede ser más importante por su tasa de filtración (José de Paggi et al., 2012), siendo pieza clave entre la comunidad microbiana y niveles tróficos superiores. Los rotíferos son capaces de colonizar hábitats rápidamente y convertir la productividad primaria en una forma aprovechable para los consumidores secundarios, haciendo disponible su energía para los siguientes niveles tróficos (Wallace et al., 2006; Rico-Martínez et al., 2016). Además, por su pequeño tamaño e impermeabilidad del integumento son susceptibles a cambios físicos y químicos (Nogrady et al., 1993; Pérez-Legaspi y Rico-Martínez, 1998; Moha-León et al., 2015; Rico-Martínez et al., 2016). Su composición, abundancia, riqueza y distribución está influenciada por diversos factores ambientales (Zanatta et al., 2007; Medeiros et al., 2010; José de Paggi et al., 2012; Keppeler et al., 2018); lo que puede influir en la estructura y funcionamiento del ecosistema. Por tanto, los datos obtenidos de este estudio contribuyen con información nueva del zooplancton presente en el SLA con énfasis sobre variación estacional en la diversidad, distribución y estructura de comunidades de rotíferos del SLA, considerando la influencia de algunos factores físicos y químicos.
MATERIALES Y MÉTODOS
Área de estudio. El Sistema Lagunar de Alvarado se localiza en la línea costera del sureste de Veracruz, México; al suroeste del Golfo de México (Fig. 1), (18º46’ - 18º42’N y 95º34’ - 95º58’W), tiene una profundidad promedio de 2.5 m y salinidad promedio de 7.5 ups (De la Lanza-Espino y Lozano, 1999; Morán-Silva et al., 2005; Moha-León et al., 2015; De la Lanza-Espino, 2017). La región tiene una temperatura media anual de 18 - 26 ºC y está influido por tres épocas climáticas: lluvias (junio-septiembre), nortes (octubre-febrero) y secas (marzo-junio) (Morán-Silva et al., 2005). El SLA está formado por una gran laguna central denominada Alvarado (4.5 m de profundidad máxima), conectada con las lagunas Buen País, Camaronera y Tlalixcoyan; aunque presenta diversos cuerpos acuáticos pequeños y zonas inundables. Este sistema lagunar desemboca hacia el mar, aunque recibe agua dulce de los ríos Papaloapan, Blanco, El Limón, Acula y Camarón (De la Lanza-Espino y Lozano, 1999; Morán-Silva et al., 2005; Calva-Benítez y Torres-Alvarado, 2011; De la Lanza-Espino, 2017). El SLA está clasificado como oligohalino (0 - 3.8 ups) durante temporada de lluvias por la influencia de los ríos y mesohalino durante nortes (0 - 11.5 ups) y secas (0 - 14.5 ups). Esta clasificación de mesohalino a oligohalino se atribuye a la influencia de los ríos (De la Lanza Espino y Lozano, 1999; De la lanza Espino, 2017), con tendencia a la heterotrofia (De la lanza Espino, 2017).
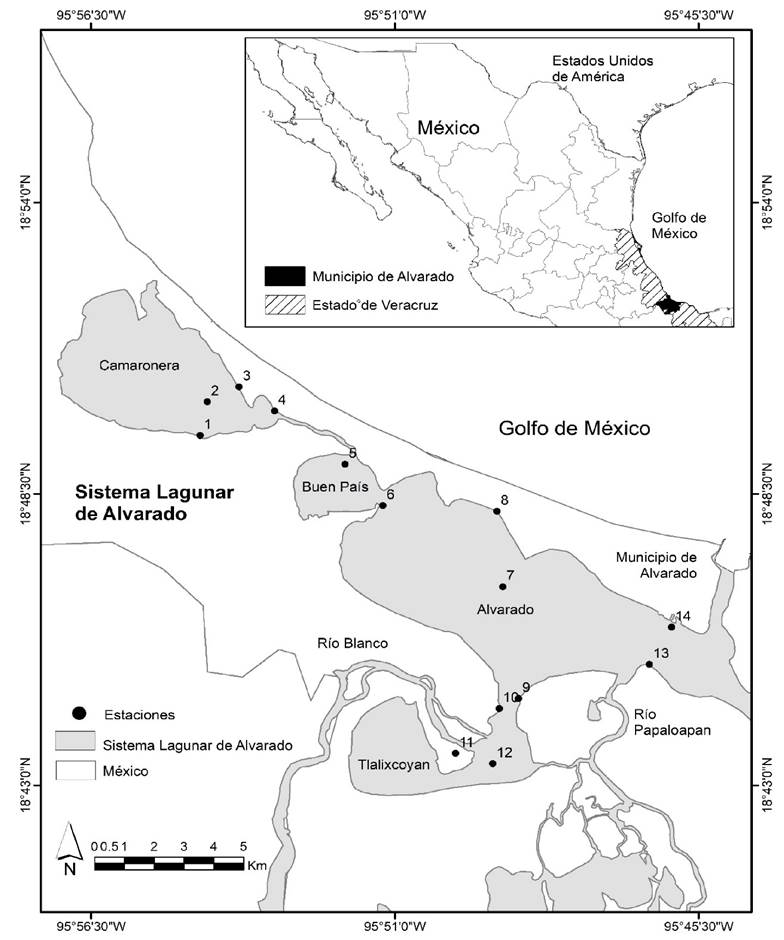
Figura 1 Localización de los sitios de recolecta (•) en el Sistema Lagunar de Alvarado, Veracruz, México. Zonas: Norte (1 - 4), Centro (5 - 8), Interior (9 - 12) y Sur (13 y 14).
El gradiente de salinidad en el SLA va desde la entrada de la laguna de Alvarado hasta laguna Camaronera y de la conexión de la laguna hacia las áreas de descarga de los ríos Papaloapan y Acula (Morán-Silva et al., 2005). Con base en este gradiente, se identificaron cuatro zonas: 1) Norte “N” comprendiendo estaciones 1, 2, 3 y 4 localizadas en lagunas Camaronera; 2) Centro “C” correspondiente a estaciones 5, 6, 7 y 8 localizadas en laguna de Alvarado y Buen País; 3) Interior “I” con estaciones 9, 10, 11 y 12 comprendiendo zona donde influyen los ríos (Blanco y Papaloapan) en dirección hacia la laguna Tlalixcoyan; 4) Sur “S” correspondiente a estaciones 13 y 14 cerca de la boca de la laguna de Alvarado.
Colecta de campo. Se tomaron muestras en el SLA durante un ciclo de ocho meses (septiembre 2017 a mayo 2018), comprendiendo épocas climáticas: secas, lluvias y nortes. Se registró la ubicación geográfica de 14 estaciones mediante un Sistema de Posicionamiento Global o GPS (Garmin eTrex®10) (Fig. 1). Las muestras de zooplancton se obtuvieron filtrando 100 L de agua a través de una red zooplanctónica tipo Wisconsin de 53 µm de apertura de malla, concentrando cada muestra en 100 mL, éstas fueron fijadas y preservadas con formalina al 4%. También, se registraron los parámetros fisicoquímicos del agua “in situ”: transparencia (turbidez), salinidad, temperatura y pH utilizando un disco de Secchi, un refractómetro portátil (ATAGO® Master-S/MillM), y un potenciómetro portátil (HANNA pH 211), respectivamente.
Análisis. Las muestras de zooplancton se trasladaron al laboratorio donde fueron separadas a nivel de grupos y de orden cuando fue posible, con ayuda de un microscopio estereoscópico (Stemi DV4 Zeiss) y un microscopio óptico (Primo Star Zeiss). Los rotíferos de la muestra fueron separados y se identificaron a nivel de especie usando claves taxonómicas (Segers, 1995a, 1995b; Nogrady y Pourriot, 1995; De Smet, 1996, 1997; Pourriot, 1997). A pesar de que el objeto de este estudio es el grupo de los rotíferos, se encontraron cladóceros que pudieron identificarse a nivel de especie mediante las claves taxonómicas de Elías-Gutiérrez et al. (2008). Para determinar la similitud en la composición biológica de las diferentes zonas del SLA se realizó un análisis de conglomerados entre estaciones de muestreo de las 4 diferentes zonas usando el algoritmo de similitud de Bray-Curtis y el método de unión simple o vecino más cercano, utilizando el programa Past 4.05 (Hammer et al., 2001).
El análisis de diversidad de rotíferos se realizó mediante el software EstimateS 9.1.0 (Colwell, 2013). Se calculó el índice de Diversidad de Shannon - Weiner y el número de especies efectivas o “diversidad verdadera” que se basa en los Números de Hill que son la diversidad de orden 0 (q0) que es igual a la riqueza de especies; diversidad de orden 1, que es el exponencial de la entropía del índice de Shannon (q1); y la diversidad de orden 2, que es el inverso del índice de Simpson (q2). El número efectivo de especies se postula como la mejor manera de describir la diversidad de una comunidad ecológica y compararla con otras comunidades (Jost, 2006; Moreno et al., 2011). Se analizaron diferencias entre estimadores de diversidad verdadera en las tres temporadas: si una comunidad 1 tiene una diversidad D1 mayor que la diversidad D2 de la comunidad 2, entonces la comunidad 1 tendrá D1/ D2 veces más diversidad que la comunidad B.
Por su parte, para determinar el efecto de las variables ambientales en la distribución de las especies de rotíferos se transformaron las variables fisicoquímicas y los datos de abundancias usando log(x+1) y se realizó un análisis de correspondencia canónico (ACC) usando el software Past 4.05 (Hammer et al., 2001).
RESULTADOS
El análisis de parámetros fisicoquímicos en las zonas de muestreo del SLA, presenta gradientes de salinidad que disminuyen desde laguna Camaronera (zona “N”) hacia el centro en laguna de Alvarado (zona “C”) hasta zonas con baja salinidad (< 4) en la boca de la laguna de Alvarado (zona “S”) y en la zona interior (zona “I”); esto asociado con el aporte de agua dulce por descarga de los ríos (Fig. 1). En temporada de lluvias el SLA presenta salinidades menores a 2 ups, una mayor transparencia 38.3 ± 17.68 cm. La temperatura promedio del SLA fue de 28 ± 2 ºC, disminuyendo en temporada de nortes hasta 20 ºC. El pH se mantuvo con valores de 7 y 8 durante todo el año, registrando los valores más bajos en la zona “N” (Fig. 2). Se registraron 18 órdenes de organismos en las muestras de zooplancton pertenecientes a 6 grupos taxonómicos. Los más abundantes son copépodos, rotíferos, moluscos y cladóceros. También, se registraron estadios larvales de los artrópodos Copépoda, Diptera, Ephemeroptera; anélidos Polychaeta y moluscos Ostreoida (Tabla 1). Aunque no son el objetivo de este estudio, se identificaron cladóceros como: Ceriodaphnia cornuta, Moina micrura, Leberis davidi e Ilyocryptus agilis ya que no existe registro previo para el SLA (Tabla 2). Se identificaron 24 especies de rotíferos pertenecientes a 12 familias. En temporada de lluvias las familias presentes en el SLA fueron Brachionidae, Dicranophoridae, Euchlanidae, Lecanidae, Trichocercidae, Hexarthridae, Trochospheridae y Philodinidae. En nortes, Brachionidae y Asplachnidae. En secas Brachionidae, Proalidae y Euchlanidae (Tabla 3). La temporada con mayor riqueza de especies y abundancia fue lluvias, seguida de nortes y secas. Las especies de rotíferos presentes todo el año en el SLA son Brachionus plicatilis y B. falcatus. El rotífero Asplachna sp., se observa todo el año en diferentes zonas del SLA. Durante lluvias, la distribución de rotíferos en el SLA muestra que B. rubens, B. plicatilis, Filinia sp. y Euchlanis sp., está influida por la salinidad y pH; así como B. quadridentatus en menor grado. El rotífero B. falcatus es mayormente influido por la temperatura, mientras que B. caudatus por la transparencia. Encentrum uncinatum y Hexarthra sp., están parcialmente influidos por la temperatura. En nortes, la distribución de B. plicatilis es afectada por la salinidad y transparencia, mientras que B. angularis por la transparencia. Philodina sp. y Asplachna sp., son afectadas por la temperatura y pH. En secas, B. plicatilis y B. rubens son afectados por la salinidad y transparencia, mientras que Euchlanis sp. y P. gammari por la transparencia y pH, donde el pH influye principalmente sobre K. americana, Philodina sp., E. uncinatum, B. caudatus, B. angularis y B. falcatus. El análisis de diversidad de rotíferos usando estimadores de diversidad verdadera q0, q1 y q2 se muestran en la Tabla 4. La mayor riqueza de especies q0 se observa en temporada de lluvias, donde la zona “Sur” y la estación 12 zona “Interior” tienen más especies. A partir del análisis de diferencias entre números efectivos de especies por temporada, en lluvias hay mas especies que en nortes (q1L/q1N) en el centro (estación 8) con 3.5 veces, interior (3.4 - 3.7 veces) y sur (3.9 - 4.0 veces); donde la zona “S” tiene mayor diversidad con 3.9 y 4 veces más especies. En secas hay mas especies que en nortes (q1S/q1N) en el interior y sur, donde el centro tiene la mayor diversidad con 3.8. El número de especies para q2 es mayor en lluvias que en nortes (q2L/q2N) para la zona “I” con 3.2 y 3.4 veces más, seguida de la zona “I” y la estación 8 de la zona “C”; donde éste sitio también muestra 3.4 veces más especies en secas que en nortes (q2S/q2N) seguida de las zonas “I” y “S” (Tabla 4).
Tabla 1 Zooplancton en el Sistema Lagunar de Alvarado, Veracruz, México. Los valores representan el número de individuos por temporada.
| Taxa | Lluvias | Nortes | Secas | Taxa | Lluvias | Nortes | Secas |
| Sarcomastigophora | Arthropoda | ||||||
| Clase: Granuloreticulosea | Clase Maxillopoda. Subclase Copepoda | ||||||
| Orden Foraminiferida | 195 | 110 | 94 | Copepoditos* | 13,498 | 7,486 | 10,948 |
| N: | 195 | 110 | 94 | Orden Calanoida | 4,204 | 10,970 | 3,984 |
| Rotifera | Orden Cyclopoida | 928 | 420 | 772 | |||
| Clase: Eurotatoria. Subclase Monogononta | Orden Syphonostomatoida | 1 | - | - | |||
| Orden Ploima | 12,314 | 415 | 2,182 | ||||
| Orden Flosculariaceae | 11,551 | 3 | 6 | Clase Branchiopoda. Subclase Cladocera | |||
| Subclase: Bdelloidea | Orden Anomopoda | 854 | 10 | 46 | |||
| Orden Philodinida | 4,369 | 2 | 12 | ||||
| N: | 28,234 | 420 | 2,200 | Clase Ostracoda | |||
| Annelida | Orden podocopida | 229 | 70 | 203 | |||
| Clase Polychaeta | |||||||
| Subclase Palpata* | 151 | 209 | 401 | Clase Malacostraca | |||
| N: | 151 | 209 | 401 | Orden Amphipoda | 8 | 14 | 3 |
| Clase Clitellata | Orden Isopoda | 1 | - | 2 | |||
| Subclase Oligochaeta | 3 | 3 | 3 | Orden Decapoda | 20 | 15 | 9 |
| N: | 154 | 212 | 404 | ||||
| Nematoda | Clase Insecta | ||||||
| Clase Chromadorea | 180 | 470 | 1,364 | Orden Diptera* | 27 | 14 | 4 |
| N: | 180 | 470 | 1,364 | Orden Ephemeroptera* | 11 | 19 | - |
| Mollusca | N: | 19,781 | 19,018 | 15,971 | |||
| Clase: Bivalvia. Superorden Filibranchia (Pteriomorphia) | |||||||
| Orden Ostreoida* | 10,094 | 94 | 594 | ||||
| Superorden Eulamellibranchia (Heterodonta) | |||||||
| Orden Veneroida | - | 1 | 617 | ||||
| Clase: Gastropoda. Subclase: Prosobranchia | |||||||
| Orden Mesogastropoda | - | 1 | - | ||||
| Subclase: Caenogastropoda | |||||||
| Orden Littorinimorpha | 83 | 37 | 161 | ||||
| N: | 10,177 | 133 | 1,372 |
* Estadios larvales; N = Número total de organismos.
Tabla 2 Cladóceros presentes en el Sistema Lagunar de Alvarado, Veracruz, México. Los valores representan el número de individuos por temporada.
| Lluvias | Nortes | Secas | |
|---|---|---|---|
| Ceriodaphnia cornuta Sars, 1885 | 168 | 1 | 6 |
| Moina micrura Kurz, 1875 | 565 | 9 | 40 |
| Leberis davidi Richard, 1895 | 121 | - | - |
| Ilyocryptus agilis Kurz, 1878 | 1 | - | - |
| N: | 855 | 10 | 46 |
Tabla 3 Distribución estacional de rotíferos en diferentes zonas del Sistema Lagunar de Alvarado, Veracruz, México.
| Familia | Género/especie | Lluvias 2017 | Nortes 2018 | Secas 2018 | |||||||||||
| N | C | I | S | N | C | I | S | N | C | I | S | ||||
| Brachionidae | Brachionus plicatilis Muller, 1786 | + | + | + | + | + | + | + | + | + | + | + | + | ||
| Brachionus rubens Ehrenberg, 1838 | + | + | + | + | + | + | + | + | + | + | + | + | |||
| Brachionus quadridentatus Hermann, 1783 | + | + | + | + | + | + | + | + | |||||||
| Brachionus falcatus Zacharias, 1898 | + | + | + | + | + | ||||||||||
| Brachionus caudatus Barrois y Daday, 1894 | + | + | + | + | + | + | + | ||||||||
| Brachionus angularis Goose, 1851 | + | + | + | + | + | + | |||||||||
| Brachionus havanaensis Rousselet, 1911 | + | + | + | + | + | ||||||||||
| Keratella americana Carlin, 1943 | + | + | + | + | + | + | + | + | + | ||||||
| Platyias quadricornis Ehrenberg, 1832 | + | + | + | + | |||||||||||
| Asplanchnidae | Asplanchna sp. | + | + | + | + | + | + | + | + | + | + | ||||
| Dicranophoridae | Encentrum uncinatum Milne, 1886 | + | + | + | + | + | |||||||||
| Epiphanidae | Epiphanes sp. | + | + | + | |||||||||||
| Proalidae | Proales baradlana Varga, 1958 | + | + | + | + | + | |||||||||
| Proales gammari Plate, 1886 | + | + | + | + | |||||||||||
| Proales theodora Gosse, 1887 | + | + | + | + | + | ||||||||||
| Euchlanidae | Euchlanis sp. | + | + | + | + | + | + | + | + | ||||||
| Lecanidae | Lecane sp. | + | + | + | + | + | + | + | + | ||||||
| Lecane quadridentata Ehrenberg, 1830 | + | + | + | + | |||||||||||
| Notommatidae | Cephalodella sp. | + | + | + | |||||||||||
| Notommata sp. | + | ||||||||||||||
| Trichocercidae | Trichocerca sp. | + | + | + | + | + | + | + | + | ||||||
| Hexarthridae | Hexarthra sp. | + | + | + | + | + | + | ||||||||
| Trochosphaeridae | Filinia sp. | + | + | + | + | + | + | ||||||||
| Bdelloidea | Philodina sp. | + | + | + | + | + | + | + | + | + | |||||
Nota: N=Zona Norte, C=Centro del Sistema Lagunar, I=Interior, Sur=Sur (Boca del Sistema Lagunar).
Tabla 4 Análisis de diversidad de rotíferos del Sistema Lagunar de Alvarado, Veracruz, México (septiembre 2017 a mayo 2018). Números efectivos de especies, donde q0 es la riqueza de especies observadas, q1 es el exponencial de la entropía del índice de Shannon y q2 es el inverso del índice de Simpson. Se muestra el cálculo de las diferencias de los números efectivos entre lluvias y nortes (qL/qN), y entre secas y nortes (qS/qN). Los valores obtenidos representan cuantas veces más especies hay en una temporada que en otra.
| q0 | q1 | q2 | Diferencias de números efectivos de especies | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Estación | Zona | Lluvias | Nortes | Secas | Lluvias | Nortes | Secas | Lluvias | Nortes | Secas | q1L/q1N | q1S/q1N | q2L/q2N | q2S/q2N |
| 1 | Norte | 8 | 1 | 5 | 2.4 | 1.0 | 2.5 | 1.7 | 1.0 | 2.2 | 2.4 | 2.5 | 1.7 | 2.2 |
| 2 | Norte | 12 | 5 | 5 | 1.9 | 2.0 | 2.2 | 1.4 | 1.5 | 1.9 | 1.0 | 1.1 | 1.1* | 1.3 |
| 3 | Norte | 6 | 3 | 4 | 1.9 | 1.9 | 2.3 | 1.4 | 1.4 | 2.0 | 1.0 | 1.2 | 1.0 | 1.4 |
| 4 | Norte | 11 | 1 | 6 | 2.3 | 1.9 | 2.6 | 1.5 | 1.4 | 2.2 | 1.2 | 1.3 | 1.1 | 1.6 |
| 5 | Centro | 9 | 2 | 7 | 2.4 | 1.2 | 3.4 | 1.6 | 1.1 | 2.8 | 1.9 | 2.8 | 1.4 | 2.6 |
| 6 | Centro | 12 | 2 | 6 | 2.5 | 1.2 | 3.5 | 1.6 | 1.1 | 2.9 | 2.0 | 2.8 | 1.5 | 2.7 |
| 7 | Centro | 6 | 3 | 11 | 2.5 | 1.3 | 3.8 | 1.6 | 1.1 | 3.0 | 1.9 | 2.9 | 1.5 | 2.7 |
| 8 | Centro | 17 | 2 | 5 | 4.6 | 1.3 | 5.0 | 2.6 | 1.1 | 3.9 | 3.5 | 3.8 | 2.4 | 3.4 |
| 9 | Interior | 15 | 2 | 5 | 5.1 | 1.5 | 5.1 | 2.9 | 1.2 | 4.0 | 3.4 | 3.5 | 2.4 | 3.3 |
| 10 | Interior | 17 | 3 | 7 | 5.7 | 1.5 | 5.2 | 3.3 | 1.2 | 4.0 | 3.8 | 3.5 | 2.7 | 3.3 |
| 11 | Interior | 13 | 5 | 5 | 6.2 | 1.7 | 5.3 | 3.5 | 1.3 | 4.0 | 3.6 | 3.0 | 2.7 | 3.1 |
| 12 | Interior | 21 | 8 | 1 | 6.9 | 1.9 | 5.3 | 3.9 | 1.4 | 4.0 | 3.7 | 2.8 | 2.9 | 3.0 |
| 13 | Sur | 20 | 4 | 13 | 7.3 | 1.9 | 5.6 | 4.3 | 1.4 | 4.2 | 3.9 | 3.0 | 3.2 | 3.1 |
| 14 | Sur | 22 | 4 | 13 | 8.0 | 2.0 | 6.2 | 4.9 | 1.4 | 4.4 | 4.0 | 3.1 | 3.4 | 3.1 |
*Sólo para este caso el número efectivo de especies de orden 2 es mayor en secas que en nortes, por lo que esta celda se calculó como q2N/q2L.
Figura 2 Registro anual de los parámetros fisicoquímicos en el Sistema Lagunar Alvarado por temporada y sitio de colecta: a) Temperatura, b) pH, c) Salinidad, d) Transparencia.
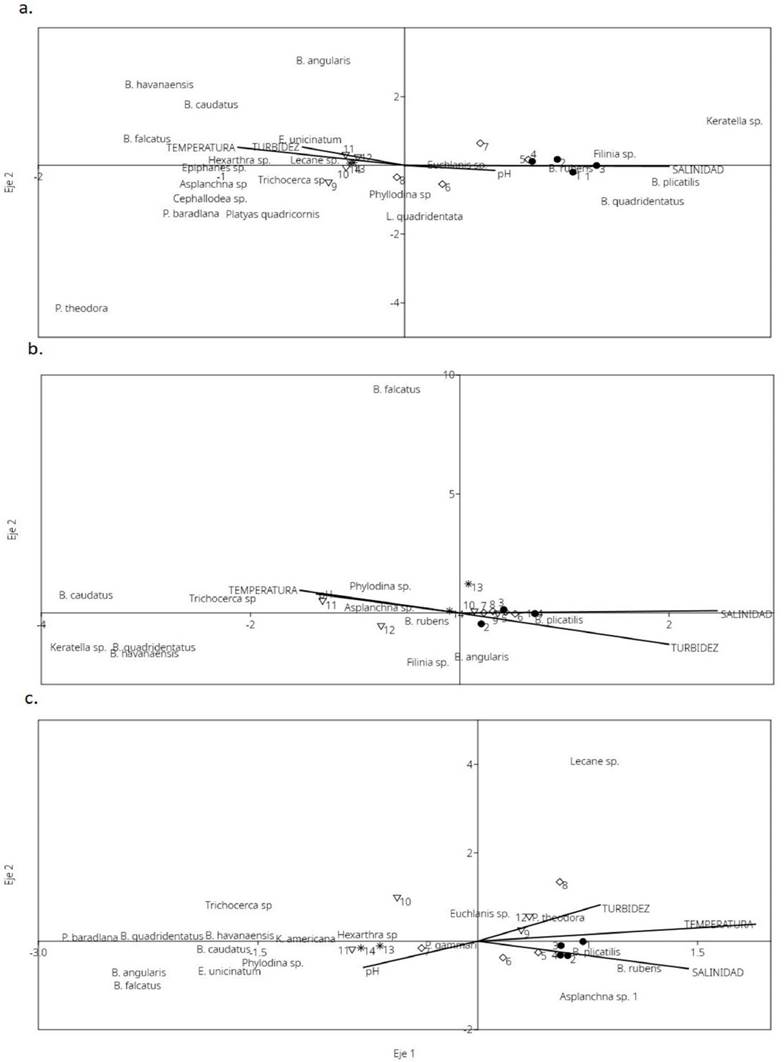
El análisis de conglomerados por temporada muestra similitud en la composición biológica entre estaciones de diferentes zonas del SLA. En lluvias el dendrograma con corte a 30 %, muestra 2 grupos (Fig. 3a): 1) Estaciones 9 a 14 que corresponden a zonas “I” y “S”, las cuales están bajo influencia de los ríos en esta temporada; 2) Estaciones 1,3, 4 y 5 de zonas “N” y “C”, respectivamente. Las estaciones 7 y 8 de la zona “C”, se mantienen como grupos externos. En nortes, el dendrograma con corte al 50% muestra 4 grupos: 1) Estación 5 y 9 de zonas “C” e “I”; 2) Estaciones 2 y 3 zona “N”, 7 y 8 zona “C”, 10 y 12 zona “I” y 13 y 14 zona “S”; 3) Estación 11 de la zona “I”; 4) Estación 1 y 4 “N” (Fig. 3b). En secas, el dendrograma con corte al 25%, muestra 2 grupos y 3 estaciones no agrupadas: 1) Estación 9 y 12 de zona “I”; 2) Estaciones 1 a 4 de la zona “N”, 5 a 7 zona “C” y estaciones 13 y 14 de zona “S”. Las estaciones 10, 11 y 8 de las zonas “I” y “C” no se parecen en la composición biológica a otras estaciones (Fig. 3c).
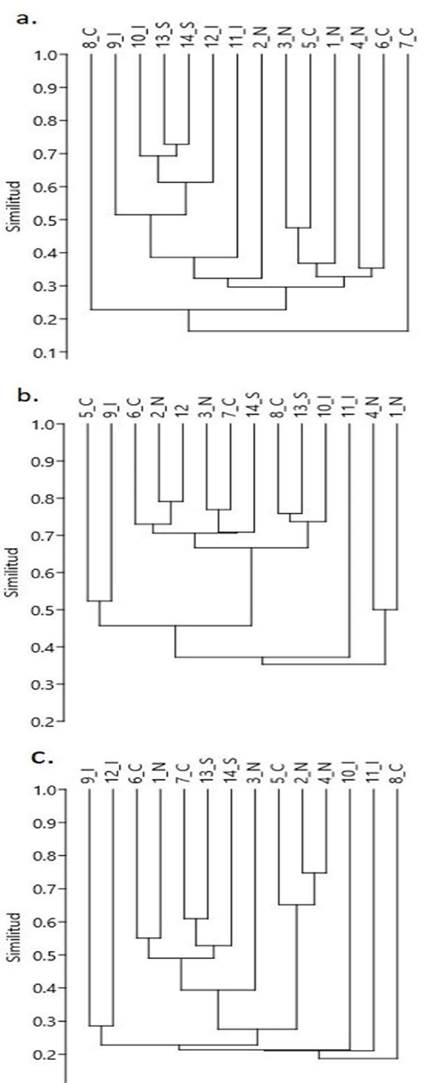
Figura 3 Análisis de conglomerados por temporada por método de unión simple y algoritmo de unión de Bray Curtis. a) Lluvias, b) Nortes, c) Secas. Los números representan las estaciones de muestreo y las letras las zonas en el SLA.
El análisis de correspondencia canónica (ACC) en lluvias muestra eigenvalores de los ejes 1 y 2 con el 95.8%, estos ejes fueron de 0.187 y 0.034, y explican el 81 % y 14.83 % de la variabilidad acumulativa especies-ambiente; respectivamente (Fig. 4a). En nortes, el ACC muestra eigenvalores de 0.195 y 0.10 para los ejes 1 y 2, que corresponden a 54.37 % y 28.49 % de la variabilidad especies ambiente (Fig. 4b). En secas, el ACC muestra que los primeros dos ejes explican el 83.76 % de la variabilidad especies-ambiente con eigenvalores de 0.25 y 0.095 para los ejes 1 y 2, explicando el 61.27 % y 22.49% de la variabilidad (Fig. 4c).
DISCUSIÓN
En este estudio se confirma el gradiente de variación de salinidad en el SLA, comprendiendo desde laguna Camaronera hacia el acceso a la laguna de Alvarado e interior, observando fuerte influencia de los ríos. Los rangos de variación de salinidad confirman que en temporada de lluvias es oligohalino en las zonas “Interior” y “Sur” coincidiendo con Morán-Silva et al. (2005). También, durante nortes, la baja profundidad de la laguna junto con las rachas de viento genera una zona de mezcla, condición que fue confirmada por el análisis de conglomerados durante el cual se forman dos grupos de composición biológica similar y solo tres estaciones que no se agrupan y corresponden a zonas donde hay mayor influencia por la descarga de los ríos en la zona “Interior” (11 y 12) y “Sur” (13 y 14). En temporada de secas, la laguna es predominantemente mesohalina, coincidiendo con Morán-Silva et al. (2005). Por tanto, el SLA presenta gradientes de oligohalino a mesohalino con poca influencia del mar, coincidiendo con Margalef (1975), De la Lanza Espino y Lozano (1999) y Morán-Silva et al. (2005). En este sistema lagunar ocurren variaciones de salinidad estacionales, siendo común observar estos gradientes en estuarios (Morán-Silva et al., 2005; De la Lanza-Espino, 2017). Las características hidrobiológicas del SLA muestran una tendencia a mesohalino durante secas y cambiando a dulceacuícola en temporada de lluvias (Villalobos et al., 1975; Morán-Silva et al., 2005).
Se observó una mayor diversidad de rotíferos en el SLA durante las lluvias. En esta temporada, los aportes fluviales y pluviales disminuyen la transparencia, aumentan la transparencia por turbulencia, suspensión y acarreo de sedimentos finos de limos, arcillas y materia orgánica (Calva-Benítez y Torres-Alvarado, 2011; De la lanza Espino, 2017). Este patrón es constante en lagunas costeras, donde la mayor diversidad ocurre durante lluvias, por la mezcla de corrientes, que incrementan la disponibilidad nutrientes (Almeida et al., 2012; Jeyaraj et al., 2014). Entre los organismos más representativos encontrados en el zooplancton del SLA se observa que la mayor proporción corresponde a rotíferos seguido de copépodos, copepoditos, moluscos bivalvos en estadios larvales y cladóceros. Es común encontrar copepoditos en humedales costeros con gradientes de salinidad, indicando la continua reproducción de copépodos. Sin embargo, su tipo de reproducción y duración del ciclo de vida limitan su población en comparación con otros grupos (Iannacone y Alvariño, 2007). Los cladóceros y rotíferos tienen ciclos de vida cortos con altas tasas reproductivas debido a que su reproducción asexual les permite colonizar nichos eficientemente (Dodson y Hanazato, 1995; Wallace et al., 2006; Rico-Martínez et al., 2016; Pérez-Legaspi et al., 2017). Aunque los cladóceros son poco frecuentes en zonas tropicales, es posible encontrar especies como Moina micrura, Diaphanosoma excisum y Ceriodaphnia cornuta debido a su amplia distribución y abundancia (Villalobos y González, 2006). En este estudio se encontraron cuatro nuevos registros de cladóceros (Tabla 2) para el SLA durante lluvias los cuales se asocian con la disminución en salinidad; Margalef (1975) reportó solo el género Ceriodaphnia en invierno no obstante ahora se confirma que corresponde a la especie cornuta para este sistema tropical, coincidiendo con Villalobos y González (2006).
En este estudio, los rotíferos fueron el grupo más abundante del mismo modo que para otros sistemas tropicales y subtropicales (Iannacone y Alvariño, 2007; Zanatta et al., 2007). La riqueza, abundancia y distribución de rotíferos está determinada por factores bióticos y abióticos que influyen en su dinámica poblacional (Zanatta et al., 2007; José de Paggi et al., 2012). Su distribución se asocia con la disponibilidad del alimento, presencia o ausencia de depredadores y competidores que pueden influir más que algunos parámetros como el oxígeno disuelto y temperatura (Zanatta et al., 2007). Esta disponibilidad de nutrientes influye en la composición de productores primarios y a su vez en la dinámica de los siguientes niveles tróficos (Murrell y Lores, 2004).
Entre los rotíferos, la familia más común en el SLA durante todo el año correspondió a la familia Brachionidae coincidiendo con Zanatta et al. (2007) para la laguna tropical la Escondida, Veracruz, México. Rotíferos de las familias Trochosphaeridae y Philodinidae se observaron durante lluvias y nortes. Entre las familias de rotíferos más comunes en ambientes tropicales se mencionan a Brachionidae, Lecanidae y Trichocercidae para quienes su distribución y abundancia depende de las lluvias (Iannacone y Alvariño, 2007; José De Paggi et al., 2012; Keppeler et al., 2018). En este estudio, se observaron rotíferos típicos de aguas cálidas, tropicales y subtropicales de ambientes oligo a mesotróficos de agua suave, ligeramente ácida como los miembros de la familia Lecanidae (Segers, 2008); rotíferos que prefieren ambientes alcalinos y condiciones eutróficas como la familia Brachionidae, entre quienes destaca el rotífero eurihalino cosmopolita B. plicatilis, el cual presenta máximo crecimiento en salinidades moderadas (Moha-León et al., 2015), así como B. quadridentatus típico de zonas litorales dulceacuícolas y salobres (García-Morales y Domínguez-Domínguez, 2019).
La distribución de rotíferos observada en el SLA muestra que los cambios temporales en la estructura de la comunidad de rotíferos están relacionados con las fases hidrológicas y ciclos estacionales, así como preferencias de hábitats presentes en este sistema tropical (Keppeler et al., 2018); es decir, en el SLA existe heterogeneidad de hábitats ocasionada por la transparencia, gradientes de salinidad y temperatura (Morán-Silva et al., 2005; Almeida et al., 2012; Jeyaraj et al., 2014) que junto con la disponibilidad de nutrientes son factores que influyen en la distribución espacial, temporal y abundancia del SLA como parte del ensamble biológico en sistemas estuarinos (Almeida et al., 2012). La dinámica de circulación del SLA está influenciada por las mareas, vientos y baja profundidad de este sistema (Morán-Silva et al., 2005). Por otra parte, en lluvias las estaciones 7 y 8 se separan de los grupos, probablemente debido a que la estación 7 se localiza en el centro de la laguna de Alvarado y la 8 en el margen este de la Laguna de Alvarado, muy cerca de la orilla. La mayoría de los análisis agruparon las estaciones 13 y 14, con características muy similares al igual que las estaciones de la zona “Interior” excepto durante nortes. Estas estaciones tienen una fuerte influencia de la descarga de agua dulce de los ríos en lluvias, lo cual reduce la salinidad e influye en la distribución de los rotíferos de este sistema lagunar concordando con Medeiros et al. (2010).
Es importante conocer la composición y distribución del zooplancton, ya que su monitoreo constante permite conocer el estatus de su biodiversidad e identificar las áreas de productividad para el apropiado manejo del sistema lagunar (Jeyaraj et al., 2014). Estas áreas de productividad son clave, pues influyen en la abundancia y distribución de organismos de interés comercial (Morán-Silva et al., 2005). Entre los rotíferos, la distribución de la familia Brachionidae en el SLA está influenciada por la salinidad y transparencia.
Finalmente, el conocimiento de la composición, distribución, y biodiversidad de rotíferos en el SLA es fundamental para entender su importancia como parte de la comunidad zooplanctónica de las lagunas costeras del Golfo de México.











 text new page (beta)
text new page (beta)