INTRODUCCIÓN
El fitoplancton es un componente fundamental en los ecosistemas acuáticos, son la base de la cadena trófica, transformando la energía solar en energía química y alimento. El zooplancton transfiere esa energía generada por el fitoplancton a los niveles tróficos superiores, de tal modo que es un vínculo entre los productores de energía y los consumidores. Debido a que responden rápidamente a cambios ambientales, estos organismos son importantes indicadores biológicos de la calidad del agua (Jakhar, 2013). Por otro lado, existen grupos taxonómicos, que bajo condiciones favorables son capaces de formar florecimientos o crecimientos algales descontrolados que resultan nocivos. Se predice que los eventos de floraciones microalgales serán más recurrentes debido al calentamiento global (Cantoral-Uriza et al., 2017; Mohapatra, 2018; Gobler, 2020). Las cianobacterias son procariotes fotosínteticos que al formar floraciones pueden liberar metabolitos bioactivos, conocidos como cianotoxinas, dentro de las más estudiadas se encuentran las microcistinas, potentes hepatotóxinas, producidas generalmente por el género Planktothrix spp. (Catherine et al., 2008; Vasas et al., 2013; Mallia et al., 2020).
Es de suma importancia identificar los factores ecológicos asociados y que disparan el inicio de las floraciones, así como su relación con la magnitud del evento. Los cambios en las comunidades microbianas dependen de las especies de algas que compongan las floraciones, de su estadio fisiológico, condiciones ambientales y etapa del florecimiento (Zheng, 2011). En los ecosistemas marinos se ha reportado que el bacterioplancton se incrementa durante las floraciones del fitoplancton (Teeling et al., 2012). Como consecuencia, la estructura de las comunidades microbianas y sus propiedades metabólicas modifican el ecosistema microbiano, ya que la disponibilidad de nutrientes, los compuestos extracelulares, como compuestos orgánicos, y la dinámica de los nichos se verá afectada (Amin et al., 2015). Se han estudiado la dinámica de las redes de microeucariotes y bacterioplancton que operan a lo largo de la formación, duración y colapso de los florecimientos algales (Needham & Fuhrman 2016; Tan et al., 2015). La dinámica microbiana durante el ciclo completo de una floración del dinoflagelado Alexandrium catenella en un ecosistema marino se ha documentado, y los grupos taxonómicos de bacterias, arqueobacterias y microeucariotes asociados fueron identificados y se establecieron interacciones positivas y negativas entre ellos (Zhou et al., 2018). Por otro lado, en un sistema lacustre se determinaron redes de co-ocurrencia entre comunidades procariotes y eucariotes durante una floración de Synechococcus (Mikhailov et al., 2018).
Se han registrado florecimientos algales nocivos en las costas de México, específicamente en la costa occidental de la península de Baja California, el Golfo de California, el Pacífico Oriental, Golfo de México y el Caribe Mexicano, sin embargo, los estudios en aguas continentales e interiores son escasos (García-Mendoza et al., 2016). Los florecimientos cianoalgales tóxicos interiores en México reportados han sido en la cuidad de México (CDMX) (Lago del bosque Chapultepec, Lago de Xochimilco, Lago de Teozomoc, Alameda Oriente, Cuemanco y Tlameleca); Estado de México (Reservorios de Valle de Bravo e Ignacio Ramírez, Sistema Lerma-Chapala, Zumpango, Laguna Atotonilco y Ciénega Chica); Michoacán (Lago de Pátzcuaro); Quintana Roo (Akumal, Cenote Uxuxubi) (Pérez-Morales, et al., 2016; Hernández-Terrones et al., 2016; Cantoral-Uriza et al., 2017). Entre las consecuencias de su aparición está la alteración de los patrones naturales de sucesión del fitoplancton, lo que disminuye la diversidad y modifica las interacciones entre las comunidades microbianas (Cantoral-Uriza et al., 2017; Amorim & Moura, 2021).
El objetivo de este estudio fue explorar mediante análisis metagenómicos, cuáles son los grupos taxonómicos presentes durante una floración cianobacterial en la presa “El Palote”, con el propósito de determinar la estructura de las comunidades microbianas que están presentes en el evento.
MATERIALES Y MÉTODOS
Área de estudio
Se estudió una presa de la ciudad de León, Guanajuato, que presentaba el desarrollo de floraciones microalgales. Se colectaron dos muestras el 11 de marzo del 2020, la primera en el embarcadero (E1) a nivel de superficie y la segunda a una profundidad de 2 metros (B2). La ubicación del sitio de toma de la muestra E1 fue 21°10’23.4”N 101°41’05.6”W y de B2 fue 21°10’21.7”N 101°41’17.1”W. Una muestra de un litro de agua de cada sitio fue colectada de acuerdo con el procedimiento establecido por la NOM 003-SEMARNAT-1997, las muestras se almacenaron a 4°C hasta ser procesadas.
Extracción de ADN
Se realizó la extracción de ADN genómico de cada muestra con el kit Quick ADN (Zymo Research) de acuerdo con las instrucciones del fabricante. La cantidad y calidad del ADN se determinó con un fluorómetro Qubit (Thermo Fisher Scientific, Inc., DE. USA), por espectrofotometría en un NanoDrop 1000 (Thermo Fisher Scientific, Inc., DE. USA) y mediante electroforesis en gel de agarosa. Una vez extraído el ADN se almacenó a -80°C hasta el momento de enviar a secuenciar.
Preparación de bibliotecas para secuenciación de las regiones de los genes rDNA 16S y 18S.
El ADN obtenido fue enviado a la empresa Zymo Research (Irvine, CA, Estados Unidos) para la generación de bibliotecas y su secuenciación utilizando el servicio ZymoBIOMICS® de secuenciación dirigida para el análisis de microbioma. Se prepararon un total de 4 bibliotecas, 2 para cada muestra, la primera dirigida para la descripción de procariontes y la segunda a eucariontes utilizando regiones variables de los genes que codifican para las rARN 16S y 18S, respectivamente. Las bibliotecas se prepararon con el kit Quick-16S™ NGS Library Prep (Zymo Research). Los oligonucleótidos utilizados para amplificar la región 16S fueron 341f (CCTACGGGNGGCWGCAG) y 805r (GACTACHVGGGTATCTAATCC), los cuales amplifican la región V3-V4 del gen que codifica la rARN 16S. Durante la preparación de la biblioteca 16S se añadieron bloqueadores de ADN cloroplasmático (Chloroplast pPNA). Para la biblioteca de eucariontes se utilizaron oligonucleótidos, propiedad de Zymo Research, que amplifican la región V9 del gen que codifica la rARN 18S. Una vez generadas las bibliotecas, éstas fueron cuantificadas mediante reacción en cadena de la polimerasa cuantitativa; las cuatro bibliotecas se mezclaron de forma equimolar y la biblioteca final obtenida fue secuenciada utilizando la plataforma MiSeq™ de Illumina® en modo pair end (2x300) utilizando el kit v3 Reagent (600 ciclos).
Procesamiento de las lecturas
Las secuencias de los amplicones fueron inferidas a partir de las lecturas crudas (raw reads) obtenidas, utilizando el pipeline Dada2; para la anotación taxonómica se utilizaron ASV (amplicon sequence variants) (Callahan et al., 2016). Las secuencias quiméricas fueron removidas utilizando el mismo pipeline. La asignación de la composición taxonómica fue realizada con Uclust de Qiime (v.1.9.1) (Caporaso et al., 2010) usando como referencia la base de datos diseñada y curada, propiedad de Zymo Research. Los análisis de diversidad fueron realizados con Qiime utilizando las funciones alpha_diversity.py y beta_diversity.py utilizando los parámetros predeterminados.
Diferencia de abundancias en procariontes
Se analizó si existían diferencias en la abundancia relativa de especies entre las muestras colectadas a nivel de la superficie y a dos metros de profundidad basado en cuantiles. Para esto, se realizó un ranking de la abundancia relativa (obtenida a partir de la cantidad de lecturas o reads) de cada especie, dicho ranking fue transformado en 5 cuantiles. Posteriormente se utilizó la diferencia entre cuantiles de las especies para identificar cambios en las abundancias entre ambas muestras. Se consideraron como especies diferencialmente abundantes cuando existía una diferencia mayor a 2 cuantiles entre E1 y B2.
Diferencia de abundancias a nivel clase en eucariontes
Debido a que la cantidad de grupos taxonómicos eucariontes fue reducida, no fue posible realizar el mismo enfoque basado en cuantiles para determinar cambios en la abundancia relativa de especies entre las dos muestras; además, las regiones secuenciadas resultaron no ser informativas para la identificación a nivel de género o especie en las muestras analizadas. Por lo anterior, se decidió determinar si existían cambios en la abundancia relativa a nivel de clase entre ambas muestras. Para ello se sumaron las abundancias relativas de los miembros de cada clase, y se calculó la diferencia de éstas (entre la muestra colectada en la superficie y la colectada a dos metros de profundidad).
RESULTADOS
Biodiversidad (Diversidad α). Para conocer la diversidad de especies encontradas en la superficie de la presa y a dos metros de profundidad, se determinó el número de especies presentes en la comunidad y la diversidad alfa, para lo cual se calcularon los índices Shannon y Simpson. No se observaron diferencias importantes al comparar la diversidad alfa entre la superficie (E1) y a dos metros de profundidad medida con Shannon (B2) (Tabla 1). El índice Shannon para la diversidad entre las comunidades procariotas (gen rADN 16S) en las muestras E1 y B2 fue de 4.14 y 3.99, respectivamente; mientras que para comunidades eucariotas fue de 5.94 y 5.82. Por el contrario, el índice Simpson presentó para bacterias un valor de 0.773, 0.758; y para eucariotes, 0.96, 096.
Tabla 1 Biodiversidad de la presa “El Palote” mediante el análisis de la diversidad α.
| Gen secuenciado | Ubicación | |||
|---|---|---|---|---|
| Shannon (H´) | Simpson (D) | Especies observadas | ||
| rADN 16S | E1 | 4.142358 | 0.773973 | 277 |
| B2 | 3.996961 | 0.758275 | 289 | |
| rADN 18S | E1 | 5.956750 | 0.960680 | 221 |
| B2 | 5.840736 | 0.961126 | 201 |
E1 = Profundidad cero metros (superficie); B2 = Profundidad de dos metros
Composición taxonómica. Se analizó la composición microbiana a diferentes niveles taxonómicos. Respecto a los filos identificados en la muestra B2, el 0.1% de la composición fueron arqueas pertenecientes al filo Euryarchaeota. Sin embargo, la mayor composición fue de Cyanobacterias con un 68 y 66% en la muestra B2 y E1 respectivamente, seguida por Proteobacterias en un 13.7 y 13%, Bacteroidetes 6 y 8,2%, Actinobacterias 5.4 y 5.5% y Planctomycetes 1.7 y 1.5%, mientras que los otros grupos presentaron menos de 1% de composición (Fig. 1A). A nivel de clase y género, en la composición taxonómica vemos ligeras diferencias entre muestras, lo que es posible apreciar eliminando el grupo mayoritario de cianoabacterias del género Planktothrix (Fig. 1B, 1C).
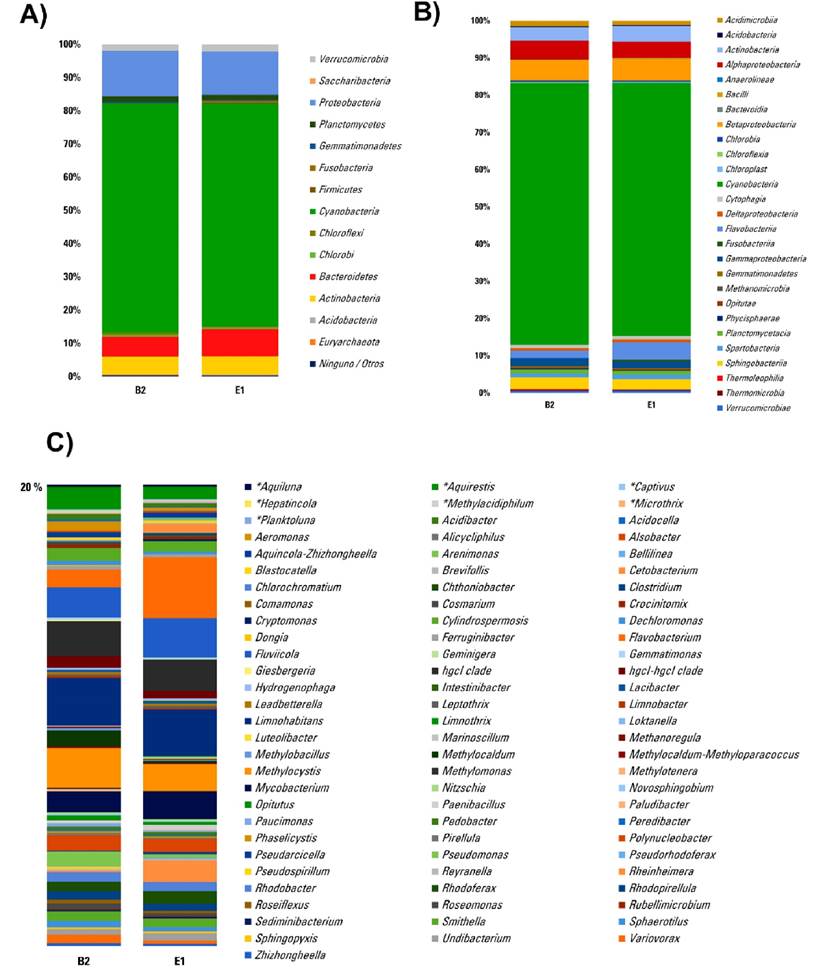
Figura 1 Composición taxonómica relativa de comunidades procariotas de muestras colectadas el 11 de marzo del 2020, E1 a cero metros de profundidad y B2 a dos metros de profundidad. A) A nivel de Filo. B) A nivel de Clase y C) A nivel de género eliminando el grupo dominante Planktothrix agardhii-rubescens.
Respecto a las comunidades eucarióticas, los grupos taxonómicos dominantes identificados a nivel de Supergrupos en E1 y B2 respectivamente fueron Opisthokonta (26 y 30.7%) y Stramenopila, Alveolata y Rhizaria (SAR en conjunto) (24.3 y 23.7%) (Fig. 2A y B). Los miembros de Alveolata fueron el 8.2%, de Cilophora (Ciliates) 3.1%, Dinoflagellata 0.8%, Protalveolata y otros 0.3%. Los miembros de Rhizaria fueron el 1.8% de Cercazoa. Respecto a los Stramenopiles, el 2.1% fueron Bicosoecida, el 1.1% MAST-12, 4.4% de Ochrophyta, 1.8% de Peronosporo mycetes (moho acuático), y 0.3 de otros (Fig. 2C).
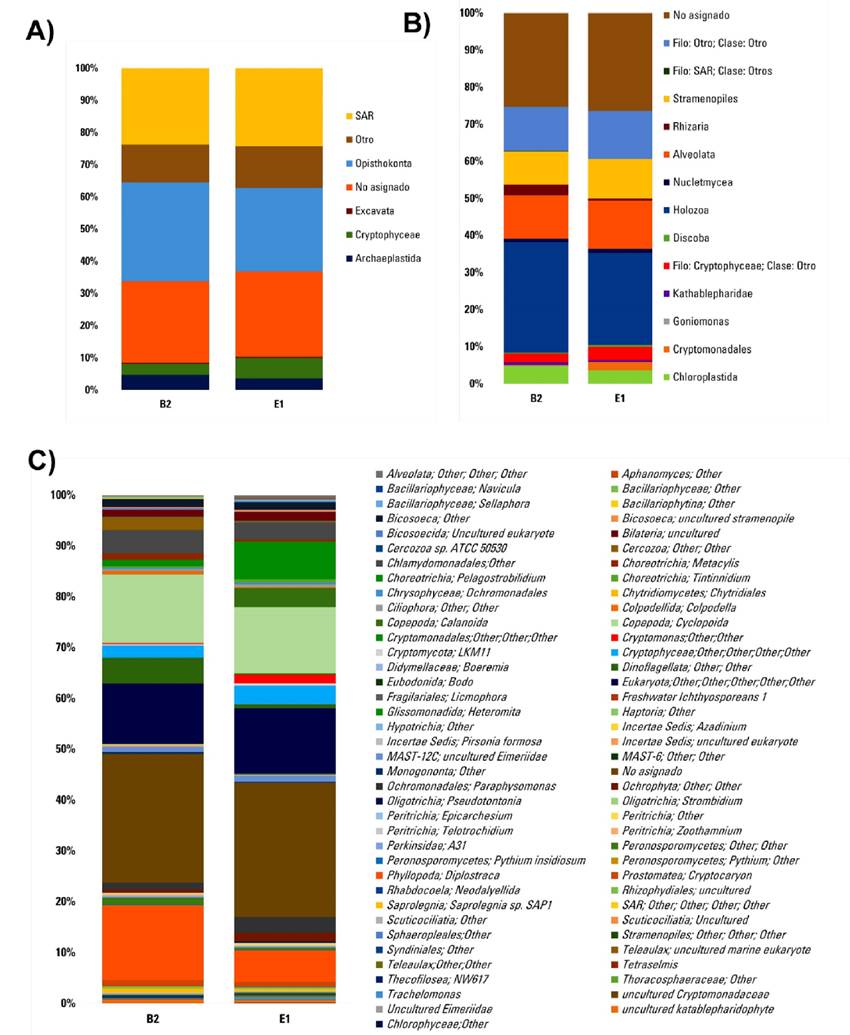
Figura 2 Composición taxonómica relativa de comunidades eucariotas de muestras colectadas el 11 de marzo del 2020, la muestra E1 a cero metros de profundidad y la muestra B2 a dos metros de profundidad. A) A nivel de Filo. B) A nivel de Clase y C) Con los datos taxonómicos relacionados con los ASVs.
Los grupos minoritarios identificados fueron comunidades pertenecientes a los Archaeplastida (3.6% y 4.7%). En el caso de Cryptophyceae se encontró que el porcentaje en la superficie (E1) fue casi el doble que los encontrados a dos metros de profundidad (B2) (6.3% y 3.4%) (Fig. 2A); lo mismo para Excavata (0.4% y 0.2%).
Variación o grado de recambio en la composición de especies. Diversidad β. Los patrones de la diversidad beta de las diferentes categorías taxonómicas de las comunidades microbianas procariotas, reflejan la abundancia de las especies encontradas en ambas condiciones (Material suplementario). Respecto a la abundancia relativa del phylum Bacteroidetes, éstos representaron el 6 y 8.2% de los procariotes a dos metros y cero metros respectivamente; hay especies que estuvieron presentes en la superficie y ausentes a dos metros de profundidad, entre ellas: Paludibacter sp., Flavobacterium chugnamense-koreense, F. daejeonense, F. fluvii, F. glycines-tructae, F. maotaiense, F. tructae y Ferruginibacter sp. Por su parte, entre las especies ausentes en la superficie fueron: Marinoscillum sp. y F. terrígena. Del resto, los datos obtenidos en la superficie (E1) y a dos metros de profundidad (B2) son muy similares (Material suplementario).
El grupo dominante fueron las cianobacterias del género Planktothrix spp. (69 y 67%; 2 m y 0 metros, respectivamente); otras cianobacterias encontradas fueron Cylindrospermopsis spp., Limnothrix redekei solo presentes en la superficie y Planktothrix agardhii encontrada e identificada a nivel de especie solo a dos metros de profundidad. Algunos Firmicutes y Fusobacteria solo se encontraron en la superficie, entre ellos Paenibacillus spp., Clostridium celatum, Intestinibactear sp. y Cetobacterium somerae sp. (Material suplementario).
Respecto al filo Proteobacteria, algunas Alphaproteobacterias como Loktanella spp. y Sphingopyxis contaminans solo estuvieron presentes en la superficie, mientras que Dongia mobilis, y algunos miembros de los Rickettsiales solo fueron identificados a dos metros de profundidad. En las Betaproteobacterias también hay diferencias dependiendo de la profundidad, en la superficie estuvieron presentes Alicycliphilus denitrificans, Comamonas sp. Hydrogenophaga spp. y Rhodoferax antarcticus mientras que a dos metros de profundidad se identificaron de forma diferencial, Polynucleobacter difficilis, Geisbergeria, Hydrogenophaga bisanensis, Methylotenera mobilis y Dechloromonas spp. Así mismo, la Gammaproteobacteria, Aeromonas rivuli-sobria, dos Chromatiales: Rheinheimera aquatica-texasensis y R. arenilitoris; un Xanthomonadaceae, Arenimonas spp. y un Verrucomicrobiae, Luteolibacter algae, solo se encontraron en la superficie, mientras que a dos metros de profundidad la Deltabacteria, Peredibacter sp.; la Gammaproteobacteria, Aeromonas sobria; además de Methylomonas methanica, Pseudospirillum sp. y Pseudomonas benzenívorans-putida solo fue posible encontrarlas a dos metros de profundidad (Material Suplementario).
Por otro lado, en las comunidades eucarióticas, se observo diferencia a nivel de filo, donde el grupo de Opisthokonta fue el más abundante a dos metros de profundidad (B2) comparado con la superficie (E1), lo cual se ve reflejado a nivel de clase y de orden, donde el grupo de Holozoa y Metazoa son mayoritarios también en B2. Otros taxa identificados fueron: Bilateria, Cercozoa, Prostomatea, Phyllopoda (Diplostraca), Choreotrichia, Ochromonadales, Chlamydomonadales, Cyclopoida (Copepoda), Calanoida (Copepoda), Eimeriidae. A nivel de género: Bicosoeca, Paraphysomonas, Glenodinium, Cryptocaryon, Metacylis, Pelagos trobilidiumy, Saprolegnia. A nivel de especie se identificó a Bosmina longirostris y Sellaphora pupula (Fig. 2 y Material Suplementario).
Diferencias de abundancias de especies bacterianas. Al comparar la abundancia relativa de especies entre E1 y B2 se identificaron 16 especies con diferencias mayores a 2 cuantiles (Fig. 3; Tabla 2). En la muestra B2 se encontraron 13 especies con mayor abundancia, de éstas, 7 pertenecían a distintas especies del género Flavobacterium: Flavobacterium sp17035-sp17044, Flavobacterium fluvii, Flavobacterium glycines-tructae, Flavobacterium sp16978, Flavobacterium sp17023, Flavobacterium tiangeerense, y Flavobacterium tructae. Además, otras 6 especies fueron más abundantes en B2, Aeromonas rivuli-sobria, Rheinheimera aquatica-texasensis, Rheinheimera arenilitoris, Cetobacterium somerae, Cryptomonas curvata y NA sp37488 (especie no identificada) (Fig. 3). El número de especies con una diferencia en su abundancia presentes en B2 del género Flavobacterium fue significativamente diferente (p = 0.0001, Fisher exact test) (Tabla 3), por lo que parece existir una asociación entre la abundancia de Flavobacterium y la profundidad. Por otra parte, las especies con mayor abundancia en la muestra E1 fueron Methylocaldum sp60855-szegediense, Pseudospirillumsp61724y Aeromonas sobria (Fig. 3).
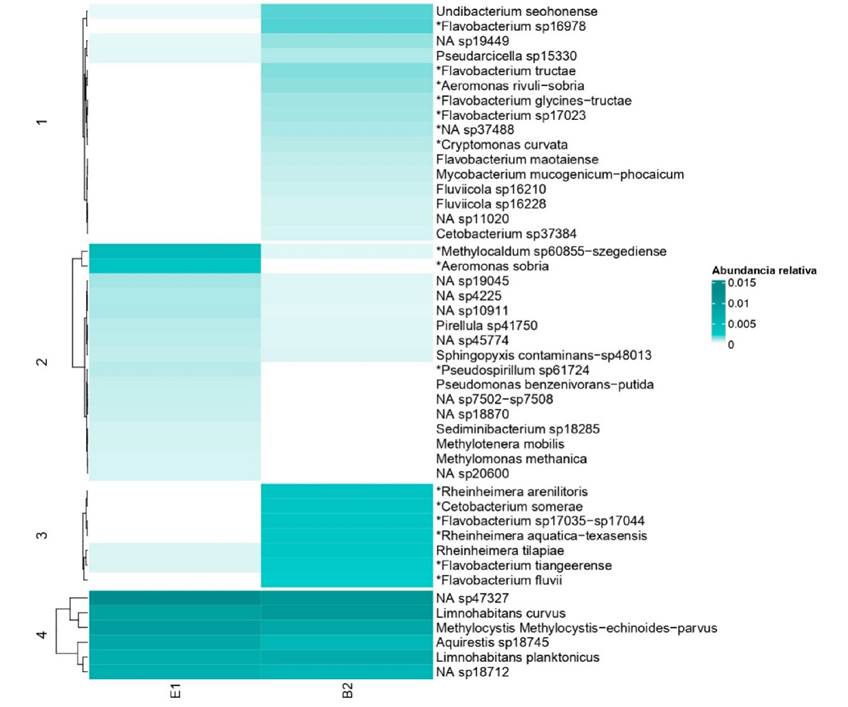
Figura 3 Mapa de calor de las abundancias relativas de especies. Se muestran las especies con una abundancia relativa mayor a 0.01 y las especies diferencialmente abundantes, indicadas con un asterisco. Se consideraron especies diferencialmente abundantes cuando la diferencia de cuantiles fue >2. En los clusters 1 y 3 se muestran las especies con mayor abundancia en la muestra B2, principalmente se identificaron como más abundantes distintas especies del género Flavobacterium. El cluster 2 muestra las especies más abundantes en E1, Methylocaldum sp60855−szegediense, Aeromonas sobria y Pseudospirillum sp61724. El cluster 4 muestra las especies más abundantes en ambas muestras, sin considerar Planktothrix spp.
Tabla 2 Abundancia relativa de las especies identificadas. Se muestra la abundancia relativa en las muestras, así como su diferencia, el cuantil (de acuerdo con la abundancia de la especie) y la diferencia de cuantiles de las especies.
| ASV | E1 | B2 | Diferencia E1-B2 | Cuantiles E1 | Cuantiles B2 | Diferencia de cuantiles E1-B2 | Diferencial |
|---|---|---|---|---|---|---|---|
| Planktoluna difficilis | 0 | 0.00030345 | -0.00030345 | Q1 | Q1 | 0 | |
| Aeromonas rivuli-sobria | 0 | 0.00124138 | -0.00124138 | Q1 | Q4 | -3 | |
| Alicycliphilus denitrificans | 0 | 0.00038621 | -0.00038621 | Q1 | Q2 | -1 | |
| Arenimonas sp64994 | 0 | 0.00038621 | -0.00038621 | Q1 | Q2 | -1 | |
| Arenimonas sp64998 | 0 | 0.00035862 | -0.00035862 | Q1 | Q2 | -1 | |
| Bellilinea sp20241-sp20462 | 0 | 0.00041379 | -0.00041379 | Q1 | Q2 | -1 | |
| Cetobacterium somerae | 0 | 0.00331035 | -0.00331035 | Q1 | Q5 | -4 | * |
| Cetobacterium sp37384 | 0 | 0.00046897 | -0.00046897 | Q1 | Q3 | -2 | |
| Clostridium celatum | 0 | 0.00046897 | -0.00046897 | Q1 | Q3 | -2 | |
| Comamonas sp48915 | 0 | 0.00030345 | -0.00030345 | Q1 | Q1 | 0 | |
| Cryptomonas curvata | 0 | 0.00082759 | -0.00082759 | Q1 | Q4 | -3 | |
| Ferruginibacter sp18100 | 0 | 0.00041379 | -0.00041379 | Q1 | Q2 | -1 | |
| Flavobacterium chungnamense-koreense | 0 | 0.00038621 | -0.00038621 | Q1 | Q2 | -1 | |
| Flavobacterium daejeonense | 0 | 0.00038621 | -0.00038621 | Q1 | Q2 | -1 | |
| Flavobacterium fluvii | 0 | 0.00215172 | -0.00215172 | Q1 | Q5 | -4 | * |
| Flavobacterium glycines-tructae | 0 | 0.00104828 | -0.00104828 | Q1 | Q4 | -3 | * |
| Flavobacterium maotaiense | 0 | 0.00071724 | -0.00071724 | Q1 | Q3 | -2 | |
| Flavobacterium sp16978 | 0 | 0.00173793 | -0.00173793 | Q1 | Q5 | -4 | * |
| Flavobacterium sp17023 | 0 | 0.00102069 | -0.00102069 | Q1 | Q4 | -3 | * |
| Flavobacterium sp17035-sp17044 | 0 | 0.00306207 | -0.00306207 | Q1 | Q5 | -4 | * |
| Flavobacterium tructae | 0 | 0.00135172 | -0.00135172 | Q1 | Q4 | -3 | * |
| Fluviicola sp16210 | 0 | 0.0006069 | -0.0006069 | Q1 | Q3 | -2 | |
| Fluviicola sp16224 | 0 | 0.00033103 | -0.00033103 | Q1 | Q2 | -1 | |
| Fluviicola sp16228 | 0 | 0.00052414 | -0.00052414 | Q1 | Q3 | -2 | |
| Geminigera cryophila | 0 | 0.00035862 | -0.00035862 | Q1 | Q2 | -1 | |
| hgcI clade sp6118 | 0 | 0.00041379 | -0.00041379 | Q1 | Q2 | -1 | |
| Hydrogenophaga bisanensis-pseudoflava | 0 | 0.0006069 | -0.0006069 | Q1 | Q3 | -2 | |
| Intestinibacter sp34281 | 0 | 0.00044138 | -0.00044138 | Q1 | Q2 | -1 | |
| Limnothrix redekei | 0 | 0.00033103 | -0.00033103 | Q1 | Q2 | -1 | |
| Loktanella cinnabarina-hongkongensis | 0 | 0.00052414 | -0.00052414 | Q1 | Q3 | -2 | |
| Luteolibacter algae | 0 | 0.00038621 | -0.00038621 | Q1 | Q2 | -1 | |
| Mycobacterium mucogenicum-phocaicum | 0 | 0.00066207 | -0.00066207 | Q1 | Q3 | -2 | |
| Mycobacterium NA | 0 | 0.00044138 | -0.00044138 | Q1 | Q2 | -1 | |
| NA sp11020 | 0 | 0.00049655 | -0.00049655 | Q1 | Q3 | -2 | |
| NA sp11885 | 0 | 0.00030345 | -0.00030345 | Q1 | Q1 | 0 | |
| NA sp14892 | 0 | 0.00044138 | -0.00044138 | Q1 | Q2 | -1 | |
| NA sp19378 | 0 | 0.00035862 | -0.00035862 | Q1 | Q2 | -1 | |
| NA sp19488 | 0 | 0.00038621 | -0.00038621 | Q1 | Q2 | -1 | |
| NA sp21784 | 0 | 0.00033103 | -0.00033103 | Q1 | Q2 | -1 | |
| NA sp37488 | 0 | 0.00093793 | -0.00093793 | Q1 | Q4 | -3 | * |
| Paenibacillus sp27231 | 0 | 0.00046897 | -0.00046897 | Q1 | Q3 | -2 | |
| Paludibacter sp13191 | 0 | 0.00038621 | -0.00038621 | Q1 | Q2 | -1 | |
| Rheinheimera aquatica-texasensis | 0 | 0.00295172 | -0.00295172 | Q1 | Q5 | -4 | * |
| Rheinheimera arenilitoris | 0 | 0.00344828 | -0.00344828 | Q1 | Q5 | -4 | * |
| Rhodoferax antarcticus | 0 | 0.00038621 | -0.00038621 | Q1 | Q2 | -1 | |
| Sediminibacterium sp18295 | 0 | 0.00071724 | -0.00071724 | Q1 | Q3 | -2 | |
| Sphingopyxis contaminans | 0 | 0.00046897 | -0.00046897 | Q1 | Q3 | -2 |
Tabla 3 Tabla de contingencia para el test exacto de Fisher. Se determinó que existe una diferencia significativa (p = 0.0001) en la cantidad de especies del género Flavobacterium presentes en distintas profundidades de la presa.
| Flavobacterium | Otros | Total fila | |
|---|---|---|---|
| Diferencialmente abundante | 7 | 9 | 16 |
| No abundante | 9 | 145 | 154 |
| Total | 16 | 154 | 170 |
Diferencias en abundancias de eucariotes. Por otra parte, en eucariotes, se identificó que en ambas muestras el grupo taxonómico Copepoda, orden Cyclopoida, presentó una abundancia de 13% (Fig. 4). Además, en B2 se observó una mayor abundancia relativa en la subclase Phyllopoda y orden Diplostraca, (0.14 en B2 y 0.06 en E1). Otra diferencia importante fue una mayor abundancia relativa de la subclase Copepoda y orden Calanoida en E1, en la que representa cerca del 4% mientras que en B2 el 0.07%. De igual forma, la subclase Choreotrichia y el género Pelagostro bilidiumes estuvieron presentes en E1 (Fig. 4).
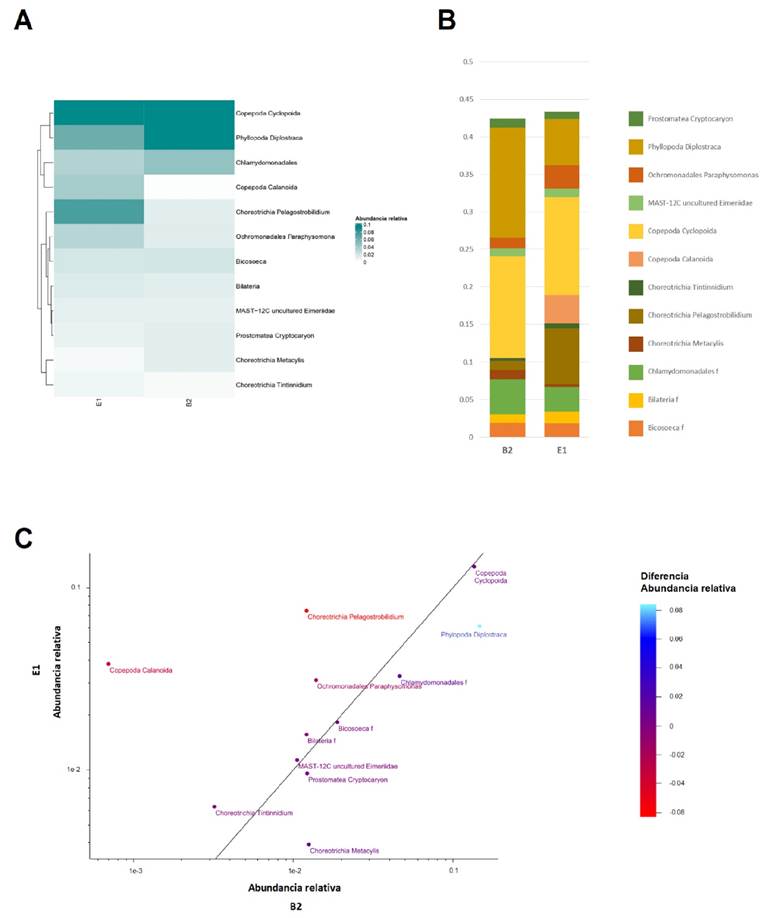
Figura 4 Abundancia relativa de los ASVs eucarióticos. A) Mapa de calor en donde se muestran las abundancias a nivel Taxon en E1 y B2, se observa que los ASVs más abundantes en ambas muestras son Ciclopoida (Copepoda), además de Phyllopoda (Diplostraca) en B2. B) Gráfica de barras acumuladas de abundancia relativa, se muestran las diferencias más importantes: Calanoida (Copepoda) y Pelagostroblidium (Choretrichia), con una mayor abundancia en E1 mientras que Phyllopoda (Diplostraca) fue más abundante en B2. C) Se muestra en escala logarítmica la relación de abundancia relativa entre B2 y E1, en la gráfica podemos observar en orden creciente cerca de la línea de tendencia aquellos ASVs con una diferencia de abundancia menor entre ambas muestras, las muestras más alejadas representan aquellas con las diferencias más importantes. En escala de colores cian a rojo se muestra la diferencia de abundancia relativa de E1-B2; en morado se muestra las diferencias cercanas a 0, en escala de azul si fueron más abundantes en B2 y en escala de rojo si fueron más abundantes en E1.
DISCUSIÓN
La eutroficación incrementa la dominancia de una o varias especies; como consecuencia, el crecimiento descontrolado de ciertas especies microalgales, afectan la diversidad natural, generando un impacto negativo sobre el ecosistema. Para estudiar la diversidad biológica en un contexto ecológico, se han creado índices para medir la diversidad de especies, como el índice Shannon y Simpson (Gotelli & Colwell, 2001; Thukral et al., 2019).
Los índices Shannon reportados para una floración de Alexandrium catenella estudiada en un estanque de sal en el sistema de pantanos en Cape Cod (Massachusetts, Estados Unidos) fueron aproximadamente entre 2 y 3 para bacterias, y entre 3 y 4 para eucariotes, durante todo el período que duró la floración (Zhou et al., 2018). El mismo estudio reportó valores para el índice Simpson, entre 0.15-0.30 para bacterias y 0.05 y 0.4 para eucariotes (Zhou et al., 2018). La diversidad alfa en nuestra área de estudio mostró índices mayores comparados con este reporte, lo que podría explicarse, posiblemente, por el tipo de floración, además de la etapa de florecimiento donde se encontraba. Como se muestra en la tabla 1, el índice Shannon tuvo valores de 3.9 y 4.1, para la diversidad bacteriana, mientras que la diversidad eucariótica, presentó valores de 5.8 y 5.9. Por otro lado, el índice Simpson presentó valores menores para procariotes (0.77 y 0.75), comparativamente con eucariotes (0.96 y 0.96) (Tabla 1). El índice Shannon es una medida de la entropía o desorden de una comunidad, una comunidad presenta alta entropía, lo que se interpreta como alta diversidad, cuando todas las especies tienen la misma abundancia (Moreno et al., 2011); y el índice Simpson representa la probabilidad de que dos individuos seleccionados al azar pertenezcan a la misma especie (Daly et al., 2018). De acuerdo con los valores del índice Shannon, la diversidad presentaba un nivel alto, especialmente en las comunidades eucariotas (Tabla 1). Mientras que el índice Simpson para las comunidades procariotas, refleja que, a pesar de la dominancia del género Planktothrix, la riqueza de especies es mayor, comparado con las comunidades eucariotas; puesto que, entre más bajo sea el índice Simpson, la diversidad es mayor; lo que sugiere que la riqueza en especies de eucariotes presentó mayor impacto negativo que las comunidades procarioticas (Tabla 1).
Valores de índice Shannon superiores a 4 al final de una floración fueron reportados en un ecosistema de agua dulce, donde la cianobacteria dominante fue Synechococcus (62.71%), Prochlorothrix (15.60%), y Microcystis (8.19%); mientras que valores de diversidad, medidos con el inverso del índice Simpson (1/D), permaneció a bajos niveles durante el brote, y se incrementaban considerablemente al final de la floración, en la fase de disminución (Zhang et al., 2018). En otro estudio en un sistema lacustre con una floración de verano de Synechococcus, los índices Shannon para procariotes y eucariotes estuvieron en un rango de entre 2.16 y 3.84 (Mikhailov et al., 2018), mientras que en un reservorio subtropical dominado por Cylindrospermopsis racibosrskii el índice Shannon estuvo entre 3.5-4.5 (Liu et al., 2019).
Con respecto a la composición taxonómica microbiana y su abundancia, la floración microalgal resultó ser de cianobacterias del género Planktothrix, ya que fue el grupo filogenético dominante (Fig. 1). El taxón dominante encontrado en la zona de estudio está dentro de los géneros productores de microcistinas más importantes en lagos templados (Oliver & Ganf, 2000). Las microcistinas son heptapéptidos cíclicos con actividad hepatotóxica codificados en una región del genoma de 50 kpb, el cluster mcy, que contiene los nueve genes para su síntesis (Davis et al., 2003). Dentro de este género, se reconoce un genotipo productor de ficoeritrina, un pigmento rojo, conocido como Planktothrix rubescens; por otro lado, la especie con el pigmento verde ficocianina es conocida como Planktothrix agardhii (Sivonen & Jones, 1999). Con la amplificación de la región del gen que codifica la rARN 16S no fue posible una identificación a nivel de especie, sin embargo, se sabe que P. rubescens se encuentra en aguas profundas, estratificadas y oli-mesotróficas en donde se pueden construir capas metalimnéticas, mientras que P. agardhii tiene una mayor distribución en aguas poco profundas, cuerpos de agua plomícticos que van de mesotróficos a hipertróficos; por otro lado, se considera muy poco frecuente que las dos especies se encuentren habitando en el mismo lugar (Kurmayer et al., 2004).
Los florecimientos cianoalgales en lagos naturales y artificiales reportados en México de 2002-2015 fueron recopilados por Pérez-Morales et al., (2016), así como las especies encontradas; en tres de los ocho lagos reportados, Planktothrix agardii estuvo presente (Favari et al., 2002; Komárek & Komárkova-Legnerová, 2002; Vasconcelos et al., 2010; Gaytán-Herrera et al., 2011; Pineda-Mendoza et al., 2012). En el lago de Xochimilco, CDMX, se identificó co-existiendo a Limnothrix redekei y Planktothrix agardii, tal como los análisis de amplicones de este estudio lo hicieron (Fig. 3). Por otra parte, Cylindrospermopsis spp., otra de las cianobacterias detectadas en baja abundancia en este estudio (Material Suplementario), fue identificada en el reservorio de Valle de Bravo del sistema Cutzamala entre el año 2006 y 2007 (Mercado-Borrayo et al., 2008). Más reciente, es el reporte de un estudio realizado durante 2016-2017 en la Laguna de Cajititlán, Jalisco; entre las cianobacterias filamentosas identificadas estuvieron Planktothrix y Cylindrospermopsis (además de Planktolyngbya), donde el alga dominante, determinada por concentración celular, fue Planktothrix (Vizcaíno et al., 2019). La coexistencia de estos dos géneros también fue reportada en un reservorio ubicado en Brasil (Dantas et al., 2011).
Los cambios en las comunidades microbianas durante el desarrollo de los florecimientos algales revelan cambios en los diferentes grupos dominantes a través del tiempo. Durante un brote de Synechococcus, Microcystis, y Prochlorothrix, en un depósito de agua potable en la ciudad de Zaozhuang, provincia de Shandong, al este de China, las Actinobacterias disminuyeron casi a la mitad durante el florecimiento, comparado con el inicio de éste (Zhang, 2018). Adicionalmente, se ha reportado que bacterias de los grupos Flavobacterias y Rhodobacteraceae se desarrollan mejor en ausencia de floraciones (Luria et al., 2017).
Por otra parte, se ha visto que las comunidades bacterianas predominantes al principio de un florecimiento del dinoflagelado A. catenella, fueron Gammaproteobacteria y Bacteroidetes, mientras que las predominantes posteriormente y al final del florecimiento fueron Alphaproteobacteria, Cyanobacteria y Actinobacteria (Zhou et al., 2018). Las arqueobacterias encontradas fueron metanógenas, presentes durante la etapa temprana del florecimiento, mientras que en la etapa tardía del florecimiento predominaron las oxidantes de amoniaco y las Halobacteriales (Zhou et al., 2018). La presencia de arqueobacterias metanógenas coincide con nuestros hallazgos, ya que el 0.1% de la composición fueron Methanomicrobia.
Así mismo, la abundancia de Proteobacterias se ha correlacionado positivamente con la concentración de células algales, y la abundancia de las Proteobacterias, tiende a incrementarse durante las floraciones (Zhang, 2018); lo mismo sucede para las bacterias oxidantes de amonio (Xue et al., 2017). Estos reportes coinciden con los hallazgos de este estudio, ya que las Proteobacterias y Bacteroidetes fueron el segundo y tercer grupo más dominante (Fig.1). Interesantemente, bacterias pertenecientes a estos grupos taxonómicos también se han asociado con algas Chlorophitas, más que con otros filotipos de bacterias (Ramanan et al., 2015; 2016). El cuarto grupo más abundante fueron las Actinobacterias (Fig. 1); en ambientes extremos naturales, las comunidades de Proteobacterias y Actinobacterias se han asociado con cianobacterias Chroococcales y Synechococcales (Wierzchos et al., 2015).
A nivel de género y especie, el análisis por cuantiles reveló que a dos metros de profundidad (B2) el género Flavobacterium spp.se presentó en mayor abundancia, comparado con la superficie (Tabla 2 y Fig. 3). Este género se ha asociado con tapetes cianobacteriales y comunidades que forman biopelículas (Brambilla et al., 2001), así como parte de la composición bacteriana de sistemas acuáticos y en comunidades microbianas dominadas por cianobaterias (Abed et al., 2006; Xu et al., 2018; Zhou et al., 2018). Se sabe que existen bacterias asociadas (epibiontes) a floraciones cianoalgales; Flavobacterium spp. está entre las comunidades epibiontes de Mycrocystis y A. catenella (Li et al., 2018; Zhou et al., 2018). Flavobacterium también ha sido correlacionada positivamente con Synechococcus, Limnohabitans, Albidiferax y acticomyctales (Mikhailov et al., 2018). Se han reportado patrones en redes de co-ocurrencia, los cuales se consideran críticos para la dominancia de cianobacterias en verano (Zhao et al., 2016). En un contexto de contaminantes peligrosos, como son las cianotoxinas, la biosíntesis y liberación de las toxinas y compuestos orgánicos complejos podría estar en equilibrio con su degradación, llevada a cabo por los epibiontes; en ese contexto, Flavobacterium spp. es conocida por su capacidad de metabolizar compuestos orgánicos complejos (Berg et al., 2009; Li et al., 2018).
Entre los otros géneros de mayor abundancia en B2 también se encontró a Aeromonas rivuli-sobria. El género Aeromonas está ampliamente distribuido en ambientes acuáticos (Figueras et al., 2011; Fernández-Bravo & Figueras, 2020). Las especies Aeromonas aquatica, A. finlandiensis y A. lacus han sido asociadas con floraciones cianoalgales (Beaz-Hidalgo et al., 2015). Por otro lado, Methylocaldum szegediense se encontró que fue más abundante en la superficie (E) comparada con la muestra tomada a dos metros de profundidad. Este organismo se reportó en una floración cianoalgal de Nodularia sp. en el mar Báltico (Tuomainen et al., 2003). En la búsqueda por solucionar y evitar las floraciones algales que pongan en peligro el suministro de agua para uso humano, se ha propuesto el uso de bacterias que produzcan metabolitos con actividad cianobactericida para su control (Fuentes et al., 2016; Ramanan et al., 2016). Las bacterias identificadas en estudios de poblaciones asociadas a floraciones cianoalgales son posibles blancos que pueden ofrecer información en este respecto (Srivastava et al., 2013, 2014).
En la diversidad microbiana en ecosistemas acuáticos, además de los procariotes, su contraparte, los eucariotes son un grupo igualmente importante y, como se ha señalado, existen correlaciones de co-ocurrencia entre las comunidades que resultan en un ecosistema en equilibrio (Ramanan et al., 2016; Zhao et al., 2016). La composición de las comunidades eucariotas en cuerpos de agua dulce no eutróficos ha sido reportada en ríos, lagos, reservorios de agua para consumo humano y estuarios (Sun, et al., 2014; Debroas et al., 2017; Inkinen et al., 2019; Yan, et al., 2020). El alcance taxonómico de las poblaciones eucarióticas identificadas en este trabajo es limitado, a pesar de ello, algunas jerarquías taxonómicas inferiores reportadas en otros estudios nos permiten englobarlas en las encontradas en la presente investigación. En un reservorio de agua donde se presentan floraciones dominadas por C. raciborskii (65.5%), se cuantificó que el 40.4% de las lecturas eucarióticas, pertenecía al grupo Metazoa y que su abundancia relativa se incrementaba con la disminución de la biomasa cianobacterial (Liu, et al., 2019). Los Metazoa, están entre el grupo mayoritario de eucariotes encontrados en la “Presa El Palote”, ya que el promedio de los Opishokonts identificados en la presa fueron 28.3%, de éstos, el 27% fueron Metazoa (Holozoa) y el 1% Holomycotas; otros miembros minoritarios identificados de Holomycoras fueron: Discicristoidea (0.1%) y Fungi (0.9%) (Fig. 2B). Liu et al. (2019), también reportaron fitoplancton eucariótico, Cryptophyta, Chrysophyceae, Chlorophyta y Dinophyta con un 24% de abundancia relativa (estos grupos disminuían con el decremento de la biomasa cianobacterial), lo que contrasta con nuestros hallazgos, donde observamos la ausencia de Cryptophyta y Dinophyta; además de una baja abundancia de Chrysophyceae, con un 0.26 y 0.45% y Chlorophyta, con un 0.11 y 0.28% (Fig. 2 y Material Suplementario). Por otro lado, en un sistema de agua salada, Zhou et al. (2018) reportaron que los dinoflagelados fueron el mayor grupo taxonómico presente durante todo el desarrollo del florecimiento de A. catenella, mientras que, en la etapa terminal, se detectó la presencia de diatomeas, algas verdes, rotifera y otros microzooplankton; lo cual está en discrepancia con la baja abundancia relativa de dinoflagelados (0.12% y 0.07%) encontrados en este trabajo (Fig. 2 y Material Suplementario).
El siguiente grupo más abundante identificado, fue Stramenopiles, Alveolata y Rhizaria (SAR) (Fig. 2 y Fig. 4). La mayor parte de los datos moleculares reportados de este grupo provienen de muestras marinas, se estima que representan el 50% de la diversidad eucariótica (Grattepanche et al., 2018). Rhizaria estuvo entre las Unidades Transcripcionales Operacionales u OTU's por sus siglas en inglés dominantes en una floración primaveral cianoalgal, dominada por Synechococcus en el Lago Baikal que se encuentra en el valle de Rift en el sureste de Siberia (Mikhailov et al., 2018).
La distribución y abundancia de especies de zooplancton son indicadores de contaminación; así mismo, se han asociado también a problemas de floraciones relacionadas con eutrofización de cuerpos de agua (Ismail & Adnan, 2016; Krupa et al., 2020). Entre los grupos reportados como indicadores de eutrofización están, Rotifera, Copepoda y Cladocera, a nivel de género y especie, Brachionus forfícula, Brachionus nilsoni y Trichocerca sp. (Ismail & Adnan 2016). En las muestras de la presa “El Palote”, en ambas profundidades se identificaron Copepoda, orden Cyclopoida y orden Calanoida (Fig. 2C, Fig. 4); la abundancia de Copepoda ha sido asociada con la presencia de nitrógeno amoniacal y fosfatos, mientras que la dominancia de Cyclopoides, como Mesocyclops leukarti, se asocia con fosfatos (Krupa et al., 2020). Phyllopoda (Diplostraca), Copepoda y Calanoida están entre los grupos de zooplancton encontrados en lagos; entre sus funciones ecológicas esta regular la presencia de cianobacterias nocivas (López-Moreira et al., 2018; Ger et al., 2016; Napiórkowska-Krzebietke et al., 2020). Estos grupos se comportaron de forma diferencial con respecto a la profundidad, estando en mayor abundancia a dos metros Cyclopoida (Copepoda), Phyllopoda (Diplostraca) y en la superficie, Calanoida (Copepoda) (Fig. 4C), los patrones diferenciales que observamos son un reflejo del cambio en la estructura del zooplancton; se ha documentado que las floraciones dominadas por Cyanobacterias y Chlorofitas impactan negativamente la riqueza de especies de zooplancton (Amorim & Moura, 2021). El impacto ecológico de los florecimientos algales en cuerpos de agua dulce incluye, además, un deterioro en la calidad del agua, una reducción en la diversidad del plancton y cambios en los patrones de dominancia lo que induce una perdida en la riqueza de especies (Amorim & Moura, 2021).
CONCLUSIONES
Nuestros resultados presentan un panorama de la diversidad de los microorganismos en un sistema donde el taxón dominante es Planktothrix spp., lo cual es un primer acercamiento para comprender sus interacciones microbianas cuando el hábitat cambia, favoreciendo el crecimiento descontrolado de un grupo taxonómico. Adicionalmente, la identificación a nivel genético de las cianobacterias potencialmente tóxicas presentes en cuerpos de agua permite predecir, prevenir y remediar de forma dirigida las posibles floraciones.











 text new page (beta)
text new page (beta)



