INTRODUCCIÓN
Thalassia testudinum (K. D. Köenig, 1805) presenta una amplia distribución en el Atlántico occidental, desde el sur de La Florida y norte del Golfo de México hasta el norte de Sudamérica (Phillips & Meñez, 1988). Esta fanerógama conforma uno de los ecosistemas más prolíferos y diversos en el ambiente marino. Su elevada complejidad estructural contribuye a mantener la heterogeneidad de estos ambientes, conformando microhábitats importantes para el establecimiento y desarrollo de diversas comunidades bentónicas (Bitter et al., 2009; Novak & Short, 2010), representando áreas de alimentación, cría, reproducción y refugio para moluscos, equinodermos, poliquetos, crustáceos y otros grupos de organismos. Estos ecosistemas son fundamentales en la estabilización del sedimento, reducción de la energía de las olas y la velocidad del flujo de agua (Kuo & Den Hartog, 2006), aportan elevados niveles de nutrientes y oxígeno al medio, permitiendo la subsistencia de una diversa fauna residente, y en conjunto con los manglares, corales y las marismas intermareales, ayudan a mitigar los efectos del cambio climático al actuar como sumideros de carbono orgánico (Duffy, 2006; Denninson, 2009).
La complejidad de las praderas de T. testudinum radica, en que éstas no funcionan aisladamente; por el contrario, están interconectadas con otros ecosistemas (arrecifes de coral, bosques de manglar, litorales rocosos y lagunas costeras), que interfieren de manera directa e indirectas sobre las características ecológicas de éstas (Pittman et al., 2007), influyendo en la riqueza y abundancia de las comunidades residentes, mediante el intercambio de especies entre los diferentes ambientes circundantes y a través del reclutamiento de larvas (Paris et al., 2007; Nagelkerken et al., 2008).
En las costas de Venezuela, existen varios tipos de formaciones geológicas tales como: zonas de arrecifes, playas rocosas, arenosas, acantilados y complejos lagunares que colindan con los sistemas de manglares y praderas de T. testudinum, y en conjunto con la productividad primaria de la zona, conforman una importante dinámica ambiental que genera cambios en las comunidades bentónicas (Prieto et al., 2000; Rueda-Roa & Muller-Karger, 2013; Jiménez-Ramos et al., 2019). Por lo antes señalado, en este estudio se evaluó si existen cambios espacio-temporales en la macrofauna bentónica; asociada a una pradera de T. testudinum, que circunda el litoral costero del complejo lagunar Chacopata-Bocaripo, en el nororiente de Venezuela.
MATERIALES Y MÉTODOS
Área de muestreo
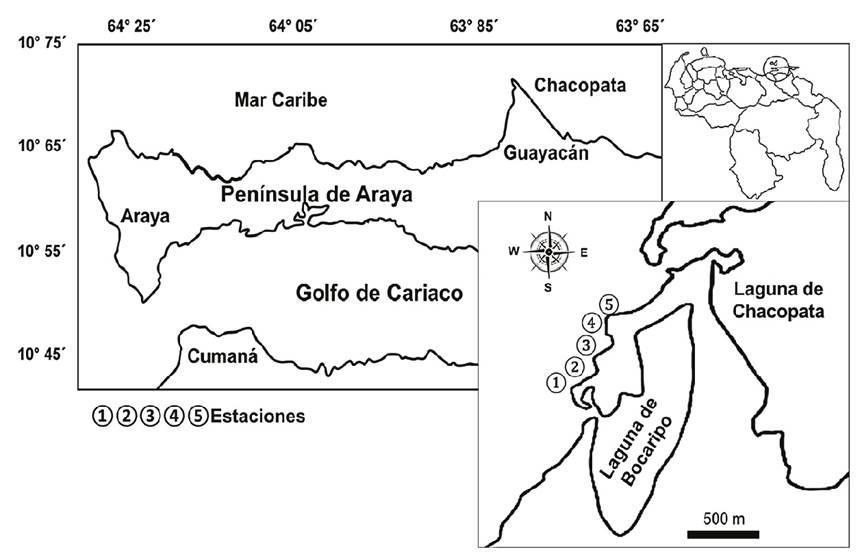
La estructura comunitaria se analizó en una pradera monoespecífica de T. testudinum, en el eje costero situado entre las desembocaduras de las lagunas de Bocaripo-Chacopata, ubicadas en la costa norte de la península de Araya, nororiente de Venezuela (Fig. 1).
METODOLOGÍA DE CAMPO
Se realizaron muestreos bimestrales entre enero y noviembre de 2017, siguiendo un transecto paralelo a la costa de 500 metros aproximadamente, a través del cual se fijaron cinco estaciones equidistantes (100 m de separación). La estación uno se situó en la desembocadura de la laguna de Bocaripo y la estación cinco, en las cercanías de la laguna de Chacopata, ambas con presencia de Rhizophora mangle L. 1753. Las estaciones dos, tres y cuatro, se ubicaron en la zona intermedia del litoral costero, frente a una playa de características arenosas.
Parámetros físico-biológicos
Los registros de temperatura y salinidad, se obtuvieron por triplicado con una sonda multiparamétrica modelo YSI6600. Para cuantificar los niveles de clorofila a y seston total, se recolectaron 2 L de agua y sus valores bimestrales se determinaron mediante métodos espectrofotométricos y gravimétricos respectivamente, según los establecido por Strickland & Parsons (1972).
Granulometría y materia orgánica
Se recolectó por triplicado 1 kg de sedimento en cada mes y estación de muestreo, hasta una profundidad de 30 cm, empleando un nucleador de PVC con un área de 0.018 m2. Para los análisis granulométricos del sedimento, se utilizó un granulómetro Ro-Tap (Wentworth, 1936; Krumbein, 1964; Tanner, 1964), siguiendo el método de separación por agitación continua en una columna de tamices (Caraballo, 1968), separando cada fracción de sedimento de acuerdo al tamaño de la partícula, según la clasificación de Sheppard (1954). La variación espacio-temporal del contenido de materia orgánica se determinó por método de calcinado o ignición en una mufla Thermolyne 1400 Fumace a 550°C (Gray, 1981). Los análisis se expresaron en porcentajes (%) de sedimento seco.
Estructura comunitaria
Para evaluar la composición de organismos asociados a T. testudinum, se recolectaron por triplicado muestras bimestrales, con la ayuda de un nucleador de PVC de 0.018 m2 de área, a una profundidad de 30-40 cm aproximadamente. Los organismos fueron separados mediante tamices de 1 mm de apertura de malla, fijados in situ en solución de formalina entre el 5 y 10% y teñidos con rosa de bengala. Posteriormente fueron limpiados de epifitos e identificados mediante observación en un microscopio estereoscópico y con el uso de claves taxonómicas para moluscos: Warmke & Abbott (1961), Abbott (1974), Abbott & Morrris (1995), Macsotay & Campos-Villarroel (2001) y Lodeiros et al. (1999); crustáceos: Rodríguez (1980) y Muñoz (1998); equinodermos: Belmonte (1985) y Martínez (1987), y para poliquetos: Liñero-Arana & Díaz-Díaz (2009). La actualización de los nombres científicos se efectuó por consulta online de la página del Registro Mundial de Invertebrados Marinos (WORMS) (http:/www.marinespecies.org/).
Biomasa
Una vez agrupados los ejemplares por grupos taxonómicos, se pesaron en una balanza analítica de 0.001g de precisión (PW 254-aeADAM-Max 250 g) para estimar la biomasa húmeda por estación y por mes.
Índices ecológicos y análisis estadísticos
La estructura comunitaria se determinó mediante la abundancia, riqueza específica, diversidad de Shannon-Wiener y frecuencia (Krebs, 1985). Los índices ecológicos fueron calculados mediante el programa estadístico PAST 3.17.
La variación espacio-temporal en los parámetros comunitarios (abundancia, riqueza, diversidad) y materia orgánica, se determinaron mediante un ANOVA doble, tomando como factores el tiempo y las estaciones, previo análisis de los supuestos de homogeneidad y normalidad, igual tratamiento se aplicó a los grupos de mayor abundancia. Las diferencias bimestrales en los factores ambientales se determinaron con una ANOVA simple tomando como factor el tiempo, mediante el programa Stargraphic Centurium XVII. En caso de diferencias significativas tanto para la ANOVA I como para la ANOVA II, se aplicó la prueba a posteriori de Duncan (Steel & Torres, 1981)
Las similitudes entre meses y entre estaciones se establecieron mediante el índice de Similitud de Jaccard (Margalef, 1985). Se realizó un Análisis de Correlación Canónica con el paquete estadístico CANOCO 4.5, para evaluar la asociación entre la materia orgánica, granulometría y factores ambientales sobre la diversidad, abundancia y biomasa de organismos en la pradera de T. testudinum.
RESULTADOS
Factores físico-biológicos
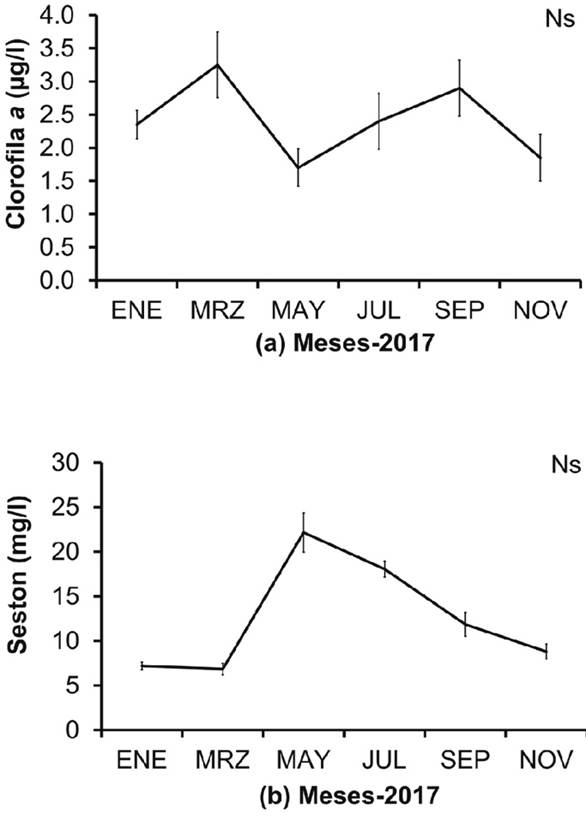
Los registros de temperatura, salinidad, clorofila a y seston orgánico total, no mostraron diferencias significativas entre los meses de muestreo. Sin embargo, la temperatura (Fs=10.13; P=0.071), presentó su máximo valor entre septiembre y noviembre (28-29°C) (Fig. 2a), mientras que los valores mínimos se registraron en marzo y julio. La salinidad (Fs=9.43; P=0.093) fluctuó entre 34.8 a 37.65 UPS, con máximos valores en marzo-mayo (36.6 y 37.65 UPS, respectivamente) y valores mínimos en septiembre (Fig. 2b).

Figura 2a-b Variación temporal de la temperatura (a) y salinidad (b) en praderas de T. testudinum en el litoral costero del complejo lagunar Chacopata-Bocaripo, nororiente de Venezuela. Ns: diferencias no significativas.
La cuantificación de la biomasa fitoplanctónica estimada mediante clorofila a (Fs=10.53; P=0.061), varió entre 1.7 y 3.25 µg/l, con dos picos máximos, en marzo (3.25±0.49 µg/l) y septiembre (2.9±0.42 µg/l), para luego descender a 1.7 µg/l en mayo y 1.85 µg/l en noviembre (Fig. 3a). El seston orgánico total (Fs=12.73; P=0.071), registró sus mayores valores entre mayo (22.15±2.19 mg/l) y julio (18.05±0.91 mg/l), mientras que entre enero y marzo, los promedios estuvieron por debajo de los 10 mg/l (Fig. 3b).
Granulometría
Los sedimentos de la pradera evaluada están constituidos por una mezcla entre arenas finas (48%±3.03), muy finas (14.16%±2.22) y limos (12.83%±6.55), cuyos mayores porcentajes se cuantificaron entre septiembre y noviembre (Fig. 4a). Temporalmente se observó cambios, predominando las arenas medias y partículas finas, muy finas y limos, cuyos porcentajes aumentaron progresivamente a partir de mayo y se mantuvieron hasta noviembre, en contraparte los porcentajes de grava gruesa, grava, arena gruesa y media, mostraron una disminución continua.

Figura 4a-b Variación temporal (a) y espacial (b) de la granulometría de los sedimentos de praderas de T. testudinum en el litoral costero del complejo lagunar Chacopata-Bocaripo, nororiente de Venezuela. GR. G: Grava Gruesa, GR: Grava, A. G: Arena Gruesa, A.M: Arena Media, A.F: Arena Fina, A.M.F: Arena Media Fina, L: Limo.
Estacionalmente, los porcentajes de las diferentes fracciones no mostraron diferencias apreciables, predominando las arenas finas a lo largo de la pradera. En las estaciones uno y cinco, las arenas finas, muy finas y limos superaron el 75% de forma conjunta. Las estaciones dos, tres y cuatro, presentaron sedimentos similares entre sí, con porcentajes de arenas finas, muy finas y limos por debajo del 70%, mientras que las gravas gruesas, gravas, arenas gruesas y medias aportaron porcentajes ligeramente superiores a los encontrados en las estaciones uno y cinco (Fig. 4b).
Materia orgánica
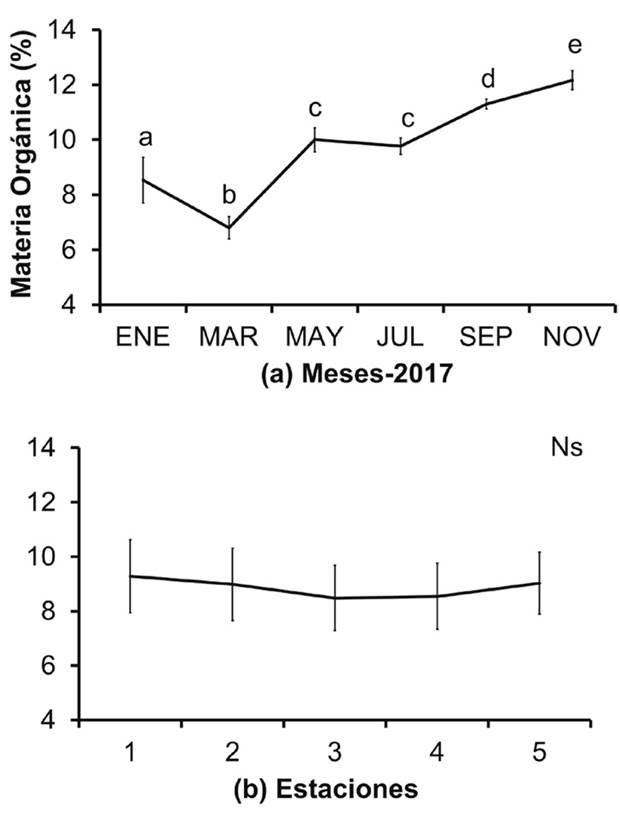
Los niveles de materia orgánica oscilaron entre 6 y 11% (Fig. 5a), con diferencias temporales (Fs=19.83; P=0.031). Entre enero y marzo, se reportaron valores menores a 9%, y en mayo-noviembre los valores superaron el 10%. Espacialmente, la materia orgánica no mostró diferencias significativas (Fs=11.73; P=0.081); sin embargo, los mayores niveles de materia orgánica, se presentaron en las estaciones uno, dos y cinco (Fig. 5b).
Fauna asociada
Se contabilizaron 2 412 organismos pertenecientes a 105 especies y 56 familias representadas en seis Phyla. Los moluscos dominaron el inventario con 85 especies y 40 familias, distribuidas en tres clases (Bivalvia, Gasterópoda y Polyplacophora), seguidos por Arthropoda con doce especies de la clase Malacostraca. Los Chordata (Ascidiacea) y Echinodermata (Asteroidea/Echinoidea), estuvieron representados por tres especies y tres familias, mientras que Anellida y Porifera, solo cuentan con un representante dentro del listado general (Tabla 1).
Tabla 1 Ubicación taxonómica de la fauna macrobentónica asociada a T. testudinum en el litoral costero del complejo lagunar Chacopata-Bocaripo, nororiente de Venezuela. Los nombres científicos ubicados entre paréntesis (), corresponden a la descripción original de la especie actualizada a través de WORMS.
| PHYLLUM | CLASE | FAMILIA | ESPECIE |
| Anellida | Polichaeta | Eunicidae | Leodice rubra (Grube, 1856) |
| Arthropoda | Malacostraca | Gecarcinidae | Gecarcinus lateralis (Guérin, 1832) |
| Menippidae | Menippe nodifrons Stimpson, 1859 | ||
| Mithracidae | Mithraculus forceps A. Milne-Edwards, 1875 (Mytrax forceps) | ||
| Mithraculus verrucosus (Edwards, 1832) (Mytrax verrucosus) | |||
| Omalacantha bicornuta (Latreille, 1825) (Microphrys bicornutus) | |||
| Pitho laevigata (A. Milne-Edwards, 1875) | |||
| Panopeidae | Eurypanopeus abbreviatus (Stimpson, 1860) | ||
| Panopeus herbstii H. Milne Edwards, 1834 | |||
| Penaeidae | Penaeus vannamei Boone, 1931 | ||
| Penaeus schmitti Burkenroad, 1936 | |||
| Portunidae | Callinectes sapidus Rathbun, 1896 | ||
| Xanthidae | Heteractaea ceratopus(Stimpson, 1860) | ||
| Chordata | Ascidiacea | Ascidiidae | Phallusia nigra Savigny, 1816 (Ascidia nigra) |
| Didemnidae | Didemnum perlucidumMonniot F., 1983 | ||
| Pyuridae | Pyura vittata (Stimpson, 1852) | ||
| Echinodermata | Asteroidea | Echinasteridae | Echinaster (Othilia) echinophorus (Lamarck, 1816) |
| Echinoidea | Echinometridae | Echinometra lucunter (Linnaeus, 1758) | |
| Toxopneustidae | Lytechinus variegatus (Lamarck, 1816) | ||
| Mollusca | Bivalvia | Arcidae | Anadara brasiliana (Lamarck, 1819) |
| Anadara secticostata (Reeve, 1844) | |||
| Arca zebra(Swainson, 1833) | |||
| Lunarca ovalis (Bruguière, 1789) (Anadara ovalis) | |||
| Cardiidae | Americardia media (Linnaeus, 1758) | ||
| Cardium reticulatum Fischer von Waldheim, 1807 | |||
| Dallocardia muricata (Linnaeus, 1758) (Trachicardium muricatum) | |||
| Trachycardium isocardia (Linnaeus, 1758) | |||
| Trigoniocardia antillarum (d’Orbigny, 1853) | |||
| Chamidae | Chama congregata Conrad, 1833 | ||
| Donacidae | Donax denticulatus Linnaeus, 1758 | ||
| Limidae | Limaria pellucida (C. B. Adams, 1848) (Lima pellucida) | ||
| Lucinidae | Ctena orbiculata (Montagu, 1808) (Codakia orbiculata) | ||
| Mactridae | Mactrotoma fragilis (Gmelin, 1791) (Mactra fragilis) | ||
| Mulinia cleryana (d’Orbigny, 1846) (Mactra cleryana) | |||
| Trinitasia iheringi (Dall, 1897) (Mactra iheringi) | |||
| Mytilidae | Botula fusca (Gmelin, 1791) | ||
| Modiolus squamosus Beauperthuy, 1967 | |||
| Musculus lateralis (Say, 1822) | |||
| Perna perna (Linnaeus, 1758) | |||
| Pectinidae | Argopecten nucleus (Born, 1778) | ||
| Pinnidae | Atrina seminuda (Lamarck, 1819) | ||
| Pteriidae | Pinctada imbricata Röding, 1798 | ||
| Pteria colymbus (Röding, 1798) | |||
| Solecurtidae | Tagelus divisus (Spengler, 1794) | ||
| Tellinidae | Ameritella consobrina (d’Orbigny, 1853) (Tellina consobrina) | ||
| Arcopagia fausta (Pulteney, 1799) (Tellina fausta) | |||
| Eurytellina lineata (W. Turton, 1819) (Tellina lineata) | |||
| Leporimetis ephippium (Spengler, 1798) (Psammotreta intastriata) | |||
| Psammotreta brevifrons (Say, 1834) (Macona cleryana) | |||
| Veneridae | Chione cancellata (Linnaeus, 1767) | ||
| Chione intapurpurea (Conrad, 1849) | |||
| Chione subrostrata Lamarck, 1818 | |||
| Pitar arestus (Dall & Simpson, 1901) | |||
| Tivela mactroides (Born, 1778) | |||
| Gasterópoda | Ancillariidae | Ancilla sp. | |
| Architectonicidae | Architectonica nobilis Röding, 1798 | ||
| Bullidae | Bulla striata Bruguière, 1792 | ||
| Calyptraeidae | Crepidula convexa Say, 1822 | ||
| Cerithiidae | Cerithium algicola Bruguière, 1792 | ||
| Cerithium eburneum Bruguière, 1792 | |||
| Cerithium litteratum (Born, 1778) | |||
| Cerithium lutosum Menke, 1828 | |||
| Cerithium muscarum Say, 1832 | |||
| Columbellidae | Costoanachis sparsa (Reeve, 1859) | ||
| Cotonopsis lafresnayi (P. Fischer & Bernardi, 1856) (Anachis lafresnayi) | |||
| Costellariidae | Pusia pulchella (Reeve, 1844) | ||
| Cypraeidae | Luria cinerea (Gmelin, 1791) (Cypraea cinerea) | ||
| Cystiscidae | Persicula muralis (Hinds, 1844) | ||
| Persicula interruptolineata (Megerle von Mühlfeld, 1816) | |||
| Persicula pulcherrima (Linnaeus, 1758) | |||
| Epithonidae | Janthina janthina(Linnaeus, 1758) | ||
| Fasciolariidae | Fasciolaria tulipa (Linnaeus, 1758) | ||
| Marginellidae | Austroginella muscaria(Lamarck, 1822) (Marginella muscaria) | ||
| Bullata sp1. | |||
| Bullata sp2. | |||
| Prunum apicinum (Menke, 1828) | |||
| Prunum marginatum (Born, 1778) | |||
| Prunum prunum (Gmelin, 1791) | |||
| Prunum roscidum (Redfield, 1860) (Marginella roscida) | |||
| Volvarina avena (Kiener, 1834) | |||
| Melongenidae | Melongena melongena (Linnaeus, 1758) | ||
| Mitridae | Neotiara nodulosa (Gmelin, 1791) (Mitra nodulosa) | ||
| Modulidae | Modulus modulus (Linnaeus, 1758) | ||
| Muricidae | Chicoreus brevifrons (Lamarck, 1822) (Murex brevifrons) | ||
| Phyllonotus pomum (Gmelin, 1791) (Murex pomun) | |||
| Vokesimurex rubidus (F. C. Baker, 1897) (Murex recurvirostris rubidus) | |||
| Urosalpinx cinerea (Say, 1822) | |||
| Nassariidae | Antillophos candeanus(d’Orbigny, 1842) | ||
| Antillophos oxyglyptus (Dall & Simpson, 1901) | |||
| Engoniophos unicinctus (Say, 1826) | |||
| Nassarius sp1. | |||
| Nassarius sp2. | |||
| Phrontis vibex (Say, 1822) (Nazzarius vivex) | |||
| Neritidae | Smaragdia viridis (Linnaeus, 1758) | ||
| Olividae | Oliva reticulata (Röding, 1798) | ||
| Olivella minuta (Link, 1807) | |||
| Pyramidellidae | Longchaeus candidus (Mörch, 1875) (Pyramidella candida) | ||
| Ranellidae | Charonia variegata (Lamarck, 1816) | ||
| Cymatium sp. Röding, 1798 | |||
| Tegulidae | Tegula fasciata (Born, 1778) | ||
| Terebridae | Terebra dislocata (Say, 1822) | ||
| Turbinellidae | Vasum muricatum (Born, 1778) | ||
| Turritellidae | Turritella variegata (Linnaeus, 1758) | ||
| Polyplacophora | Chitonidae | Acanthopleura granulata (Gmelin, 1791) | |
| Porifera | Demospongiae | Niphatidae | Niphates erecta Duchassaing & Michelotti, 1864 |
Parámetros comunitarios
Abundancia
El número de organismos contabilizados mostró diferencias temporales (F= 2.96; P= 0.031). En enero, julio y septiembre (grupo a) se cuantificaron las mayores abundancias (>430 ind), entre marzo y mayo (grupo b) se contabilizaron 376 y 357 ejemplares respectivamente, mientras que en noviembre (grupo c) se recolectaron 229 individuos (Fig. 6a). Entre las estaciones no se encontraron diferencias significativas (F= 0.18; P= 0.94); sin embargo, en la estación uno (530) y cuatro (511) se registraron los mayores valores, mientras que en la estación cinco (448 ind) se obtuvo la menor abundancia (Fig. 6b).

Figura 6a-b Abundancia temporal (a) y espacial (b) de la fauna macrobentónica asociada a T. testudinum en el litoral costero del complejo lagunar Chacopata-Bocaripo, nororiente de Venezuela. Letras iguales indican promedios estadísticamente similares (LSD; P>0.05), Ns: diferencias no significativas. Grupos= a, b, c.
De los 2 412 individuos colectados, el Phyla Mollusca aportó el 88.85% del total (2 143 ind), seguido por Echinodermata (152 ind), Arthropoda (93 ind) y en menor número Anellida, Chordata y Porifera con 13, 7 y 4 individuos, respectivamente (Tabla 2). Los moluscos (F= 0.20; P= 0.93), equinodermos (F= 0.57; P= 0.68) y artrópodos (F= 1.17; P= 0.34), se distribuyeron equitativamente entre las estaciones, mientras que temporalmente los moluscos (F= 4.75; P= 0.006) y los artrópodos (F= 2.83; P= 0.037) mostraron diferencias significativas, en cambio los equinodermos no presentaron cambios de abundancia en el tiempo (F= 1.83; P= 0.14); por su parte los cordados, poríferos y anélidos fueron contabilizados solo en mayo y julio.
Tabla 2 Variación espacio-temporal de la abundancia por grupos taxonómicos asociados a praderas de T. testudinum, en el litoral costero del complejo lagunar Chacopata-Bocaripo, nororiente de Venezuela.
| PHYLLUM | Estaciones | Meses (2017) | Total | % | |||||||||
| 1 | 2 | 3 | 4 | 5 | Ene | Mar | May | Jul | Sep | Nov | |||
| Mollusca | 472 | 406 | 404 | 462 | 399 | 427 | 364 | 287 | 444 | 392 | 229 | 2 143 | 88.85 |
| Artropoda | 15 | 18 | 15 | 7 | 38 | 37 | 0 | 24 | 12 | 20 | 0 | 93 | 3.19 |
| Echinodermata | 34 | 30 | 35 | 42 | 11 | 48 | 12 | 35 | 33 | 24 | 0 | 152 | 6.96 |
| Chordata | 7 | 0 | 0 | 0 | 0 | 0 | 0 | 7 | 0 | 0 | 0 | 7 | 0.29 |
| Porifera | 2 | 0 | 2 | 0 | 0 | 0 | 0 | 4 | 0 | 0 | 0 | 4 | 0.18 |
| Anellida | 0 | 10 | 3 | 0 | 0 | 0 | 0 | 0 | 13 | 0 | 0 | 13 | 0.53 |
| Total | 530 | 464 | 459 | 511 | 448 | 512 | 376 | 357 | 502 | 436 | 229 | 2 412 | 100% |
El Phyla Mollusca, estuvo representado principalmente por los gasterópodos Engoniophus unicinctus Say, 1826 (398 ind), Bulla striata Bruguière, 1792 (341), Ceritthium eburneum Bruguière, 1792 (298) y Prunum apicinum Menke, 1828 (122); mientras que los bivalvos más abundantes fueron: Chione cancellata Linnaeus, 1767 (63), Modiolus squamosus Beauperthuy, 1967 (45) y Donax denticulatus Linnaeus, 1758 (33). Las especies Lytechinus variegatus Lamarck, 1816 (53) y Panopeus herbstii Milne 1834 (32), también registraron altas abundancias (Tabla 3).
Tabla 3 Abundancia espacio-temporal de las especies identificadas en la pradera de T. testudinum, ubicada en el litoral costero del complejo lagunar Chacopata-Bocaripo, nororiente de Venezuela.
| Especies | Estaciones | Meses (2017) | |||||||||||
| 1 | 2 | 3 | 4 | 5 | Total | Ene | Mar | May | Jul | Sep | Nov | Total | |
| Engoniophos unicinctus | 122 | 75 | 74 | 91 | 36 | 398 | 138 | 71 | 2 | 81 | 83 | 23 | 398 |
| Bulla striata | 63 | 63 | 75 | 106 | 34 | 341 | 24 | 86 | 70 | 75 | 52 | 34 | 341 |
| Cerithium eburneum | 92 | 23 | 26 | 25 | 132 | 298 | 72 | 68 | 112 | 26 | 20 | 298 | |
| Prunum apicinum | 27 | 22 | 19 | 27 | 27 | 122 | 5 | 58 | 54 | 5 | 122 | ||
| Phrontis vibex | 23 | 7 | 12 | 30 | 25 | 97 | 4 | 6 | 11 | 19 | 57 | 97 | |
| P. interruptolineata | 3 | 18 | 18 | 38 | 7 | 84 | 55 | 9 | 20 | 84 | |||
| Chione cancellata | 9 | 18 | 11 | 5 | 20 | 63 | 18 | 2 | 15 | 28 | 63 | ||
| Lytechinus variegatus | 9 | 15 | 9 | 4 | 16 | 53 | 30 | 7 | 5 | 11 | 53 | ||
| Modiolus squamosus | 4 | 16 | 7 | 10 | 8 | 45 | 5 | 9 | 11 | 1 | 19 | 45 | |
| Austroginella muscaria | 7 | 6 | 17 | 12 | 42 | 4 | 24 | 14 | 42 | ||||
| Volvarina avena | 2 | 9 | 15 | 6 | 6 | 38 | 2 | 11 | 8 | 17 | 38 | ||
| Callinectes sapidus | 5 | 3 | 7 | 11 | 9 | 35 | 13 | 5 | 6 | 4 | 7 | 35 | |
| Donax denticulatus | 21 | 7 | 5 | 33 | 33 | 33 | |||||||
| Panopeus herbstii | 16 | 1 | 6 | 6 | 3 | 32 | 16 | 7 | 9 | 32 | |||
| Smaragdia viridis | 3 | 2 | 5 | 14 | 7 | 31 | 6 | 1 | 3 | 21 | 31 | ||
| Bullata sp1. | 11 | 10 | 8 | 29 | 29 | 29 | |||||||
| Antillophos candei | 6 | 5 | 15 | 26 | 11 | 15 | 26 | ||||||
| Omalacantha bicornuta | 6 | 2 | 3 | 14 | 1 | 26 | 9 | 2 | 10 | 5 | 26 | ||
| Trachircardium isocardia | 2 | 6 | 8 | 9 | 25 | 2 | 23 | 25 | |||||
| Nassarius sp. | 14 | 8 | 2 | 24 | 24 | 24 | |||||||
| Lunarca ovalis | 2 | 4 | 5 | 6 | 6 | 23 | 3 | 3 | 1 | 4 | 12 | 23 | |
| Penaeus schmitti | 15 | 3 | 5 | 23 | 23 | 23 | |||||||
| Prunum prunum | 2 | 6 | 3 | 10 | 1 | 22 | 9 | 2 | 11 | 22 | |||
| Arca zebra | 8 | 5 | 3 | 3 | 2 | 21 | 2 | 2 | 17 | 21 | |||
| Pitar arestus | 1 | 5 | 1 | 13 | 1 | 21 | 4 | 14 | 3 | 21 | |||
| Antillophos oxyglyptus | 4 | 15 | 19 | 15 | 3 | 1 | 19 | ||||||
| Cerithium lutosum | 13 | 4 | 1 | 18 | 4 | 14 | 18 | ||||||
| Echinaster echinophorus | 5 | 3 | 4 | 2 | 4 | 18 | 7 | 2 | 9 | 18 | |||
| Fasciolaria tulipa | 3 | 4 | 1 | 3 | 7 | 18 | 4 | 5 | 3 | 5 | 1 | 18 | |
| Bullata sp2. | 17 | 17 | 17 | 17 | |||||||||
| Heteroctea cerotopus | 7 | 2 | 4 | 4 | 17 | 17 | 17 | ||||||
| Leporimetis ephippium | 3 | 1 | 12 | 16 | 16 | 16 | |||||||
| Trinitasia iheringi | 5 | 5 | 3 | 3 | 16 | 3 | 5 | 2 | 3 | 3 | 16 | ||
| Melongena melongena | 6 | 4 | 4 | 1 | 15 | 2 | 9 | 4 | 15 | ||||
| Leodice rubra | 10 | 3 | 13 | 13 | 13 | ||||||||
| Atrina seminuda | 5 | 4 | 1 | 2 | 12 | 12 | 12 | ||||||
| Penaeus vannamei | 4 | 7 | 1 | 12 | 8 | 4 | 12 | ||||||
| Persicula muralis | 12 | 12 | 12 | 12 | |||||||||
| Persicula puclherrima | 2 | 2 | 6 | 2 | 12 | 4 | 2 | 6 | 12 | ||||
| Crepidula convexa | 4 | 1 | 4 | 10 | 6 | 1 | 3 | 10 | |||||
| Architectonica nobilis | 3 | 2 | 3 | 8 | 1 | 1 | 2 | 4 | 8 | ||||
| Cerithium algicola | 3 | 1 | 1 | 3 | 8 | 2 | 5 | 1 | 8 | ||||
| Chione subrostraca | 2 | 4 | 2 | 8 | 1 | 3 | 1 | 3 | 8 | ||||
| Janthiana janthina | 1 | 2 | 1 | 4 | 8 | 8 | 8 | ||||||
| Luria cinerea | 8 | 8 | 7 | 1 | 8 | ||||||||
| Tivela mactroides | 1 | 7 | 8 | 7 | 1 | 8 | |||||||
| Turritella variegata | 3 | 1 | 4 | 8 | 1 | 1 | 4 | 2 | 8 | ||||
| Vokesimurex rubidus | 3 | 3 | 2 | 8 | 4 | 1 | 3 | 8 | |||||
| Ameritella consobrina | 3 | 1 | 3 | 7 | 3 | 4 | 7 | ||||||
| Argopecten nucleus | 7 | 7 | 7 | 7 | |||||||||
| Costoanachis sparsa | 6 | 1 | 7 | 1 | 6 | 7 | |||||||
| Anadara brasiliana | 1 | 2 | 3 | 6 | 2 | 4 | 6 | ||||||
| Echinometra lucunter | 1 | 2 | 1 | 2 | 6 | 1 | 5 | 6 | |||||
| Pusia pulchella | 6 | 6 | 6 | 6 | |||||||||
| E. abbreviatus | 3 | 2 | 5 | 5 | 5 | ||||||||
| Gecarcinus lateralis | 1 | 2 | 2 | 5 | 5 | 5 | |||||||
| Pyura vittata | 5 | 5 | 5 | 5 | |||||||||
| Tegula fasciata | 1 | 4 | 5 | 5 | 5 | ||||||||
| Ancilla sp. | 4 | 4 | 4 | 4 | |||||||||
| Botula fusca | 4 | 4 | 4 | 4 | |||||||||
| Cerithium muscarum | 2 | 2 | 4 | 4 | 4 | ||||||||
| Chama congregata | 1 | 2 | 1 | 4 | 4 | 4 | |||||||
| Chicoreus brevifrons | 1 | 3 | 4 | 4 | 4 | ||||||||
| Didemnun perlucidum | 4 | 4 | 4 | 4 | |||||||||
| Modulus modulus | 1 | 2 | 1 | 4 | 4 | 4 | |||||||
| Mulinia cleryana | 2 | 1 | 1 | 4 | 1 | 3 | 4 | ||||||
| Oliva reticulata | 1 | 3 | 4 | 4 | 4 | ||||||||
| Terebra dislocata | 4 | 4 | 4 | 4 | |||||||||
| Americardia media | 3 | 3 | 3 | 3 | |||||||||
| Cerithium literatum | 2 | 1 | 3 | 1 | 2 | 3 | |||||||
| Menippe nodifrons | 3 | 3 | 3 | 3 | |||||||||
| Olivella minuta | 3 | 3 | 3 | 3 | |||||||||
| Pitho laevigata | 1 | 2 | 3 | 3 | 3 | ||||||||
| Pteria colymbus | 1 | 1 | 1 | 3 | 3 | 3 | |||||||
| Vasum muricatum | 1 | 1 | 1 | 3 | 3 | 3 | |||||||
| Acanthopleura granulata | 2 | 2 | 2 | 2 | |||||||||
| Charonia variegata | 2 | 2 | 2 | 2 | |||||||||
| Chione intapurpurea | 1 | 1 | 2 | 1 | 1 | 2 | |||||||
| Cotonopsis lafresnayi | 1 | 1 | 2 | 1 | 1 | 2 | |||||||
| Cymatium sp. | 2 | 2 | 2 | 2 | |||||||||
| Eurytellina lineata | 2 | 2 | 2 | 2 | |||||||||
| Mactrotoma fragilis | 2 | 2 | 2 | 2 | |||||||||
| Mithrax aculeatus | 1 | 1 | 2 | 2 | 2 | ||||||||
| Nassarius sp2. | 2 | 2 | 2 | 2 | |||||||||
| Phallusia nigra | 2 | 2 | 2 | 2 | |||||||||
| Tagelus divisus | 1 | 1 | 2 | 2 | 2 | ||||||||
| Urosalpinx cinerea | 2 | 2 | 2 | 2 | |||||||||
| Anadara secticostata | 1 | 1 | 1 | 1 | |||||||||
| Arcopagia fausta | 1 | 1 | 1 | 1 | |||||||||
| Cardium reticulatum | 1 | 1 | 1 | 1 | |||||||||
| Ctena orbiculata | 1 | 1 | 1 | 1 | |||||||||
| Dallocardia muricata | 1 | 1 | 1 | 1 | |||||||||
| Limaria pellucida | 1 | 1 | 1 | 1 | |||||||||
| Longchaeus candidus | 1 | 1 | 1 | 1 | |||||||||
| Macona cleryana | 1 | 1 | 1 | 1 | |||||||||
| Musculus lateralis | 1 | 1 | 1 | 1 | |||||||||
| Mytrax forceps | 1 | 1 | 1 | 1 | |||||||||
| Neotiara nodulosa | 1 | 1 | 1 | 1 | |||||||||
| Niphates erecta | 1 | 1 | 1 | 1 | |||||||||
| Perna perna | 1 | 1 | 1 | 1 | |||||||||
| Phyllonotus pomum | 1 | 1 | 1 | 1 | |||||||||
| Prunum marginatum | 1 | 1 | 1 | 1 | |||||||||
| Prunum roscidum | 1 | 1 | 1 | 1 | |||||||||
| Trigoniocardia antillarum | 1 | 1 | 1 | 1 | |||||||||
| Total | 529 | 464 | 459 | 511 | 448 | 2 412 | 512 | 376 | 357 | 502 | 436 | 229 | 2 412 |
T= total; Ene= Enero; Mar= Marzo; May=Mayo; Jul= Julio Sep= Septiembre; Nov= Noviembre.
Biomasa
Los moluscos fueron el grupo con mayor aporte de biomasa (3 048.85 g), seguidos por los equinodermos (2 343.25 g). Entre los grupos restantes, los artrópodos aportaron 445.47 g de biomasa, mientras que en su conjunto los poríferos, cordados y anélidos apenas superaron los 100 g, representando el 1.81% de la biomasa total (Fig. 7).
Riqueza
La riqueza temporal presentó diferencias significativas en el tiempo (F=10.75; P=0.0000) (Fig. 8a), siendo mayor en julio, septiembre y enero (grupo a) con 50, 36 y 35 especies respectivamente. El número de especies por estación, no mostró diferencias significativas entre las estaciones 1, 2 y 3. La riqueza espacial osciló entre 57 y 60 especies, mientras que en las estaciones 4 y 5, se identificaron 47 especies (Fig. 8b).
Diversidad
La diversidad expresó cambios mensuales (F=9.42; P=0.0000), con un registro general de 2.04 bits/ind (Fig. 9a). En septiembre se obtuvo la mayor diversidad (2.63 bits/ind) y en noviembre el menor valor (1.63 bits/ind). Entre las estaciones no se observó variabilidad significativa, con valores superiores a 1.70 bits/ind, en todas las estaciones (Fig. 9b).

Figura 9a-b Diversidad temporal (a) y espacial (b) de la fauna macrobentónica asociada a T. testudinum en el litoral costero del complejo lagunar Chacopata-Bocaripo, nororiente de Venezuela. Letras iguales indican promedios estadísticamente similares (LSD; P>0.05), Ns: diferencias o significativas. Grupos= a, b, c, d y e.
Frecuencia
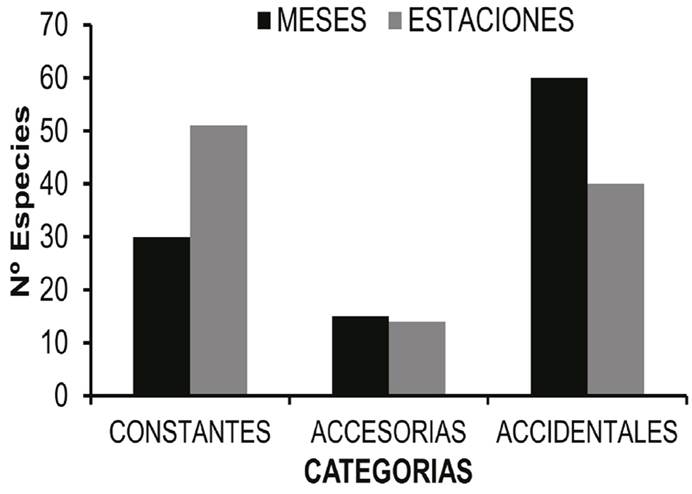
La frecuencia de aparición mostró que 30 especies son constantes en el tiempo y en el espacio (más del 50% de los muestreos). Veintidós especies estuvieron presentes entre el 25 y el 50% de los meses muestreados, considerándose especies accesorias; sin embargo, estas mismas especies se presentaron en más de la mitad de las estaciones de muestreo. Las 55 especies restantes, mostraron comportamientos variables con relación al tiempo y a las estaciones, presentándose como accesorias o accidentales (Tabla 4). Los gasterópodos, B. striata y E. unicinctus, fueron las únicas especies presentes en todos los meses y estaciones de muestreo
Tabla 4 Constancia espacio-temporal de la fauna macrobentónica asociada a T. testudinum, ubicada en el litoral costero del complejo lagunar Chacopata-Bocaripo, nororiente de Venezuela.
| Meses (2017) | Estaciones | ||||||||||||
| Especies | Ene | Mar | May | Jul | Sep | Nov | Cat. | 1 | 2 | 3 | 4 | 5 | Cat. |
| Leodice rubra | X | Acd | X | X | Acs | ||||||||
| Callinectes sapidus | X | X | X | X | X | C | X | X | X | X | X | C | |
| Omalacantha bicornuta | X | X | X | X | C | X | X | X | X | X | C | ||
| Eurypanopeus abbreviatus | X | X | Acs | X | X | Acd | |||||||
| Panopeus herbstii | X | X | X | Acs | X | X | X | X | X | C | |||
| Penaeus vannamei | X | X | Acs | X | X | X | C | ||||||
| Gecarcinus lateralis | X | Acd | X | Acd | |||||||||
| Heteroctea cerotopus | X | Acd | X | X | X | X | C | ||||||
| Menippe nodifrons | X | Acd | X | Acd | |||||||||
| Mithraculus forceps | X | Acd | X | Acd | |||||||||
| Mithraculus verrucosus | X | Acd | X | X | X | C | |||||||
| Penaeus schmitti | X | Acd | X | X | X | C | |||||||
| Pitho laevigata | X | Acd | X | X | Acs | ||||||||
| Echinometra lucunter | X | X | Acs | X | X | X | X | C | |||||
| Lytechinus variegatus | X | X | X | X | C | X | X | X | X | X | C | ||
| Echinaster echinophorus | X | X | X | C | X | X | X | X | X | C | |||
| Phallusia nigra | X | Acd | X | Acd | |||||||||
| Didemnun perlucidum | X | Acd | X | X | Acs | ||||||||
| Pyura vittata | X | Acd | X | Acd | |||||||||
| Lunarca ovalis | X | X | X | X | X | C | X | X | X | X | X | C | |
| Modiolus squamosus | X | X | X | X | X | C | X | X | X | X | X | C | |
| Trinitasia iheringi | X | X | X | X | X | C | X | X | X | X | C | ||
| Chione cancellata | X | X | X | X | C | X | X | X | X | X | C | ||
| Chione subrostraca | X | X | X | X | C | X | X | X | C | ||||
| Arca zebra | X | X | X | C | X | X | X | X | X | C | |||
| Pinctada imbricata | X | X | X | C | X | X | X | X | C | ||||
| Pitar arestus | X | X | X | C | X | X | X | X | X | C | |||
| Ameritella consobrina | X | X | Acs | X | X | X | C | ||||||
| Anadara brasiliana | X | X | Acs | X | X | X | C | ||||||
| Chione intapurpurea | X | X | Acs | X | X | Acs | |||||||
| Mulinia cleryana | X | X | Acs | X | X | X | C | ||||||
| Tivela mactroides | X | X | Acs | X | X | Acs | |||||||
| Trachircardium isocardia | X | X | Acs | X | X | X | C | ||||||
| Americardia media | X | Acd | X | Acd | |||||||||
| Anadara secticostata | X | Acd | X | Acd | |||||||||
| Arcopagia fausta | X | Acd | X | Acd | |||||||||
| Argopecten nucleus | X | Acd | X | Acd | |||||||||
| Atrina seminuda | X | Acd | X | X | X | X | C | ||||||
| Botula fusca | X | Acd | X | Acd | |||||||||
| Cardium reticulatum | X | Acd | X | Acd | |||||||||
| Chama congregata | X | Acd | X | X | X | C | |||||||
| Ctena orbiculata | X | Acd | X | Acd | |||||||||
| Dallocardia muricata | X | Acd | X | Acd | |||||||||
| Donax denticulatus | X | Acd | X | X | X | C | |||||||
| Eurytellina lineata | X | Acd | X | Acd | |||||||||
| Leporimetis ephippium | X | Acd | X | X | X | C | |||||||
| Limaria pellucida | X | Acd | X | Acd | |||||||||
| Mactrotoma fragilis | X | Acd | X | Acd | |||||||||
| Musculus lateralis | X | Acd | X | Acd | |||||||||
| Perna perna | X | Acd | X | Acd | |||||||||
| Psammotreta brevifrons | X | Acd | X | Acd | |||||||||
| Pteria colymbus | X | Acd | X | X | X | C | |||||||
| Tagelus divisus | X | Acd | X | X | Acs | ||||||||
| Trigoniocardia antillarum | X | Acd | X | Acd | |||||||||
| Engoniophos unicinctus | X | X | X | X | X | X | C | X | X | X | X | X | C |
| Bulla striata | X | X | X | X | X | X | C | X | X | X | X | X | C |
| Cerithium eburneum | X | X | X | X | C | X | X | X | X | X | C | ||
| Fasciolaria tulipa | X | X | X | X | X | C | X | X | X | X | X | C | |
| Phrontis vibex | X | X | X | X | X | C | X | X | X | X | X | C | |
| Architectonica nobilis | X | X | X | X | C | X | X | X | C | ||||
| Cerithium algicola | X | X | X | C | X | X | X | X | C | ||||
| Prunum apicinum | X | X | X | X | X | C | X | X | X | X | X | C | |
| Smaragdia viridis | X | X | X | X | C | X | X | X | X | X | C | ||
| Turritella variegata | X | X | X | X | C | X | X | X | C | ||||
| Volvarina avena | X | X | X | X | C | X | X | X | X | X | C | ||
| Crepidula convexa | X | X | X | C | X | X | X | C | |||||
| Austroginella muscaria | X | X | X | C | X | X | X | X | C | ||||
| Melongena melongena | X | X | X | C | X | X | X | X | C | ||||
| Persicula interruptolineata | X | X | X | C | X | X | X | X | X | C | |||
| Prunum prunum | X | X | X | C | X | X | X | X | X | C | |||
| Vasum muricatum | X | X | X | X | C | X | X | Acs | |||||
| Vokesimurex rubidus | X | X | X | C | X | X | X | C | |||||
| Antillophos candei | X | X | Acs | X | X | X | C | ||||||
| Neotiara nodulosa | X | X | Acs | X | X | Acs | |||||||
| Cerithium literatum | X | X | Acs | X | X | Acs | |||||||
| Cerithium lutosum | X | X | Acs | X | X | X | C | ||||||
| Cotonopsis lafresnayi | X | X | Acs | X | X | Acs | |||||||
| Luria cinerea | X | X | Acs | X | Acd | ||||||||
| Ancilla sp. | X | Acd | X | Acd | |||||||||
| Antillophos oxyglyptus | X | X | Acd | X | Acd | ||||||||
| Bullata sp1. | X | Acd | X | X | X | C | |||||||
| Bullata sp2. | X | Acd | X | Acd | |||||||||
| Pusia pulchella | X | Acd | X | Acd | |||||||||
| Cerithium muscarum | X | Acd | X | X | Acs | ||||||||
| Charonia variegata | X | Acd | X | Acd | |||||||||
| Chicoreus brevifrons | X | Acd | X | X | Acs | ||||||||
| Costoanachis sparsa | X | Acd | X | X | X | C | |||||||
| Cymatium sp. | X | Acd | X | Acd | |||||||||
| Janthiana janthina | X | Acd | X | X | X | X | C | ||||||
| Longchaeus candidus | X | Acd | X | Acd | |||||||||
| Modulus modulus | X | Acd | X | X | X | C | |||||||
| Nassarius sp. | X | Acd | X | Acd | |||||||||
| Nassarius sp1. | X | Acd | X | X | X | C | |||||||
| Oliva reticulata | X | Acd | X | Acs | |||||||||
| Olivella minuta | X | Acd | X | Acd | |||||||||
| Persicula pulcherrima | X | Acd | X | Acd | |||||||||
| Persicula muralis | X | Acd | X | Acd | |||||||||
| Phyllonotus pomum | X | Acd | X | Acd | |||||||||
| Prunum marginatum | X | Acd | X | Acd | |||||||||
| Prunum roscidum | X | Acd | X | Acd | |||||||||
| Tegula fasciata | X | Acd | X | X | Acs | ||||||||
| Terebra dislocata | X | Acd | X | Acd | |||||||||
| Urosalpinx cinérea | X | Acd | X | Acd | |||||||||
| Acanthopleura granulata | X | Acd | X | Acd | |||||||||
| Niphates erecta | X | Acd | X | Acd | |||||||||
E= enero, M= marzo, My= mayo, J= julio, S= septiembre, N= noviembre, CAT= categoría, C= constante, Acs= accesoria, Acd= accidentales.
Comparación espacial de la comunidad
El dendrograma mostró que las estaciones dos y tres, situadas en la zona intermedia de la pradera, comparten 39 especies. La estación uno (boca de la laguna de Bocaripo) presentó la mayor disimilitud respecto al resto de las estaciones, registrando la mayor variación mensual en las especies, con un alto predominio de especies accidentales (53). Entre tanto, las estaciones cuatro y cinco (cercanas a la boca de la laguna de Chacopata), mostraron mayor similitud con las estaciones dos y tres y baja similitud con la estación uno (Fig. 11).
Comparación temporal de la comunidad
El dendrograma mostró que julio, septiembre y enero (grupo a), constituyen un grupo con 16 especies comunes. El mes de noviembre (grupo b) presentó una mayor disimilitud con respecto al resto de los meses, registrándose los valores más bajos en todos los parámetros comunitarios determinados; no obstante, el inventario de especies identificadas en mayo fue similar al registrado en marzo, conformando un grupo aparte (grupo c) (Fig. 12).
Análisis de Correspondencia Canónica
La diversidad de la comunidad evaluada (Fig. 13), está asociada con altas concentraciones de materia orgánica (r=0.81), porcentajes de limo (r=0.61) y con el aumento de la temperatura (con un promedio de 26.72 ± 1.20). La riqueza y la abundancia, se asociaron con incrementos en las concentraciones de clorofila a, altos porcentajes de arenas medias y gravas gruesas, mientras que la biomasa estuvo relacionada positiva y significativamente con los porcentajes de arenas gruesas (r=0.89), gravas medias (r=0.77) y seston total (r= 0.51).
DISCUSIÓN
Las características hidrobiológicas del complejo lagunar Chacopata-Bocaripo, reflejan el resultado de procesos oceanográficos y de la dinámica estacional del litoral adyacente (Oliveros, 1984; Ramírez, 1996). Los registros de temperatura y salinidad obtenidos en la pradera evaluada coinciden con otros estudios realizados en la zona, los cuales señalan que la poca variabilidad en ambos parámetros está relacionada a la ausencia de afluentes de agua dulce y la baja pluviosidad de la zona (Prieto et al., 1999; Cedeño et al., 2010; Pérez et al., 2012; López-Monroy & Trocoli-Ghinaglia, 2014), además de la baja profundidad de la pradera, (1 metro aproximadamente).
Las fluctuaciones en los niveles de clorofila a y seston orgánico total, aunque no fueron significativas, estuvieron influenciadas por la inestabilidad ambiental producida por el fenómeno de surgencia costera característico del nororiente de Venezuela, que genera un aumento en la productividad primaria del área y favorece el crecimiento y reproducción de diversas especies, permitiendo la formación de extensos bancos naturales de moluscos bivalvos de importancia socioeconómica para la región nororiental de Venezuela (Gómez, 1996; Rueda-Roa & Muller-Karger, 2013; Díaz-Fermín & Acosta-Balbás, 2018), que a su vez constituyen el sustrato para la fijación de otros organismos y desde donde se da un flujo casi continuo de larvas y juveniles hacia ambientes cercanos como los pastos marinos y manglares.
La ubicación y baja profundidad de la pradera analizada, la expone a la acción constante del oleaje. En este sentido, la surgencia continua estimulada por los fuertes vientos provenientes del noreste (Gómez, 2007), generan la remoción del fondo marino y produce cambios en la conformación y textura del sedimento, ocasionando que las partículas finas se mantengan resuspendidas en la columna de agua durante la época más intensa de la surgencia (enero-mayo), para luego asentarse en el sedimento, quedando atrapados por la pradera de T. testudinum. Esta dinámica explicaría el aumento en los porcentajes de arenas finas, limos y materia orgánica posterior a los meses de enero-mayo, donde los vientos del noreste son más fuertes.
La predominancia de partículas finas, muy finas y limosas, en sus diferentes fracciones han sido descritas para las lagunas de Chacopata y Bocaripo, caracterizadas por presentar sedimentos superficiales de tipo areno-limosos (Laguna de Chacopata) y diferentes fracciones de arena: muy gruesa, gruesa, media y fina (Laguna de Bocaripo) (Fuentes, 1999; Prieto et al., 1999; Pérez-Loreto et al., 2015). Las características sedimentológicas antes descritas, son similares a las señaladas en otras praderas del Caribe Venezolano (Prieto et al., 1999; Jiménez et al., 2000; Rodríguez & Villamizar, 2000; Bitter et al., 2009; Rodríguez, 2017), con niveles de materia orgánica menores a los reportados en este estudio.
En general, la composición granulométrica y la materia orgánica en la pradera estudiada podrían estar influenciadas por el flujo continuo de material sedimentario que es aportado desde el interior de las lagunas hacia el litoral adyacente. En este sentido, las lagunas de Chacopata y Bocaripo, actúan como áreas de gran provisión de materia orgánica autóctona, provenientes particularmente de la descomposición de la hojarasca del manglar, que es exportada a la zona externa del litoral costero adyacente, durante el proceso de llenado y vaciado de las mismas.
Lo anterior explicaría los altos niveles de materia orgánica registrados en la pradera evaluada, lo que a su vez indicaría que la pradera estaría almacenando detritus, producto de la fragmentación y degradación de sus hojas y materia orgánica procedente de la descomposición del manto residual de hojarasca de los parches de R. mangle cercanos a la boca de las lagunas Bocaripo y Chacopata y de los manglares en el interior de ambas lagunas. Un hecho que soporta esta hipótesis, es que las estaciones uno y cinco, ubicadas en la desembocadura de ambas lagunas, presentaron los mayores porcentajes de partículas finas y materia orgánica.
Los procesos de resuspensión y posterior asentamiento de las partículas sedimentarias, en conjunto con los niveles de materia orgánica del sedimento, son factores responsables de los cambios estructurales de la fauna asociada (Jiménez & Liñero, 1993; Bitter et al., 2009). De esta forma, la poca variabilidad espacial en las características granulométricas y factores ambientales, permiten explicar la distribución homogénea de la comunidad de invertebrados a lo largo de la pradera, mientras que las variaciones temporales en el sedimento, pudieron modular los cambios significativos en la estructura comunitaria.
Los valores generales de abundancia y riqueza superan los reportes de Prieto et al. (1999) y Cedeño et al. (2010) para sustratos someros y raíces de mangle rojo (R. mangle) dentro la laguna de Bocaripo, respectivamente, siendo superiores a los registrados por Villafranca & Jiménez (2004) y Acosta et al. (2007) en bancos naturales de moluscos de importancia comercial en la costa nororiental de Venezuela.
La estructura comunitaria descrita es similar a la reportada para otros ecosistemas del Caribe Venezolano, coincidiendo con los estudios de Jiménez et al. (2000), Rodríguez & Villamizar (2000); Bitter et al. (2009), Sánchez (2013), Rodríguez (2017) y Díaz-Fermín & Acosta-Balbás (2018) en praderas de la bahía de Mochima, Parque Nacional Morrocoy y en agregaciones de A. zebra en las costas de Guayacán, respectivamente. Sin embargo, fue superior a lo descrito para el Caribe Colombiano (Garzón-Urbina, 2006; Aguirre-Aguirre et al., 2007; Albis, 2007; Otero & Romaní, 2009; Ospina et al., 2010), Centroamérica (Fonseca et al., 2007; Nielsen-Muñoz & Cortez, 2008) e islas caribeñas (Corlett & Jones, 2007). Esta diferencia entre ambientes similares de la región Neotropical, se debe principalmente a que esta porción caribeña de Venezuela, presenta una mayor productividad marina y elevada complejidad en sus ecosistemas, dando como resultado una estructura comunitaria más diversa, favorecida por los procesos de surgencia costera.
La conectividad existente entre la pradera estudiada y el sistema de manglar, principalmente con R. mangle, que bordea ambas lagunas, asociado a la dinámica oceanografíca de los cuerpos lagunares de Chacopata y Bocaripo, así como la presencia de bancos de A. zebra, P. perna y P. viridis en la región del nororiental de Venezuela, conforman una compleja red trófica que genera un intercambio de organismo entre dichos ambientes; esta dinámica explicaría los cambios temporales de la macrofauna bentónica identificada, siendo la heterogeneidad de ambientes lo que permite la coexistencia e intercambio de organismos, generando un aumento de la biodiversidad (Casares & Creed, 2008; Downes et al., 1998).
El inventario estuvo dominado ampliamente por los moluscos (86 especies y 2143 ind), cuyos registros de riqueza y abundancia son superiores a los mencionados para otras praderas del nororiente de Venezuela (Jiménez, 1994; Prieto et al., 1999; Jiménez et al., 2000; Rodríguez & Villamizar, 2000; Prieto et al., 2003; Díaz-Díaz & Liñero-Arana, 2004; Jiménez et al., 2005), estando asociados a bajos porcentajes de arenas finas, muy finas y limos, viéndose afectada por altos niveles de materia orgánica y temperaturas superiores a los 27 °C.
Los moluscos, conjuntamente con los equinodermos y crustáceos, fueron los grupos más frecuentes, considerados como los más representativos de la fauna asociada a praderas de T. testudinum, ya que utilizan estos ambientes de manera ocasional, como áreas de alimentación o refugio. En el caso de los crustáceos y los equinodermos, el 60% de las especies, se presentaron como accidentales o accesorias, lo que coincide con Kikuchi & Peres (1977), Bitter (1993), Bitter et al. (2009) y Ortiz (2007), quienes describen intercambios diarios de hasta el 50% de crustáceos desde las praderas de T. testudinum, a ambientes cercanos como corales y manglares; mientras que Hernández-Ávila et al. (2007), destaca que la presencia de equinodermos en parches de T. testudinum, se debe a que éstos son principalmente herbívoros.
Las comunidades asociadas a T. testudinum, están integradas principalmente por especies accidentales (Kikuchi & Peres, 1977; Bitter, 1999; Ortiz, 2007); resaltando que aunque las asociaciones planta-animal son fuertes, no son necesariamente estáticas, por lo que la migración espacio-temporal a ambientes circundantes es común, esto explicaría que el 55% de las especies se presentaron de forma accidental en todas las estaciones. Es por ello que la predominancia de especies accesorias y accidentales explica la poca similitud en la estructura comunitaria entre las estaciones y meses, hecho relacionado a la convergencia de ambientes con distintos grados de heterogeneidad, asociados a la pradera evaluada, los cuales se establecen principalmente en las estaciones situadas en las desembocaduras de Bocaripo y Chacopata, lo que promueve cambios en la composición de especies y favorece la diversidad.
Los resultados encontrados demuestran la importancia de la conectividad y heterogeneidad entre los ecosistemas, considerando que algunas de las especies identificadas abundan en otros ambientes, como el caso de D. denticulatus, bivalvo característico de playas arenosas y que fue identificado en los márgenes de la pradera evaluada, mientras que algunas especies como M. melongena, P. prunum, P. apicicum y P. herbstii, han sido reportadas como parte de la fauna asociada al manglar de las lagunas de Bocaripo y Chacopata.
Los cambios en la composición de especies y la granulometría del sedimento estuvieron influenciados por la dinámica interna del complejo lagunar Bocaripo-Chacopata, los procesos oceanográficos del área producto de la surgencia costera, así como por la interconectividad que presenta la pradera evaluada con otros ambientes cercanos, como los manglares; es por ello que T. testudinum constituye un ambiente de gran importancia en el mantenimiento de la diversidad, abundancia y biomasa de organismos en las zonas adyacentes a las lagunas costeras en el nororiente de Venezuela.











 text new page (beta)
text new page (beta)