Introducción
La distribución de los seres vivos depende de factores de diversa índole que abarcan escalas espaciales y temporales muy distintas, desde globales hasta locales, o debido a interacciones biológicas. Las comunidades ecológicas son inherentemente complejas por la permanente existencia de un número importante de variables del hábitat que influyen sobre las especies, y la gran cantidad de especies que coexisten e interactúan. En general, las interacciones son amplias y diversas, involucrando a gremios multiespecíficos de competidores que, en conjunto, son un mecanismo importante que estructura a las comunidades naturales (Albrecht & Gotelli, 2001; Palmer et al., 2003). Los peces son vertebrados acuáticos de sangre fría, dotados de respiración branquial y provisto de aletas (Pérez-Hernández & Torres-Orozco, 2006). En el mundo se han descrito cerca de 21,700 especies de peces (Moyle & Cech, 2000), pero se estima que esta cifra podría ascender a 28,000 (Nelson et al., 2004). Información reciente en México estima que los peces constituyen el grupo más numeroso, con aproximadamente 2,763 especies (Espinosa-Pérez, 2013). En aguas epicontinentales estas comunidades de peces se encuentran representadas por 47 Familias que agrupan cerca de 507 especies, de las cuales 375 están virtualmente confinadas a las aguas dulces; del total, 145 son especies primarias o exclusivamente dulceacuícolas; 350 son secundarias, capaces de tolerar cierta salinidad y 57 son vicarias; nombre que reciben aquellas especies que muestran una gran afinidad con las formas marinas, pero curso de su evolución se han adaptado únicamente al agua dulce (Espinosa et al., 2011). Para el sureste Mexicano, Rodiles-Hernández (2005) registra 207 especies para el estado de Chiapas, mientras que Martínez & Gómez (2006) reportan 129 especies en las cuencas hidrológicas de Oaxaca. Chumba y Barrientos (2010) reportan 419 especies, de las cuales 23 son nativas para la península de Yucatán. Para el estado de Tabasco, Espinosa-Pérez y Daza-Zepeda (2005), registran 14 órdenes, 28 familias, 58 géneros y 95 especies, de las cuales, nueve son endémicas de la cuenca Grijalva-Usumacinta y seis son introducidas. No obstante la cantidad de antecedentes, la diversidad de peces en el mundo podría ser mayor debido a las recientes modificaciones en la identidad taxonómica de algunas taxa (Bockmann & Guazzeli, 2003; Rodiles-Hernández, 2005; Miller et al., 2005).
Por lo tanto, el presente trabajo plantea: I). Evaluar los posibles cambios espaciales y temporales de la comunidad íctica en la subcuenca del río San Pedro durante dos épocas climáticas. II). Actualizar el inventario de la composición de las especies III). Determinar las principales variables ambientales asociadas a la distribución de las especies en los sitios de la zona baja de la subcuenca.
Materiales y métodos
Área de estudio. El río San Pedro se localiza entre las coordenadas 17° 16' 46.69" N, 90° 59' 15.71" W del estado de Tabasco. Se realizaron cinco salidas de muestreo a los sitios I, II y III (zona de inundación) y en los sitios IV y V (del cauce principal del río), durante la época de estiaje o seca (marzo-agosto 2007) y la época húmeda o mayor precipitación (septiembre 2007- febrero 2008), según Velazquez (1994) estos últimos están ubicados en la parte baja de la subcuenca del río San Pedro (Fig. 1). En cada sitio se determinó el oxígeno disuelto (mg l-1), la temperatura (°C) y el pH con un medidor de calidad de agua HANNA, HI-9828; asimismo se midió la transparencia (cm) y la profundidad (cm). Para la captura de los peces se utilizó una red tipo camaronera de 7.25 m de largo con 5.20 m de abertura de boca, con tamaño de poro de malla 1.9 cm. Cada arrastre tuvo una duración de 6 minutos. Se calculó el área de barrido del arte de pesca según la metodología de Stevenson (1982), cubriéndose un área de arrastre de 1,404 m2. Los organismos capturados fueron fotografiados y posteriormente fijados en formol 10%. Las muestras fueron lavadas con agua de la llave y conservadas en alcohol etílico al 70%. Para la identificación se utilizaron las claves de peces dulceacuícolas Álvarez, (1970); Schmitter-Soto, (1998) y Miller et al. (2005) Los organismos fueron validados con el material ictiológico de la Colección de peces de El Colegio de la Frontera Sur (ECOSUR), Unidad San Cristóbal (ECOSC).
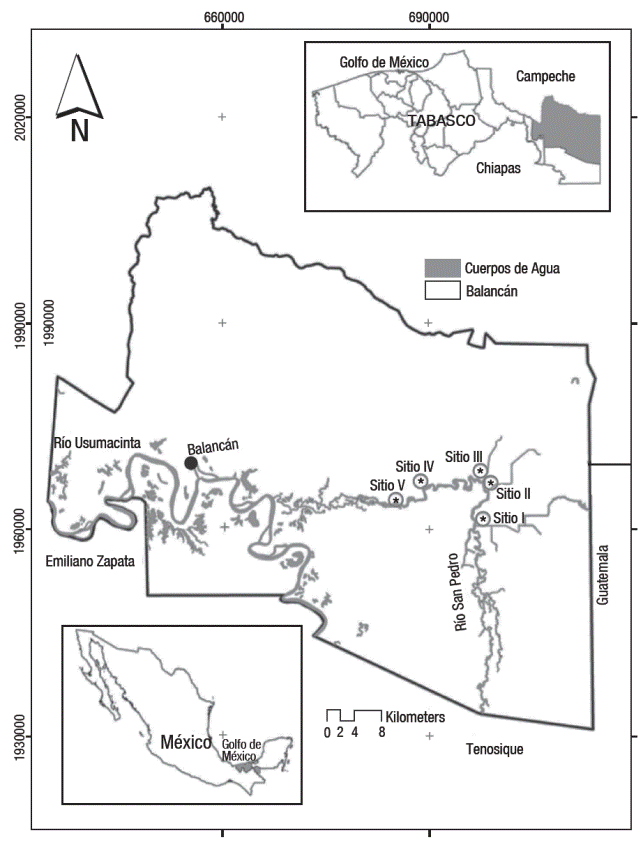
Figura 1 Area de estudio. Sitios de muestros del subsistema; zona de indundación (I,II y III) y el subsiste ma; cauce principal del río (IV y V) de la zona baja del río San Pedro, Balancán, Tabasco.
Análisis de la composición taxonómica y riqueza. Para observar los cambios espaciales y temporales en la comunidad de peces se utilizaron los índices de riqueza de especies y equidad. La diversidad de especies en cada muestra se estimó por medio del índice de Shannon-Wiener:
donde,
S = número total de especies en cada muestra;
Ni =número de individuos de la especie i;
N = número total de individuos.
Para determinar si la abundancia de las especies era semejante en los diferentes sitios, se empleó el índice de equidad de Pielou (1975) utilizando la siguiente fórmula:
Donde:
H' = índice de Shannon-Wiener
log2 S = es la diversidad máxima (H'max).
La dominancia (λ) de especies se estimó según el índice no sesgado de Simpson:
Los valores de riqueza y abundancia corresponden al número de especies encontradas e individuos recolectados. Respecto a la diversidad de las especies, equidad y dominancia se analizaron con el Índice de Shannon, usando el logaritmo natural. Estos valores se obtuvieron con el programa Past (Hammer et al., 2001).
Finalmente, se empleó el Coeficiente de Similitud de Jaccard para expresar el grado en el que dos muestras eran semejantes por su composición de especies, por el cual es una medida inversa de la diversidad, que se refiere al cambio de especies entre dos estaciones (Pielou, 1975; Magurran, 1989). El intervalo de valores para el índice de Jaccard va de 0, cuando no hay especies compartidas entre ambas estaciones, hasta 1, cuando dos estaciones tienen la misma composición de especies. Este coeficiente se obtuvo según la siguiente expresión:
donde a = número de especies presentes en el sitio A,
b = número de especies presentes en el sitio B y
C =número de especies presentes en ambos sitios A y B.
Este análisis fue realizado con el programa Multivarite Statistical Package 3.2 (Kovach, 2002)
Análisis estadísticos. Debido a que no se cumplió con los supuestos del ANDEVA (normalidad y homogeneidad de varianza) entre la diversidad y los sitios, se procedió a utilizar un análisis de varianza no paramétrico de Kruskal-Wallis (Zar, 1999). Para detectar las posibles diferencias entre sitios, se utilizó la prueba de Mann-Whitney (Wackerly et al., 2002). Asimismo para determinar la correlación existente entre las variables ambientales y la composición de especies en el río San Pedro en función de los sitios, se utilizó un análisis de correspondencia canónica (ACC) (Ter Braak, 1995). Los datos fueron transformados aplicándose Log10 (x + 1) (Underwood, 1997) previo a su análisis. El análisis se realizó con el programa STATISTICA 8.0 (StatSoft, 2007).
Resultados
Composición taxonómica y riqueza de las especies. Se capturó un total de 1,035 individuos, pertenecientes a 14 familias, 25 géneros y 33 especies (Tabla 1). La familia Cichlidae estuvo representada por ocho géneros y 12 especies, seguida de la familia Poeciliidae con tres géneros y cuatro especies. Se identificaron dos nuevos registros de especies; P. usumacintae y P. pardalis. Cuatro especies fueron identificadas como introducidas; P. pardalis, C. idella, O. niloticus y P. managuensis. La mayor abundancia númerica estuvo representada por T. affinis (n= 445) y T. helleri (n= 95), mientras que P. usumacintae, Phallichthys fairweatheri, "Cichlasoma" Nandopsis urophthalmus, C. idella y B. goldmani, fueron los menos abundantes, representados con la captura de un sólo organismo por especie.
Tabla 1 Listado de peces dulceacuícolas de la subcuenca del río San Pedro durante el periodo marzo-agosto 2007 y septiembre 2007- febrero 2008. += Presencia. Abreviaturas: sitio I= Dren Capulín; sitio III= Dren López Zamora; sitio III= Dren Naranjito; sitio IV= San Miguelito; sitio V= Torno Largo.
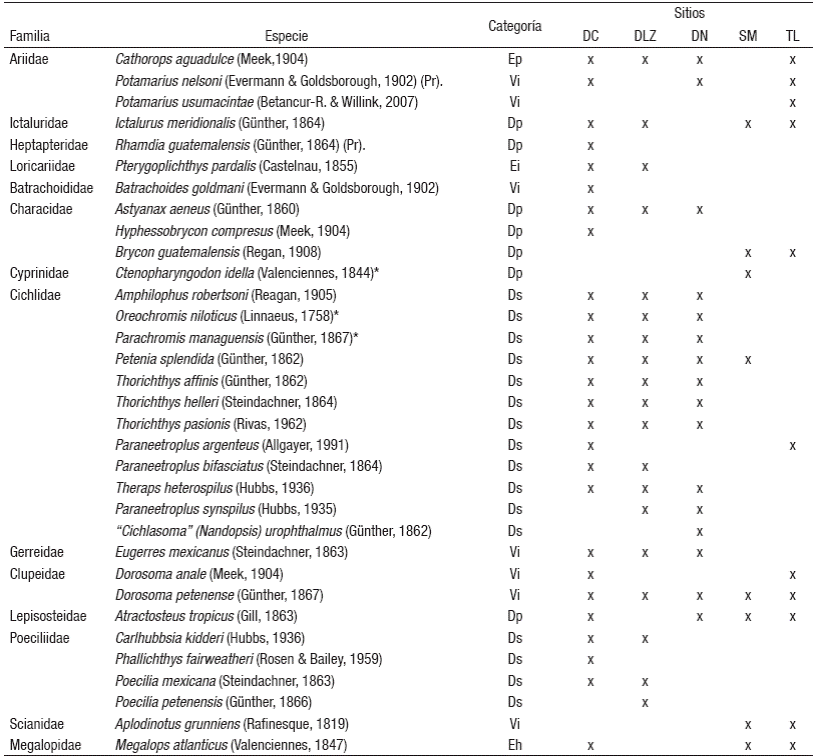
Distribución ecótica: Dp = Dulceacuícola secundria; Ep = Estuarina permanente; Eh = Estenohalina; Vi = Vicaria; * = Especie introducida; Pr = protección especial.
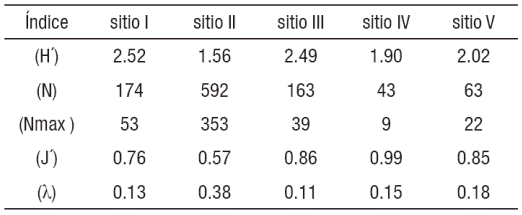
Variación espacio-temporal: Con relación a la comparación espacial; el sitio I presentó mayor número de especies (26 especies) mientras que el sitio IV, sólo mostró 7 especies. El número total de individuos (N) estuvo representado en el sitio II (n=592) y ahí también se encontró la especie más abundante (Nmax= 353), representado por una dominancia (λ= 0.38). La mayor diversidad de especies estuvo representada en los sitios I (H´=2.52 bits) y III (H´= 2.49 bits), mientras que el sitio II (H´= 1.56 bits) fue el menos diverso (Tabla 2). La mayor equidad o igualdad de especies se presentó en los sitios IV (J´=0.99) y III (J´=0.86), mientras que el sitio II (J´=0.57) fue el menos equitativo (Tabla 2). La comparación de la diversidad entre los sitios mostró diferencia significativa (Kruskall-Wallis H=15.58, p<0.05). Estás diferencias se evidenciaron en su comparación entre los sitios I y IV (U de Mann-Whitney = -3.68 p<0.05), I y V (U de Mann-Whitney =-3.15 p<0.05), los sitios II y IV (U de Mann- Whitney =-2.83 p<0.05) y los sitios III y IV (U de Mann- Whitney =-2.70 p<0.05). La comparación temporal, mostró que la época I (estiaje o secas), presentó el mayor número de especies (31), mientras que la época II (húmeda o mayor precipitación) mostró menor número de especies (24). El análisis de la amplitud de las épocas, mostró que las especies con mayor abundancia relativa fueron: T. affinis (0.41), T. helleri (0.10), Astyanax aeneus (0.07) y Petenia splendida (0.06), mismas que estuvieron presentes en ambas épocas. La comparación de la riqueza de especies entre ambas épocas no presentó diferencias significativas (Kruskall-Wallis H=2.75, p>0.05). La similitud entre los sitios o heterogeneidad ambiental, mostró dos agrupamientos según las distancias de conexión de similitud de Jaccard. El subsistema (zona de inundación) representados por los sitios I, III y II (0.55) y el subsistema (cauce principal del río ) por los sitios V y IV (0.45) (Fig. 2). El índice de similitud de Jaccard indicó que existen sitios con similitud entre las épocas.
Tabla 2 Diversidad especies (H´), Número total de Individuos (N), Nú mero de individuos de la especie más abundante (Nmax) e índice de equidad (J´) y Dominancia (λ) para la comunidad de peces del río San Pedro.
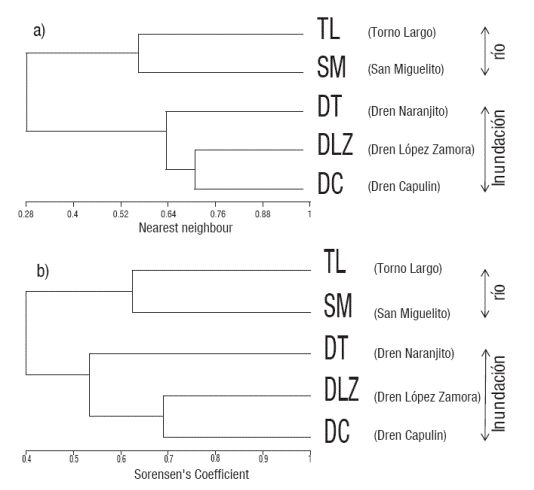
Figuras 2a-b Dendrograma de agrupación jerárquica de los sitios de muestrea dos en la dos épocas (a) época de secas o estiaje y (b) época húmeda o de ma yor precipación, en la zona baja del río San Pedro, Balancán, Tabasco, México.
Relación entre las variables ambientales y la distribución de las especies en función de los sitios. En el Análisis de Correspondencia Canónica (ACC) se observó la relación de las variables ambientales y la diversidad de las especies en función de los sitios, la cual pudo ser explicada por dos funciones canónicas (Tabla 3). La segunda función extraída explicó la máxima cantidad de varianza con 100%, lo cual indica que las especies estuvieron asociadas con la temperatura, la profundidad y la transparencia. Sin embargo, la temperatura del agua fue el parámetro que determinó la distribución de la especies en esta función con una correlación negativa. De igual manera, la primera función contribuyó con 99%, observándose una mayor interrelación de los sitios con las variables de oxígeno disuelto y profundidad que fueron determinantes para la distribución de las especies. No obstante, el oxígeno disuelto fue el parámetro que representó la mayor variabilidad con una asociación negativa.
Discusión
Composición taxonómica y riqueza de las especies. El elenco ictiofaunístico descrito en la presente investigación coincide con lo reportado en otros trabajos; enfatizando la considerable riqueza y diversidad de las familias Cichlidae y Poeciliidae en los ecosistemas neotropicales de México (Sparks, 2003; Miller et al. 2005; Rodiles-Hernández, 2005; Valdez-Moreno et al. 2005). El número de especies registradas en el presente estudio fue menor a lo reportado por Noiset & Hernández (1991). La diferencia del número de especies reportadas puede deberse al mayor tiempo de duración de la investigación, así como a la intensidad de los muestreos, mayor número de artes de captura y tamaño del área estudiada. En el último inventario de la ictiofauna del estado de Tabasco, Espinosa-Pérez y Daza-Zepeda (2005), reportaron un menor número de especie para la zona, de las cuales sólo dos especies se mencionan como introducidas C. idella (Valenciennes, 1844) y O. aureus (Steindachner, 1864). Caso contrario a lo reportado en la presente investigación donde se incrementó el número de especies introducidas: O. niloticus (Linnaeus, 1758), C. idella (Valenciennes, 1844), P. managuensis (Günther, 1867) y P. pardalis (Castelnau, 1855), asimismo se capturó el bagre P. usumacintae, como nuevo registro para la zona del río San Pedro en México, especie de reciente descripción según Betancurt & Willink (2007). La dominancia numérica de las especies estuvo representada por el género Thorichthys, lo cual difiere por lo reportado por Noiset & Hernández (1991), donde mencionan que "Cichlasoma" fue el género más abundante. La amplia diversificación regional que presenta Thorichthys, así como; su estrategia reproductiva (desovador parcial) a través del año y con características de agrupación en grandes concentraciones, pueden explicar los altos valores de sus abundancias (Rodiles-Hernández & González-Díaz, 2006). Otro aspecto importante de esta familia es la tolerancia a las variaciones ambientales y su plasticidad genética (Urriola et al. 2004; Peña-Mendoza et al., 2005; Sáenz et al., 2006) que influyen para que este taxón sea el mejor representado, toda vez que tales atributos le confieren una mejor posición sobre otros componentes de la ictiofauna del río San Pedro.
Parámetros ecológicos. El índice de diversidad (H´), fue menor a lo estimado por Barrientos (1999) para varios taxones de la comunidad de peces de los ríos San Pedro y Sacluc en Guatemala. Los valores más alto del índice (H´) se mostraron en los sitios I y III, esto podría explicarse por la similitud del hábitat, con respecto a la poca velocidad de la corriente, sin secuencia de rápidos y pozas (Habit & Parra, 2001); estos sitios mostraron ser propicios para el establecimiento de las familias; Cichlidae, Ariidae y Characidae. La baja riqueza en la época húmeda o de mayor precipitación, probablemente se debió al patrón de dispersión de las especies y a factores intrínsecos del medio ambiente, tales como: la calidad del hábitat y la disponibilidad recursos alimenticios, ya que en esta época disminuye la heterogeneidad debido a la relación directa entre la dinámica hidrológica presente en este tipo de ecosistemas (Okada et al., 2003). La disimilitud entre los sitios o heterogeneidad ambiental mostró dos agrupamientos según las distancias de conexión. El subsistema: zona de inundación, con similitud de familias: Cichlidae, Poeciliidae y Characidae, mismas que influyeron en el grado de semejanza. El subsistema: cauce principal del río, con similitud de la dominancia de las familias: Scianidae, Megalopidae, Ariidae y Cyprinidae. Esto concuerda con lo mencionado por Welcome (1992), donde menciona que hábitats similares en los subsistemas están separados por distancias considerables de biotopo hostil, lo que da lugar a la formación de grupos distintos de especies adaptados a condiciones similares a lo largo del río.
Relación de las variables ambientales y la distribución de las especies. Diversos estudios han señalado la influencia de las variables ambientales en la composición de las asociaciones de peces (Gelwick et al., 2001; Hoeinghaus et al., 2003; Kobza et al., 2004). Otros autores atribuyen que estás variaciones en las comunidades de peces son causadas por las diversas interacciones biológicas, como la cobertura de micrófitas, la complejidad del hábitat, las redes tróficas y las relaciones de competencia y depredación (Kupschus & Tremainm 2001; Torres-Castro, 2009; Petry et al., 2003). Las fluctuaciones en el nivel de agua, estuvieron directamente relacionadas en los sitios y las épocas así como con la dinámica de escorrentía en la subcuenca, donde la disminución del nivel de agua está fuertemente relacionada con época de estiaje o seca. Las variaciones en la concentración de oxígeno disuelto puede deberse a la fluctuación de la temperatura del agua, el aporte de sedimentos alóctonos derivados de la escorrentía o a la generación de oxígeno dentro del cuerpo de agua por la actividad de organismos fotosintéticos. La temperatura del agua está influenciada por las condiciones de profundidad, transparencia en la zona y la incidencia de luz solar, ya que la energía luminosa es absorbida exponencialmente con respecto a la profundidad en el subsistemas tributarios, esto coincide con lo reportado por Quiroz et al. (2010), quienes mencionan que la mayor parte del calor es retenido en la capa superior del sistema. La temperatura varió en ambas épocas, siendo la época de estiaje más cálida, lo cual se asocia a la ocurrencia de la canícula o sequía intraestival en la región (Pereyra et al., 2004). No obstante, la relación inversa entre la temperatura del agua y la concentración de oxígeno disuelto, puede notarse alterada en estos ambientes naturales, por efecto de los procesos de fotosíntesis y respiración (Graham, 1995). Otro parámetro que mostró ligera variación fue la transparencia, la cual está en función de la incidencia de luz durante el día, y también está relacionada con la productividad primaria (Arredondo, 2007), donde los valores mínimos se presentaron en los sitios más cercanos (III y IV) en la época húmeda o de mayor precipitación, éstos valores están relacionados con la presencia de material orgánico e inorgánico. El pH es un parámetro relacionado con la concentración de protones en el agua, la mayoría de las aguas epicontinentales presentan intervalos de seis punto cinco a nueve, aunque pueden haber factores importantes que lo afecten (Boyd, 1998), este parámetro se mostró ligeramente alcalino en los sitios (IV y V) del subsistema cauce principal para ambas épocas, lo cuál responde a las características típicas de sistemas carbonatados con aguas básicas en la superficie y una tendencia de neutralidad hacia el fondo (Schmitter-Soto et al., 2002; Cervantes-Martínez et al., 2009). Finalmente, se concluye que la comunidad de la subcuenca del río San Pedro está adaptada a dos subsistemas en escala espacial y temporal a las fluctuaciones en el nivel del agua en relación directa con la dinámica hidrológica en las épocas, determinando así la heterogeneidad de los hábitats y la composición y riqueza de las especies presentes.











 text new page (beta)
text new page (beta)



