Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Hidrobiológica
Print version ISSN 0188-8897
Hidrobiológica vol.24 n.2 Ciudad de México May./Aug. 2014
Artículos
Estructura de tallas y relación peso-longitud del pez guitarra pinta, Rhinobatos glaucostigma (Rajiformes: Rhinobatidae) en la plataforma continental de Sinaloa, México
Length structure and weight-length relationship of the slaty-spotted guitarfish, Rhinobatos glaucostigma (Rajiformes: Rhinobatidae) from continental shelf of Sinaloa, Mexico
Raúl E. Lara-Mendoza y Juan Fernando Márquez-Farías
Facultad de Ciencias del Mar. Universidad Autónoma de Sinaloa. Paseo Claussen s/n, Col. Los Pinos, Mazatlán, 82000. Sinaloa. e-mail: rlara.fish@gmail.com
Recibido: 17 de julio de 2012.
Aceptado: 4 de julio de 2013.
RESUMEN
Se analizó la estructura de tallas y la relación peso-longitud de Rhinobatos glaucostigma de la plataforma continental de Sinaloa, México. Se examinaron un total de 1,129 organismos, de los cuales 491 fueron hembras y 638 machos. Las tallas para las hembras fueron de 7.4 a 87 cm de longitud total (LT) con promedio de 39.7 cm y los machos presentaron longitudes comprendidas entre 8.3 y 71.9 cm con promedio de 40.3 cm. El peso total (PT) de las hembras fue de 6 a 2,256 g con promedio de 332.1 g y los machos de 6 a 900 g con media de 284.5 g. Los embriones tuvieron tallas entre 7.4 y 11 cm (8.6 ± 1.3 cm), los neonatos entre los 16 y 31.2 cm (21.5 ± 3.4 cm), los juveniles de 17 a 61 cm (32.6 ± 10.3 cm) y los adultos de 26.5 a 87 cm (57.4 ± 8.4 cm). La relación PT-LT para las hembras fue PT = 0.004(LT)2.968 y para machos PT = 0.004(LT)2.924. La proporción sexual para los organismos adultos fue de 1:1.3 (hembras:machos) y la proporción sexual embrionaria de 1:0.95 (hembras:machos). Las capturas ocurrieron entre los 3.6 y 45 m de profundidad, recolectándose en los primeros 15 m más del 83% de la población. La pesquería de arrastre de camarón incidió en más del 63% sobre los organismos juveniles que en otros estadios, por lo que dicha actividad puede llegar a afectar seriamente la productividad de la población de R. glaucostigma al no permitir que los organismos lleguen a su etapa reproductiva.
Palabras clave: Rhinobatos glaucostigma, relación peso-longitud, Sinaloa, tallas.
ABSTRACT
We analyzed the size structure and weight-length relationship of Rhinobatos glaucostigma in the continental shelf of Sinaloa, Mexico. A total of 1129 specimens were examined, of which 491 were female and 638 were males. The sizes for females were 7.4 to 87 cm of total length (LT) with mean of 39.7 cm and males ranged 8.3 and 71.9 cm with mean of 40.3 cm. The total weight (WT) for females ranged 6 to 2256 g with mean of 332.1 g and males ranged 6 to 900 g with mean of 284.5 g. The size embryos ranged 7.4 to 11 cm (8.6 ± 1.3 cm), the neonates between 16 and 31.2 cm (21.5 ± 3.4 cm), the juvenile ranged of 17 to 61 cm (32.6 ± 10.3 cm) and the adults 26.5 to 87 cm (57.4 ± 8.4 cm). The TL-TW relationship for females were TW = 0.004(TL)2.968 and for males were TW = 0.004(TL)2.924. The sex ratio for adults was 1:1.3 (females: males) and for embryos was 1:0.95 (females : males). Catches occurred between 3.6 to 45 m depth, collecting in the first 15 m over 83% of the population. The shrimp trawl fishery had an impact on more than 63% of juvenile than other maturity stages; this can affect directly in the population of R. glaucostigma by not allowing them get to reproductive process.
Key words: Rhinobatos glaucostigma, weight-length relationship, Sinaloa, sizes.
INTRODUCCIÓN
El pez guitarra pinta, Rhinobatos glaucostigma (Jordan & Gilbert, 1883) es un elasmobranquio perteneciente al superorden Batoidea, el cual se distribuye desde el sur de la península de Baja California, el Golfo de California (GC) y hasta Ecuador. Es una especie de aguas someras que se alimentan de peces pequeños e invertebrados bentónicos (McEachran & Notarbartolo-Di-Sciara, 1995). Como la mayoría de los batoideos bentónicos, esta es una especie vivípara aplacentada que habita sobre fondos blandos poco activos en términos de dinámica oceánica. En las zonas de alta productividad del Golfo de California se desarrollan importantes pesquerías artesanales de la guitarra pinta. La pesca artesanal de rayas opera con diversos sistemas de captura destacando la red agallera de distintas aberturas de malla que incide directa e indirectamente sobre R. glaucostigma y otras especies de batoideos (Márquez-Farías, 2002; Bizzarro etal., 2009).
En México, la mayor producción de elasmobranquios proviene de la costa del Pacífico (78.6% de las capturas de 2000-2009) (CONAPESCA, 2010). Históricamente el 90% de la producción de mantas y rayas (Batoideos) del Pacífico es capturada en el Golfo de California, principalmente de los estados de Sonora, Baja California, Baja California Sur y Sinaloa. En un estudio reciente, se reportó que en el Golfo de California cohabitan más de 32 especies de batoideos de importancia pesquera como especie objetivo (Bizzarro et al., 2009; Márquez-Farías, 2007a) y algunas otras son componentes importantes de la fauna de acompañamiento de la flota industrial camaronera. La guitarra, R. glaucostigma puede ocupar hasta el cuarto lugar, en términos de descargas pesqueras regionales, con respecto al total de rayas capturadas, representando el 4.6% de la captura en número y junto con las otras dos especies del mismo género R. productus (Ayres, 1854) y R. leucorhynchus (Günther, 1867), componen el primer lugar en capturas (32.1%) (Márquez-Farías 2000, 2002; Bizzarro et al., 2009).
Actualmente, la lista roja de la Unión Internacional para la Conservación de la Naturaleza (UICN), mantiene a R. glaucostigma en la categoría de deficiencia de datos (DD) y consideramos que el presente estudio puede contribuir para una futura evaluación del estatus de conservación de esta especie. Asimismo, consideramos que la información aquí presentada puede ser útil para mejorar las acciones de regulación y administración de esta pesquería en el Golfo de California.
MATERIALES Y MÉTODOS
Se recolectaron ejemplares de guitarra pinta durante 2007 al 2011 en la plataforma continental de Sinaloa (25°04'30'' a 22°32'40''N y 105°46'70'' a 108°23'03''W), los cuales provinieron de la fauna de acompañamiento de la pesca de camarón que operaron principalmente con redes de arrastre con longitud de 34.9 m y una luz de malla de 30 mm en toda la red. A cada ejemplar se le registró la longitud total (LT) y ancho del disco (AD) con un ictiómetro convencional (± 1 mm); mientras que el peso total (PT) fue medido con una balanza digital OHAUS (± 0.1 g). El sexo fue determinado de acuerdo a las características externas (gonopterigio), los cuales son visibles desde el momento de su nacimiento. El ciclo de vida de la guitarra pinta fue dividido en 4 estadios; embrión (e), neonato (n), juvenil (j) y adulto (a). En las hembras, los estados de desarrollo fueron determinados de acuerdo a la condición de los ovarios y la morfología del tracto reproductivo (Márquez-Farías, 2007b). En los machos el estadio de desarrollo fue asignado observando el tamaño del gonopterigio en relación al tamaño de la aleta pélvica siendo pequeño y flexible para los organismos juveniles; y grande y calcificado para los organismos adultos (Holden & Raitt, 1974).
La longitud promedio entre sexos, estadios y años fue analizada estadísticamente mediante un análisis de varianza (ANOVA). La relación peso total-longitud total (PT-LT) fue estimado para machos y hembras utilizando el modelo potencial (Ricker, 1975).
PT = a (LT)b
Donde:
a es la ordenada al origen, y
b es la pendiente.
La relación longitud total-ancho del disco (LT-AD) fue estimado para machos y hembras utilizando el modelo lineal.
AD = a + b (LT)
Donde:
a es la ordenada, y
b es la pendiente de la recta.
Mediante una prueba t-student se determinó la diferencia estadística en los coeficientes de isometría de cada sexo con respecto a la hipótesis de crecimiento isométrico (b = 3). Para conocer las diferencias estadísticas entre sexos se empleó el análisis de curvas coincidentes (Chen et al., 1992)
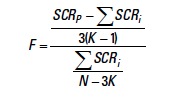
Donde:
SCRP es la suma de cuadrados residuales de todos los datos agrupados,
SCRi es la suma de cuadrados residuales de cada sexo,
K es el número de curvas a comparar, y
N es el número total de pares de datos edad-longitud.
La proporción de sexos fue evaluada para adultos y embriones usando una prueba de chi-cuadrada con los valores observados y esperados (0.5) de los machos y hembras.
RESULTADOS
Se muestrearon un total de 1,129 ejemplares de guitarra pinta durante 2007 al 2011 en la plataforma continental de Sinaloa, de los cuales 491 organismos fueron hembras (43.5%) y 638 machos (56.5%). Las hembras presentaron longitudes entre los 7.4 y 87 cm de LT, con promedio de 39.7 cm (± 18 cm), mientras que los machos tuvieron longitudes entre los 8.3 y 71.9 cm, con promedio de 40.3 cm (± 14.8 cm). El intervalo en peso total para las hembras fue de 6 a 2256 g, con promedio de 332.1 g (±438.9 g) y para los machos el peso total osciló entre los 6 y 900 g, con promedio de 284.5 g (±235.7 g). En general, las longitudes entre machos y hembras no mostraron diferencias significativas (F = 0.35; p = 0.55), pero sí se mostraron diferencias en la distribución de los pesos entre sexos (F=5.45; p < 0.05).
Se detectaron diferencias significativas en la longitud promedio de los estadios entre sexos (F = 36.32; p < 0.05), en la longitud promedio de los estadios entre años (F= 20.23; p < 0.05) y en la longitud promedio de los estadios entre sexo y años en conjunto (F = 5.36; p < 0.05). Las longitudes mínimas, máximas y promedio de cada estadio de madurez por sexo y año son presentadas en la Tabla 1. Contrastando con los demás años de muestreo (2007-2009), durante el 2011 también se analizaron 6 embriones con una longitud total promedio de 8.6 cm (±1.3 cm).
La relación entre el peso total (PT) y la longitud total (LT) para todo el periodo de estudio fue descrita por el modelo potencial, el cual presentó diferencias significativas entre sexos (F = 6.59; p < 0.05) y los datos fueron analizados por separado. Los parámetros de la relación PT-LT para las hembras fueron: a = 0.004, b = 2.968, r2 = 0.983, por lo que se consideró un crecimiento de tipo isométrico (ts = 0.76; p > 0.05) y para los machos los parámetros correspondieron a = 0.004, b = 2.924, r2 = 0.987, mostrando un crecimiento alométrico negativo (ts = 2.51; p < 0.05). Los parámetros estimados de esta relación y el tipo de crecimiento para cada año, se encuentran reportadas en la Tabla 2.
La relación entre la longitud total (LT) y el ancho del disco (AD) mostró una elevada proporcionalidad entre dichas variables, al presentar coeficientes de determinación (r2) superiores al 98% y se determinó la existencia de diferencias significativas entre sexos (F = 148.82; p < 0.05). La ecuación resultante para las hembras fue AD = 0.705 + 0.328 (LT) con una r2 = 0.99 y para los machos AD = 1.573 + 0.294 (LT) con una r2 = 0.98. Para las hembras el ancho mínimo del disco fue de 2.3 cm que correspondió a un embrión completamente desarrollado de 7.4 cm; mientras que el ancho de disco máximo reportado fue de 30 cm para una hembra madura de 87 cm. Los machos presentaron un ancho de disco mínimo de 2.7 cm para un embrión de 8.3 cm y el máximo ancho de disco fue de 21.2 cm para un organismo adulto de 71.9 cm. Las ecuaciones de la relación LT-AD por sexo y por año son mostradas en la Tabla 2.
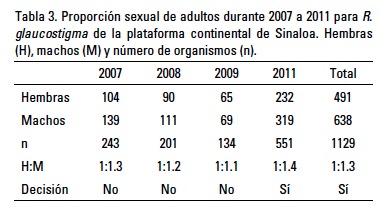
La proporción sexual de los organismos adultos durante el periodo estudiado fue de 1:1.3 (hembras:machos) y presentó diferencias significativas con respecto al valor esperado de 1:1 (x2 = 9.44; p < 0.05), aunque en el 2007, 2008 y 2009 dicha proporción no mostró esta diferencia (Tabla 3). La proporción sexual embrionaria correspondió a 1:0.95 (hembras:machos) y no mostró diferencias significativas con respecto al valor esperado (x2 = 0.01; p > 0.05), mostrando similitud en el aporte de ambos sexos a la población.
Los organismos fueron capturados entre los 3.6 y 45 metros de profundidad, el 45% de las capturas ocurrió en la parte más somera entre los 0 y 5 metros de profundidad. Los neonatos fueron reportados entre los 3.6 y 43.2 m, aunque el 79% fueron capturados en los primeros 15 m de profundidad. Para los juveniles la distribución fue entre los 3.6 y 45 m de profundidad y el 85% se distribuyó en los primeros 15 m. El 81% de los organismos adultos fueron capturados entre 5 y 15 m. De acuerdo a los datos analizados en este trabajo, no se pudo evidenciar una posible segregación por sexo, ni por estadio de desarrollo o madurez para la guitarra pinta en la plataforma continental de Sinaloa.
La evaluación de los estadios de madurez de la guitarra pinta permitió determinar que la mayoría de las hembras capturadas aún eran juveniles y todavía no estaban sexualmente maduras (63.16%), las hembras maduras con óvulos fecundados y/o embriones en el útero representaron el 21.84% y los neonatos o crías recién nacidas fueron capturados en un 14.74%. Con respecto al número total de machos, la captura estuvo representada en su mayoría por organismos juveniles (57.2%), los machos maduros con gonopterigios desarrollados y calcificados fueron capturados en un 26.8% y el 16% restante correspondió a machos recién nacidos o neonatos.
DISCUSIÓN
El presente estudio amplia a 87 cm de longitud total la talla máxima reportada con anterioridad para la guitarra pinta por McEachran y Notarbartolo Di Sciara (1995) (76.3 cm), Robertson y Allen (2006) (77 cm) y Valadez-González (2007) (82 cm), la cual correspondió a una hembra madura. Las tallas analizadas entre sexos no mostraron diferencias significativas, aunque las hembras tuvieron tallas y pesos más grandes que los machos, lo cual ha sido reportado para la mayoría de las especies del género Rhinobatos (Capapé & Zaouali, 1984; Abdel-Aziz et al., 1993; Seck et al., 2004; Ismen et al., 2007; Márquez-Farías, 2007b; Basusta et al., 2008; Kume et al., 2009; Payán et al., 2011), esto se pudiera atribuir a la ganancia en peso de las hembras debido a la acumulación de lípidos durante el proceso reproductivo (Seck et al., 2004; Kume et al., 2009).
Al comparar el tipo de crecimiento mediante la relación PT-LT se presentaron diferencias significativas en las curvas entre sexos. Las hembras tendieron a crecer de manera isométrica (crecimiento proporcional entre el peso y la longitud) y los machos tuvieron un crecimiento de tipo alométrico negativo, siendo menos pesados para la longitud que tienen. Diferencias similares y significativas también se han reportado para R. horkelli(Müller & Henle, 1841) (Texeira, 1982), R. productus (Ayres, 1854) (Villavicencio-Garayzar, 1995; Márquez-Farías, 2007b), R. cemiculus (Geoffroy Saint-Hilaire, 1817) (Seck et al., 2004), R. rhinobatos (Linnaeus, 1758) (Ismen etal., 2007), R. hynnicephalus (Richardson, 1846) (Kume et al., 2009) y R. leucorhynchus (Günther, 1867) (Payán et al., 2011); mientras que para R. rhinobatos del noreste del Mar Mediterráneo, no se reportaron diferencias significativas en la relación PT-LT y LT-AD (Basusta et al., 2008).
La proporción sexual determinada para R. glaucostigma presentó diferencias en cuanto a la relación del número de hembras y machos, y es la primera vez que se reporta para esta especie en todo su intervalo de distribución en el Pacífico oriental tropical; dicha proporción se asemeja a la reportada para otras especies del género Rhinobatos como R. productus de Bahía Almejas (BCS, México) (Villavicencio-Garayzar, 1993) y R. rhinobatos de las aguas de Tunez (Ismen et al., 2007; Abdel-Aziz et al., 1993), aunque difiere de los resultados de Basusta et al. (2008), quienes encontraron en R. rhinobatos del noreste del Mar Mediterráneo, una proporción sexual equilibrada, al igual que en R. percellens (Walbaum, 1792) del Caribe Colombiano (Moreno-Rodríguez et al., 2008). Con respecto a la proporción sexual de los embriones, en las especies del mismo género se han reportado una proporción sexual 1:1 (hembras:machos) (Abdel-Aziz et al., 1993; Basusta et al., 2008; Cek et al., 2009; Márquez-Farías, 2007b; Payán et al., 2011; Villavicencio-Garayzar, 1993, 1995; Webin & Shuyuan, 1993).
No se sugiere una separación o segregación espacio-temporal por sexos, ni por estadios de madurez para el pez guitarra pinta de la plataforma continental de Sinaloa, ya que los análisis indicaron que esta especie puede presentarse en cualquier profundidad a lo largo del año, aunque tiene ciertas preferencias por habitar los primeros 15 metros de profundidad de acuerdo a las capturas realizadas. Este comportamiento fue similar al descrito para esta misma especie en la plataforma continental del Pacífico central mexicano (Jalisco y Colima), aunque con un intervalo de distribución batimétrica más profundo (>80 metros), lo cual no había sido reportado para esta especie. Existen algunos estudios para especies del mismo género que indican la segregación espacio-temporal por sexos y en estadios ontogénicos, tales como en R. productus que habita en Bahía Almejas (BCS, México) (Downton-Hoffman, 1996), en R. cemiculus de las aguas de Tunez (Capapé & Zaouali, 1994, Capapé et al., 1997) y Senegal (Seck et al., 2004), R. rhinobatos en el Este del Mar Mediterráneo (Cek et al., 2009) y en R. leucorhynchus en el Pacífico colombiano (Payán et al., 2011).
De acuerdo a los análisis de los cuatro años de muestreo, se determinó que el 57% de las capturas estuvo representada por los organismos juveniles, los cuales aún no maduraban sexualmente. Este hecho puede ocasionar que la población de R. glaucostigma sea afectada negativamente debido a que la pesca incidental no permitirá que los organismos lleguen a la etapa adulta y los procesos de reproducción no podrá llevarse a cabo, para dejar una nueva generación de organismos a la población. Por lo tanto la productividad de la especie podría verse disminuida. Se han documentado casos de colapso de poblaciones de batoideos en diversas partes del mundo, lo cual ha sido resultado de la intensidad de la pesca dirigida e incidental y a la baja resiliencia de éstas especies (Dulvy et al., 2000; Dulvy & Reynolds, 2002).
La información que se presenta en este estudio aporta por primera vez información de distribución de la estructura de la población de R. glaucostigma. Esta especie al igual que la mayoría de los batoideos forman parte importante en la fauna incidental de la pesca ribereña y del camarón de altamar en Sinaloa. No obstante que su importancia económica es baja en la región, el estado de su población se desconocía hasta ahora, por lo que los resultados de este estudio se enfocan solamente en esta especie, la cual está bien representada en la plataforma continental de Sinaloa. Aunque su población aparentemente no refleja signos de deterioro debido al efecto de la presión por pesca, R. glaucostigma debe de ser bien estudiada antes de que la población de esta y otras especies de rayas sean afectadas en su estructura poblacional y abundancia.
AGRADECIMIENTOS
Se agradece el apoyo de los pescadores ribereños de camarón en Sinaloa, a Erasmo Brambila "El Ñoño" y a Héctor "Mele" quienes facilitaron el soporte técnico durante los muestreos. Este proyecto fue parcialmente financiado por el Instituto Nacional de Pesca y la Facultad de Ciencias del Mar, a través de los proyectos PROFAPI UAS 81/2010 y PROFAPI UAS 101/2011 de la Universidad Autónoma de Sinaloa. Se extiende un especial agradecimiento a Vicente Moreno y Abraham Aviles del INAPESCA por su apoyo técnico en campo. Al Consejo Nacional de Ciencia y Tecnología (CONACyT) por la beca otorgada para la realización de estudios de posgrado.
REFERENCIAS
Abdel-Aziz, S. H., A. N. Khalil & S. A. Abdel-Maguid. 1993. Reproductive cycle of the common guitarfish Rhinobatos rhinobatos (Linnaeus, 1758), in Alexandria waters, Mediterranean sea. Australian Journal of Marine and Freshwaters Research 44 (3): 507-517. [ Links ]
Basusta, N., S. A. Demirhan, E. Cicek, A. Basusta & T. küleli. 2008. Age and growth of the common guitarfish, Rhinobatos rhinobatos, in Iskenderun Bay (north-eastern Mediterranean, Turkey). Journal of the Marine Biological Association of the United Kingdom 88 (4): 837-842. [ Links ]
Bizzarro, J. J., W. D. Smith, J. F. Márquez-Farías, J. Tyminski & R. E. Hüeter. 2009. Temporal variation in the artisanal elasmobranch fishery of Sonora, México. Fisheries Research 97: 103-117. [ Links ]
Capapé, C., R. Ben-Brahim & J. Zaouali. 1997. Aspects de la biologie de la reproduction de la guitare commune (Rhinobatos rhinobatos) des eaux tunisiennes. Ichtyophysiologica acta 20: 113-127. [ Links ]
Capapé, C. & J. Zaouali. 1994. Distribution and reproductive biology of the blackchin guitarfish Rhinobatos cemiculus (Pisces: Rhinobatidae) in the Tunisian waters. Australian Journal of Marine and Freshwater Research 45 (4): 551-561. [ Links ]
Cek, S., N. Basusta, S.A. Demirhan & M. Karalar. 2009. Biological observations on the common guitarfish Rhinobatos rhinobatos from Iskenderun Bay (Turkey, Eastern Mediterranean). Animal Biology 59: 211-230. [ Links ]
Chen, Y., D. A. Jackson & H. H. Harvey. 1992. A comparison of von Bertalanffy and polynomial function in modeling fish growth data. Canadian Journal of Fisheries and Aquatic Sciences 49: 1228-1235. [ Links ]
CONAPESCA 2010. Anuario estadístico de pesca 2009. SAGARPA [ Links ]
Dulvy, N. K. & J. D. Reynolds. 2002. Predicting extinction vulnerability in skates. Conservation Biology 16: 440-450. [ Links ]
Dulvy, N. K., J. D. Reynolds, J. D. Metcalfe & J. Glanville. 2000. Fisheries stability, local extinctions and shifts in community structure in skates. Conservation Biology 14: 1-11. [ Links ]
Downton-Hoffmann, C. A. 1996. Estrategia reproductiva de la guitarra, Rhinobatus productus, (Ayres 1856), en la costa occidental de Baja California Sur, México. Tesis de Licenciatura. Depto. Biol. Mar, UA-BCS. La Paz, B.C.S. 51 p. [ Links ]
Grijalba-Bendeck, M., A. Acero P. & E. González. 2008. Biología reproductiva de Rhinobatos percellens (Walbaum, 1792) (Batoidea: Rajiformes) en el Caribe colombiano. Revista de Biología Marina y Oceanografía 43 (3): 469-481. [ Links ]
Holden, M. J. & D. F. S. Raitt. 1974. Manual of fisheries science. Part 2. Methods of resource investigation and their application. FAO Fisheries Technical Report. 214p. [ Links ]
Ismen, A., C. Yigin & P. Ismen. 2007. Age, growth, reproductive biology and feed of the common guitarfish (Rhinobatos rhinobatos Linnaeus, 1758) in Iskenderun Bay, the eastern Mediterranean Sea. Fisheries Research 84 (2): 263-269. [ Links ]
Kume, G., K. Fürümitsü, S. Tanaka & A. Yamagüchi. 2009. Reproductive biology of the guitarfish Rhinobatos hynnicephalus (Batoidea: Rhinobatidae) in Ariake Bay, Japan. Environmental Biology of Fishes 85: 289-298. [ Links ]
Márquez-Farías, J. F. 2000. Tiburones del Golfo de California. In: INP-SEMARNAP (Ed.). Sustentabilidad y Pesca Responsable en México: Evaluación y Manejo. 1999-2000. pp. 238-257. [ Links ]
Márquez-Farías, J. F. 2002. The artisanal ray fishery in the Gulf of California: Development, Fisheries Research and Management Issues. IUCN Shark Specialist Group. Shark News 14: 1-5. [ Links ]
Márquez-Farías, J. F. 2007a. Demografía del pez guitarra, Rhinobatos productus (Ayres, 1854), del Golfo de California. Tesis de Doctorado. CIBNOR, S. C. La Páz, B.C.S. 147 p. [ Links ]
Márquez-Farías, J. F. 2007b. Reproductive biology of shovelnose guitarfish Rhinobatos productus from the eastern Gulf of California, Mexico. Marine Biology 151: 1445-1454. [ Links ]
McEachran, J. D. & G. Notarbartolo-Di-Sciara. 1995. Peces batoideos. In: Fischer, W., F. Krupp, W. Schneider, C. Sommer, K. E. Carpenter & V. H. Niem (Eds.). Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro-oriental. Vol. II. FAO. Roma, pp. 745-792. [ Links ]
Moreno-Rodríguez, F., K. Acevedo & J. Paramo. 2008. Aportes a la biología de tiburones y rayas demersales en la región norte del Caribe colombiano. Acta Biológica Colombiana 13 (3): 123-132. [ Links ]
Payán, L. F., A. F. Navia, E. A. Rubio & P. A. Mejía-Falla. 2011. Biología de la raya guitarra Rhinobatos leucorhynchus (Günther, 1867) (Rajiformes: Rhinobatidae) en el Pacífico colombiano. Latin American Journal of Aquatic Research 39 (2): 286-296. [ Links ]
Ricker, W. E. 1975. Computation and interpretation of biological statistics of fish populations. Bulletin Fisheries Research Boardof Canada 191: 382. [ Links ]
Robertson, D. R. & G. R. Allen. 2006. Shorefishes of the tropical eastern Pacific: an information system. Version 2.0. Smithsonian Tropical Research Institute. Balboa, Panamá [ Links ].
Seck, A. A., Y. Diatta, M. Diop, 0. Guélorget, C. Reynaud & C. Capapé. 2004. Observation on the reproductive biology of the blackchin guitarfish, Rhinobatos cemiculus E. Geoffroy Saint-Hilaire, 1817 (Chondrichthyes, Rhinobatidae) from de coast of Senegal (Eastern Tropical Atlantic). Scientia Gerundensis 27: 19-30. [ Links ]
Texeira, R. P. 1982. Biologie et dinamique des population de Rhinobatos horkelli (Muller & Henle, 1841) du plateau continental du Rio Grande du Sul (Brasil). Thése du Doctorat de Spécialité en Oceanographie, Université de Bretaigne Occidentale. 234 p. [ Links ]
Valadez-González, C. 2007. Distribución, abundancia y alimentación de las rayas bentónicas de la costa de Jalisco y Colima, México. Tesis de Doctorado en Ciencias. Centro Interdisciplinario de Ciencias Marinas. IPN, La Paz, B.C.S., México. 119 p. [ Links ]
Villavicencio-Garayzar, C. J. 1993. Biología reproductiva de Rhinobatos productus (Pisces: Rhinobatidae), en Bahía Almejas, Baja California Sur, México. Revista de Biología Tropical 41: 441-446. [ Links ]
Villavicencio-Garayzar, C. J. 1995. Biología reproductiva de la guitarra pinta, Zapteryx exasperata (Pisces: Rhinobatidae), en Bahía Almejas, Baja California Sur, México. Ciencias Marinas 21 (2): 141-153. [ Links ]
Webin, Z. & Q. Shuyuan. 1993. Reproductive biology of the guitarfish, Rhinobatos hynnicephalus. Environmental Biology of Fishes 38: 81-93. [ Links ]














