Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Hidrobiológica
Print version ISSN 0188-8897
Hidrobiológica vol.21 n.3 Ciudad de México Sep./Dec. 2011
Los metales y la camaronicultura en México
Metals and shrimp aquaculture in Mexico
Martín Gabriel Frías-Espericueta,1 Marisela Aguilar-Juárez,1 Isidro Osuna-López,1 Selene Abad-Rosales,2 Gildardo Izaguirre-Fierro1 y Domenico Voltolina3
1 Laboratorio de Estudios Ambientales, FACIMAR, UAS, Mazatlán, Sinaloa, 82000. México. e-mail: friasm@ola.icmyl.unam.mx
2 Centro de Investigación en Alimentación y Desarrollo, Unidad Mazatlán, Mazatlán, Sinaloa.
3 Laboratorio de Estudios Ambientales, UAS-CIBNOR, Mazatlán, Sinaloa.
Recibido: 03 de junio de 2011.
Aceptado: 22 de septiembre de 2011.
RESUMEN
La camaronicultura mexicana se ha desarrollado principalmente en la franja costera de los estados del noroeste del país, donde compite con otras actividades humanas, principalmente con la agricultura y la ganadería, además de las industrias relacionadas. Éstas, junto con los asentamientos urbanos, generan cantidades importantes de contaminantes entre los cuales, por lo menos en algunas áreas, los metales pesados se han señalado como posibles fuentes de preocupación. En este trabajo se presenta una síntesis de la información disponible a la fecha sobre los niveles de algunos metales que se han registrado en algunas áreas de la franja costera, del noroeste de México, en las cuales se encuentran concentradas la mayor parte de las granjas camaronícolas del país, además de la generada sobre el contenido de metales en los sedimentos de las mismas granjas y de los camarones tanto cultivados como silvestres. Se examinan y resumen además los efectos de estos metales, en especial los de toxicidad aguda, efectos subletales, daños a nivel histológico, sistémico y genético para la especie de mayor interés para la camaronicultura Mexicana, Litopenaeus vannamei, y para otras de interés actual o potencial para su cultivo en la región.
Palabras clave: Metales, camaronicultura, toxicidad, efectos letales, efectos subletales.
ABSTRACT
In Mexico, shrimp aquaculture has been mainly developed in the coastal areas of the Northwestern states where it competes with other human activities, mainly agriculture and animal husbandry, as well as with the related industries. These activities, as well as the urban settlements of the region, generate large quantities of pollutants among which, at least in certain areas, heavy metals have been detected as possible sources of concern. This paper synthetizes the information available to date on the levels of some metals present in the coastal areas of Northwestern Mexico where a high number of shrimp farms has been established, as well as on shrimp farm sediments and on cultured and wild- shrimp tissues. The effects of some metals are examined in terms of acute toxicity levels, sublethal effects, dam-ages at the histological, systemic and genetic levels determined for the most important species for Mexican shrimp aquaculture, Litopenaeus vannamei. Other actual or potential species of interest for the regional aquaculture have also been considered.
Key words: Metals, shrimp culture, toxicity, lethal effects, sublethal effects.
INTRODUCCIÓN
La producción acuícola mexicana está dominada por el cultivo del camarón, principalmente en la región noroeste, en la cual los estados de Sonora y Sinaloa aportan el 62.8 y 28.8% de la producción nacional, respectivamente (129,096 toneladas en 2009) (CESASIN, 2010).
La camaronicultura es una de las actividades económicas de Latinoamérica que han registrado una de las más altas tasas de crecimiento, lo que la coloca en conflicto con otras actividades como la agricultura y el turismo, además de los problemas ambientales, económicos y sociales con los cuales se le ha relacionado (Martínez-Córdova et al., 2009).
En los últimos años se han registrado diversos problemas en la camaronicultura, entre los cuales sobresalen los de sanidad acuícola que han provocado serios daños económicos por las altas mortandades ocasionadas por enfermedades como la mancha blanca (WSSV).
Con el objetivo de prevenir grandes pérdidas y/o mejorar la producción, los acuacultores han incorporado al manejo de los estanques, la aplicación de varios productos químicos como antibióticos, desinfectantes, alguicidas, compuestos terapéuticos, pesticidas, aditivos en el alimento y tratamientos a sedimentos y agua, los cuales provocan alteraciones bioquímicas y/o fisiológicas en los organismos de cultivo (Bainy, 2000).
Además, las granjas camaronícolas están expuestas a diversos contaminantes, entre los cuales Páez-Osuna (2001) y Wu & Yang (2011) documentan que los metales están entre los contaminantes ambientales de mayor preocupación en el ambiente acuático.
Agusa et al. (2007) señalan que, debido al rápido crecimiento económico y al incremento de los asentamientos humanos, existen importantes emisiones de metales al medio ambiente. Phillips & Rainbow (1993) señalan que las fuentes antropogénicas aportan más Ni, Cr, Cu, Zn, Pb, Hg y Cd al medio ambiente que las naturales, en proporciones que van del 60 al 95%.
Entre las actividades humanas que aportan metales al ambiente se pueden mencionar a la minería, la industria manufacturera, y la agricultura, cuyos residuos, junto con los efluentes municipales, pueden llegar a la zona costera debido al transporte atmosférico y a la escorrentía (Pandey et al., 2009).
Existen varios estudios que han determinado el nivel de concentración de algunos metales en la zona costera de México, entre los cuales destacan los trabajos de Vázquez & Sharma (2004) quienes realizaron un estudio en la sonda de Campeche, a la que encontraron altamente impactada por las actividades humanas; Muñoz-Barbosa et al. (2000) usaron el mejillón Mytilus californianus (Conrad, 1837) como indicador de metales en la costa noroeste de Baja California, relacionando los niveles de Pb con fuentes antropogénicas.
Por su parte, García-Rico et al. (2011) evaluaron los niveles de Cd, Pb, Hg, Cu, Fe, Mn y Zn en las costas de Sonora, y reportaron que las concentraciones más altas de estos metales fueron observadas en la zona costera, relacionándolas con fuentes urbanas. Frías-Espericueta et al. (2009a) trabajaron en siete lagunas costeras de Sinaloa, usando al bivalvo Crassostrea corteziensis (Hertlein 1951) como bioindicador, concluyendo que el Cd constituye un posible riesgo de salud en seis de las siete lagunas analizadas.
Como se comentó, una gran proporción de estos metales son de origen antropogénico, lo cual fue demostrado por Soto-Jiménez et al. (2003), quienes concluyeron que la agricultura aporta cantidades significativas de Cd, Cu y Zn a la zona costera; mientras que Ruiz-Fernández et al. (2003) al analizar el contenido de metales en las capas sedimentarias del estuario del Rio Culiacán, observaron que las tendencias están relacionadas con el incremento de la población en esa zona.
En la Tabla 1 se presentan los resultados del contenido de metales en sedimentos superficiales de la zona costera de los estados de Sonora y Sinaloa. Estas investigaciones corroboran la presencia de metales en la zona costera de México, algunos a niveles que pueden ser fuente de preocupación y es en esa zona en donde se ubica la mayoría de las granjas camaronícolas.
NIVELES DE METALES EN GRANJAS CAMARONÍCOLAS
Por su ubicación en áreas con impacto antropogénico, el agua del influente de las granjas camaronícolas es una ruta de entrada de metales a sus estanques, aunque no es la única, ya que el manejo de los estanques contribuye a incrementar su concentración, dado que los fertilizantes, la cal, el alimento y otros productos químicos usados durante el cultivo son fuentes adicionales de metales (Lacerda et al., 2006). Otra fuente es el transporte atmosférico, aunque su aportación de metales puede ser variable y debería ser objeto de mayores estudios (Fig. 1).

Dado que en general las tasas de recambio de agua en los estanques camaronícolas son bajas, esto contribuye a que los metales sean retenidos en los diferentes compartimentos de los estanques: una parte se une a la materia orgánica particulada y/o disuelta, otra es incorporada por la biota, y la mayor parte se deposita en los sedimentos.
En sedimentos. Varios estudios han demostrado que la entrada de metales a un ecosistema se ve reflejado por su concentración en los sedimentos, lo cual se aplica también a los estanques camaronícolas (Green-Ruiz & Páez-Osuna, 2003). Diferentes trabajos han evaluado el nivel de concentración de metales en la capa superficial (0-5 cm) de los sedimentos de granjas camaronícolas, que es la más activa química y biológicamente, motivo por el cual tiene una gran influencia sobre la calidad del agua y sobre los organismos bentónicos, puesto que los intercambios en la frontera agua/sedimento, ocurren en esta capa (Boyd et al., 1994; Munsiri et al., 1995).
Entre estos, Frías-Espericueta et al. (2006) evaluaron el contenido de Cd, Cu, Pb y Zn en sedimentos de nueve granjas ubicadas en Sinaloa, en los cuales encontraron niveles promedio de 0.82 ± 0.3, 14.9 ± 5.6, 19.6 ± 7 y 56.3 ± 2.1 pg/g, respectivamente. De acuerdo a este estudio se encontraron concentraciones mayores en las granjas de la zona central de Sinaloa que en las ubicadas en la zona sur del estado, lo cual puede estar relacionado con la el grado de intensificación de la actividad agrícola en estas regiones, aunque no existe una relación entre el contenido de metales en el sedimento y la producción del estanque. Por otra parte, los valores de plomo registrados en estas granjas resultaron superiores al límite permisible, y los niveles de otros metales fueron cercanos a los límites de preocupación, por lo cual estos autores concluyeron que se debe seguir con este tipo de estudios, ya que en nuestro país existen muchas granjas camaronícolas ubicadas en zonas impactadas por actividades que son fuentes probables de contaminación.
En otro estudio realizado en sedimentos de cultivos ostrícolas en la costa de Sonora, donde las principales actividades de los alrededores son la agricultura, la ganadería y el turismo, García-Rico et al. (2003) determinaron que entre los metales estudiados (Cd, Cu, Pb, Zn, As y Hg), solo el Cd alcanzó valores que pueden ser causa de preocupación.
En organismos. Debido al contacto de los camarones con los sedimentos, éstos pueden incorporar y bioacumular metales a través de las branquias y/o mediante la dieta.
La bioacumulación consiste en la retención neta de un contaminante por un organismo en relación al tiempo y es necesario cuantificarla por los siguientes motivos (Chapman, 1997): (1) determinar la biodisponibilidad específica de los contaminantes, (2) ayudar en la identificación de posibles agentes con potencial tóxico, (3) relacionar la concentración en un organismo con aquella encontrada en los diferentes eslabones tróficos de una cadena alimentaria (biomagnificación), (4) evaluar/predecir efectos en los organismos cuando están expuestos a bajas concentraciones pero por periodos largos de exposición.
Otro motivo importante, es el de conocer si los niveles de concentración en las partes comestibles de especies de importancia comercial como peces, ostiones y camarones, sobrepasan los límites permitidos para el consumo humano.
Aunque en México existen varios estudios en los cuales se ha determinado el nivel de concentración de metales en camarones, la mayor parte de estos estudios se refiere a camarones silvestres, y sólo el trabajo de Páez-Osuna & Tron-Mayen (1996) registra valores de los metales esenciales Cu y Zn encontrados en camarones de granja, que se encuentran dentro del intervalo reportado para otros camarones de cultivo; mientras que los valores de Cd y Pb resultaron más bajos que los encontrados por Amaraneni (2006) en cultivos del SE de India (Tabla 2).
Debido a que la zona costera se encuentra expuesta a aportes de metales, es recomendable realizar estudios de este tipo a lo largo de la costa Noroeste del país y compararlos con el de Páez-Osuna & Tron-Mayen (1996), con el fin de verificar si existe alguna tendencia del nivel actual con respecto al descrito para los años 90.
EFECTOS DE LOS METALES EN CAMARONES
Dependiendo del tiempo de exposición y de la concentración, los metales, esenciales (e.g. Cu, Zn, Mn) o no esenciales (e.g. Cd, Pb, Hg), tienen el potencial de provocar un efecto tóxico en los organismos. Otros factores que influyen en la respuesta/efecto de un organismo, son: (1) variables biológicas como la edad, el sexo, el estado de salud y nutricional; (2) variables ambientales como salinidad, temperatura, pH y contenido de oxígeno disuelto, entre otros (Bainy, 2000).
Lacerda et al. (2006) sugieren que la suma de todos los aportes de metales, pueden llegar a tener un efecto negativo en la producción camaronícola, puesto que pueden afectar varios procesos fisiológicos y metabólicos del camarón, aunque esto ocurre sólo cuando los organismos no pueden regular los niveles internos de concentración y se ven rebasadas sus estrategias de desintoxicación y de almacenamiento en formas menos tóxicas.
En la Figura 2, se observan algunos efectos de los metales cuando el organismo se encuentra expuesto a contaminantes, los cuales pueden ser letales o subletales. En los efectos subletales, los metales alteran algunas reacciones bioquímicas/enzimáticas, afectando algunos organelos celulares, los cuales pueden tener efectos a nivel histológico y/o a nivel de procesos fisiológicos.

Cualquiera que sea el efecto, la exposición a metales puede provocar un daño a la estructura poblacional.
Liao et al. (2006) concluyeron que el estrés ocasionado por la exposición a metales aumenta la susceptibilidad de los organismos a patógenos, por lo que sugirieron implementar estudios de monitoreo ambiental en los sistemas de cultivo. Abad-Rosales et al. (2011) sugieren que existe una interacción entre los factores abióticos (incluidos los contaminantes) con los patógenos y el hospedero, en este caso, el camarón.
Pruebas de toxicidad aguda. Estas pruebas son de corta duración, que puede ser de unas horas hasta pocos días en función de la especie utilizada, de su ciclo de vida y de la respuesta que se busca, que normalmente es su mortalidad. Con esta información se calcula la concentración letal media (CL50), que es la concentración de un contaminante que causa el 50% de mortalidad de una población en un tiempo determinado. Este dato (en el caso de camarones, la CL50 más común es la que se obtiene a 96 horas de exposición) es usado para comparar la tolerancia de esa especie con otras, y sirve además para calcular los límites permisibles para el cultivo del organismo en cuestión.
Frías-Espericueta et al. (2001, 2003) presentaron las CL50 a 96 horas de Cd, Cu, Mn, Pb y Zn para postlarvas de camarón blanco (Litopenaeus vannamei Boone, 1931), que fueron 2.49, 37, 130, 134, 2.08 mg/L, respectivamente; y compararon estos valores con los conocidos para otras especies (Tabla 3). De acuerdo a sus resultados, las postlarvas de esta especie de camarón presentan una gran tolerancia a la presencia de metales, que puede ser debida al manejo de los organismos en las granjas y en los laboratorios de producción de postlarvas, en los cuales se usan compuestos que contienen algunos de estos metales, haciendo al camarón más tolerante a dichos contaminantes.
Sin embargo, tanto en el medio natural como en los sistemas de cultivo, los camarones no están expuestos solo a un metal, ya que las descargas naturales y/o antropogénicas contienen mezclas que pueden provocar efectos a concentraciones diferentes de las que causan cuando se trata de un solo metal. Por ejemplo, Frías-Espericueta et al. (2003, 2009b) expusieron postlarvas de L. vannamei a mezclas de metales y los resultados, que se muestran en la tabla 4, indican que en el caso de las mezclas Cu-Zn y Cd-Zn las concentraciones de los dos metales son mayores de las CL50 individuales, indicando un efecto de antagonismo, con consiguiente disminución de toxicidad. Por otra parte, en las mezclas Cd-Hg y Hg-Pb las concentraciones que provocan un 50% de mortalidad son menores de las encontradas para camarones expuestos de manera individual a esos metales, indicando un efecto de sinergismo.
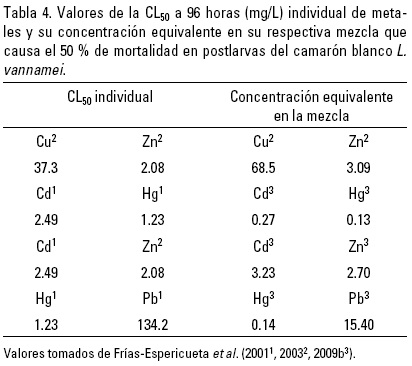
Por el contrario, en otro estudio realizado por Vanegas et al. (1997), se observó un efecto de sinergismo en camarones de la especie Litopenaeus setiferus (Linnaeus, 1767) expuestos a la mezcla de Cd-Zn; mientras que Negilski et al. (1981) describieron un resultado similar con el crustáceo decápodo australiano Callianassa australiensis (Dana, 1852). Esta diferencia en la respuesta observada en L. vannamei puede ser debido a diferencias genéticas y/o diferencias en las características químicas de sus respectivos ambientes (Frías-Espericueta et al., 2009b).
Pruebas de toxicidad subletal. En este tipo de pruebas se busca como respuesta un efecto de inhibición/activación de alguna enzima, la presencia de indicadores moleculares o fisiológicos, como alteraciones del crecimiento, de la proporción entre sexos, de la reproducción, problemas de osmorregulación o respuesta inmune, entre otros, incluyendo daños a nivel de ADN y sus repercusiones, que se traduce en efectos teratogénicos, muta-génicos y carcinogénicos (Dhawan et al., 2009). A continuación se presentan los resultados de algunos estudios realizados en México sobre los efectos subletales de los metales en camarones.
Efectos a nivel histológico. La histología como herramienta diagnóstica es una técnica de gran utilidad en el desarrollo de diversas investigaciones, ya que permite analizar la estructura microanatómica y detectar modificaciones o cambios, cuyo agente causal pueden ser múltiples factores como son los químicos, físicos y/o biológicos (Abad-Rosales et al., 2010).
Actualmente, esta herramienta de diagnóstico se utiliza como una variable de respuesta durante estudios tanto de laboratorio como en muestreos de campo, ya que proporciona información sobre las modificaciones a nivel celular y tisular debidas a la exposición a uno o más factores de estrés. Como ejemplo, el sulfato de cobre es de gran utilidad para la acuicultura ya que se emplea en el control de macroalgas y bivalvos durante los ciclos de cultivo del camarón. Sin embargo, sus efectos tóxicos pueden ser incrementados por los bajos porcentajes de recambio de agua, creando condiciones sub-óptimas para el cultivo.
Frías-Espericueta et al. (2008a) expusieron juveniles de L. vannamei a concentraciones de Cu consideradas subletales, y observaron necrosis, infiltración hemocítica y pérdida de la arquitectura normal de las lamelas secundarias de las branquias, así como estructura tubular irregular, atrofia y necrosis del hepatopáncreas, en el caso de exposición a las concentraciones más altas (3.512, 1.756 y 0.878 mg/L); mientras que para la concentración de 0.101 mg/L (que se usa en algunas granjas camaronícolas), se observó el inicio de un proceso inflamatorio en branquias y separación del mioepitelio y epitelio tubular en el hepatopáncreas.
Dadas sus características de organismo eurihalino, el camarón blanco se está cultivando también en aguas dulces o medianamente salobres (3-8 ups). En este caso, además de exponer a los organismos a una situación de estrés hipo-osmótico, el efecto de la menor salinidad se traduce en un incremento de la proporción del ión libre del cobre, que es una de las especies químicas más tóxicas.
Para verificarlo, Abad-Rosales et al. (2010) expusieron juveniles de L. vannamei a 0.101 mg/L de sulfato de cobre y a diferentes salinidades (10, 5 y 1 ups) durante 25 días, y observaron desprendimiento de las células epiteliales de los túbulos del he-patopáncreas, infiltración hemocítica y reducción de las células R y B en la salinidad más baja a partir de los diez días de exposición (Fig. 3). En los tratamientos de 5 y 10 ups, estos autores registraron las mismas alteraciones pero a partir de los 20 días de exposición y con menor grado de severidad.
Por otra parte se ha comentado que los organismos no están expuestos a un metal, sino a mezclas de varios metales, y que el efecto de cada uno puede ser sinérgico, provocando daño en los camarones a concentraciones inferiores a las que se consideran como seguras.
Frías-Espericueta et al. (2008b) observaron una relación entre la dosis y la respuesta de juveniles de L. vannamei expuestos a la combinación de siete metales (Cd, Cu, Fe, Hg, Mn, Pb y Zn), con efectos evidentes en el hepatopáncreas, branquias, epipoditos e intestino medio. Las alteraciones en el hepatopáncreas incluyeron pérdida de células R, atrofia tubular y desprendimiento celular. Las branquias presentaron dilatación anormal de las lagunas de las lamelas secundarias (Fig. 4); en los epipoditos se detectaron múltiples nódulos melanizados y finalmente el intestino presentó infiltración hemocítica severa.
Efectos a nivel de ADN. Varios estudios han demostrado que la presencia de contaminantes puede ejercer un efecto directo en las cadenas de ADN, por lo cual esta molécula ha sido considerada como un bioindicador (Everaarts, 1995), y cabe además destacar el riesgo de una posible alteración del material genético (Dhawan et al., 2009). Por este motivo, la evaluación de la integridad del ADN de las células germinales por medio de técnicas especializadas tiene una importancia crucial.
El ensayo cometa (electroforesis en gel de una sola célula) es una de las herramientas moleculares empleadas para determinar el daño en el ADN a nivel celular (Ostling & Johansson, 1984), que se fundamenta en la impregnación de células en un gel de agarosa, las cuales son sometidas a diferentes acciones para romper sus membranas celulares, y posteriormente exponerlas a un campo eléctrico, que contribuye a que el ADN salga del núcleo celular.
Cuando esto ocurre, se obtiene una imagen semejante a un cometa, y la magnitud de su cola es directamente proporcional al grado del daño (Piperakis, 2009). Esta técnica, considerada simple, sensitiva y rápida, ha sido utilizada exitosamente en estudios de toxicología, monitoreo ecológico, genética, genotoxicidad, daño por criopreservación y epidemiología humana (Lee & Steiner, 2003; Piperakis, 2009).
No existen muchos ejemplos de la aplicación de esta técnica para especies acuáticas, pese a que su uso podría ser relevante para la determinación del potencial genotóxico de contaminantes al medio ambiente (Dhawan et al., 2009).
La evaluación de la genotoxicidad de metales con el ensayo cometa se ha realizado principalmente en células de hemolinfa, hepatopáncreas, embriones, branquias, glándulas digestivas o en celomitos de especies marinas y de agua dulce. Estos estudios se han realizado principalmente en bivalvos como Mytilus edulis Linnaeus, 1758 (Prusky & Dixon, 2002) y Mytilus galloprovincialis Lamarck, 1819 (Dailianis et al., 2005); en peces como Leuciscus cephalus Linnaeus, 1758 (Winter et al., 2004), Mugilsp. (De Andrade et al., 2004), Oncorhynchus mykiss Walbaum, 1792 (Risso-Faverney et al., 2001), en el delfín Tursiops truncatus Montagu, 1821 (Betti & Nigro, 1996) y en el camarón estuarino Palaemonetes pugio Holthuis, 1949 (Lee et al., 2000).
Recientemente, Frías-Espericueta et al. (2011) usaron el ensayo cometa para evaluar el daño en ADN de hemocitos del camarón blanco (L. vannamei) expuestos a diferentes concentraciones de cobre, y confirmaron la genotoxicidad de este contaminante para esta especie.
Es importante mencionar que la incorporación de metales en el material genético de estos organismos podría afectar su variabilidad genética y alterar de manera importante las características deseables en las prácticas selectivas de las crías. Por lo anterior, se requieren de más estudios de esta índole, puesto que además del cobre, se ha observado la presencia de otros metales como el cadmio y el níquel, que también son considerados genotóxicos.
Efectos sobre la tasa de respiración. Varios autores han observado que el consumo de oxígeno es un buen indicador del estado de estrés de un organismo, y por lo tanto de su exposición a contaminantes (como los metales), ya que su primera respuesta es el incremento del consumo de oxígeno para producir energía y hacer frente a este estrés.
Vosloo et al. (2002) observaron un aumento del consumo de oxígeno del cangrejo Potamonautes warreni Calman, 1918 expuesto a 1 mg/L de Cu, a partir de los 7 días de exposición; el consumo disminuyó a los 21 días, debido a los daños ocasionados en las branquias. Barbieri (2009) expuso al camarón Farfantepenaeus paulensis Pérez-Farfante, 1967 a Zn y Cd y observó una reducción del 25 y 32.4% del consumo de oxígeno, respectivamente, mostrándose un mayor efecto con el Cd. Este autor concluyó que el principal efecto patológico del Cd es la interferencia en la actividad del sistema respiratorio a nivel celular.
Chinni et al. (2000) comentaron que el daño citológico relacionado con el decremento en el consumo de oxígeno se debe a que las branquias son el principal objetivo de los metales disueltos. Esto causa cambios en el grosor del epitelio branquial y en el patrón de la hemolinfa en las branquias, incrementando la vacuolización y un estancamiento de la perfusión de la hemolinfa.
En la literatura científica internacional, existen varios trabajos similares sobre este tema. En México, solo se tiene el estudio de Ramírez et al. (1989), quienes expusieron a la jaiba Callinectes similis Williams, 1966 a Cd y Cr y observaron un incremento en su consumo de oxígeno durante las primeras 96 horas, que relacionaron con el incremento de la actividad locomotora y del sistema de ventilación, como un intento de escape de la situación adversa. En un estudio realizado por Wu & Chen (2004), se encontró que el Cd y Zn también provocaron una disminución en el consumo de oxígeno de L. vannamei. Por lo anterior, en nuestro país se requieren más estudios con camarones, ya que las condiciones ambientales pueden afectar la respuesta del organismo.
Efectos en el crecimiento. Frías-Espericueta et al. (2009b) expusieron postlarvas del camarón L. vannamei a diferentes concentraciones de una mezcla de metales (Cd, Cu, Fe, Hg, Mn, Pb y Zn) preparada considerando diferentes porcentajes de sus respectivas CL50, conocidos como factores de aplicación (a saber, mayor es el factor, mayor es la concentración a la que está expuesto el organismo). Observaron que el crecimiento de los camarones se vio afectado de manera proporcional a la concentración de la mezcla, evidenciando una relación dosis-respuesta (Figura 5), y comentaron que esta disminución en el crecimiento se debe a que los organismos usan una gran cantidad de energía metabólica para proteger sus células de los efectos tóxicos de los metales.
CONCLUSIONES
Los metales pueden ejercer su efecto tóxico alterando algunos procesos fisiológicos en los camarones, como son la respiración, la osmoregulación, el crecimiento y la respuesta inmune. Además, existen pocos estudios sobre el nivel de concentración de metales relacionados con la camaronicultura, por lo que es importante evaluar su contenido en los sedimentos, agua y organismos por sus implicaciones en el buen desarrollo del cultivo y por los riesgos a la salud humana.
AGRADECIMIENTOS
Los autores agradecen a María Clara Ramírez Jáuregui por la recopilación del acervo bibliográfico y a Rogelio Maytorena Ramírez la elaboración de las figuras 1 y 2.
REFERENCIAS
Abad-Rosales, S. M., M. G. Frías-Espericueta, A. Inzunza-Rojas, I. Osuna-López, R. Lozano-Olvera & D. Voltolina. 2010. Histological effect of Cu to white shrimp Litopenaeus vannamei juveniles at low salinities. Revista de Biología y Oceanografía 45 (1): 99-105. [ Links ]
Abad-Rosales, S. M., M. Betancourt-Lozano, F. Vargas-Albores & A. Roque. 2011. Interacción de factores físicos, químicos y biológicos en el cultivo del camarón. In: Ruiz-Luna, A., C. A. Berlanga-Robles & M. Betancourt-Lozano (Eds.). Avances en Acuicultura y Manejo Ambiental. Mazatlán. Trillas, pp. 151-164. [ Links ]
Agusa, T., T. Kunito, A. Sudaryanto, I. Monirith, S. Kan-Atireklep, H. Iwata, A. Ismail, J. Sanguansin, M. Muchtar, T. S. Tana & S. Tanabe. 2007. Exposure assessment for trace elements from consumption of marine fish in Southeast Asia. Environmental Pollution 145 (3): 766-777. [ Links ]
Amaraneni, S. R. 2006. Distribution of pesticides, PAHs and heavy metals in prawn ponds near Kolleru lake wetland, India. Environment International 32 (3): 294-302. [ Links ]
Bainy, A. C. D. 2000. Biochemical responses in penaeids caused by con-taminants. Aquaculture 191 (1-3): 163-168. [ Links ]
Bambang, Y., P. Thuet, M. Charmantier-Duares, J. P. Trilles & G. Charmantier. 1995. Effect of copper on survival and osmoregulation of various developmental stage of the shrimp Penaeus japonicus Bate (Crustacea, Decapoda). Aquatic Toxicology 33 (2): 125-139. [ Links ]
Barbieri, E. 2009. Effects of zinc and cadmium on oxygen consumption and ammonium excretion in pink shrimp (Farfantepenaeus paulensis Pérez-Farfante, 1967, Crustacea). Ecotoxicology 18 (3): 312-318. [ Links ]
Betti, C. & M. Nigro. 1996. The comet assay for evaluation of the genetic hazard of pollutants in cetaceans: preliminary results on the genotoxic effects of methyl-mercury on the bottle-nosed dolphin (Tursiops truncatus) lymphocytes in vitro. Marine Pollution Bulletin 32 (7): 545-548. [ Links ]
Boyd, C. E., M. E. Tanner, M. Madkour & K. Masuda. 1994. Chemical characteristics of bottom soils from freshwater and brackishwater aquaculture ponds. Journal of the World Aquaculture Society 25 (4): 517-534. [ Links ]
Carbonell, G., C. Ramos & J. V. Tarazona. 1998. Heavy metals in shrimp culture areas from the Gulf of Fonseca, Central America. II. Cultured shrimp. Bulletin of Environmental Contamination and Toxicology 60 (2): 260-265. [ Links ]
CESASIN, (2010). Producción de camarón en México. Industria Acuícola 6 (3): 35. [ Links ]
Chapman, P. 1997. Is bioaccumulation useful to predicting impacts. Marine Pollution Bulletin 34 (5): 282-283. [ Links ]
Chinni, S., R. N. Khan & P. R. Yallapragada. 2000. Oxygen consumption, ammonia-N excretion, and metal accumulation in Penaeus indicus postlarvae exposed to lead. Bulletin of Environmental Contamination and Toxicology 64 (2): 144-151. [ Links ]
Chou, C. L., K. Haya, L. A. Paon, L. Burridge & J. D. Moffat. 2002. Aquaculture-related trace metals in sediments and lobsters and relevance to environmental monitoring program ratings for near-filed effects. Marine Pollution Bulletin 44 (11): 1259-1268. [ Links ]
Dailianis, S., S. M. Piperakis & M. Kaloyianni. 2005. Cadmium effects on ROS production and DNA damage via adrenergic receptors stimu-lation: role of Na+/H+ exchanger and PKC. Free Radical Research 39 (10): 1059-1070. [ Links ]
De Andrade, V. M., J. Silva, F. R. Silva, V. D. Heuser, J. F. Dias & M. L. Yoneama. 2004. Fish as bioindicator to assess the effects of pollution in two southern Brazilian rivers using the comet assay and micronucleus test. Environmental and Molecular Mutagenesis 44 (5): 459-468. [ Links ]
Dhawan, A., M. Bajpayee & D. Parmar. 2009. Comet assay: A reliable tool for assessment of DNA damage in different models. Cell Biology and Toxicology 25 (1): 5-32. [ Links ]
Everaarts, J. M. 1995. DNA integrity as a biomarker of marine pollution: Strand breaks in sea star (Asterias rubens) and dab (Limanda limanda). Marine Pollution Bulletin 31 (4): 431-438. [ Links ]
Frías-Espericueta, M. G., D. Voltolina & I. Osuna-López. 2001. Acute toxicity of cadmium, mercury, and lead to whiteleg shrimp (Litopenaeus vannamei) postlarvae. Bulletin of Environmental Contamination and Toxicology 67 (4): 580-586. [ Links ]
Frías-Espericueta, D. Voltolina & I. Osuna-López. 2003. Acute toxicity of copper, zinc, iron, and manganese and of the mixtures copper-zinc and iron-manganese to whiteleg shrimp Litopenaeus vannamei postlarvae. Bulletin of Environmental Contamination and Toxicology 71 (1): 912-917. [ Links ]
Frías-Espericueta, M. G., J. I. Osuna-López, P. J. López-Sáenz, G. López-López & G. Izaguirre-Fierro. 2004. Heavy metals in surface sediments of Huizache-Caimanero lagoon, Northwest coast of Mexico. Bulletin of Environmental Contamination and Toxicology 73 (4): 749-755. [ Links ]
Frías-Espericueta, M. G., I. Osuna-López, D. Voltolina, E. M. Correa-González, M. J. Armenta-Monje, G. López-López & G. Izaguirre-Fierro. 2006. Metals in shrimp farm sediments, Sinaloa Northwest Mexico. Bulletin of Environmental Contamination and Toxicology 77 (6): 912-917. [ Links ]
Frías-Espericueta, M. G., R. Castro-Longoria, G. J. Barrón-Gallardo, S. Abad-Rosales, F. Páez-Osuna & D. Voltolina. 2008a. Histological changes and survival of Litopenaeus vannamei juveniles with different copper concentrations. Aquaculture 278 (1-4): 97-100. [ Links ]
Frías-Espericueta, M. G., S. Abad-Rosales, A. C. Nevárez-Velázquez, J. I. Osuna-López, F. Páez-Osuna, R. Lozano-Olvera & D. Voltolina. 2008b. Histological effects of a combination of heavy metals on Pacific whi-te shrimp Litopenaeus vannamei juveniles. Aquatic Toxicology 89 (3): 152-157. [ Links ]
Frías-Espericueta, M. G., I. Osuna-López, I. Bañuelos-Vargas, G. López-López, M. D. Muy-Rangel, G. Izaguirre-Fierro, W. Rubio-Carrasco, P. C. Meza-Guerrero & D. Voltolina. 2009a. Cadmium, copper, lead and zinc contents of the mangrove oyster Crassostrea corteziensis of seven coastal lagoons of NW Mexico. Bulletin of Environmental Contamination and Toxicology 83 (4): 595-599. [ Links ]
Frías-Espericueta, M. G., D. Voltolina, I. Osuna-López & G. Izaguirre-Fierro. 2009b. Toxicity of metal mixtures to the pacific white shrimp Litopenaeus vannamei postlarvae. Marine Environmental Research 68 (5): 223-226. [ Links ]
Frías-Espericueta, M. G., M. Aguilar-Juárez, D. Voltolina & C. Paniagua-Chávez. 2011. Effect of Cu on hemocytic DNA of the white shrimp Litopenaeus vannamei assessed by the comet assay. Journal of the World Aquaculture Society 42 (4): 586-590. [ Links ]
García-Hernández, J., L. García-Rico, M. E. Jara-Marini, R. Barraza-Guardado & A. H. Weaver. 2005. Concentrations of heavy metals in sediments and organisms during a harmful algal bloom (HAB) at Kun Kaak bay, Sonora, Mexico. Marine Pollution Bulletin 50 (7): 733-739. [ Links ]
García-Rico, L., S. Wilson-Cruz, M. C. Frasquillo-Félix & M. E. Jara-Marini. 2003. Total metals in intertidal surface sediment of oyster culture areas in Sonora, Mexico. Bulletin of Environmental Contamination and Toxicology 70 (6): 1235-1241. [ Links ]
García-Rico, L., M. S. Soto-Cruz, M. E. Jara-Marini & A. Gómez-Álvarez. 2004. Fracciones geoquímicas de Cd, Cu y Pb, en sedimentos costeros superficiales de zonas ostrícolas del estado de Sonora, México. Revista Internacional de Contaminación Ambiental20(4): 159-167. [ Links ]
García-Rico, L., M. Valenzuela-Rodríguez & M. E. Jara-Marini. 2006. Geochemistry of mercury in sediments of oyster areas in Sonora, Mexico. Marine Pollution Bulletin 52 (4): 453-458. [ Links ]
García-Rico, L., L. Tejeda-Valenzuela, M. E. Jara-Marini & A. Gómez-Álvarez. 2011. Dissolved and particulate metals in water from Sonora coast: a pristine zone of Gulf of California. Environmental Monitoring and Assessment 176 (1-4): 109-123. [ Links ]
Green-Ruiz, C. & F. Páez-Osuna. 2003. Heavy metals distribution in surface sediments from a subtropical coastal lagoon system associated with an agricultural basin. Bulletin of Environmental Contamination and Toxicology 71 (1): 52-59. [ Links ]
Green-Ruiz, C. & F. Páez-Osuna. 2006. Heavy metals and clay minerals in surface sediments of Mazatlán bay, Mexican subtropical Pacific coast. International Journal of Environment and Pollution 26 (1-3): 201-219. [ Links ]
Green-Ruiz, C., J. Ruelas-Inzunza & F. Páez-Osuna. 2005. Mercury in surface sediments and benthic organisms from Guaymas bay, east coast of the Gulf of California. Environmental Geochemistry and Health 27 (4): 321-329. [ Links ]
Johnson, M. W. & J. H. Gentile. 1979. Acute toxicity of cadmium, copper, and mercury to larval American lobster Homarus americanus. Bulletin of Environmental Contamination and Toxicology 22 (1): 258-264. [ Links ]
Lacerda, L. D., J. A. Santos & R. M. Madrid. 2006. Copper emission factors from intensive shrimp aquaculture. Marine Pollution Bulletin 52 (12): 1823-1826. [ Links ]
Lee, R. F. & S. Steinert. 2003. Use of the single cell gel electrophoresis/comet assay for detecting DNA damage in aquatic (marine and freshwater) animals. Mutation Research 544 (1): 43-64. [ Links ]
Lee, R. F., G. B. Kim, K. A. Maruya, S. A. Steinert & Y. Oshima. 2000. DNA strand breaks (comet assay) and embryo development effects in grass shrimp (Palaemonetes pugio) embryos after exposure to genotoxicants. Marine Environmental Research 50 (1-5): 553-557. [ Links ]
Liao, C. M., C. F. Chang, C. H. Yeh, S. C. Chen, K. C. Chiang, C. P. Chio, B. Y. H. Chou, L. J. Jou, G. W. Lien, C. M. Lin, H. H. Shen & G. D. Wu. 2006. Metal stresses affect the population dynamics of disease transmission in aquaculture species. Aquaculture 257 (1-4): 321-332. [ Links ]
Mariño-Balsa, J. C., E. Poza, E. Vázquez & R. Beiras. 2000. Comparative toxicity of dissolved metals to early larval stage of Palaemon elegans, Maja squinado, and Homarus gammarus (Crustacea:Decapoda). Archives of Environmental Contamination and Toxicology 39 (3): 345-351. [ Links ]
Martin, M., K. E. Osborn, P. Billig & N. Glickstein. 1981. Toxicity of ten metals to Crassostrea gigas and Mytilus edulis embryos and Cancer magister larvae. Marine Pollution Bulletin 12 (9): 305-308. [ Links ]
Martínez-Córdova, L. R., M. Martínez-Porchas & E. Cortés-Jacinto. 2009. Camaronicultura mexicana y mundial. ¿Actividad sustentable o industria contaminante? Revista Internacional de Contaminación Ambiental 25 (3): 181-196. [ Links ]
Munsiri, P., C. E. Boyd & B. F. Hajek. 1995. Physical and chemical cha-racteristics of bottom soil profiles at Auburn, Alabama USA and a proposed system for describing pond soil horizons. Journal of the World Aquaculture Society 26 (4): 346-377. [ Links ]
Muñoz-Barbosa, A., E. A. Gutiérrez-Galindo & G. Flores-Muñoz. 2000. Mytilus californianus as an indicator of heavy metal in the northwest coast of Baja California, Mexico. Marine Environmental Research 49 (2): 123-144. [ Links ]
Negilski, D. S., M. Ahsanullah & M. C. Mobley. 1981. Toxicity of zinc, cadmium and copper to the shrimp Callianassa australiensis. II. Effects of paired and triad combinations of metals. Marine Biology 64 (3): 305-309. [ Links ]
Ochoa-Valenzuela, L. E., A. Gómez-Álvarez, L. García-Rico & A. I. Villalba Atondo. 2009. Distribution of heavy metals in surface sediments of the Bacochibampo bay, Sonora, Mexico. Chemical Speciation and Bioavailability 21 (4): 1-8. [ Links ]
Ostling, O. & K. J. Johanson. 1984. Microelectrophoretic study of radiation induced DNA damages in individual mammalian cells. Biochemical and Biophysical Research Communications 123 (1): 291-298. [ Links ]
Osuna-López, J. I., F. Páez-Osuna & P. Ortega-Romero. 1986. Cd, Co, Cr, Cu, Fe, Ni, Pb y Zn en los sedimentos del puerto y antepuerto de Mazatlán. Ciencias Marinas 12 (2): 35-45. [ Links ]
Osuna-López, J.I., H. Zazueta-Padilla, M. Frías-Espericueta, G. Izaguirre-Fierro & G. López-López. 1997. Metales pesados en sedimentos superficiales del sistema Arroyo Jabalines-Estero del Infiernillo, Mazatlán, Sinaloa, México. Revista de Ciencias del Mar 15 (1): 43-49. [ Links ]
Páez-Osuna, F. 2001. La interacción camaronicultura y medioambiente. In: Páez-Osuna, F. (Ed.). Camaronicultura y Medioambiente. ICMyL-UNAM. PUAl y Colegio de Sinaloa, pp. 15-21. [ Links ]
Páez-Osuna, F. & L. Tron-Mayen. 1996. Concentrations and distributions of heavy metals in tissues of wild and farmed shrimp Penaeus van-namei from the Northwest coast of Mexico. Environment International 22 (4): 443-450. [ Links ]
Pandey, J., K. Shubhashish & R. Pandey. 2009. Metal contamination of Ganga River (India) as influenced by atmospheric deposition. Bulletin of Environmental Contamination and Toxicology 83 (2): 204-209. [ Links ]
Piperakis, S. M. 2009. Comet assay: A brief history. Cell Biology and Toxicology 25 (1): 1-3. [ Links ]
Phillips, D. J. H. & P. S. Rainbow. 1993. Biomonitoring of trace aquatic contaminants. Elsevier, Londres. 371 p. [ Links ]
Pruski, A. M. & D. R. Dixon. 2002. Effects of cadmium on nuclear integrity and DNA repair efficiency in the gill cells of Mytilus edulis L. Aquatic Toxicology 57 (3): 127-137. [ Links ]
Ramírez, P., G. Barrera & C. Rosas. 1989. Effects of chromium and cadmium upon respiration and survival of Callinectes similis. Bulletin of Environmental Contamination and Toxicology 43 (6): 850-857. [ Links ]
Risso de Faverney, C., A. Devaux, M. Lafaurie, J. P. Girard, B. Bailly & R. Rahmani. 2001. Cadmium induces apoptosis and genotoxicity in rainbow trout hepatocytes through generation of reactive oxygen species. Aquatic Toxicology 53 (1): 65-76. [ Links ]
Ruiz-Fernández, A. C., C. Hillaire-Marcel, F. Páez-Osuna, B. Ghaleb & M. Soto-Jiménez. 2003. Historical trends of metal pollution recorded in the sediments of the Culiacan River estuary, Northwestern Mexico. Applied Geochemistry 18 (4): 577-588. [ Links ]
Soto-Jiménez, M., F. Páez-Osuna & A. C. Ruiz-Fernández. 2003. Geochemical evidences of the anthropogenic alteration of trace metal composition of the sediments of Chiricahueto marsh (SE Gulf of California). Environmental Pollution 125 (3): 423-432. [ Links ]
Vanegas, C., S. Espina, A. V. Botello & S. Villanueva. 1997. Acute toxicity and synergism of cadmium and zinc in the white shrimp Penaeus setiferus juveniles. Bulletin of Environmental Contamination and Toxicology 58 (1): 87-92. [ Links ]
Vázquez, F. G. & V. K. Sharma. 2004. Major and trace elements in sediments of the Campeche sound, southeast Mexico. Marine Pollution Bulletin 48 (1-2): 87-90. [ Links ]
Vosloo, A., W. J. Aardt & L. J. Mieni. 2002. Sublethal effects of copper on the freshwater crab Potamonautes warreni. Comparative Biochemistry and Physiology 133A (3): 695-702. [ Links ]
Winter, M. J., N. Day, R. A. Hayes, E. W. Taylor, P. J. Butler & J. K. Chipman. 2004. DNA strand breaks and adducts determined in feral and caged chub (Leuciscus cephalus) exposed to rivers exhibiting variable water quality around Birmingham, UK. Mutation Research 552 (1-2): 163-175. [ Links ]
Wu, J. P. & H. C. Chen. 2004. Effects of cadmium and zinc on oxygen consumption, ammonium excretion, and osmoregulation of white shrimp (Litopenaeus vannamei). Chemosphere 57 (11): 1591-1598. [ Links ]
Wu, X. Y. & Y. F. Yang. 2011. Heavy metal (Pb, Co, Cd, Cr, Cu, Fe, Mn and Zn) concentrations in harvest-size white shrimp Litopenaeus vannamei tissues from aquaculture and wild source. Journal of Food Composition and Analysis 24 (1): 62-65. [ Links ]














