Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.18 no.3 Ciudad de México dic. 2008
Artículos
Biología reproductiva de la cornuda común Sphyrna lewini Griffith & Smith (Sphyrnidae) en el Golfo de California
Reproductive Biology of the Scalloped Hammerhead Shark Sphyrna lewini Griffith & Smith (Sphyrnidae) in the Gulf of California
Ana María Torres–Huerta1*, Carlos Villavicencio–Garayzar2 y David Corro–Espinosa3
1 Universidad del Mar. Ciudad Universitaria. P. O. Box 70902. Puerto Ángel, Oaxaca. 70902. México.
2 Universidad Autónoma de Baja California Sur. Carretera al sur Km. 5.5. Apartado Postal 19–B. La Paz, Baja California Sur. 23080. México
3Centro Regional de Investigaciones Pesqueras de Mazatlán. Camarón Sábalo s/n esq. Tiburón. Fracc. Sábalo Country Club. Mazatlán, Sonora. 82100. México
*Autor para correspondencia:
Ana María Torres–Huerta, Universidad del Mar
E e–mail: anamaria@angel.umar.mx
Recibido: 30 de agosto de 2006
Aceptado: 20 de junio de 2008
RESUMEN
Durante el período de 1994 a 1996 se obtuvieron datos de longitud total (LT), peso total, sexo y madurez gonádica de 1 693 individuos de Sphyrna lewini, capturados en ocho campos pesqueros de tiburón en el Golfo de California. En las hembras la longitud total tuvo un intervalo de 41 a 363 cm, mientras que en los machos fue de 43 a 290 cm. La proporción de sexos en embriones, neonatos y juveniles fue de 1:1, no así en adultos donde las proporciones variaron en las localidades de muestreo. Los machos y hembras alcanzaron la talla de primera madurez a los 170 y 207 cm de LT, respectivamente. El período de gestación tiene una duración aproximada de 11 meses y la fecundidad máxima fue de 32 embriones por hembra. El nacimiento de las crías ocurre en junio, con una talla entre 41 y 53 cm de LT. La presencia de neonatos y hembras grávidas durante el verano en la región central y sureste del Golfo de California sugiere que éstas son dos importantes áreas de nacimiento para la cornuda común en el Golfo de California. Mientras que, la costa este del Golfo de California y la Bahía de La Paz funcionan como área de crianza para los juveniles.
Palabras clave: Reproducción, fecundidad, madurez sexual, Shyrna lewini, Golfo de California.
ABSTRACT
Reproductive biology of scalloped hammerhead shark Sphyrna lewini, was investigated in eight shark fishing camps in the Gulf of California (Mexico) from 1994 to 1996. A total of 1 693 specimens were determined total length (TL), total weight, sex and the gonadal maturity. The total length range was from 41 to 363 cm for females and from 43 to 290 cm for males. The sex proportion of embryos, neonates and juveniles in most of the cases was 1:1; however, this was not the case for adults, where the proportions varied at the sampling sites. Sexual maturity was reached at 170 cm for males and 207 cm TL for females. The gestation period was 11 months and the highest fecundity was 32 embryos. The June births were between 41 and 53 cm TL. The presence of neonates, gravid females, and small juveniles in the east coast of the Gulf of California and in La Paz Bay indicates that these areas are used as a nursery for S. lewini. In addition, the presence of male and female adults during the summer in the central and southeastern Gulf of California suggests that these two places are important as mating areas.
Key words: Reproduction, fecundity, sexual maturity, Sphyrna lewini, Gulf of California.
INTRODUCCIÓN
En México, los mayores volúmenes de captura de tiburón se registran en la zona noroeste, incluyendo el Golfo de California y la costa occidental de Baja California. En esta zona se tienen registradas seis especies de tiburón martillo, de las cuales, la cornuda común Sphyrna lewini (Griffith & Smith 1834) es frecuentemente capturada en la región sur del Golfo de California. La cornuda común es una especie vivípara placentaria con distribución circumtropical, los juveniles viven principalmente en aguas costeras llegando a formar agrupaciones con predominancia de hembras (Klimley 1981; Klimley & Nelson 1981). Los adultos son semioceánicos, se les encuentra viviendo solitarios o en grupos menores (Compagno et al. 1995) y durante el verano realizan migraciones hacia el Golfo de California con fines reproductivos (Klimley, 1987). Dentro del Golfo, al sur de Sinaloa, se tiene registrada una zona de nacimiento y crianza para la especie (Saucedo–Barron 1983); otras zonas de nacimiento y crianza en aguas del Pacífico mexicano se reportan en la costa de Michoacán (Anislado–Tolentino 2000) y costa de Chiapas (Campuzano–Caballero 2002).
De acuerdo a Hernández–Carvallo (1967), Saucedo–Barron et al. (1982) y Galván–Magaña et al. (1989) la cornuda común está presente durante todo el año en la costa sureste del Golfo, con mayor abundancia en invierno y en verano en la costa suroeste. Estas diferencias en la abundancia determinan que la captura comercial se realice durante temporadas diferentes en ambas costas. Asimismo, S. lewini es la especie que soporta la pesquería de tiburón en aguas costeras y su población ha registrado una disminución en las capturas en los últimos años debido a la sobrepesca de juveniles y hembras grávidas. Lo anterior ha ocasionado que durante décadas, las zonas de nacimiento, crianza y reproducción de la cornuda común hayan sido sometidas a una intensa extracción pesquera, sin que hasta el momento se cuente con normas que protejan y regulen el aprovechamiento de estas áreas y muy probablemente estén causando cambios ecológicos en el ecosistema. Por lo anterior, el objetivo del presente estudio es aportar información sobre las tallas, proporción de sexos, relación longitud total–peso, longitud total de nacimiento, longitud total de primera madurez, fecundidad y periodo de gestación de S. lewini en el Golfo de California.
MATERIALES Y MÉTODOS
De 1994 a 1996 se examinaron 1 693 cornudas comunes capturadas en ocho localidades dedicadas a la captura comercial de tiburón, siendo éstas: San Francisquito y El Barril en Baja California; El Quelele en Baja California Sur; Bahía Kino en Sonora; Altata, Playa Sur y Teacapan en Sinaloa y Boca de Camichín en Nayarit (Fig. 1). Los muestreos se realizaron mensualmente en Teacapan y El Quelele; mientras que en El Barril, San Francisquito y Bahía Kino se realizaron durante la temporada de captura de tiburón de mayo a octubre, y en Altata y Playa Sur de noviembre a abril.
La captura de los organismos se realizó con embarcaciones menores tipo panga utilizando palangres pelágicos de 250 a 500 anzuelos del número 5, redes de deriva de 25 y 30 cm de abertura de malla; así como redes agalleras con abertura de malla de 9 cm.
De cada organismo capturado se obtuvo la longitud total (LT), peso total (PT), sexo y estado de madurez clasificando a las hembras y machos como neonatos, juveniles y adultos. Los tiburones con cicatriz umbilical se clasificaron como neonatos (Castro, 1996). Las hembras se consideraron adultas cuando se encontraron ovocitos maduros en el ovario, huevos o embriones en el oviducto; mientras que las hembras juveniles fueron las que presentaron ovarios delgados de apariencia celular homogénea, útero delgado y flácido e indistinto de los oviductos (Springer 1960; Pratt 1979). Los machos fueron catalogados adultos cuando los mixopterigios (órganos copuladores) sobrepasaban el extremo posterior de las aletas pélvicas y la estructura interna era visible, dura y osificada; mientras que los machos juveniles presentaron mixopterigios cortos y suaves, y sus testículos eran delgados e incoloros (Clark & von Schmidt 1965; Pratt 1979).
En el caso de las hembras grávidas se registraron el número de embriones por hembra, longitud total y sexo de cada embrión; así como el diámetro del ovocito de mayor tamaño y más cercano al oviducto. En los machos se evaluó la longitud y el estado de calcificación de los mixopterigios (Pratt 1979). La talla de madurez del 50% para machos y hembras se determinó mediante un modelo logístico, Y= [1 + e–( a + bX )]–1, donde Y es la proporción de individuos maduros (Hosmer & Lemeshow 1989) y X es la longitud total (cm).
La diferencia de la proporción de sexos en embriones, neonatos, juveniles y adultos fue determinada con una prueba de bondad de ajuste de Chi cuadrada. La relación longitud–peso, se estableció a través de la ecuación de la curva PT = a(LT)b, donde PT es el peso (g), LT es la longitud total (cm), b es el coeficiente de alometría, y a es una constante (Ricker 1979). La transformación logarítmica de esta expresión es Log PT = Log a + b Log LT y fue calculada por sexos separados. Para detectar las posibles diferencias en la relación LT – PT entre sexos se realizó un análisis de covarianza usando el estadístico F (α = 0.05) y para verificar si el coeficiente de alometría, se diferencia del valor teórico 3 que identifica el crecimiento isométrico en peso, se aplicó una t de Student (a = 0.05). Los análisis estadísticos fueron realizados en los paquetes estadísticos Statistica versión 5.1, a un nivel de confianza del 95%.
RESULTADOS
De acuerdo a la temporada y zonas de captura de las localidades visitadas se establecieron 4 regiones de captura de S. lewini siendo estas: la Región 1 que corresponde a la zona de captura de San Francisquito, El Barril, y Bahía Kino (Fig. 1); la Región 2 de Altata y Playa Sur; la Región 3 de El Quelele y la Región 4 a la zona de captura de Teacapan y Boca de Camichín.
En las Regiones 1 y 4 se registraron tanto neonatos (46.5% en ambas), como juveniles (9.6 y 46.9%, respectivamente) y adultos (43.9 y 6.6%, respectivamente) (Fig. 2). En las Regiones 2 y 3 se observaron neonatos (2.1 y 2.9%, respectivamente) y juveniles (97.9 y 97.1%, respectivamente).
Los neonatos fueron colectados en junio y julio en la Región 1, 3 y 4. Los adultos en la Región 1 de mayo a julio y en la Región 4 de julio a noviembre. En la Región 3 y 4 se observaron juveniles durante todo el año, en la primera las mayores abundancias se registraron de junio a agosto y en la segunda de septiembre a noviembre (Fig. 3). Las hembras neonato presentaron tallas de 41 a 55 cm y los machos neonato de 42 a 54 cm de LT. Las hembras juveniles de 57 a 204 cm y los machos de 58 a 170 cm de LT. Las hembras adulto de 210 a 363 cm y los machos de 172 a 290 cm de LT. La Tabla 1 muestra las longitudes totales de hembra y machos por región de captura.
La proporción de sexos (hembras por macho) de los neonatos en la Región 1 (χ2 = 0.67, gl = 1, p = 0.41) y 4 (χ2 = 1.00, gl = 1, p = 0.31) no se desvía significativamente de la proporción 1:1 esperada. En los juveniles de la Región 1 (χ2 = 1.47, gl = 1, p = 0.22), Región 2 (χ2 = 0.52, gl = 1, p = 0.47), Región 3 (χ2 = 0.24, gl = 1, p = 0.62) y Región 4 (χ2 = 0.19, gl = 1, p = 0.66) la proporción de sexos (hembras por macho) también no se desvía significativamente de la proporción 1:1 esperada. En lo referente a los adultos, la proporción de hembras por macho fue de 3:1 en la Región 1 (χ2 = 12.55, gl = 1, p < 0.01), y de 1:2 en la Región 4 (χ2 = 7.05, gl = 1, p < 0.01).
La relación longitud total–peso para sexos separados muestra una pendiente de 3.10 para hembras y 2.82 para machos (Fig. 4). La prueba t de Student indicó que la pendiente es mayor a tres para hembras (t = –6.63, gl = 73, p < 0.01) y menor para machos (t = –8.57, gl = 61, p < 0.01). El análisis de covarianza aplicado para determinar diferencias entre las pendientes e interceptos de la ecuación de machos y hembras indicó que existen diferencias significativas (F= 46.13, gl = 1,138, p < 0.01), estimándose una ecuación para cada sexo.
La longitud y calcificación de los órganos copuladores indicó que los machos con tallas menores a 154 cm de LT presentaron mixopterigios sin calcificar (Fig. 4). El proceso de maduración sexual se realiza entre los 161 y 186 cm de LT, con un crecimiento acelerado de los órganos copuladores. En los machos con tallas mayores a 188 cm de LT se observaron mixopterigios calcificados. Con base en el modelo logístico, la talla de 170 cm de LT corresponde a la longitud donde el 50% de machos están maduros (Fig. 5).
El desarrollo de los ovarios estableció que las hembras con tallas menores a 204 cm de LT presentaron ovarios inmaduros; mientras que las hembras observadas con tallas superiores a 212 cm de LT mostraron ovarios desarrollados y ovocitos diferenciados con diámetros entre 8.3 y 23.8 mm. Sin embargo, la hembra de menor talla con embriones en desarrollo en el útero fue de 232 cm de LT. El modelo logístico indicó que la talla de 207 cm de LT corresponde a la longitud donde el 50% de hembras maduran (Fig. 6).
Se registraron 24 hembras grávidas en la Región 1 y 4 (Tabla 2) durante los meses de mayo, junio, julio y septiembre. La fecundidad promedio fue de 25 embriones por hembra. La LT promedio de los embriones se incrementó de 42.1 en mayo a 47.8 cm en julio (Fig. 7a). En agosto no hubo registros de hembras grávidas; sin embargo, las hembras adultas observadas fueron encontradas con el útero distendido y flácido, señal del reciente alumbramiento. En septiembre, se observaron dos hembras grávidas de 250 y 253 cm de LT, con embriones de 10.7 cm de LT promedio. De octubre a abril no hubo registros en ninguna de las regiones de hembras grávidas. Los neonatos fueron observados en julio y agosto en las 4 regiones. En julio presentaron una talla mínima de 41 cm y máxima de 59 cm de LT (Fig. 7b), por lo que se asume que la cornuda común nace a partir de julio con una talla promedio de nacimiento de 50 cm de LT.
El crecimiento de los ovocitos se presentó de manera simultánea al de embriones, con un diámetro máximo del ovocito mas cercano al oviducto de 28 mm en mayo (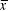 = 22.4), 37 mm en junio (
= 22.4), 37 mm en junio (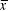 = 34.5) y 47 mm en julio (
= 34.5) y 47 mm en julio (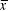 = 46.5) (Fig. 7c). La ovulación ocurrió entre julio, encontrándose huevos en el oviducto con un diámetro promedio de 33 mm. En las hembras grávidas recolectadas en septiembre los ovocitos tuvieron un diámetro máximo de 15 mm (
= 46.5) (Fig. 7c). La ovulación ocurrió entre julio, encontrándose huevos en el oviducto con un diámetro promedio de 33 mm. En las hembras grávidas recolectadas en septiembre los ovocitos tuvieron un diámetro máximo de 15 mm (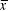 = 12.5).
= 12.5).
DISCUSIÓN
La captura del 99.0% de los neonatos en la costa este del Golfo de California (Región 1 y 4) y el 1.0% en la suroeste (Región 3), al parecer está relacionado con las características geográficas. Por una parte, la costa este ofrece a los neonatos una plataforma continental amplia en toda su extensión, que va de 5 a 25 km, y por su condición de neonatos las aguas someras incrementan su probabilidad de sobrevivencia al brindarles mayor protección de sus depredadores (Castro 1993). Por el contrario, en la plataforma de la costa oeste que es más estrecha, aproximadamente 5 km en promedio, en la Bahía de La Paz hay una amplitud máxima de 25 km (Contreras 1985), se registraron el 1% de los neonatos. Aunado a lo anterior, son también importantes las características oceanográficas que determinan que, en la costa este del Golfo de California, durante julio y agosto se presenten eventos de surgencias (Pegau et al. 2002); lo que genera una productividad alta y con esto los neonatos cuentan con una mayor disponibilidad de alimento en las primeras etapas de su vida. Anislado–Tolentino (2000) recolectó neonatos de S. lewini en la costa de Michoacán, México, entre julio y agosto en aguas que no sobrepasan los 50 m de profundidad. Por su parte, Campuzano–Caballero (2002) observó a los neonatos en la costa de Chiapas de mayo a agosto y Clarke (1971) en Bahía Kaneone, Hawai, en aguas que no sobrepasan los 19 m de profundidad.
Los juveniles permanecen durante todo el año en la Región 3 y 4 con mayor abundancia de julio a agosto en la Región 3 y de septiembre a diciembre en la Región 4. En la Región 3, Galván–Magaña et al. (1989), establecieron su presencia de primavera a otoño, con mayor abundancia en verano. Por su parte, Klimley (1981) y Klimley y Nelson (1981) observaron grandes cardúmenes durante el verano en la costa oeste del Golfo de California; y Klimley y Butler (1988) asociaron la presencia de estos cardúmenes de cornuda común y otros pelágicos con la entrada de una masa de agua tropical durante el verano. En la Región 2 no fue posible verificar si fuera de la temporada de captura de tiburón los juveniles están o no presentes; sin embargo, se registró su mayor abundancia durante diciembre a febrero. Esto concuerda con las abundancias obtenidas en la costa sur de Sinaloa por Saucedo–Barron et al. (1983) y Righetty & Castro (1990), quienes determinaron las mayores abundancias entre invierno y principios de primavera. Finalmente, en la Región 1 la talla de los juveniles corresponde a la de organismos preadultos. En cuanto a los adultos, el 85.1% de los individuos en la Región 1 fueron capturados de mayo a julio, y el 98.7% de los adultos de la Región 4 fueron capturados de julio a noviembre.
Los datos de los neonatos capturados con red agallera durante el verano y los juveniles con cicatriz umbilical prácticamente cicatrizada capturados de septiembre a diciembre, sugieren que en las primeras etapas de su vida y conforme se incrementa su talla, la cornuda común permanece en la costa del Golfo de California utilizando esta zona como área de crianza. Entonces podríamos sugerir que las tallas entre 122 y 170 cm LT, que fueron las menos abundantes, sobre todo fuera de la época reproductiva, muy probablemente se mueven hacia otras áreas. Esto se ha señalado por Saucedo–Barrón et at. (1982) en la costa de Sinaloa, sugiriendo dos posibles causas: primero, la necesidad de condiciones diferentes para alimentarse y alcanzar la madurez sexual, ya que se trata de tallas en las que se inicia el proceso de maduración y segundo, la distribución de estos organismos en la columna de agua puede ser diferente a las tallas adultas y esto los hace poco vulnerables a los equipos de pesca.
Igual número de machos y hembras nacen en la región central y sureste del Golfo (Región 1 y 4), esta proporción se mantiene en los juveniles. Esto concuerda con lo observado por Anislado–Tolentino (2000) en la costa de Michoacán y por Campuzano–Caballero (2002) en la costa de Chiapas quienes registraron una proporción de sexos de 1.2:1 hembras por macho y 1:1, respectivamente. En los adultos, la proporción de hembras es mayor en la región central, esto puede deberse a que efectivamente éstas son más numerosas que los machos o que posiblemente son más vulnerables a la pesca (Che–Tsung et al. 1988), y particularmente a las redes agalleras de deriva. Por el contrario en la costa sureste donde se captura a la especie con palangres, los machos tienden a ser más numerosos, esta proporción aumenta considerablemente por el hecho de que se acercan a la costa fuera del período reproductivo.
La relación longitud–peso encontrada para los machos indica un crecimiento alométrico negativo y para hembras alométrico positivo. Observándose que a partir de los 140 cm LT, las hembras tienden a ser más pesadas que los machos de similar talla, incrementándose esta diferencia conforme alcanzan tallas mayores. Righetty & Castro (1990) reportan también que las hembras de la cornuda común presentan en la región sureste del Golfo mayor peso que los machos de similar talla.
Los datos de longitud de los mixopterigios sugieren que en los machos el proceso de maduración inicia a los 161 cm LT y alcanzan la madurez a los 170 cm LT. Esto concuerda con las observaciones de Klimley (1987), Anislado–Tolentino (2000) y Campuzano–Caballero (2002) quienes encontraron espermatóforos en los conductos deferentes de los machos con tallas de 163 cm LT en el Golfo de California y de 175 cm de LT tanto en la costa de Michoacán como en la costa de Chiapas, respectivamente. Así mismo, de acuerdo a Che–Tsung et al. (1988) en la costa del Pacífico occidental (Taiwán) la talla de primera madurez para machos ha sido establecida en 198 cm LT. Las hembras examinadas a partir de los 212 cm de LT presentaron ovarios desarrollados; sin embargo, es hasta los 232 cm de LT cuando las hembras ovulan. Anislado–Tolentino (2000) estimó la talla de primera madurez en 209 cm de LT y Campuzano–Caballero (2002) de 215 cm LT en la costa de Chiapas. Por su parte, Che–Tsung et al. (1988) estimaron la talla de primera madurez en 212 cm de LT y Bass etal. (1975) reportan hembras inmaduras de 212 cm LT en la costa este de Sudáfrica.
En el presente trabajo se encontró que en promedio nacen 25 cornudas comunes por hembra, con una fecundidad máxima de 32 embriones y con una talla de nacimiento de entre 41 y 53 cm LT. Esto coincide con lo reportado por Anislado–Tolentino (2000), quien determinó en la costa de Michoacán una fecundidad promedio de 30 embriones por hembra y una fecundidad máxima de 42 embriones para la cornuda común; asimismo, Campuzano–Caballero (2002) reporta una fecundidad máxima de 43 embriones en la costa de Chiapas. En cuanto a la talla de nacimiento Branstetter (1987) reporta una talla de nacimiento de 49 cm de LT en el noroeste del Golfo de México, Che–Tsung et al. (1988) de 47 cm de LT en aguas al noreste de Taiwan, Compagno etal. (1995) de 50 cm de LT en el Pacífico Central Oriental y Castro (1996) entre 38 y 45 cm LT en aguas de Norteamérica.
En las hembras grávidas registradas durante el verano en la región central y sureste del Golfo, los embriones se encontraban en la última etapa de su desarrollo con tallas de 32 a 53 cm de LT, a su vez en el ovario los ovocitos alcanzaban su mayor diámetro (< 40mm) (Fig. 6), siendo esto el indicador de un ciclo reproductivo anual. A pesar de que en agosto no se examinaron hembras grávidas, con las 2 hembras observadas con tallas embrionarias promedio de 10.7 cm de LT en septiembre se podría sugerir que durante esta época se realizó la fecundación, iniciándose el crecimiento de embriones y ovocitos para el siguiente periodo de gestación, el cual tiene una duración aproximada de 11 meses. El período de gestación para la cornuda es de 10 meses en las costas de Taiwan (Che–Tsung et al. 1988), de 12 meses en el noroeste del Golfo de México (Branstetter 1987) y de aproximadamente 10 meses en la costa de Michoacán (Anislado–Tolentino 2000). Las hembras grávidas de la cornuda barrosa migran al Golfo de California y dan a luz a los neonatos entre mayo y julio. La época de nacimiento para la cornuda común en la costa de Michoacán y Chiapas también ocurre de mayo a julio (Anislado–Tolentino 2000; Campuzano–Caballero 2002).
De acuerdo a Springer (1967) y Castro (1993) las áreas de crianza de tiburones son consideradas zonas donde las hembras grávidas liberan a sus crías o depositan sus huevos, y los juveniles pasan las primeras semanas, meses o años de su vida. Se localizan en áreas costeras someras y ricas en energía, en las que existe abundante alimento y escasa depredación. Con base en la presencia de neonatos, hembras grávidas y juveniles de tallas pequeñas (entre 60 y 100 cm de LT) se sugiere que la costa este del Golfo de California y la Bahía de La Paz funcionan como un área de crianza para S. lewini. Asimismo, la presencia de hembras y machos adultos durante el verano en la región central y sureste del Golfo de California sugiere que estas son dos importantes áreas de reproducción.
AGRADECIMIENTOS
Este estudio fue financiado por el Sistema de Investigadores del Mar de Cortes–CONACyT a través del proyecto Pesquería y biología reproductiva de Elasmobranquios de la región central del Golfo de California, y por la Universidad Autónoma de Baja California Sur con el proyecto Los Elasmobranquios del Golfo de California.
REFERENCIAS
Anislado–Tolentino, V. 2000. Ecología pesquera del tiburón martillo Sphyrna lewini (Griffth y Smith, 1834) en el litoral del estado de Michoacán, México. Tesis de Maestría en Ciencias (Biología de Sistemas y Recursos Acuáticos), Facultad de Ciencias, UNAM, México. 142 p. [ Links ]
Bass, A. J., J. D. D'Aubrey & N. Kistnassamy. 1975. Sharks of the east coast of southern Africa. III. The families Carcharhinidae (excluding Mustelus and Carcharhinus) and Sphyrnidae. South African Association for Marine Biological Research. Oceanographical Research Institute. Investigational Report No.38, 100 p. [ Links ]
Branstetter, S. 1987. Age, growth and reproductive biology of the silky shark, Carcharhinus falciformis, and the scalloped hammerhead, Sphyrna lewini, from the northwestern Gulf of Mexico. Environmental Biology Fishes 19 (3): 161–173. [ Links ]
Campuzano–Caballero, J. C. 2002. Biología y pesquería del tiburón martillo Sphyrna lewini (Griffth y Smith, 1834), en Puerto Madero, Chiapas, Estados Unidos Mexicanos. Tesis de Licenciatura (Biología), Facultad de Ciencias, UNAM. 196 p. [ Links ]
Castro, J. I. 1993. The shark nursery of Bull Bay, South Carolina, with a review of the shark nurseries of the southeastern coast of the United States. Environmental Biology Fishes 38: 37–48. [ Links ]
Castro, J. I. 1996. The Sharks on the North American Waters. Texas A. & M. Univ. Press, College Station. 180 p. [ Links ]
Che–Tsung, C., L. Tzyh–Chang & J. Shooü–Jeng. 1988. Notes on reproduction in the scalloped hammerhead, Sphyrna lewini, in northeastern Taiwan waters. Fishery Bulletin 86 (2): 389–393. [ Links ]
Clark, E. & K. von Schmidt. 1965. Sharks of central gulf coast of Florida. Bulletin of Marine Science 15: 13–83. [ Links ]
Clarke, T. A. 1971. The ecology of the scalloped hammerhead shark, Sphyrna lewini, in Hawaii. Pacific Science 25 (2): 133–144. [ Links ]
Compagno, L. J. V., F. Krüpp & W. Schneider. 1995. Tiburones. In: W. Fischer, F. Krupp, W. Schnider, C. Sommer, K. E. Carpenter & V. H. Niem (Eds.). Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro–oriental, Vol. II: pp. 648–743. [ Links ]
Contreras, F. 1985. Las lagunas costeras mexicanas. Centro de Ecodesarrollo. Secretaria de Pesca. México. 253 p. [ Links ]
Galván–Magaña, F., H. J. Nienhüis & A. P. Klimley. 1989. Seasonal abundance and feeding habits of sharks of the lower Gulf of California, Mexico. California Fish and Game 75 (2): 74–84. [ Links ]
Hernández–Carvallo, A. 1967. Observations on the hammerhead sharks (Sphyrna) in waters near Mazatlan, Sinaloa, Mexico. In: P.W. Gilbert, R. F. Mathewson & D. P. Rall (Eds.) Sharks, skates and rays. John Hopkins Press, Baltimore. pp. 79–84. [ Links ]
Hosmer, D. W. & S. Lemeshow. 1989. Applied logistic regression. John Wiley and Sons, New York, NY, 328 p. [ Links ]
Klimley, A. P. 1981. Grouping behavior in the scalloped hammerhead. Oceanus 24 (4): 65–71. [ Links ]
Klimley, A. P. 1987. The determinants of sexual segregation in the scalloped hammerhead shark, Sphyrna lewini. Environmental Biology Fishes 18 (1): 27–40. [ Links ]
Klimley, A. P. & D. R. Nelson. 1981. Schooling of the scalloped hammerhead shark, Sphyrna lewini, in the Gulf of California. Fishery Bulletin 79 (2): 356–360. [ Links ]
Klimley, A. P. & S. B. Butler. 1988. Immigration and emigration of pelagic fish assemblage to seamount in the Gulf of California related to water mass movements using satellite imagery. Marine Ecology Progress Series 49: 11–22. [ Links ]
Pegau, W. S., E. Boss, & A. Martinez. 2002. Ocean color observations of eddies during the summer in the Gulf of California, Geophysical Research Letters 29, 10.1029/2001GL014076. [ Links ]
Pratt, H. L., Jr. 1979. Reproduction in the blue shark, Prionace glauca. Fishery Bulletin 77: 445–469. [ Links ]
Ricker, W. E. 1979. Growth rates and models. In: Hoar, W. S.; D. J. Randall & J. R. Brett (Eds.), Fish Physiology. Vol. 8. Bioenergetics and growth. Academic Press, Inc. Orlando, Florida, USA: pp. 677–743. [ Links ]
Righetty, B. R. & F. J. Castro M. 1990. Estudio de algunos aspectos biológicos pesqueros del tiburón, en la región de Mazatlán, Sinaloa. Memoria para obtener el título de Biólogo Pesquero. Escuela de Ciencias del Mar. U.A.S. Mazatlán 77 p. [ Links ]
Saucedo–Barron, J. C., G. Colado U., J. G. Martinez A., S. Burgos Z., J. G. Chacon C. & J. Espinosa F. 1982. Contribución al estudio de la pesquería del tiburón en la zona del estado de Sinaloa. Memoria de Servicio Social. UAS. Mazatlán 60 p. [ Links ]
Saucedo–Barron, J. C. 1983. El tiburón: Contribución al estudio de la pesquería de la zona sur de Sinaloa, México. Ciencias del Mar 2: 14–29. [ Links ]
Springer, S. 1967. Social Organization of Sharks Populations. In: P.W. Gilbert, R. F. Matheson & D. P. Rall (Eds.) Sharks, Skates, and Rays, John Hopkins Press. Baltimore. pp. 149–174. [ Links ]
Springer, S. 1960. Natural history of the sandbar shark Eulamia milberti. US Fish and Wildlife. Service Fishery Bulletin 61: 1–38. [ Links ]














