Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Hidrobiológica
Print version ISSN 0188-8897
Hidrobiológica vol.17 suppl.1 Ciudad de México Jul. 2007
Fitotoxicidad del herbicida Roundup® Max sobre la especie no blanco Lemna gibba en estudios de campo y laboratorio
Phytotoxicity of the Roundup® Max herbicide on the non-target species Lemna gibba in field and laboratory studies
Cecilia Sobrero1, María Laura Martin1 y Alicia Ronco1
1 CIMA, Departamento de Química, Facultad de Ciencias Exactas, Universidad Nacional de La Plata, La Plata, Argentina. Tel/Fax (++54)(+221)4229329. csobrero@quimica.unlp.edu.ar
Recibido: 16 de octubre de 2005
Aceptado: 17 de julio de 2006
Resumen
La Argentina ha incrementado ampliamente la superficie de cultivos transgénicos resistentes al glifosato, siendo el Roundup®Max uno de los formulados comerciales de mayor uso. Considerando el impacto que las prácticas agrícolas ocasionan sobre ambientes acuáticos vecinos a agroecosistemas, es importante estudiar la sensibilidad de especies no blanco a los productos utilizados en las mismas. Se evaluó la respuesta de la macrófita Lemna gibba L. al Roundup®Max en ensayos estandarizados de laboratorio y a campo. La fitotoxicidad del formulado en el laboratorio se evaluó sobre la tasa de multiplicación (TM) y el contenido de clorofila (CTC). La TM se inhibió a partir de 1 mg/L de principio activo (p.a.) y el CTC a 7.5 mg p.a./L, observándose además reducción en el crecimiento foliar y radical. Los efectos variaron a lo largo del ensayo: a bajas concentraciones la toxicidad inicial es mayor, disminuyendo a lo largo de la exposición, mientras que a concentraciones mayores la toxicidad se incrementa con el tiempo de ensayo. En dos estudios a campo en limnocorrales localizados en un arroyo adyacente a un cultivo, se observó que la aplicación de Roundup®Max (1 kg/ha) en el cultivo, inhibió significativamente la producción de biomasa seca (35.5 %) y el CTC (75.5 %), en una primer aplicación, y solamente el CTC (53.9 %), en la segunda aplicación. El impacto por deriva, no mostró efectos en el escenario estudiado. Los niveles de glifosato esperados y medidos en el arroyo donde se emplazaron los limnocorrales, produjeron fitotoxicidad significativa en L. gibba en ensayos de laboratorio.
Palabras clave: Macrófita, fitotoxicidad, Roundup®Max, soja.
Abstract
The use of the herbicide formulate Roundup® in transgenic crops of the Pampa's plains of Argentina has extensively increased, though there is scarce information on its impact on non-target vascular plants from agro-ecosystem related surface waters. Within this frame, the sensitivity of the macrophyte Lemna gibba L. to Roundup® Max was studied in standardized laboratory conditions and field experiments. In the laboratory, phytotoxic effects were assessed on the growth rate (GR) and total chlorophyll content (TCC). The GR was affected at 1 mg/L and TCC at 7.5 mg/L as active ingredient. Effects varied along testing time: toxicity was higher at low concentrations at the beginning, but diminishing during exposure, while at higher concentrations toxicity increments during testing. Also, a reduction of frond and root growth was detected. Field experiments with caged plants placed close to field crops showed an inhibition of 35.5 % in biomass production (dry weight) and 75.5 % in TCC when a dose of 1 kg/ha was applied. Although, in a second dose, only an inhibition effect on TCC of 53.9 % was detected. The assessment of the herbicide drift did not show an influence of this exposure route on the plants for the studied scenery. The lowest glyphosate concentration producing an effect in the laboratory is in agreement with the detected levels of the herbicide in the water body associated with effects in field experiments.
Key words: Macrophytes, phytotoxicity, Roundup®Max, soybean.
Introducción
Dentro de los países de América Latina, Argentina tiene desde la última década el liderazgo en la implementación de cultivos genéticamente modificados (Pengue, 2000; Mentaberry, 2001). Más del 95 % de las hectáreas sembradas con soja corresponden a la variedad transgénica resistente al glifosato (soja RR), cultivada mediante la técnica de siembra directa. Esta práctica agrícola implica el uso exclusivo del glifosato como herbicida y de diferentes insecticidas como la cipermetrina, el clorpirifos y el endosulfan para el control de diferentes plagas. Dependiendo del estado del cultivo, los productos formulados de glifosato o de insecticidas, se aplican solos o como diferentes mezclas (Pengue, 2000; Jergentz et al., 2004). Teniendo en cuenta que la superficie sembrada con soja resistente al glifosato ha superado los 12 millones de hectáreas y que consecuentemente se produjo un aumento significativo del consumo de este herbicida (Satorre, 2005; Trigo, 2005), se ha planteado la necesidad de realizar estudios que permitan conocer el impacto que generan los plaguicidas utilizados en estas prácticas agrícolas sobre los ecosistemas, en particular el herbicida glifosato.
Existen diversos antecedentes bibliográficos sobre el impacto de herbicidas sobre especies vegetales acuáticas no blanco representativas de distintos ambientes (Lockhart et al.,1989; Peterson et al.,1994; Boutin et al., 1995; Ralph, 2000; Michel et al., 2004) y en el contexto de cultivos genéticamente modificados que usan glifosato (Blackburn & Boutin, 2003; Tsui & Chu, 2003), aunque sólo recientemente se han iniciado estudios sobre los efectos en la flora de la región pampásica (Martín et al., 2003). Según los resultados obtenidos por diferentes autores que evaluaron la toxicidad en lemnáceas en particular, el glifosato es de baja fitotoxicidad en comparación a otros herbicidas con otro modo de acción (Lockhart et al., 1989; Peterson et al., 1994; Paradiso Giles, 2000; Michel et al., 2004). No obstante, debido a la gran difusión en el uso de este herbicida, y su consecuente incorporación en agroecosistemas, es relevante evaluar la sensibilidad de una especie representativa de la flora acuática regional .
Lemna gibba L., junto con otras especies de lemnáceas, han sido recomendadas como organismo de referencia en protocolos estandarizados para la evaluación de la fitotoxicidad de plaguicidas y otros contaminantes (Boutin et al., 1993; USEPA, 1996; Environment Canada, 1999; OECD, 2000). Dada la amplia distribución y representación de esta especie en los cuerpos de agua de las regiones templadas y subtropicáles de la Argentina (Landolt, 1996), se ha puesto particular interés en el estudio de la sensibilidad de un clon local de L. gibba a plaguicidas y otros contaminantes (Sobrero et al., 2004) como organismo de referencia para futuras aplicaciones en evaluaciones de riesgo ambiental locales o regionales.
El objetivo del presente estudio es evaluar el impacto del herbicida glifosato (formulado Roundup®Max) en la especie no blanco L. gibba por exposición en un ambiente natural y en condiciones estandarizadas de laboratorio, a distintos tiempos de exposición. Para ello se implementaron bioensayos de campo con poblaciones de L. gibba expuestas al herbicida en limnocorrales ubicados en un cuerpo de agua de la región pampásica (Buenos Aires, Argentina), y se realizaron además bioensayos de laboratorio considerando niveles de exposición al herbicida equivalentes a los esperados en el ambiente. La fitotoxicidad del herbicida se evaluó sobre la tasa de multiplicación y el contenido total de clorofila, además de la inhibición sobre el crecimiento de la raíz y el desarrollo de las frondes. A fin de evaluar la peligrosidad del uso del glifosato sobre las especies no blanco, se compararon los niveles de concentración que producen efecto significativo en L. gibba, en condiciones experimentales de campo y laboratorio, con valores teóricos de estimación de la concentración en solución esperada en el ambiente (CEA), debida a deriva o escurrimiento superficial (Peterson et al.,1994; Boutin et al., 1995).
Materiales y métodos
Bioensayos de toxicidad en laboratorio: se utilizó como especie diagnóstico un clon local de Lemna gibba aislado a partir de plantas colectadas en el arroyo del Pescado, Buenos Aires, Argentina (Sobrero et al., 2004). El ensayo de toxicidad se realizó en condiciones controladas de laboratorio (24 ± 2 °C; fotoperíodo de 16 h de luz; 80 µM/·m2·seg de irradiancia medida con el equipo Data Logger LI Cor LI-1000), en 300 ml de solución nutritiva, sin renovación (250 µM NH4NO3, 220 µM CaCl2, 406 µM MgSO4, 30 µM K2HPO4, 500 µM NaHCO3, 1.8 µM EDTA-FeCl3, 17.8 µM H3BO3, 1.8 µM MnCl2, 0.08 µM CoCl2, 0.16 µM ZnSO4, 0.08 µM CuSO4, 1.4 µM Na2MoO4, pH 6.5). Todos los reactivos utilizados para la preparación de la solución nutritiva son de calidad analítica (J.T. Baker, México). A fin de mantener condiciones exponenciales de crecimiento durante los 10 días de exposición, se realizó el sobreagregado de nutrientes cada 3 ó 4 días de ensayo (1 ml de solución 5X). Los cultivos de L. gibba se mantuvieron en las condiciones experimentales de crecimiento al menos durante un mes, previo a la realización de la experiencia. El control de calidad del ensayo incluyó el mantenimiento del crecimiento exponencial en los controles negativos. La vía de exposición al herbicida fue en solución, ensayándose siete concentraciones del formulado Roundup®Max (0.5; 1; 7.5; 15; 25; 60 y 80 mg/L de principio activo), además de los controles negativos. La selección final del intervalo de concentraciones se realizó a partir de ensayos preliminares, considerando bajos niveles de glifosato esperables de encontrar en ambientes acuáticos cercanos a cultivos que reciben la aplicación del producto, además de concentraciones mayores representativas de situaciones de lavado de maquinarias o vuelco accidental del herbicida en el cuerpo de agua. El diseño experimental incluyó al menos 4 repeticiones por tratamiento. Las diluciones del tóxico se prepararon en la solución nutritiva, llevando a 6.5 el pH de las soluciones al inicio del ensayo. La variación del pH se registró (Metrhom 691) durante el período de exposición (Tsui & Chu, 2003). Los resultados se expresan como la concentración nominal del principio activo glifosato en el formulado Roundup®Max al inicio del ensayo. El 74.4 % del Roundup®Max corresponde al principio activo glifosato, siendo el resto de los componentes sustancias coadyuvantes que facilitan la eficiencia en la aplicación del producto. Entre ellos, el surfactante POEA (polioxietilen amina), está presente en el Roundup, pudiendo constituir hasta el 15 % del formulado (Blackburn & Boutin, 2003; Cox, 2003; Tsui & Chu, 2003). Se verificó la concentración de glifosato (mg p.a./L) a los 10 días de exposición en los tratamientos correspondientes a 1 y 25 mg p.a./L. El pre tratamiento de las muestras y la cuantificación del herbicida se realizó de acuerdo a Peruzzo et al. (2003). La concentración de glifosato se determinó por HPLC (Beckman, System Gold modelo 126, detector 166 UV, columna Supelco RP 18), previa derivatización con FMOC-Cl (cloruro de 9-fluoroenilmetil cloroformo) y buffer borato. Las condiciones de corrida cromatográficas fueron: buffer fosfato 0.05 M (pH = 5.5): acetonitrilo (65:35) como fase móvil, con flujo de 0.8 ml/min y detección a 206 nm.
Los efectos fitotóxicos en L. gibba por exposición al Roundup®Max se evaluaron sobre las curvas de crecimiento poblacional, la tasa de multiplicación (TM) y el contenido total de clorofila (CTC) (Sobrero et al., 2004).
Bioensayos de toxicidad a campo: el área seleccionada para los estudios a campo pertenece a la zona núcleo del cultivo de soja en Argentina. El curso de agua corresponde a un afluente de primer orden perteneciente al sistema Pergamino-Arrecifes (Camilión et al., 2003). Se seleccionó un sector aledaño a parcelas con cultivos, y cuya naciente se encuentra en zona cultivable. El género Lemna está ampliamente representado en la región y en particular la especie L. gibba seleccionada en el presente estudio. En el ensayo a campo las frondes de L. gibba fueron expuestas en el cuerpo de agua, conteniéndolas (200 frondes iniciales) dentro de limnocorrales (Fig. 1). El diseño experimental incluyó 4 repeticiones por tratamiento, ubicando los limnocorrales hacia ambos márgenes del arroyo. Los parámetros medidos en los organismos expuestos en limnocorrales, fueron el contenido total de clorofila (CTC) y la producción de biomasa seca (BS) antes (un día) y después de las aplicaciones de plaguicidas (5 y 2 días luego de la primera y segunda aplicación, respectivamente). Los porcentajes de efecto se expresan en relación con los parámetros medidos antes de la aplicación. El pH del arroyo se midió con un medidor multiparámetro de campo (TOA WQC-20A).

Sobre la base de los resultados obtenidos luego de la primera aplicación, se realizó un diseño experimental complementario para discriminar los efectos producidos por las diferentes vías de exposición (en solución y por contacto superficial por deriva). Para ello en la segunda aplicación, un grupo de limnocorrales se cubrieron con una película plástica transparente evitando el contacto superficial de los plaguicidas.
Los ensayos a campo se realizaron durante dos eventos de aplicación de la mezcla del herbicida e insecticidas, realizadas por el productor, al inicio de la fructificación del cultivo de soja. El formulado comercial de glifosato utilizado en el cultivo también fue Roundup®Max. La dosis aplicada fue de 1 kg/ha Roundup®Max + 800 ml/ha clorpirifos (Shooter) (Primer aplicación) y 1 kg/ha Roundup®Max + 800 ml/ha clorpirifos (Lorsban) + 100 ml/ha de cipermetrina (Sherpa) (Segunda aplicación). Ambas aplicaciones se realizaron vía terrestre.
Medición de los puntos finales de evaluación de la fitotoxicidad y análisis estadístico de los resultados: la producción de biomasa seca por fronde se determinó por gravimetría hasta peso constante (80 ºC). La tasa de multiplicación se calcula como: TM = 1000 · (log Ft-log Fo)/t, donde Fo es el n° de frondes al día 0 y Ft es el n° de frondes al tiempo t de exposición en días (Environment Canada, 1999). El CTC se estimó a partir del extracto de biomasa vegetal fresca (0.05 g biomasa, 4 ml solvente) con N, N-dimetilformamida, mediante medición espectrofotométrica (Shimadzu UV-1203) a 647 y 664 nm (Moran,1989).
Los resultados se analizaron estadísticamente mediante análisis de regresión (comparación de curvas de crecimiento) y ANOVA, realizándose transformaciones logarítmicas de los datos no normales y en la linealización de las curvas de crecimiento exponencial. La comparación de las pendientes de las regresiones y de las medias de los diferentes tratamientos, se realizó mediante el método de Tukey (Zar, 1996). La Concentración Inhibitoria (CI) se estimó mediante un método no paramétrico de interpolación lineal (Environment Canada, 1999).
Estimación teórica de la concentración esperada en el ambiente: La estimación teórica de la concentración del herbicida en solución esperada en el ambiente (CEA), debida a deriva o escurrimiento superficial, se calculó como el concentración resultante de aplicar la dosis de producto recomendada, en un área de 1 m2 con 15 cm de profundidad, (Boutin et al., 1993; 1995). Considerando las dosis máxima (3.2 kg/ha) y mínima (0.8 kg/ha) de aplicación del Roundup®Max recomendadas para diferentes usos en Argentina, la CEA es de 1.59 y 0.40 mg p.a./L, respectivamente. Para las aplicaciones realizadas sobre el cultivo (1 kg/ ha de Roundup®Max), la CEA es de 0.5 mg p.a./L.
Resultados
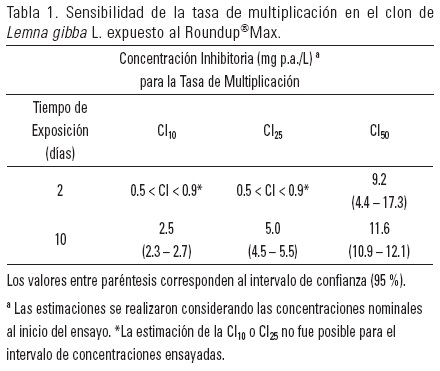
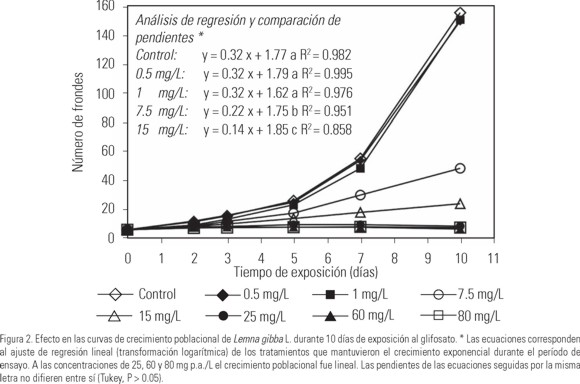
Los resultados obtenidos en los bioensayos de toxicidad en laboratorio se muestran en la Tabla 1 y en las Figuras 2, 3 y 4. De manera general, se observa fitotoxicidad a todas las concentraciones de glifosato ensayadas a partir de la exposición a 1 mg p.a./L, durante los 10 días de ensayo. A 0.5 mg p.a./L no se verifican efectos significativos en ninguno de los parámetros evaluados. La Figura 2 muestra el efecto en el crecimiento poblacional de L. gibba como resultado de la exposición a diferentes concentraciones de glifosato. La producción de nuevas frondes en el control, a lo largo del período de ensayo, sigue un modelo de crecimiento exponencial, observándose alteraciones estadísticamente significativas (P ≤ 0.05) en las curvas de crecimiento por efecto del glifosato a partir de 7.5 mg p.a./L. La reducción en la tasa de multiplicación a lo largo del período de ensayo determina curvas de crecimiento lineales a partir de 15 mg p.a./L, disminuyendo la pendiente con el aumento de la toxicidad. A 60 y 80 mg p.a./L el crecimiento poblacional está completamente inhibido, manteniéndose constante el número de frondes iniciales.
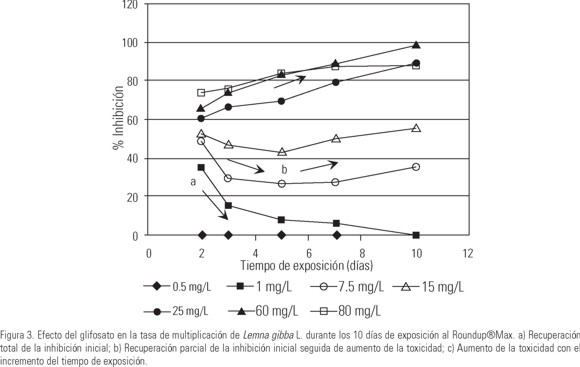
En la Figura 3 se observa la variación de la tasa de multiplicación (TM) con relación al tiempo de exposición de los organismos. El patrón de toxicidad en este parámetro es dependiente de la concentración y del tiempo de exposición, observándose tres comportamientos diferentes en las curvas de inhibición. A 1 mg p.a./L (en el orden de la CEA) la inhibición inicial registrada a los 2 días de exposición, disminuye con el tiempo, recuperándose los valores normales a los 10 días de ensayo. A 7.5 y 15 mg p.a./L se registran valores elevados de inhibición al inicio de la exposición (2 días), observándose luego, hasta los 5 días de ensayo, una leve disminución de la toxicidad, aunque la respuesta se invierte a mayor tiempo de exposición. En las plantas expuestas a 25 mg p.a./L, y a concentraciones mayores, la toxicidad aumenta con el incremento del tiempo de exposición.
En la Tabla 1 se indican las concentraciones inhibitorias para diferentes porcentajes de efecto (CI10, CI25 y CI50) en la TM, comparando la sensibilidad de L. gibba luego de 2 y 10 días de exposición. La sensibilidad de L. gibba al glifosato es menor a mayor tiempo de exposición, siendo las diferencias más marcadas al considerar menor porcentaje de efecto. Estas diferencias en los valores de CI a lo largo de la exposición se corresponden con las variaciones descritas para las curvas de inhibición de la tasa de multiplicación (Figura 3). Como se puede observar en la Tabla 1, los valores de CI10 y CI25 a los dos días de exposición, son del orden de las concentraciones estimadas para la CEA, si bien luego de 10 días existe una marcada disminución de la toxicidad.
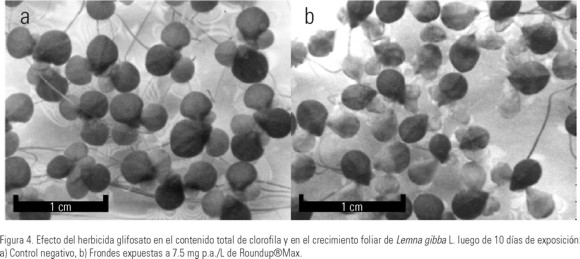
En la Figura 4 se puede ver el efecto producido por la exposición al glifosato en la reducción del contenido total de clorofila. Si bien la clorosis es leve en las frondes bien desarrolladas, los efectos son mayores en las yemas hijas. Se evidencia inhibición significativa en el CTC desde los dos días de exposición en las plantas expuestas a 7.5 mg p.a./L. Dado que los efectos en el CTC son marcadamente mayores en las frondes hijas y yemas respecto de las frondes adultas desarrolladas en los primeros días de exposición, sumado a la reducción en número y tamaño de las frondes nuevas, la cuantificación de los efectos en el CTC se ve subestimada, principalmente a mayores niveles de inhibición de la TM y del crecimiento foliar. Por ejemplo, si bien la CI50 para el CTC, estimada para siete días de exposición al Roundup®Max, es de 42 mg p.a./L, se puede observar que la exposición a 7.5 mg p.a./L produce yemas totalmente cloróticas a los siete días de exposición, extendiéndose estos efectos a las frondes más desarrolladas transcurridos los días de ensayo. En la Figura 4 se observan además los efectos del glifosato en la reducción en el crecimiento foliar, siendo mayor la inhibición en el eje transversal de las frondes respecto del longitudinal, determinando así el desarrollo de frondes más pequeñas y angostas. Otros efectos fitotóxicos observados fueron la reducción en la elongación de las raíces (registrados a partir de 1 mg p.a./L) y la elongación diferencial del estipe que conecta las yemas y las frondes hijas a las progenitoras a partir de la exposición a 7.5 mg p.a./L (Fig. 4). Si bien a 1 mg p.a./L la inhibición en la TM se recupera, los efectos registrados en el crecimiento foliar, crecimiento de las raíces y en el número de frondes por colonia, siguen siendo significativos a los 10 días de exposición (Sobrero, manuscrito en preparación).
Los resultados obtenidos en los ensayos en limnocorrales a campo se indican en la Tabla 2. Para ambas dosis aplicadas y luego de dos o cinco días de la exposición, se verifica fitotoxicidad, observándose reducción significativa en el contenido total de clorofila. Sólo se registró inhibición significativa en la biomasa seca luego de cinco días de exposición a los plaguicidas (primera aplicación).
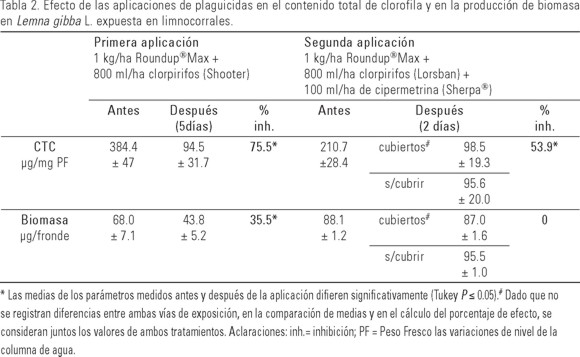
Para las condiciones de aplicación en las que se realizó el ensayo, no se observaron diferencias en la toxicidad en las plantas expuestas solamente al glifosato en solución (limnocorrales cubiertos) respecto de las que lo pudieron recibir por deriva (limnocorrales sin cubrir).
Simultáneamente con la evaluación de la fitotoxicidad de las aplicaciones de plaguicidas mediante los ensayos con L. gibba, Peruzzo et al. (2003) realizaron el análisis de residuos de herbicidas e insecticidas en el ambiente. Estos autores informaron concentraciones de glifosato en el agua del arroyo, luego de la aplicación, por debajo de 0.5 mg/L, valor correspondiente al limite de detección para la metodología utilizada. La evaluación de la concentración de glifosato durante la exposición de L. gibba en condiciones de laboratorio, indica un intervalo de decaimiento entre el 15 % (para 1 mg p.a./L) y el 35 % (para 15 mg p.a./L) luego de 10 días de exposición. Esta disminución en la concentración de principio activo, estaría explicando la recuperación de los efectos en la TM luego de 10 días de exposición a 1 mg p.a./L.
El pH registrado en el agua del arroyo durante los eventos de aplicación de los plaguicidas fue de 8.1 ± 0.2 (Media ± DS). Durante el período de exposición en laboratorio, los valores de pH registrados variaron entre 6.5 al inicio del ensayo, alcanzando el valor máximo de 7.8 a los 10 días de exposición (Media ± DS: 7.7 ± 0.13).
Discusión
La sensibilidad del clon de Lemna gibba permitió detectar efectos fitotóxicos del Roundup®Max debido a exposiciones por su uso en el campo, así como por la exposición en bioensayos de laboratorio a concentraciones del orden de la CEA. La comparación de los resultados obtenidos con los registrados en la bibliografía para otras especies de lemnáceas, indica una alta sensibilidad del clon local de L. gibba al glifosato. Por ejemplo, luego de 7 días de exposición al herbicida Lockhart et al (1989) no detectaron inhibición en las curvas de crecimiento de L. minor a 16.9 mg p.a./L, ni Peterson et al. (1994) en el número de frondes a 2 mg p.a./L. Michel et al. (2004) informan, para L. paucicostata, un valor de Concentración Efectiva para el 50 % de efecto (CE50) para la tasa de crecimiento (midiendo área foliar) de 66 mg p.a./L, luego de siete días de exposición. Para el caso de L. gibba, un estudio de la sensibilidad de 20 clones geográficamente diferentes mostró valores para la CE50 entre 16 y 58 mg p.a./L, evaluando efectos sobre el número de frondes a los 15 días de exposición (Paradiso Giles, 2000). No obstante, en comparación con la respuesta observada en especies algales (Peterson et al., 1994; Tsui & Chu, 2003) o incluso en plántulas de Lactuca sativa (Martin & Ronco, 2006), la sensibilidad de L. gibba es menor.
En el presente estudio, la exposición al Roundup®Max, como consecuencia de aplicaciones en el campo, produjo fitotoxicidad en poblaciones de L. gibba de un cuerpo de agua superficial muy cercano al cultivo. Cabe destacar la respuesta inmediata de esta especie frente a la exposición a la mezcla de plaguicidas, registrándose inhibición significativa en el CTC incluso a los dos días después de realizada la aplicación sobre el cultivo. Sin embargo, es de esperar que no se detecten variaciones significativas en la producción de biomasa (peso seco) luego de dos días de exposición, debido al breve tiempo transcurrido y a las condiciones naturales de crecimiento en el arroyo, a las que se le asocia una baja tasa de multiplicación y, consecuentemente, poca variación en la producción de biomasa.
A bajos niveles de exposición, el CTC resulta ser un buen punto final de estudio y de mayor versatilidad para su uso en campo, indicando a corto plazo signos de estrés en los organismos. No obstante, la cuantificación de los efectos en la producción de biomasa, si bien implica mayor tiempo de exposición para evidenciarse la respuesta, aporta información relevante sobre el impacto de las aplicaciones en la productividad de los ambientes asociados a los cultivos. A pesar de que la respuesta en laboratorio de la tasa de multiplicación es significativa, su seguimiento a campo con la frecuencia necesaria no siempre es factible. De allí que se hace necesario diseñar ensayos de validación que permitan verificar a campo los efectos en el crecimiento poblacional observados en el laboratorio. No obstante, el contenido total de clorofila (CTC), puede ser recomendado como punto final para la evaluación de la fitotoxicidad en este tipo de experimentos ya que además de su rápida respuesta, no involucra un seguimiento exhaustivo a lo largo del tiempo.
Teniendo en cuenta los elevados niveles de inhibición registrados en el CTC para la exposición de L. gibba en las aplicaciones a campo, en comparación con la sensibilidad en el laboratorio, y a pesar de los bajos niveles de glifosato detectados por Peruzzo et al. (2003), los individuos de Lemna debieron haber estado expuestos a concentraciones mayores, incluso respecto de las estimadas según cálculos teóricos (CEA). Estas apreciaciones son válidas para ambos eventos de aplicación, aún a dos días después de ser expuestas al herbicida.
Si bien los insecticidas clorpirifos y cipermetrina fueron diseñados para afectar rutas metabólicas que no se encuentran en las plantas, la presencia de coadyuvantes en los formulados comerciales de estos insecticidas, podría conferirle fitotoxicidad o generar efectos sinérgicos al incorporarlos a mezclas con otros compuestos. Para el caso de L. gibba, la exposición a las mezclas de plaguicidas en los ensayos a campo, también podría estar contribuyendo a la mayor toxicidad observada con relación a las concentraciones de glifosato detectadas en el ambiente y con la sensibilidad registrada en los ensayos en laboratorio.
Otro aspecto a considerar es que la toxicidad del surfactante POEA (polioxietilen amina) presente en el formulado de glifosato, es mayor a pH alcalino (Blackburn & Boutin, 2003; Krogh et al., 2003; Tsui & Chu, 2003). El POEA está como forma catiónica a pH ácido o neutro, y no iónica a pH alcalino. De esta manera, la forma no iónica de este surfactante podría generar una mayor toxicidad a los organismos, principalmente por disrupción no específica a nivel de membrana (Krogh et al., 2003; Tsui & Chu, 2003). Para el caso de las aplicaciones a campo, dada la alcalinidad de las aguas del arroyo, el aumento en la toxicidad de los surfactantes también podría estar contribuyendo a la mayor inhibición registrada como consecuencia de la exposición en el ambiente natural. Del mismo modo, el aumento del pH en las condiciones experimentales contribuiría a la variación en la respuesta tóxica observada con el aumento del tiempo de exposición a 7.5 y 15 mg p.a./L (Fig. 3). En este caso, el aumento de la inhibición, luego de una leve recuperación a los 5 días, podría deberse a la mayor toxicidad asociada a los surfactantes al alcalinizarse el medio durante la exposición (pH 8.1).
No se observaron diferencias en los experimentos a campo en los limnocorrales con y sin cobertura plástica, ello para las condiciones particulares de aplicación, que indiquen mayor impacto de la vía de exposición por contacto directo por la deriva, respecto de la exposición a los tóxicos en solución en la columna de agua. La ausencia de toxicidad asociada a la exposición por deriva podría deberse al efecto protector generado por la flora riparia en el sitio de ubicación de los limnocorrales (Dabrowsky et al., 2005). No obstante es necesario incluir en trabajos futuros, una caracterización más acabada de las vías de exposición y niveles de impactos diferenciados, no sólo en el campo, sino también en condiciones controladas de laboratorio (Lockhart et al., 1989; Dabrowsky et al., 2005). Por otra parte, dada la diversidad de productos fitosanitarios utilizados en los diferentes cultivos, tanto plaguicidas como coadyuvantes, es importante evaluar los efectos ecotóxicos de diferentes mezclas, teniendo en cuenta la interacción de los productos y la generación de sinergismos o antagonismos.
De los resultados obtenidos, se concluye que el uso del herbicida glifosato, de acuerdo a las dosis de aplicación recomendadas para el cultivo de soja transgénica, produce fitotoxicidad en la flora no blanco de cuerpos de agua asociados a estos ambientes productivos. El clon local de Lemna gibba utilizado en este trabajo, resulta ser un organismo de referencia de gran utilidad para la evaluación del impacto del uso de este herbicida. Esta especie es muy sensible a niveles de glifosato factibles de encontrarse en ambientes acuáticos de agroecosistemas de la región pampásica.
Referencias
BLACKBURN, I. & C. BOUTIN. 2003. Subtle effects of herbicide use in the context of genetically modified crops: A case study with gliphosate (Roundup®). Ecotoxicology 12: 271-285. [ Links ]
BOUTIN, C., K. FREEMARK & C. KEDDY. 1993. Proposed Guidelines for Registration of Chemical Pesticides: Nontarget Plant Testing and Evaluation. Technical Report Series 145. Canadian Wildlife Service (Headquarters), Enviroment Canada, Ottawa, 91p. [ Links ]
BOUTIN, C., K. FREEMARK & C. KEDDY. 1995. Overview and rationale for developing regulatory guidelines for nontarget plant testing with chemical pesticides. Environmental Toxicology and Chemistry 14: 1465-1475. [ Links ]
CAMILION, C., M.J. MANASSERO & A. RONCO. 2003. Erosión hídrica asociadas a prácticas agrícolas en la región pampásica, Argentina. Memorias Conferencia Internacional Usos del Agua, Agua 2003, Cartagena de Indias, Colombia, 1-5. [ Links ]
COX, C. 2003. Herbicide factsheet glyphosate (Roundup). Journal of Pesticide Reform 18: 3-17, (1998, updated 4/03). [ Links ]
DABROWSKI, J.M., A. BOLLEN, E.R. BENNETT & R. SCHULZ. 2005. Pesticide interception by emergent aquatic macrophytes: Potential to mitigate spray-drift input in agricultural streams. Agriculture Ecosystems & Environment 111: 340-348. [ Links ]
ENVIRONMENT CANADA. 1999. Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte Lemna minor. EPS 1/RM/37, Environmental Canada, Environmental Protection Service, Ottawa, 98 p. [ Links ]
JERGENTZ, S., H. MUGNI, C. BONETTO & R. SCHULZ. 2004. Runoff-related Endosulfan contamination and aquatic macroinvertebrates response in rural basins near Buenos Aires, Argentina. Archives of Environmental Contamination and Toxicology 46: 345-352. [ Links ]
KROGH, K.A., B. HALLING-SORENSEN, B.B. MOGENSEN & K.V. VEJRUP. 2003. Environmental properties and effect of nonionic surfactants adjuvants in pesticides: a review. Chemosphere 50: 871-901. [ Links ]
LANDOLT, E. 1996. Lemnaceae. Flora Fanerogámica Argentina 21: 1-8. [ Links ]
LOCKHART, W.L., B.N. BILLECK & C.L. BARON. 1989. Bioassays with a floating aquatic plant (Lemna minor) for effects of sprayed and dissolved glyphosate. Hydrobiologia 188/189: 353-359. [ Links ]
MARTIN, M.L., M.C. SOBRERO, C. RIVAS, F. RIMOLDI & A.E. RONCO. 2003. Impacto del uso de plaguicidas asociado a la siembra directa sobre especies no-blanco: Flora riparia y acuática. Memorias Conferencia Internacional Usos del Agua, Agua 2003, Cartagena de Indias, Colombia: 27-31. [ Links ]
MARTIN, M.L. & A.E. RONCO. 2006. Effects of mixtures of pesticides used in the direct seedling technique on non-target plant seeds. Bulletin of Environmental Contamination and Toxicology. 77 (2): 228-236. [ Links ]
MENTABERRY, A. 2001. La revolución genética y la agricultura. Ciencia Hoy 11 (62): 22-34. [ Links ]
MICHEL, A., R. JOHNSON, S. DUKE & B. SCHEFFLER. 2004. Dose-Response relationships between herbicides with different modes of action and growth of Lemna paucicostata: an improved ecotoxicological method. Enviromental Toxicology and Chemistry 23 (4): 1074-1079. [ Links ]
MORAN, R. 1989. Formulae for determination of clorophyllous pigments extracted with N,N-Dimethylformamide. Plant Physiology 69: 1376-1381. [ Links ]
ORGANIZATION FOR ECONOMIC COOPERATION AND DEVELOPMENT (OECD). 2000. Guidelines for the Testing of Chemicals. Guideline 221 Lemna sp. Growth Inhibition Test. OECD publication service, Paris,14 p. [ Links ]
PARADISO GILES, M. 2000. Variabilidad interclonal en Lemna gibba L. frente a dos herbicidas con distinto modo de acción. Tesis de Maestría en Biología (Ecología), Facultad de Ciencias, Universidad de la República, Montevideo, Uruguay, 73 p. [ Links ]
PENGUE, W.A. 2000. Cultivos transgénicos ¿Hacia dónde vamos?. Lugar Editorial, Buenos Aires, 190 p. [ Links ]
PERUZZO, P., D. MARINO, C. CREMONTE, M. DA SILVA, A.A. PORTA & A.E. RONCO. 2003. Impacto de plaguicidas en aguas superficiales y sedimentos asociado a cultivos por siembra directa. Memorias Conferencia Internacional Usos del Agua, Agua 2003, Cartagena de Indias, Colombia, 35-42. [ Links ]
PETERSON, H., C. BOUTIN, P. MARTIN, K. FREEMARK, N. RUECKER & M. MOODY. 1994. Aquatic phyto-toxicity of 23 pesticides applied at expected enviromental concentrations. Aquatic Toxicology 28: 275-292. [ Links ]
RALPH, P.J. 2000. Herbicide toxicity of Halophila ovalis assessed by chlorophyll a fluorescence. Aquatic Botany 66: 141-152. [ Links ]
SATORRE, E.H. 2005. Cambios tecnológicos en la agricultura argentina actual. Ciencia Hoy 15 (87): 24-31. [ Links ]
SOBRERO, M.C., J. BELTRANO & A.E. RONCO. 2004. Comparative response of Lemnaceae clones to Cu(II), Cr(VI) and Cd(II) toxicity. Bulletin of Environmental Contamination and Toxicology 73 (2): 416-423. [ Links ]
TRIGO, E. 2005. Consecuencias económicas de la transformación agrícola. Ciencia Hoy 15 (87): 46-51. [ Links ]
TSUI, M.T.K. & L. M. CHU. 2003. Aquatic toxicity of glyphosate-based formulations: comparison between different organisms and the effects of environmental factors. Chemosphere 52 (7): 1189-1197. [ Links ]
UNITED STATED ENVIRONMENTAL PROTECTION AGENCY (USEPA) .1996 Ecological Effects Test Guidelines OPPTS 850.4400 Aquatic Plant Toxicity Test using Lemna sp. EPA 712-C-96-156, Washington DC, 8 p. [ Links ]
ZAR, J.H. 1996. Bioestatistical analisys. Prentice Hall, New Jersey, 718 p. [ Links ]














