Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Hidrobiológica
Print version ISSN 0188-8897
Hidrobiológica vol.14 n.2 Ciudad de México 2004
Artículo
Balance energético de juveniles de Chirostoma estor estor (Jordan, 1879) (Pisces, Atherinopsidae) en relación con el tamaño corporal
Energetic balance in Chirostoma estor estor (Jordan, 1879) (Pisces, Atherinopsidae) juveniles in relation to size
María Eugenia Vega1, *Fernando Díaz2 y Sonia Espina3
1 Laboratorio de Taxonomía y Ecología de Peces. Centro de Investigación y Estudios Avanzados (CINVESTAV), Instituto Politécnico Nacional. Km. 6 Antig. Carr. a Progreso. A. P. 73 Cordemex. C. P. 97310 Mérida, Yucatán, México.
2 Departamento de Biotecnología Marina. Centro de Investigación Científica y Educación Superior de Ensenada (CICESE). Kilómetro 107 Carretera Tijuana-Ensenada. Ensenada, Baja California, México. Fax (646) 175-05-34. C. P. 04510. E-mail: fdiaz@cicese.mx
3 Laboratorio de Ecofisiología, Departamento de Ecología y Recursos Naturales. Facultad de Ciencias, Universidad Nacional Autónoma de México (UNAM). 04510 México, D.F., México.
Recibido: 22 de noviembre de 2003
Aceptado: 2 de julio de 2004
Resumen
En este trabajo se determinó el flujo energético de juveniles de Chirostoma estor estor (Jordan, 1979) de dos diferentes clases de peso (P < 0.05). En la Clase A se agruparon los peces de 1.50 ± 0.22 g y en la Clase B los de 3.30 ± 0.29 g. Los peces mantenidos a 20 °C, se alimentaron al 4% del peso corporal, con una dieta balanceada comercial (28% de proteína). Se midieron las respuestas fisiológicas y se integraron en la ecuación del balance energético con el fin de estimar la energía potencial de crecimiento o campo de crecimiento que se canalizaría a crecimiento somático. Independientemente del peso, dicho valor fue 80% de la energía incorporada con el alimento ingerido; las pérdidas de energía a través de heces y excreción nitrogenada alcanzaron el 6.88 y 3.65 % de la energía extraída del alimento ingerido, respectivamente. La energía utilizada en metabolismo aerobio correspondió al 9.42%. Los modelos que describen la tasa de consumo de oxígeno (R) de los peces fueron A: R = 0.246 Peso0.91 y B: R = 0.501 Peso0.91 (P < 0.05; R2 = 0.884). Esto significa que la tasa de consumo de oxígeno no varío en el intervalo de peso considerado, sin embargo la intensidad de la tasa aumentó en un 50% en los organismos de mayor tamaño. Estos datos son importantes para instrumentar y mejorar las prácticas de cultivo de la especie.
Palabras clave: Balance energético, Juveniles, Chirostoma estor estor.
Abstract
In this work we determined the energetic flow in juveniles of Chirostoma estor estor (Jordan, 1879) of two classes of weight (P < 0.05). We had two groups A and B, both were selected by weight 1.50 ± 0.22 g and 3.30 ± 0.29 g. respectively. The fish were maintained at 20 °C, were feed to the 4% of wet weight, with a commercial balanced diet (28% of protein). The physiological responses were measured and integrated in o the equation of energetic balance in order to estimate the potential energy for growth or scope for growth that would be channeled to somatic growth. Independently to the weight, the scope for growth was 80% of energy incorporated with the ingested food; the losses of energy through feces and nitrogen excretion reached 6.88 and 3.65 % of extracted energy from the ingested food, respectively. Energy used in aerobic metabolism corresponded to the 9.42%. The models that describe the oxygen consumption rate (R) of the fish were A: R = 0.246 W0.91 and B: R = 0.501 W0.91 (P < 0.05; R2 = 0.884). This indicates that the oxygen consumption rate do not vary in relation to the weight interval, however the intensity of the rate increase in a 50% in the organisms of larger size. The data provided is important to improve the culture practices of the species.
Key Words: Energetic balance, Juvenile, Chirostoma estor estor.
Introducción
Entre los peces nativos del Lago de Pátzcuaro, Michoacán, el pescado blanco Chirostoma estor estor (Jordan, 1879) es considerada una especie de gran valor comercial (Alaye, 1993; Jiménez-Badillo & Gracia, 1995; Martínez-Palacios et al., 2002a). Esta especie durante los últimos años ha estado sujeta a una explotación exhaustiva, que en conjunto con los cambios experimentados en el lago, así como a la introducción de especies exóticas y a la pesca poco selectiva, que afecta a todos los estadios del ciclo de vida, han influido en la disminución de sus volúmenes de captura comercial y en consecuencia la producción ha disminuido significativamente desde su máximo histórico de 122.6 toneladas capturadas en 1982 hasta las 13.0 toneladas que se registraron en 1996 (Henderson, 1974; Chacón-Torres & Rosas-Monge, 1995; Anónimo 2000; Hernández-Montaño, 2002). Esta disminución en las capturas se ha observado desde hace tiempo y ha motivado investigaciones con diferentes enfoques; así, el trabajo de Solórzano (1963) se centra en la pesca comercial en el lago de Pátzcuaro, el de Rosas (1970) se refiere a la especie Chirostoma estor y Lara (1974) menciona ciertos aspectos del cultivo. Armijo y Saso (1976) hacen experimentos en acuarios sobre incubación y alevinaje del pescado blanco. Posteriormente, Rosas-Monge & Chacón-Torres (1995) desarrollaron el cultivo de C. estor mediante la recolecta, fertilización e incubación de sus huevos y la liberación de los alevines, obteniendo un éxito en la eclosión y sobrevivencia de juveniles del 80 y 90%, respectivamente. Dentro de las líneas prioritarias de investigación de especies nativas, su precisión taxonómica a través de estudios de genética (Alaye, 1996); Uribe Alcocer & Díaz Jaimes (2003) realizaron el análisis cariotípico de tres especies representativas del género Chirostoma; Barriga Sosa (2003) estudio la variabilidad morfológica y genética en el género Chirostoma, así como los estudios referidos a la biología reproductiva y alimentación larvaria en condiciones experimentales y recientemente los ecofisiológicos enfocados al crecimiento y a las eficiencias de crecimiento, incluyéndose la determinación de la temperatura y salinidad óptimas y la evaluación de las enzimas proteoliticas en el intestino de los especimenes que son relativamente recientes (Espina et al., 1980; Vega et al., 1981; Martínez-Palacios et al., 2002b; Chacón-Torres et al ., 2003; Martínez-Palacios et al., 2003) y también lo son los centrados en aspectos bioenergéticos (Vega, 1982; Espina et al., 1988).
Los aspectos bioenergéticos de los estudios ecofisiológicos se refieren a la determinación e interpretación del flujo de energía a través del animal o del sistema al que pertenece. El conocimiento del balance energético permite comprender e interpretar los fenómenos relacionados tanto con la distribución de los organismos como su adecuación al medio y de manera pragmática, dicho conocimiento es fundamental para el cultivo de una especie en particular (Beamish et al., 1975).
La investigación sobre el balance energético en peces se inició con los trabajos de Ivlev (1939) y Winberg (1956). Los autores proponen un modelo que ha sido ampliamente aceptado por la comunidad científica (Klekowski & Duncan, 1975); en dicho modelo se integran las tasas fisiológicas de los peces expresadas en unidades de energía:
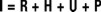
Las cuales se refieren a las tasa de incorporación de la energía con el alimento ingerido (I), la energía utilizada en respiración (R), la perdida a través de la excreción (U) y evacuación de heces (H); P es la producción. Esta tasa indica la energía potencial de crecimiento o campo de crecimiento. El valor de P se obtiene por diferencia entre I y los diferentes destinos de la energía en el organismo. Este conocimiento es útil para determinar la interacción de las variables fisiológicas con las variables ambientales, entre ellas la temperatura y nutrimentales como la cantidad de alimento y composición de la dieta, con miras al crecimiento y conversión del alimento óptimos de la especie objeto de estudio. Asimismo, como lo señalan Bayne et al. (1976) la energía potencial de crecimiento del organismo en condiciones determinadas permite describir, explicar y predecir su condición fisiológica.
En México la producción acuícola por medio del cultivo está básicamente centrada en los organismos de agua dulce, entre los que se incluyen cinco especies de carpa, cuatro de tilapia, una de bagre y una de trucha; también se realizan cultivos de lobina, pescado blanco y mojarra nativa. Por lo tanto este trabajo se llevó a cabo con el propósito de obtener una mayor información que fuera útil para mejorar las prácticas de cultivo del pescado blanco de Pátzcuaro. Se investigó el efecto del peso corporal sobre las tasas fisiológicas requeridas por el modelo del balance energético con el fin de calcular el campo de crecimiento y determinar la eficiencia con la cual los especimenes de C. estor estor utilizan la energía contenida en el alimento manufacturado comercial.
Materiales y métodos
Los experimentos se llevaron a cabo en juveniles (N = 50), con un intervalo de peso húmedo de 0.70 - 4.4 g proporcionados por el Centro Regional de Investigación Pesquera de Pátzcuaro, Michoacán (CRIP-Pátzcuaro) durante 1980 y 1982. Estos ejemplares fueron producto de un desove artificial efectuado en dicho Centro, a partir de un lote de reproductores identificados de acuerdo a los criterios de Barbour (1973). El mantenimiento en el lago se realizó en corrales de 4 m2 limitados por una malla de mosquitero y una profundidad de 2.2 m. Los peces se capturaron en estas jaulas flotantes con cubetas de plástico debido a que los juveniles de esta especie tienden a estresarse con el manejo (Martínez-Palacios et al., 2002a). Asimismo, para evitar el estrés metabólico de los juveniles, el traslado al laboratorio se efectuó en un cilindro que contenía doble bolsa de plástico; en la bolsa interna se colocaron los peces con agua del medio, se insufló aire comprimido y se cerró herméticamente y en la externa se puso hielo. En el laboratorio los juveniles se mantuvieron durante 20 días en acuarios de 60 L con filtro químico. La temperatura del agua se mantuvo a 20 °C, pH 7.5 y el oxígeno disuelto de 5.8 - 6.0 mg O2 L−1. Los peces se alimentaron diariamente con una dieta balanceada Purina proporcionada al 4% del peso húmedo corporal en dos raciones diarias durante dos horas. Esta dieta comercial tuvo un contenido de proteína de 27.8%, de grasas 6.6%, de carbohidratos 55.0%, de cenizas 7.4% y fibra cruda 3.2%, en base seca. El fotoperíodo se fijó en 12 h luz-12 h obscuridad.
Debido a que la distribución del peso de los peces recolectados de seis meses de edad fue bimodal, se separaron en dos clases de peso: A. 1.5 ± 0.22 g (n=23) y B. 3.3 ± 0.29 g (n=27). Para cada clase se determinaron las diferentes tasas fisiológicas.
La tasa de ingestión (I) se midió por el método gravimétrico por diferencia entre el peso del alimento proporcionado y el remanente después de un periodo de alimentación de 2 h (Espina et al., 1986). El alimento se retiró mediante sifón filtrándolo por una malla de 70 micras; en este proceso se filtraron aproximadamente dos tercios del volumen de agua de los acuarios y se reemplazaron por agua de las mismas características. Después de 24 h se retiraron las heces (H) mediante el mismo procedimiento, el periodo experimental fue de 21 días. Las heces y el alimento remanente se deshidrataron a 60 °C hasta peso constante para conocer el peso seco (PS, g). El valor calórico (medido en una bomba calorimétrica Parr) para el alimento fue 5.048 y el de las heces 3.85 Kcal g−1.
La tasa respiratoria (R) se midió en un respirómetro cerrado (Espina et al., 1986). La conversión del oxígeno consumido en su equivalente calórico se hizo empleando el valor oxicalórico de 3.36 Kcal mg−1 O2 (Beamish et al., 1975).
La tasa de excreción nitrogenada (U) se estimó en 15% de la proteína usada por los peces de acuerdo a lo mencionado por Jobling (1994). La proteína utilizada se calculó por diferencia entre el contenido de proteína del alimento ingerido y la depositada, la cual representa el 16% de la proteína ingerida (Niimi & Beamish, 1974). El valor nitrocalórico empleado fue 5.7 cal mg−1.
El campo de crecimiento (P) se calculó empleando el modelo mencionado anteriormente: P = I − (R + H + U). Las tasas representadas en la ecuación energética se expresaron en las mismas unidades de energía Joules día−1 animal−1 de acuerdo al equivalente propuesto por Lucas (1996) de 1 cal = 4.186 Joules.
Se utilizó la prueba no paramétrica de Mann-Whitney con el fin de conocer si las diferencias observadas eran significativas (Zar, 1999)
Resultados
Durante la captura y el traslado de los organismos al laboratorio no se observó mortalidad. Asimismo durante las fases de mantenimiento y experimental de 41 días, la supervivencia de los juveniles del pescado blanco fue del 100%.
Con respecto al tamaño de los organismos se establecieron dos clases de peso: A 1.5 ± 0.22 g (n=23) y la clase B 3.3 ± 0.28 g (n=27). Las diferencias entre los valores promedio de ambas clases de peso fue significativa (P < 0.05).
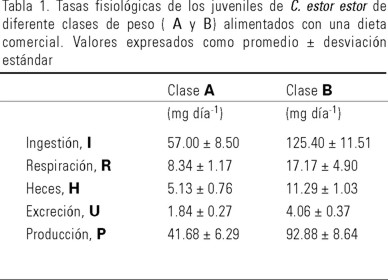
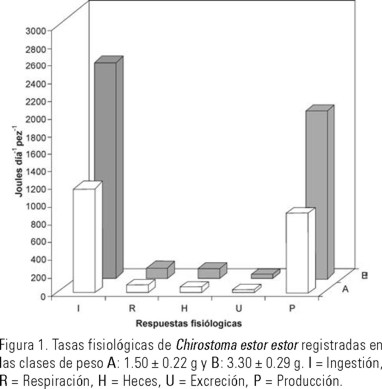
El peso influyó significativamente (P < 0.05) la tasa de ingestión (Tabla 1). Se observó que los peces de la clase (A 1.5 g) ingirieron 45.5% menos alimento que los de (B 3.3 g). El valor calórico del alimento ingerido para A fue 1,205.36 y para B de 2,650.60 Joules día−1 animal−1 (Fig. 1).
El metabolismo aerobio se determinó indirectamente a través de la tasa de consumo de oxígeno de rutina. Se calculó la regresión logarítmica entre el consumo de oxígeno (R, mg O2 h-1) y el peso corporal de todos los peces (W, g). El modelo fue altamente significativo: R = 0.17 W 0.91, R2 = 0.884 y (P < 0.05). Al separar las clases de peso, las ecuaciones fueron las siguientes:

Esto significa que la tasa de cambio es la misma independientemente del intervalo de peso considerado, en cambio la intensidad de la tasa respiratoria aumenta en 50% en los animales de mayor peso. Estos modelos también fueron adecuados (P < 0.05).
Los juveniles de C. estor estor produjeron el 9% de su peso corporal en heces, la pérdida calórica por esta vía fue 82.92 Joules día−1 animal−1 para los de la clase A y 182.17 Joules día−1 animal−1 para los de B (Fig. 1). Consecuentemente el 6.9% del contenido de energía del alimento ingerido se perdió en heces (Fig. 2).

El valor de la tasa de excreción nitrogenada de los peces clase B fue el doble de los A, aproximadamente (Fig. 1); sin embargo, en ambas clases de peso correspondió al 3.65% de la energía contenida en el alimento ingerido (Fig. 2).
En la figura 2 se presenta esquemáticamente el balance energético de C. estor estor. La energía potencial de crecimiento fue 45 % mayor en la clase de peso B, no obstante los valores relativos a la energía del alimento ingerido fueron similares, independientemente del peso corporal.
Con respecto a los índices de utilización de la energía captada o eficiencia de crecimiento bruta (K1) y neta (K2), los valores también fueron similares en ambas clases de peso, 80 y 86% respectivamente y la eficiencia de asimilación de 89% siguió la misma tendencia.
Discusión
Se conoce que los procedimientos comunes en acuicultura son estresantes para los organismos en cautiverio (Adams, 1990; Jobling, 1994; Espina & Vanegas, 1996; Wedemeyer, 1997, Martínez-Palacios et al., 2002a).-
Wedemeyer (1997) se refiere al desafío fisiológico que representan las alteraciones de las características físicas y químicas del agua, las interacciones de los peces, la manipulación requerida por ciertos procedimientos del cultivo y de transporte; los peces sobreviven a toda esta gama de estresores, pero con gasto de energía. Es necesario tener en cuenta que el efecto patológico del estrés crónico es la disminución de la resistencia de los peces a las enfermedades infecciosas, lo cual es preocupante para la acuicultura. Al respecto, la alta sobrevivencia observada en el blanco de Pátzcuaro se puede atribuir a los procedimientos de la captura descritos por Vega (1982) con el fin de evitar la manipulación de los peces. Este procedimiento es aconsejable ya que la hipotermia reduce el consumo de oxígeno y la excreción de productos tóxicos (Wedemeyer, 1997), el autor también menciona que en tales condiciones se aminoran los efectos de las respuestas de estrés con reducción de la hiperglucemia, entre otros.
La tasa de ingestión del pez cambia por la acción de factores tanto bióticos como abióticos (Jobling, 1994). En este trabajo se mantuvo constante la temperatura y la ración del alimento ofrecida, en ambas clases de peso consideradas. Cabe señalar que la temperatura estable de 20 °C se seleccionó acorde a la prevaleciente en el lugar de captura, aunque se sabe que los regímenes fluctuantes de temperatura favorecen el crecimiento de diferentes especies como Oreochromis mossambicus (Peters,1852), Catostomus tahoensis (Gill & Jordan, 1878), Oncorhynchus mykiss (Walbaun, 1792), Ictalurus punctatus (Rafinesque, 1818) (Sánchez et al., 1984; Vondracek et al.,1989; Hokanson et al., 1997; Sierra et al., 1999), respectivamente. El valor de la tasa de ingestión se incrementó al aumentar el peso de los especimenes, aunque en ambos grupos alcanzó el 3.8% del peso corporal. En la misma especie, pero de mayor tamaño, la tasa de ingestión correspondió a 2.2-2.5% del peso corporal (Espina et al., 1988). Estos resultados concuerdan con los valores de 1.16 a 3.45% obtenidos por Pierce & Wissing (1974) en Lepomis macrochirus (Rafinesque, 1819).
Con respecto a la pérdida de energía a través de las heces producidas, Elliot (1976) menciona que en general en los peces no excede del 10% y Jobling (1994) argumenta que dicha pérdida depende de varios factores entre los que se incluyen el tamaño del pez, la condición fisiológica, la calidad del alimento y la temperatura del agua. Cui & Liu, (1990) observaron pérdidas entre 7.4 y 11% en carpas Cyprinus carpio (Linnaeus, 1758), Carassius auratus (Linnaeus, 1758) y en la tilapia Oreochromis mossambicus. Sierra et al. (1999) refieren que Ictalurus punctatus mantenidos a 23°C pierde vía heces el 9.4%. Los datos obtenidos en este trabajo para el pescado blanco no son diferentes, ya que perdieron el 7% independientemente del tamaño (1.5 a 3.3 g); en peces de mayor tamaño de C. estor se encontraron pérdidas del 6% (Espina et al., 1988).
Los valores de la excreción amoniacal de C. estor estor de 3.65% de la energía absorbida, también concuerdan con los medidos en otras especies de peces; así, en carpas y tilapias fueron de 3.6 a 5.9% (Cui y Liu, 1990), en I. punctatus de 3.0% (Sierra et al., 1999) y en C. estor de 3.6 a 3.7% dependiendo del tamaño (Espina et al., 1988).
Klekowski & Duncan (1975), mencionan que la respiración es una medida de la porción de energía del alimento asimilado que es utilizada en el mantenimiento del organismo así como en crecimiento somático o producción. En el pescado blanco las tasas metabólicas promedio (mg O2 día−1 animal−1) fueron siete veces más altas en los agrupados en la clase B que en los de la clase A (Fig. 1). Sin embargo, con respecto a la energía ingerida no se observaron diferencias. Los resultados también concuerdan con los obtenidos por Fisher (1970, 1972) para Ctenopharyngodon idella (Valenciennes, 1844) y Lepomis macrochirus (Pierce & Wissing, 1974). En contraste, los valores fueron 18% y 38% menores que los obtenidos en el bagre de canal I. punctatus (Sierra et al., 1999) y en C. estor de tamaño mayor (Espina et al., 1988).
Por otra parte Winberg (1956) proporcionó un modelo para la tasa metabólica de los peces en general: Q = 0.307 W 0.81. En el pescado blanco, el valor del exponente del peso fue diferente (0.91) y la intensidad metabólica fue 1.8 veces menor. Estos resultados se atribuyen a que probablemente la actividad de C. estor estor es menor que la de los peces incluidos en el estudio del autor.
La energía potencial de crecimiento de los juveniles de C. estor estor fue del 80%, similar a lo referido por Winberg (1956) para la generalidad de los peces. Los valores fueron 10% superiores a los obtenidos por Tandler & Beamish, (1979) en Micropterus salmoides ( Lacepède, 1802) alimentados con dietas proporcionadas al 4% del peso corporal como en este trabajo, a C. estor de mayores tallas (Espina et al., 1988) y 30% superiores a I. punctatus (Sierra et al., 1999).
La alta eficiencia de asimilación de ambas clases de peso del 80 a 90% obtenidas para el pescado blanco, corresponden a los valores observados en peces alimentados con dietas manufacturadas balanceadas (Beamish et al., 1975). Por otra parte, los valores de las eficiencias de crecimiento bruta (K1) y neta y (K2) se consideran índices cuantitativos del balance energético asociados a los cambios experimentados por el organismo en función de la energía incorporada con el alimento ingerido o asimilado. Estas eficiencias fueron altas en el pescado blanco lo que se podría interpretar, de acuerdo con Hasting (1976), que son reflejo del adecuado balance nutritivo de la dieta, su aceptabilidad, digestibilidad y las óptimas condiciones térmicas en las que se encontraban los peces, cuya demanda metabólica se canalizó principalmente a crecimiento.
Cabe destacar que en general las eficiencias energéticas de los juveniles de C. estor estor fueron independientes del peso en los intervalos considerados en este trabajo.
La información obtenida sobre el balance energético de los peces tiene aplicación en la interpretación y manejo de la producción biológica, ya que es importante para el control de la productividad de un sistema de cultivo, conocer la transferencia de energía entre los distintos niveles tróficos. Asimismo, la información referente a los factores ambientales y a la calidad de la dieta, que se transformaría eficientemente en masa corporal, hace posible la obtención de una alta eficiencia de crecimiento de los especimenes juveniles en corto tiempo. Asimismo para el traslado de los peces es importante conocer la intensidad del metabolismo respiratorio a una temperatura determinada debido a que si ésta se incrementa en 10 °C el consumo de oxígeno del pez se eleva en un 50%. Por tales razones se considera que la información obtenida en este trabajo sería útil para mejorar las prácticas de cultivo de la especie.
Agradecimientos
A José Maria Domínguez y Francisco Javier Ponce del Departamento de Dibujo del CICESE. Así como a los revisores anónimos por sus valiosas sugerencias.
Referencias
ADAMS, S.M. 1990. Status and use of biological indicators for evaluating the effect of stress on fish. American Fisheries Society Symposium 8: 1-8. [ Links ]
ALAYE, N.A. 1993. El pescado blanco (Genero Chirostoma) del Lago de Pátzcuaro, Michoacán. Composición de especies. Ciencia Pesquera 9:113-128. [ Links ]
ALAYE, N.A. 1996. Estudios del polimorfismo de la hemoglobina para identificar especies del genero Chirostoma del Lago de Pátzcuaro, Michoacán, México . Ciencia Pesquera 13:1-9. [ Links ]
ANONIMO. 2000. Pesquería de Aguas Continentales: Lago de Pátzcuaro, Michoacán. Instituto Nacional de la Pesca. 793-820. [ Links ]
ARMIJO, O.A & Y.L. SASSO. 1976. Observaciones preliminares sobre incubación y alevinaje de aterinidos (Chirostoma spp.) del Lago de Pátzcuaro. Michoacán. Fideicomiso para el Desarrollo de la Fauna Acuática (3). 13pp. [ Links ]
BARBOUR. C.D. 1973. The systematics and evolution of the genus Chirostoma Swainson (Pisces, Atherinidae). Tulane Studies in Zoology and Botany 18: 97-141. [ Links ]
BARRIGA SOSA, I.D.L.A. 2003. Estudios sobre la variabilidad morfológica y de genética molecular en el género Chirostoma realizados en la PexPa UAM-Iztapalapa, pp.107-123. In: P.M. Rojas Carrillo & D. Fuentes Castellanos (Eds.). Historia y Avances del Cultivo de Pescado Blanco. Instituto Nacional de la Pesca [ Links ]
BAYNE, B.L., J. WINDOWS, & R.J. THOMPSON. 1976. Physiological integrations. pp 261-291. In: B.L. Bayne (Eds.) Animal Physiology: Principles and Adaptations. MacMillan Company, New York. [ Links ]
BEAMISH, F.W.H., A.J. NIIMI, & P.F. LETT. 1975. Bioenergetics of teleost fishes: environmental influences, pp. 189-209. In: L. Bolis, H.P. Mandrell & K. Schmidt-Nielsen (Eds.) Comparative Physiology. Functional Aspects of Structural Materials. North Holland, Publ. Co. [ Links ],
CUI, Y. & Y. LIU. 1990. Comparison of energy budget among six teleosts - I. Food consumption, fecal production and nitrogenous excretion. Comparative Biochemistry and Physiology 96A: 163-171. [ Links ]
CHACÓN-TORRES, A & C. ROSAS-MONGE, 1995. A restoration plan for pez blanco in lake Pátzcuaro, México. American Fisheries Society Symposium. 15: 122-126. [ Links ]
CHACÓN-TORRES, A., C. ROSAS-MONGE. & V. SEGURA-GARCÍA. 2003. Biología reproductiva y alimentación larvaria del pez blanco en condiciones experimentales, pp.125-139. In: P.M. Rojas Carrillo & D. Fuentes Castellanos (Eds.). Historia y Avances del Cultivo de Pescado Blanco. Instituto Nacional de la Pesca. [ Links ]
ELLIOT, J.M. 1976. Energy losses in the waste products of brown trout (Salmo trutta L.). Journal of Animal Ecology 45: 561-560. [ Links ]
ESPINA, S., F. DÍAZ., J. LATOURNERIÉ,. A. SÁNCHEZ., C. ROSAS. & M.E. VEGA. 1980. Estudios preliminares para determinar la eficiencia de crecimiento del pescado blanco de Pátzcuaro, Chirostoma estor (Atherinidae). IV Congreso Nacional de Zoología. Ensenada, B.C., Res. 84. [ Links ]
ESPINA, S., F. DÍAZ., C. ROSAS. & I. ROSAS. 1986. Influencia del detergente sobre el balance energético de Ctenopharyngodon idella a través de un bioensayo crónico. Contaminación Ambiental 2: 25-37. [ Links ]
ESPINA, S., J. LATOURNERIÉ., A. SÁNCHEZ. & M.E. VEGA. 1988. Determinación de los elementos del balance energético en el pescado blanco adulto, Chirostoma estor J. (Pisces, Atherinidae). Anales del Instituto de Ciencias del Mar y Limnología. Universidad Nacional Autónoma de México 15: 185-194. [ Links ]
ESPINA, S & C. VANEGAS. 1996. Ecofisiología y contaminación, pp. 45-68. In: A.V. Botello, J.L. Rojas Galavíz, J.A. Benítez & D. Zárate Lomelí (Eds.) Golfo de México Contaminación e Impacto Ambiental: Diagnóstico y Tendencias. EPOMEX Serie Científica 5. Universidad Autónoma de Campeche, México. [ Links ]
FISHER, Z. 1970. The elements of energy balance in carp (Ctenopharyngodon idella Val.). Part I. Polish Archives of Hydrobiology 17: 421-434. [ Links ]
FISHER, Z. 1972. The elements of energy balance in carp (Ctenopharyngodon idella Val.). Part III. Assimilability of protein, carbohydrates and lipids by fish fed plant and animal food. Polish Archives of Hydrobiology 19: 83-95. [ Links ]
HASTING, H.W. 1976. Fish nutrition and fish feed manufacture. Conferencia Técnica de FAO sobre Agricultura. Kyoto, Japón. 1-13. [ Links ]
HENDERSON, F. 1974. Programa de evaluación de recursos para apoyar el desarrollo pesquero en aguas mexicanas. Programa de Investigación para el Fomento Pesquero. MEXICO/PNUD/FAO/CEPM:8 Contribuciones al Estudio de Pesquerías en México. 25 pp. [ Links ]
HERNÁNDEZ-MONTAÑO, D. 2002. Evaluación de las poblaciones de peces en el Lago de Pátzcuaro, Mich. Mem. I Foro Científico de Pesca Ribereña. INP. CRIP. Guaymas. 1-3. [ Links ]
HOKANSON, E.F.K., F.C. KLEINER & W. THORSLUND. 1997. Effects of constant temperatures and diel temperature fluctuations on specific growth and mortality rates and yield of juvenile rainbow trout, Salmo gairdneri. Journal of the Fisheries Research Board of Canada 34: 639-648. [ Links ]
IVLEV, V.S. 1939. Energy balance in the carp. Zoolog Zhurn 18: 303-318. [ Links ]
JOBLING, M. 1994. Fish Bioenergetics. Fish and Fisheries Series 13. Chapman and Hall, London. 309 p. [ Links ]
JIMÉNEZ-BADILLO, M.L & G.A. GRACIA. 1995. Evaluación de la pesquería multiespecífica de charales (Chirostoma spp., Pisces, Atherinidae) del Lago de Pátzcuaro, Michoacán, México. Anales del Instituto de Biología Universidad Nacional Autónoma de México Serie Zoología 66: 205-231. [ Links ]
KLEKOWSKI, K.R. & A. DUNCAN. 1975. Physiological approach to ecological energetics, pp. 15-36. In: W.R.Z. Grodzinski, K.R. Klekowski & A. Duncan (Eds.) Methods for Ecological Bioenergetics. Blackwell Science, Oxford. [ Links ]
LARA, V.A. 1974. Aspectos del cultivo extensivo e intensivo del pescado blanco de Pátzcuaro (Chirostoma estor Jordan 1879). Simposio FAO/Carpas: Acuicultura en América Latina, 1: 113-116. [ Links ]
LUCAS, A., 1966. Bioenergetics of aquatic animals. Taylor & Francis. London. 169 pp. [ Links ]
NIIMI, A.J. & F.W.H. BEAMISH. 1974. Bioenergetics and growth of large-mouth bass (Micropterus salmoides) in relation to body weight and temperature. Canadian Journal of Zoology 52: 447-456. [ Links ]
MARTÍNEZ-PALACIOS, C.A., M.G. RÍOS-DURAN., A. CAMPOS MENDOZA., M. TOLEDO CUEVAS & L.G. ROSS. 2002a. Avances en el cultivo del Pescado Blanco de Pátzcuaro Chirostoma estor estor. pp. 336-351. In L.E. Cruz, D. Ricque-Marie, M., Tapia-Salazar, M.G. Gaxiola-Cortes, N. Simoes (Eds.). Avances en Nutrición Acuícola VI. [ Links ]
MARTÍNEZ-PALACIOS, C.A., E.B. TOVAR., J.F. TAYLOR., G.R. DURAN. & L.G. ROSS. 2002b. Effect of temperature on growth and survival of Chirostoma estor estor, Jordan 1879, monitored using a simple video technique for remote measurement of length and mass of larval and juvenile fishes. Aquaculture, 209: 369-377. [ Links ]
MARTÍNEZ-PALACIOS, C.A., M.G. RÍOS DURAN., A. CAMPOS MENDOZA., E.M. TOLEDO CUEVAS., M.C. AGUILAR VALDEZ, & L.G. ROSS. 2003. Desarrollo tecnológico en el cultivo del pez blanco de Pátzcuaro, pp.169-189. In: P.M. Rojas Carrillo & D. Fuentes Castellanos (Eds.). Historia y Avances del Cultivo de Pescado Blanco. Instituto Nacional de la Pesca. [ Links ]
PIERCE, R.J. & T.E. WISSING. 1974. Energy costs of food utilization in bluegill (Lepomis macrochirus). Transaction of American Fisheries Society 103: 39-45. [ Links ]
ROSAS, M., 1970. Pescado blanco (Chirostoma estor estor) su fomento y cultivo en México. Secretaria de Industria y Comercio. Instituto Nacional de Investigaciones Biológico Pesqueras. 80 pp. [ Links ]
ROSAS-MONGE, C & A. CHACÓN-TORRES. 1995. Advances to increase restocking of native fishes in Lake Pátzcuaro, México. American Fisheries Society Symposium.15: 122-126. [ Links ]
SÁNCHEZ, A., C. ROSAS., J. LATOURNERIÉ. & S. ESPINA. 1984. Influencia de diferentes regímenes de temperatura sobre la asimilación, conversión alimenticia y eficiencia de crecimiento de la tilapia roja (Sarotherodon mossambicus). Revista Latinoamericana de Acuicultura. 22: 14-19. [ Links ]
SIERRA, E., F. DÍAZ & S. ESPINA. 1999. Energy budget of Ictalurus punctatus exposed to constant and fluctuating temperatures. Rivista Italiana di Aquacoltura 34: 71-78. [ Links ]
SOLÓRZANO, A.P. 1963. Algunos aspectos biológicos del pescado blanco del Lago de Pátzcuaro, Mich. Chirostoma estor. Dirección General de Pesca e Industrias Conexas. Sección de Industria y Comercio. Instituto Nacional de Investigación Biológico-Pesqueras. 1-15 [ Links ]
TANDLER, A. & F.W.H. BEAMISH. 1979. Mechanical and biochemical compound of apparent specific dynamic action in largemouth bass Micropterus salmoides Lacéped. Journal of Fish Biology 14: 343-350. [ Links ]
URIBE ALCOCER, M. & P. DÍAZ JAIMES. 2003. Análisis cariotípico de un pescado blanco y dos charales del género Chirostoma (Pisces:Atherinopsidae): evolución cariotípica en el Orden Atheriniformes, pp. 79-105. In: P.M. Rojas Carrillo & D. Fuentes Castellanos (Eds.). Historia y Avances del Cultivo de Pescado Blanco. Instituto Nacional de la Pesca. [ Links ]
VEGA, M.E., F. DÍAZ., J. LATOURNERIÉ., A. SÁNCHEZ. & S. ESPINA. 1981. Estudio comparado sobre la eficiencia de crecimiento en Chirostoma estor juveniles y adultos. V Congreso Nacional de Zoología. Cuernavaca, Morelos, México. Resúmenes. 61. [ Links ]
VEGA, M.E. 1982. Balance energético de Chirostoma estor, captación de alimento y eficiencia de la extracción de energía en juveniles y adultos. Tesis de Licenciatura. Facultad de Ciencias. Universidad Nacional Autónoma de México. 36 pp. [ Links ]
VONDRACEK, B., J.J. CECH JR & K.R. BUDDINGTON. 89. Growth efficiency and assimilation efficiency of the Tahoe sucker in cyclic and constant temperature. Environmental Biology of Fishes. 24: 151-156. [ Links ]
WARREN, C.E. & G.E. DAVIS. 1967. Laboratory studies on the feeding, bioenergetics and growth of fish, pp. 175-214. In: S.D. Gerking (Ed.) The Biological Basis of Freshwater Fish Production. Blackwell Sci. Publ., Oxford. [ Links ]
WEDEMEYER, G.A. 1996. Physiology of Fish in Intensive Culture Systems. Chapman and Hall, New Cork. 232 pp. [ Links ]
WEDEMEYER, G.A. 1997. Effect of the rearing conditions on the health and physiology quality of fish in intensive aquaculture, pp. 35-71. In: G.K. Iwama, A.D. Pickering. J.P. Sumpter, C.B. Schreck (Eds.) Fish Stress and Health in Aquaculture. Cambridge University Press. [ Links ]
WINBERG, G.G., 1956. The rate of metabolism and food requirements of fishes. Belorussian University. Minsk. In Russian, (Engl. Transl. Fisheries Research Board of Canada Translation Series, 194). [ Links ]
ZAR, H.J. 1999. Biostatistical Analysis. Prentice-Hall, Inc., Englewood Cliffs, New York. 690 pp. [ Links ]














