Introducción
La salinidad del suelo es un problema muy preocupante porque afecta negativamente al crecimiento y desarrollo de las plantas, especialmente en las regiones áridas y semiáridas, donde más del 6% de la superficie total del mundo está afectada por la sal (Santos et al., 2016). Los efectos de la salinidad en las plantas incluyen estrés osmótico, interrupción del transporte de iones a través de membrana, toxicidad directa de altas concentraciones citoplasmáticas de sodio y cloruro en los procesos celulares y estrés oxidativo inducido (Volkov & Beilby, 2017).
El tomate Solanum lycopersicum L. es considerado el segundo cultivo de hortalizas de mayor importancia en muchos países del mundo, y se consume en grandes cantidades debido a sus propiedades nutricionales y funcionales. Se cultiva en diversos sistemas de producción, sobre todo hidropónicos, donde la salinidad es una grave limitante en la producción. El tomate es un cultivo moderadamente tolerante a la sal, aunque se ha descubierto que el estrés salino modifica varios procesos fisiológicos que conducen a la reducción del crecimiento y el rendimiento (Yurtseven et al., 2005). Se ha observado que un incremento en la concentración de salinidad en suelo puede mejorar la calidad del fruto de tomate, por lo que esta condición ha sido empleada con el fin de producir frutos de mayor valor de mercado (Zushi et al., 2009). Por esa razón, resulta importante realizar estudios encaminados a determinar los mejores parámetros del cultivo de tomate en estrés salino como mejorador de los atributos nutracéuticos del fruto (Hao et al., 2000).
Los hongos micorrízicos arbusculares (HMA) son uno de los grupos de hongos del suelo más importantes y se colocan en el filo Glomeromycota, el cual se divide en cuatro órdenes, 11 familias, 25 géneros y más de 200 especies (Redecker et al., 2013). La variación en las poblaciones de estos hongos y su simbiosis con las raíces está relacionada tanto con las propiedades del suelo como con las plantas. En las últimas décadas, se ha obtenido una mayor conciencia de los efectos positivos de dicha simbiosis en el rendimiento de las plantas (Schubert et al., 2020). Además, las especies y los aislados de HMA difieren en su tolerancia a las condiciones físicas y químicas adversas del suelo (Aliasgharzad et al., 2017). Varios estudios han demostrado que la inoculación con HMA mejora el crecimiento y la productividad bajo estrés salino (Sannazzaro et al., 2006). Existen pruebas de que los HMA mejoran la capacidad de las plantas para hacer frente al estrés salino al mejorar la absorción de nutrientes, la actividad fotosintética, el equilibrio iónico y el uso eficiente del agua, así como estimular la actividad de las enzimas protectoras al estrés en plantas micorrizadas (De Melo et al., 2019; Sheng et al., 2008). Los HMA son biomejoradores importantes para suelos salinos, ya que la colonización micorrízica arbuscular mejora el crecimiento, nutrición y vigor de la planta y mitiga el daño en las plantas hospederas causado por la salinización del suelo (Evelin et al., 2012). Además, existe evidencia de que la interacción de las plantas de tomate con los HMA aumenta la calidad de los nutrientes al aumentar los contenidos de ácido cítrico, carotenoides y ciertos aminoácidos, así como la capacidad antioxidante de los frutos (Schubert et al., 2020).
Las plantas combaten el estrés osmótico empleando varios fenómenos coherentes que relacionan su anatomía y fisiología con los mecanismos celulares. El aminoácido prolina se ha abordado como un osmolito único de bajo peso molecular que responde a las tensiones relacionadas con la ósmosis en amplias variedades de plantas (Chun et al., 2018). La prolina puede eliminar especies reactivas de oxígeno y estabilizar el DNA, proteínas y membranas, reduciendo la desnaturalización enzimática inducida por NaCl. Además, proporciona carbono, nitrógeno y energía en la recuperación al estrés; por lo tanto, las plantas micorrizadas pueden acumular menos prolina a medida que experimentan un estrés reducido (Evelin et al., 2019).
El objetivo de este estudio fue determinar el efecto de la asociación del hongo micorrízico arbuscular R. irregularis con plantas de jitomate cv MicroTom en condiciones de estrés salino (0 mM, 100 mM y 200 mM de NaCl) y su relación con el contenido de carbohidratos, licopeno y prolina en frutos a dos niveles de madurez fisiológica.
Materiales y Métodos
Establecimiento del experimento
Semillas de tomate Solanum lycopersicum L. cv. MicroTom fueron lavadas en una solución acuosa de Tritón X-100 (SIGMA) al 5% (v/v) durante cinco minutos y se enjuagaron tres veces en agua destilada estéril. Después, se sumergieron en etanol al 70% durante 1 min, se enjuagaron tres veces con agua destilada estéril por 3 min y se transfirieron a una solución de hipoclorito de sodio al 1% durante 15 min. Finalmente, las semillas fueron enjuagadas tres veces con agua destilada y se germinaron en sustrato estéril de peat moss:vermiculita 1:1 (p/p). El experimento se estableció en un diseño completamente al azar con arreglo factorial 3X2, considerando dos condiciones de estrés por salinidad (100 mM y 200 mM de NaCl) además de un control (0 mM de NaCl) y presencia de micorriza (Control sin -HMA y +HMA con 900 esporas del inóculo por planta). Una unidad experimental consistió en una planta en recipientes de 500 ml, y se emplearon 10 repeticiones por tratamiento. Para los tratamientos con sal se realizaron aplicaciones de 50 ml de una solución de NaCl a 100 mM y 200 mM al inicio de la floración y se suspendió hasta el llenado del fruto (Figura 1a y 1b). Se utilizaron 50 ml de solución nutritiva de Hoagland y Arnon al 50% para fertilizar una vez por semana. Las plantas permanecieron en un cuarto de cultivo en condiciones controladas a 25 °C±2 °C y un fotoperiodo de 16 h luz y 8 h oscuridad. Para evaluar el porcentaje de colonización micorrízica se utilizó la metodología de Phillips & Hayman (1970), que consistió en lavar cada una de las muestras de raíces con abundante agua y realizar cortes de raicillas de 1 cm a 2 cm de longitud, las cuales se depositaron en tubos de vidrio. Posteriormente, se adicionó una solución de KOH al 10% (p/v), y los tubos se mantuvieron a 96 oC por 30 min. Además, se lavaron las raicillas, se agregó una solución de HCl al 10% (v/v) hasta cubrir las raíces, se mantuvieron las muestras a 96 oC por 10 min y se decantó la solución de HCl. Para teñir las estructuras intrarradicales se adicionó una solución de azul de tripano al 0.05% en lactoglicerol (ácido láctico: glicerol: agua 1:2:1 v/v/v), dejando reposar por 24 h, luego se decantó el colorante y se montaron dos grupos de cinco segmentos de raíces en portaobjetos para su visualización a 40X. Para determinar la colonización, se observó la presencia de hifas, arbúsculos o vesículas dentro del segmento de raíz. El porcentaje de colonización micorrízica se calculó como: % Colonización = número de campos colonizados/número de campos observados * 100.

Fuente: Elaboración propia.
Figura 1 Etapas fenológicas de jitomate cv MicroTom. a) Etapa de floración e inicio de adición de solución salina; b) Llenado de frutos; c) Estado de maduración de frutos empleados en el estudio: N = naranja (30%-60% de la superficie color naranja o roja) y R = rojo maduro (90% de color rojo) indicado con flechas.
Preparación de extractos
Para la obtención de los extractos, se tomó el pericarpio de los frutos en dos etapas de madurez: intermedia (color naranja) y maduros (color rojo) (Figura 1c), los cuales fueron macerados en etanol al 80% en proporción 1:10 (p/v) durante 48 h a 4 °C. Posteriormente, las muestras se centrifugaron a 10 000 rpm por 10 min, se colectó el sobrenadante y se almacenó a -70 °C hasta su uso.
Extracción y determinación de prolina
La cuantificación de prolina en los frutos fue determinada de acuerdo con la metodología descrita por Gibon et al. (2000). Una alícuota de 0.4 ml de soluciones seriadas de L-prolina (1 μg/mL-100 μg/mL) o el extracto de fruto fueron mezcladas con 0.8 ml de solución de ninhidrina al 1% (diluida en ácido acético: etanol 60:20 v/v). Después de homogeneizar la mezcla, se incubó en baño de agua a 99 °C durante 20 min. Se dejó alcanzar temperatura ambiente, y los microtubos fueron centrifugados a 2500 rpm durante 1 min. La medición se realizó a 520 nm con un equipo Thermo Scientific Multiskan GO y los resultados se expresaron en microgramos de prolina por gramo de peso fresco.
Contenido de fenoles totales
La cuantificación de fenoles totales se realizó de acuerdo con la metodología descrita por Añibarro-Ortega et al. (2020), con modificaciones. En un microtubo se colocaron 50 μL de muestra con 125 μL del reactivo Folin-Ciocalteu al 1 N y se agregaron 400 μL de Na2CO3 al 7% (p/v) y 425 μL de agua bidestilada. La mezcla se incubó a 45 °C por 15 min y se midió la absorbancia a 760 nm con un equipo Thermo Scientific Multiskan GO. Se realizó una curva de calibración de ácido gálico (10 μg/mL-200 μg/mL diluido en metanol). Los resultados se expresaron en miligramos equivalentes de ácido gálico (EAG) por gramo de peso fresco.
Flavonoides totales
El contenido total de flavonoides se determinó de acuerdo con la metodología propuesta por Chang et al. (2002), con modificaciones. En un tubo se colocaron 100 μL de cada extracto o soluciones de quercetina (10 μg/mL-100 μg/mL, diluidas en metanol), después se agregó 300 μL de metanol, 20 μL de cloruro de aluminio al 10%, 20 μL de acetato de potasio 1 M y 560 μL de agua bidestilada. La mezcla se agitó vigorosamente y permaneció 30 min a temperatura ambiente. La absorbancia se midió a 415 nm con un equipo Thermo Scientific Multiskan GO.
Determinación de azúcares totales
La determinación de azúcares totales se determinó por la metodología descrita por Masuko et al. (2005), con modificaciones. La curva de calibración se preparó con soluciones de sacarosa (50 μg/mL-500 μg/mL). En tubos de cristal se agregó 1 ml de muestras de sacarosa o extractos acuosos del fruto, rápidamente se agregó 1.25 ml de ácido sulfúrico al 98% y 0.25 ml de fenol al 5%. Las muestras se mezclaron vigorosamente y fueron incubadas a 90 °C durante 5 min. Las muestras se incubaron en baño de agua fría durante 5 min, y la absorbancia se registró a 490 nm con un equipo Thermo Scientific Multiskan GO. Los resultados se expresaron en miligramos de carbohidratos totales por gramo de tejido fresco.
Cuantificación de Licopeno
La cuantificación de pigmentos se realizó de acuerdo con el protocolo de Nagata & Yamashita (1992). Para extraer los pigmentos se utilizó acetona al 90% en relación 1:10 (p/v). Posteriormente, las muestras se sonicaron durante 10 min y permanecieron 24 h a 4 °C protegidas de la luz. Los extractos fueron centrifugados a 14 000 rpm por 15 min, el sobrenadante fue recuperado, y la absorbancia se midió a 543 nm, 505 nm y 663 nm con un equipo Thermo Scientific Multiskan GO. La concentración de licopeno fue determinada de acuerdo con la siguiente formula: Licopeno (mg/g) = [(0.0458) (Abs663) + (0.372) (Abs505) - (0.0806) (Abs543)] (peso de la muestra/volumen del extracto).
Análisis estadístico
Cada tratamiento se realizó con 10 repeticiones y por triplicado por medición. Se realizó un análisis de varianza simple (Anova) para cada variable por concentración de sal; posteriormente, se hizo una comparación de medias por Tukey con un nivel de significancia p ≤ 0.05. Todos los análisis se realizaron en el programa Statgraphics Centurion XVII.
Resultados
Colonización micorrízica, contenido de fenoles y flavonoides
El análisis microscópico de las raíces al final del experimento (10 semanas) mostró que las plantas no inoculadas no presentaron alguna estructura fúngica, mientras que las adicionadas con esporas de R. irregularis presentaron un porcentaje de colonización de 36%, 18% y 10% para las concentraciones de 0 mM, 100 mM y 200 mM de NaCl, respectivamente (tabla 1). En el contenido de fenoles totales en frutos color naranja sin micorriza se observó un incremento de aproximadamente el doble en condiciones salinas, mientras que en frutos color rojo no se observó un incremento significativo en la condición salina aún en presencia del HMA. Los resultados anteriores se explican debido a que los tomates contienen quercetina, naringenina, rutina y ácido clorogénico como principales compuestos fenólicos, los cuales participan como mecanismos de defensa ante estrés oxidativo y patógenos, que posteriormente son degradados durante el proceso de maduración (Martínez-Valverde et al., 2002).
Con relación a los flavonoides, los frutos color naranja no micorrizados presentan un mayor contenido, incrementando sustancialmente de 105 μg/g de p.f. hasta 457 μg/g de p.f. a 200 mM de NaCl, mientras que el contenido disminuye significativamente de 126 μg/g de p.f. a 11 μg/g de p.f. en frutos color rojo, debido a la degradación de dicho pigmento. Al igual que en la condición de frutos de color naranja, la micorriza no tuvo influencia en la concentración a los diferentes niveles de estrés (Tabla 1).
Tabla 1 Contenido de fenoles, flavonoides en frutos en dos estados de maduración (naranja-rojo) en plantas colonizadas por el hongo micorrízico arbuscular R. irregularis (+HMA) o en ausencia (-HMA) a diferentes concentraciones de salinidad en el agua de riego.
| [NaCl 0 mM] | [NaCl 100 mM] | [NaCl 200 mM] | ||
| Fenoles totales mg/100 g p.f. |
Fruto/Col. HMA(%) | 36±5.7 | 18±4.1 | 10±2.8 |
| Naranja - HMA | 34.4±2.3b* | 61.9±1.4a | 57.2±1.1a | |
| Naranja + HMA | 42.7±2.1a | 40.4±3.8b | 56.3±3.0a | |
| Rojo - HMA | 32.3±3.4b | 26.0±9.4c | 36.3±5.0b | |
| Rojo + HMA | 30.3±3.0b | 29.0±3.3c | 29.3±6.0c | |
| Flavonoides mg/100 g p.f. |
Naranja - HMA | 10.5±5.6b | 38.6±2.7a | 45.7±1.1a |
| Naranja + HMA | 27.5±2.9a | 9.4±1.1b | 33.5±7.0ab | |
| Rojo - HMA | 12.6±5.6b | 7.0±6.1b | 13.1±2.6bc | |
| Rojo + HMA | 12.3±1.1b | 11.0±2.2b | 11.4±1.01c | |
*Letras diferentes para cada variable por tratamiento salino son significativamente diferentes por Tukey a p ≤ 0.05 (n = 10). Col. HMA (%): colonización micorrízica en %; p. f.: peso fresco.
Fuente: Elaboración propia.
Contenido de carbohidratos, licopeno y prolina
Se observó un incremento en el contenido de carbohidratos totales a salinidad moderada de 100 mM (Figura 2), donde el tratamiento con micorriza en combinación con estrés salino incrementa la concentración de carbohidratos totales en frutos de 3.9 mg/g a 5.4 mg/g, y se mantiene a 200 mM de NaCl. Al aumentar el estrés salino, se observa una disminución del contenido de carbohidratos totales en los frutos de las plantas que no fueron inoculadas; sin embargo, es comparable con la condición sin estrés salino.
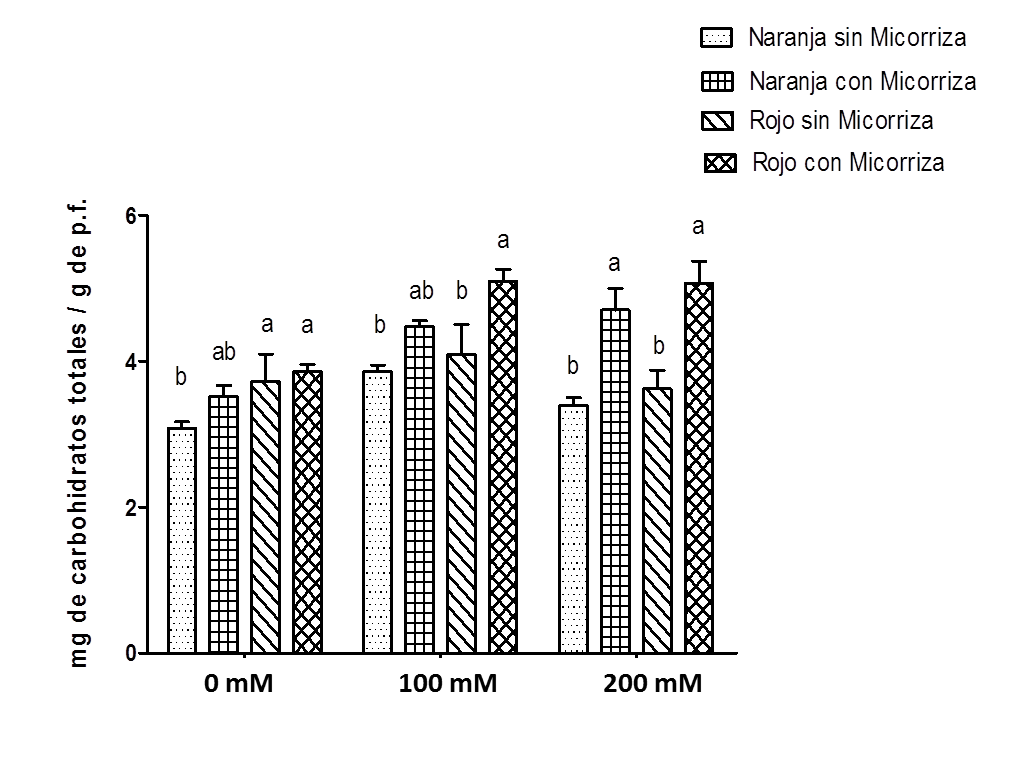
Fuente: Elaboración propia.
Figura 2 Contenido de carbohidratos totales en frutos en dos estados de madurez (color naranja y rojo) de S. lycopersicum c.v. MicroTom en presencia o ausencia radicular de HMA R. irregularis a diferentes concentraciones de NaCl (0 mM, 100 mM y 200 mM) de riego después de la floración.
El licopeno es un pigmento vegetal natural clasificado como carotenoide, el cual aporta color rojo a los tomates. La Figura 3 muestra que en frutos color naranja el licopeno se mantiene en un promedio de 25 μg/g, independientemente de la condición salina o micorrízica. Como es de esperarse, este pigmento aumenta significativamente en frutos color rojo a 180 μg/g, y se mantiene en las mismas concentraciones en 0 mM y 100 mM de NaCl, mientras que a 200 mM disminuye a 120 μg/g.
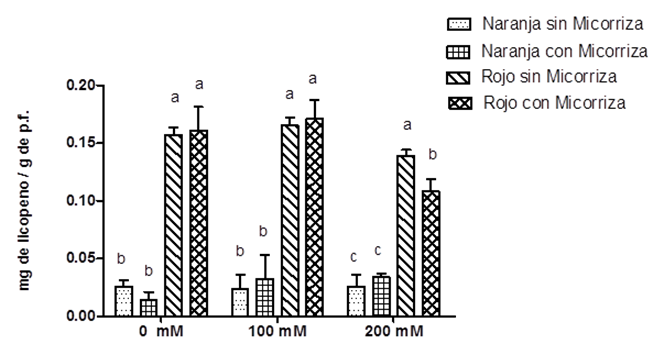
Fuente: Elaboración propia.
Figura 3 Contenido de licopeno en frutos en dos estados de madurez (color naranja y rojo) de S. lycopersicum c.v. MicroTom en presencia o ausencia radicular de HMA R. irregularis a diferentes concentraciones de NaCl (0 mM, 100 mM y 200 mM) de riego después de la floración.
Uno de los mecanismos protectores para contrarrestar el estrés salino es el incremento de solutos como la prolina. En la Figura 4 se encontró un incremento de prolina en frutos color naranja no micorrizados de aproximadamente 60 μg/g a 80 μg/g en 200 mM de NaCl. En frutos color naranja micorrizados se observa una disminución inicial del contenido de prolina, la cual aumenta a mayor salinidad, y en frutos color rojo la prolina disminuye en aproximadamente un 50% en 100 mM y 200 mM de NaCl.
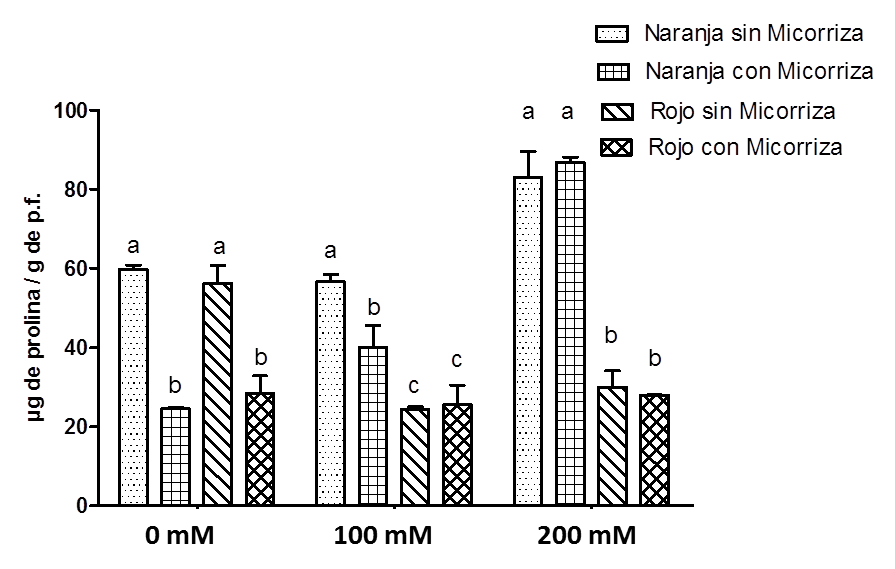
Fuente: Elaboración propia.
Figura 4 Contenido de prolina en frutos en dos estados de madurez (color naranja y rojo) de S. lycopersicum c.v. MicroTom en presencia o ausencia radicular de HMA R. irregularis a diferentes concentraciones de NaCl (0 mM, 100 mM y 200 mM) de riego después de la floración.
Discusión
Es evidente que la salinidad suprime la colonización micorrízica de 36% a 10%, tal como se demuestra en el presente estudio. Esto se ha reportado en plantas de palma, donde el nivel de colonización de micorriza en las raíces de las plantas decreció significativamente con la aplicación de estrés salino a 240 mM de NaCl; además, la frecuencia e intensidad de la infección decreció en 43.38% y 63%, respectivamente (Ait-El-Mokhtar et al., 2019). Por tal motivo, es importante establecer la simbiosis micorrízica antes de iniciar el estrés salino, ya que el jitomate se considera medianamente tolerante al estrés salino; una conductividad por arriba de 2.5 dS/m que corresponde a 100 mM de NaCl limita el crecimiento vegetativo. Es importante considerar la fuente del inóculo de HMA, porque algunas especies pueden estar mejor adaptadas a condiciones de estrés, por lo cual para estudios de salinidad y micorriza es recomendable el aislamiento de HMA de plantas halófitas y propagar el inóculo en condiciones salinas mayores a 16 dS/m.
Varios estudios han demostrado que la inoculación con estos hongos mejora el crecimiento de las plantas bajo estrés salino y aumenta la calidad de los nutrientes (Schubert et al., 2020; Tian et al., 2004). Esto puede ser atribuido al incremento en la adquisición de nutrientes minerales como fósforo (P), zinc (Zn), cobre (Cu) y hierro (Fe). También existen indicios de que los HMA protegen el metabolismo de las hojas de la toxicidad por sodio (Na). Las ventajas para la planta que resultan de la interacción con un HMA son no solo un mejor suministro de nutrientes, sino también una mayor resistencia contra los patógenos y una mejor tolerancia al estrés hídrico y salino (Miransari, 2017).
En condiciones de estrés salino, la célula vegetal acumula una amplia gama de solutos compatibles u osmolitos para equilibrar la presión osmótica de los iones en vacuolas. La sacarosa, la prolina y la glicina betaína se encuentran entre los osmolitos más estudiados que se acumulan ante el estrés salino. El fruto, al igual que el resto de los tejidos vegetales, se ve afectado por las condiciones salinas. En diversos trabajos se ha reportado la acumulación de prolina en tejidos, órganos de las plantas sometidas a varios tipos de estrés, entre ellos al estrés salino, donde el aumento temporal de estos compuestos osmorreguladores es importante en la respuesta de la planta al estrés (Bacha et al., 2017; Evelin et al., 2019; Gomes et al., 2020). Los resultados obtenidos en este trabajo muestran un aumento significativo en el contenido de prolina en frutos de S. lycopersicum tratado con diferentes concentraciones de NaCl, similar a los encontrados en tejido foliar, donde el alto nivel de prolina permite a las plantas mantener equilibrio osmótico cuando crecen bajo potenciales hídricos bajos. La prolina actúa como una importante reserva de energía y nitrógeno que será utilizada por las plantas sometidas a estrés por salinidad (Kaya et al., 2009).
Durante la maduración de los frutos, ocurren cambios fisiológicos, bioquímicos y estructurales que influyen en la producción de compuestos químicos que generan el sabor y aroma correspondientes. En general, el S. lycopersicum cv. MicroTom presenta valores bajos de azúcares totales (máximo 6 mg/g) por ser un modelo de estudio comparado con variedades comerciales como el Saladette, el cual puede alcanzar de 15 mg/g a 23 mg/g. Los azúcares funcionan como osmorreguladores y, en el caso de una salinidad moderada de 100 mM, su contenido aumenta; sin embargo, el aumento solo es significativo en presencia del HMA.
Entre los principales flavonoides de S. lycopersicum se encuentran la quercetina y el canferol en concentraciones de 13.8 mg±0.6 mg por 100 g de fruto fresco (Steward et al., 2000). Estos flavonoides incrementan en frutos color naranja en condiciones salinas altas, independientemente de la condición micorrízica, mientras que disminuyen considerablemente por degradación al madurar el fruto a color rojo. En este caso, la salinidad afectó significativamente el contenido de flavonoides.
Conclusiones
El incremento de la salinidad a 100 mM en agua de riego posterior a la floración aumenta significativamente atributos organolépticos y fitoquímicos en frutos de tomate, como los fenoles, flavonoides y licopeno, donde el HMA R. irregularis aporta un incremento de carbohidratos totales en esta condición tanto en frutos color naranja como en frutos color rojo, mientras que al incrementar la concentración de salinidad disminuye la colonización radicular del HMA.
Debido al interés del tomate como cultivo en el sector agrícola y a la creciente salinización de las tierras cultivadas, que limita el crecimiento de las plantas y el rendimiento de los frutos, se ha dedicado un esfuerzo considerable al estudio de la tolerancia a la sal en el tomate, por lo que la presencia de HMA en los cultivos se presenta como una alternativa para mitigar el daño en las plantas causado por la condición salina en el sustrato.
Conflictos de intereses
Los autores declaran que no existen conflictos de interés.











 text new page (beta)
text new page (beta)


