Introducción
La clase Reptilia en la República Mexicana cuenta con un total de 1292 especies dispuestas en seis órdenes (anura, caudata, gymnophiona, crocodylia, squamata y testudines). El orden testudines cuenta con un registro de 50 especies de tortugas, de las cuales siete especies son marinas, siendo una de ellas Lepidochelys olivacea (Flores-Villela & García-Vázquez, 2014; Johnson et al., 2017). Las tortugas marinas son organismos de hábitos pelágicos que presentan en muchas ocasiones asociaciones simbióticas con otros seres vivos que se hospedan de manera parásita o epizoica en sus caparazones, ejemplo de ello son los cirripedios, sanguijuelas y anfípodos (Alonso, 2007; Gámez et al., 2006; Lara & Mota, 2014). Por otra parte, organismos de menor tamaño, como las microalgas, también pueden adherirse a estas estructuras, pero sin ocasionar ningún daño. En las últimas décadas, los estudios relacionados con este tipo de relaciones simbióticas, particularmente con microalgas epibiontes, se han desarrollado en distintas partes del mundo, destacando principalmente los primeros registros, observaciones y revisiones de investigaciones previas, así como aspectos de distribución y estructura de comunidades algales; ya sea sobre organismos animales o vegetales en distintos hábitats tanto marinos como costeros, y más recientemente sobre análisis bioquímicos de biopelículas en animales marinos (Argumedo & Siqueiros, 2008; Cupul-Magaña & Cortés-Lara, 2005; Gárate-Lizarraga & Muñetón-Gómez, 2009; Hernández-Vázquez & Valadez-González, 1998; Lazo-Wasem et al., 2011; López-Fuente & Siqueiros-Beltrones, 2006; Rivera et al., 2018; Violante-Huerta, 2018; Violante-Huerta et al., 2017). Con la finalidad de contribuir al conocimiento de la diversidad microalgal epibionte, el presente trabajo tiene como objetivo analizar la composición de las diatomeas epizoicas en hembras de la especie Lepidochelys olivacea durante un periodo de anidación en la localidad de Playa Ventura, Copala, Guerrero.
Material y Métodos
La comunidad Juan Nepomuceno Álvarez (16º 32' N; 98º 54' O), mejor conocida como Playa Ventura, se ubica en la Sierra Madre del Sur, en el municipio de Copala, dentro de la región denominada Costa Chica de Guerrero, México, a una altitud de 10 m.s.n.m. (Instituto Nacional de Estadística y Geografía [INEGI], 2010). El trabajo de campo se combinó con las actividades de recolección de huevos de tortuga del Centro Tortuguero “Los Quelonios” de octubre de 2015 a enero de 2016. Lepidochelys olivacea anida durante todo el año, aunque lo hace con mayor frecuencia de julio a octubre. Las muestras fueron recolectadas realizando patrullajes a pie con el fin de encontrar tortugas desovando. Los recorridos fueron nocturnos en un transecto de 12 km, en un horario de 21:00 a 4:00 horas (Eckert et al., 2000). Las muestras biológicas se obtuvieron raspando el caparazón de 46 individuos con ayuda de una espátula, tomando en cuenta cuatro áreas de 10 cm de diámetro en cada uno de los costados del caparazón. Los raspados se hicieron entre el segundo y tercer escudo lateral y entre el sexto y séptimo escudo lateral en ambos lados (Figura 1). Las muestras se depositaron en frascos de vidrio de 60 ml con agua destilada y 10 ml de formol al 4% (García-Rodríguez et al., 2003). En el laboratorio se realizó la técnica de oxidación ácida para la limpieza de diatomeas propuesta por Johansen et al. (1983) y Lara et al. (1996), para después realizar el montaje en resina Naphrax. Para la observación de las diatomeas se utilizó un microscopio compuesto de campo claro Leica DM500, y para el registro de las especies se empleó una cámara ICC50 HD. La identificación taxonómica se llevó a cabo con la consulta de claves especializadas (Guiry-Guiry & Guiry, 2020; Novelo et al., 2007; Segura-García, 2011; Segura-García et al., 2012; Spaulding & Edlund, 2008). La prevalencia (P) se calculó siguiendo la metodología descrita por Bush et al. (1997), que consiste en calcular el número de individuos de una especie encontrados en el total de la población registrada, es decir, el número de hospederos con diatomeas de una especie dividido entre el número de hospederos examinados expresada en porcentaje.
Resultados
De las 46 tortugas de las que se tomaron muestras, en 30 de ellas se encontró material biológico. Noviembre fue el mes con mayor cantidad de tortugas (17 individuos de un total de 21 revisados) encontradas con presencia de microalgas epizoicas. En diciembre, 11 ejemplares de tortuga de los 16 totales presentaron diatomeas. En enero, dos tortugas de un total de seis presentaron microalgas. Finalmente, en octubre, se muestrearon tres tortugas en total, pero en ninguna de ellas se observaron microalgas epizoicas (Tabla 1). Un total de 17 géneros y 20 especies de diatomeas fueron identificados sobre los caparazones de Lepidochelys olivácea. En las muestras recolectadas en el mes de noviembre se identificaron 14 especies, en diciembre se reconocieron 10 especies y en enero 11 (Tabla 2). Cinco especies de diatomeas estuvieron presentes en los tres meses de muestreo (Halamphora sp., Gomphonema mexicanum, Pinnularia cf. brebissonii, Planotidium lanceolatum y Tabellaria flocculosa), cinco especies se encontraron en solo dos meses (Cocconeis lineata, Gomphonema gracile, Gomphonema sp., Hantzschia amphioxys, Rhoicosphenia abbrevia ta) y 10 especies se presentaron únicamente en uno de los meses de muestreo (Achnanthidium lanceolatum, Alveus marinus, Cocconeis placentula, Delphineis sp., Coscinodiscus sp., Diploneis splendida, Nitzschia amphibia, Pseurostaurosira polonica, Rhopalodia gibba, Ulnaria sp.) (Figura 2 y 3). El mayor número de especies reconocidas pertenecen a los géneros Gomphonema (tres especies) y Cocconeis (dos especies). Los 15 géneros restantes estuvieron representados por una especie. Las diatomeas que tuvieron mayor prevalencia fueron Planothidium lanceolatum (35%), Gomphonema mexicanum (20%), Pinnularia cf. brebissonii (20%), Hantzschia amphioxys (15%) y Tabellaria frocculosa (15%). El resto osciló entre el 13% y 2% (Tabla 3).
Tabla 1 Presencia de diatomeas epizoicas en Lepidochelys olivacea.
| Octubre | Noviembre | Diciembre | Enero | Total | ||||||
| Lepidochelys olivacea | Total de arribazón | Con Diatomeas | Total arribazón | Con Diatomeas | Total arribazón | Con diatomeas | Total Arribazón | Con diatomeas | Arribazón | Con diatomeas |
| 3 | 0 | 21 | 17 | 16 | 11 | 6 | 2 | 46 | 30 | |
Fuente: Elaboración propia.
Tabla 2 Especies de diatomeas epizoicas presentes en Lepidochelys olivacea.
| Especie\Mes | Oct | Nov | Dic | Ene | Ambiente | Forma de vida |
| Achnanthidium lanceolatum | X | Agua dulce | Plantónica Béntica | |||
| Alveus marinus | X | Marina | Béntica | |||
| Cocconeis lineata | X | X | Agua dulce | Plantónica Epilítica | ||
| Cocconeis placentula | X | Agua dulce Marina | Plantónica Epilítica | |||
| Delphineis sp. | X | Marina | Béntica | |||
| Coscinodiscus sp. | X | Marina | Plantónica | |||
| Diploneis splendida | X | Marina | Béntica | |||
| Gomphonema sp. | X | X | Agua dulce | Plantónica Epilítica Epífita Béntica | ||
| Gomphonema gracile | X | X | Agua dulce | Plantónica Epilítica Epífita Béntica | ||
| Gomphonema mexicanum | X | X | X | Agua dulce | Epilítica | |
| Halamphora sp. | X | X | X | Agua dulce Salobre Marina | Plantónica Epilítica Béntonica | |
| Nitzschia amphibia | X | Agua dulce | Plantónica Epilítica | |||
| Hantzschia amphioxys | X | X | Agua dulce | Plantónica Epilítica Epífita | ||
| Pinnularia cf. brebissonii | X | X | X | Agua dulce | Béntica Epífita | |
| Planothidium lanceolatum | X | X | X | Agua dulce | Epilítica Epífita | |
| Pseurostaurosira polonica | X | Agua dulce | Plantónica Epilítica | |||
| Rhoicosphenia abbreviata | X | X | Agua dulce Salobre | Plantónica Epilítica | ||
| Rhopalodia gibba | X | Agua dulce | Epilítica | |||
| Tabellaria flocculosa | X | X | X | Agua dulce | Plantónica Epilítica Epífita | |
| Ulnaria sp. | X | Agua dulce | Plantónica Epilítica |
Fuente: Elaboración propia.
Fuente: Elaboración propia.
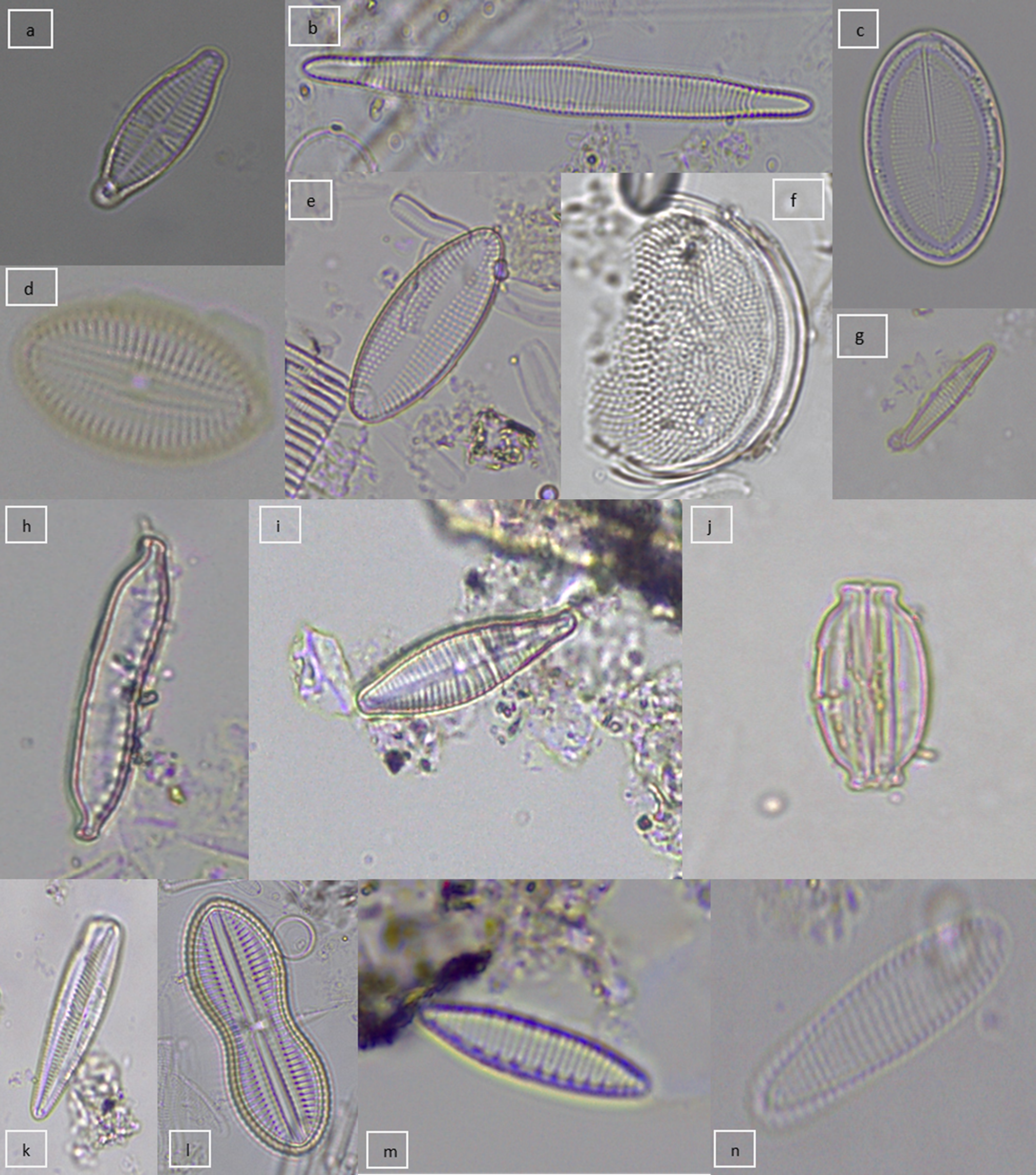
Figura 2 Diatomeas epizooicas reconocidas: a) Achnanthidium lanceolatum, b) Alveus marinus, c) Cocconeis lineata, d) Cocconeis placentula, e) Delphineis sp., f) Coscinodiscus sp., g) Gomphonema gracile, h) Hantzschia amphioxys, i) Gomphonema mexicanum, j) Halamphora sp., k) Gomphonema sp., l) Diploneis splendida, m) Nitzschia amphibia, n) Rhoicosphenia abbreviata.

Fuente: Elaboración propia.
Figura 3 Diatomeas epizooicas reconocidas (continuación): o) Pseudostaurosira polonica, p) Rhopalodia gibba, q) Tabellaria flocculosa, r) Ulnaria sp.
Tabla 3 Prevalencia de diatomeas en Lepidochelys olivacea.
| Diatomeas | Prevalencia (%) |
| Planothidium lanceolatum | 35 |
| Gomhonema mexicanum | 20 |
| Pinnularia cf. brebissonii | 20 |
| Hantzschia amphioxys | 15 |
| Tabellaria frocculosa | 15 |
| Halamphora sp. | 13 |
| Cocconeis lineata | 7 |
| Gomphonema sp. | 7 |
| Gomphonema gracile | 7 |
| Nitzschia amphibia | 4 |
| Rhoicosphenia abbreviata | 4 |
| Achnanthidium lanceolatum | 2 |
| Alveus marinus | 2 |
| Cocconeis placentula | 2 |
| Delphineis sp. | 2 |
| Coscinodiscus sp. | 2 |
| Diploneis splendida | 2 |
| Pseurostaurosira polonica | 2 |
| Rhopalodia gibba | 2 |
| Ulnaria sp. | 2 |
Fuente: Elaboración propia.
Discusión
Estudios realizados con distintas especies de tortugas de agua dulce nativas de la región neotropical indican la presencia de diatomeas como uno de los grupos más diversos y con mayor prevalencia sobre los caparazones de estos reptiles, además sugieren que la rugosidad del caparazón junto al estado de sucesión y la capacidad de adherencia puede explicar esta composición diatomológica. Las características morfológicas de las diatomeas pennadas facilitan la adherencia a distintos sustratos debido al mucilago (lipoproteínas) que generan, además de que se han reportado con una amplia distribución y frecuentes tanto en ambientes eutróficos como oligotróficos (Donato-Rondón et al., 2018; Valdivia, 2019).
Algunos géneros reportados en el presente estudio, como Cocconeis, han sido descritos como un taxon con afinidad por aguas limpias a moderadamente enriquecidas. Por ejemplo, se ha descrito a Cocconeis neothumensis var. marina como epizoica de la tortuga golfina en playa Ostional, Costa Rica (Majewska et al., 2015). Este género también ha sido reportado como epifito de Thalassia testudinum (hierba de tortuga) y como bentónico en Dzilam de Bravo en la Península de Yucatán (Hernández, 2012; Hernández-Almeida et al., 2013). Adicionalmente, se ha reportado en los sedimentos adyacentes al manglar de la Zona de Canales perteneciente al Sistema Lagunar Magdalena-Almejas, en Baja California (López-Fuente & Siqueiros-Beltrones, 2006). Por lo tanto, Cocconeis se considera como un género ampliamente adaptable a distintas formas de vida; ya sea sobre plantas, animales o sustratos. Sin embargo, no es particular del género, sino del grupo de diatomeas en general, ya que los reportes de algunas investigaciones indican que el monitoreo de estos organismos microscópicos no ha sido del todo documentado, y eso ha limitado conocer con certeza la distribución que presentan y los hábitats que ocupan (Denys & de Smet, 2010). Por otra parte, géneros como Pinnularia y Nitzschia han sido reportados en condiciones ambientales de alta carga orgánica, así como en ambientes de agua salobre, ricos en nutrientes y baja concentración de oxígeno, situación que refuerza que las condiciones ambientales a las que se adaptan estas microalgas responden a un gran número de hábitats. Esta capacidad de adaptación y distribución de las diatomeas se relaciona con los hábitos de Lepidochelys olivácea, ya que durante los meses de anidación se acerca a las desembocaduras de ríos o incluso puede llegar a alcanzar las lagunas costeras que se encuentran próximas a su zona de desove, lo que propicia una oportunidad de contacto para que estas microalgas se establezcan sobre los caparazones de algunas tortugas (Cupul-Magaña & Cortés-Lara, 2005; Gómez et al., 2001; Hernández, 2012; Liria-Loza, 2011; Majewska et al., 2015; Novelo, 2012).
En este sentido, la capacidad de adherencia de las diatomeas a distintos sustratos puede explicar su presencia sobre estos reptiles, ya que al estar en contacto con Lepidochelys olivacea encuentran un sustrato adecuado para su establecimiento, fijándose a ellos cuando realizan actividades de alimentación o descanso sobre el lecho marino (Majewska et al., 2015).
Existen diferentes tipos de relaciones simbióticas en la naturaleza en las que el empleo de ciertas herramientas puede brindar información relevante. Una de las pruebas más utilizadas en trabajos en donde se determina la relación parasito-hospedero es la prevalencia, ya que los hospederos presentan varios atributos que pueden determinar que se presente algún tipo de relación con otra especie. Algunos de esos atributos pueden ser sus hábitos de alimentación, patrones de conducta, desplazamiento diario y áreas de distribución. Desde el punto de vista del individuo, puede influir la edad, sexo y tamaño corporal (Poulin & Morand, 2004; Sánchez-Serrano & Cásares-Martínez, 2011). La prevalencia es una medida sencilla de presencia/ausencia de especies de epibiontes en una muestra de hospederos expresada en porcentaje, que indica el grado de relación que tiene una especie con otra (Bush et al., 1997). Los resultados del análisis de prevalencia indican que las especies de diatomeas con mayor porcentaje están mejor adaptadas morfológicamente para adherirse a distintos tipos de sustratos, pues son consideradas como epilíticas, mientras que las de menor prevalencia pueden presentar hábitos bentónicos en ambientes salobres como Rhopalodia gibba o simplemente presentar abundancias bajas en la mayoría de los ecosistemas en donde se han reportado, como puede ser el caso del género Ulnaria. La diversidad algal registrada en el presente trabajo nos indica que los caparazones de estas tortugas ofrecen condiciones adecuadas para su establecimiento y que su presencia no necesariamente está influenciada por condiciones abióticas o climáticas (Arevalo, 2018; Novelo, 2012; Rivera, et al., 2018; Segura-García et al., 2012).
Un aspecto poco considerado, pero que es relevante para explicar cómo es que se establecen estos epibiontes sobre las tortugas, es la iluminación artificial; la mayoría de las playas donde las tortugas anidan presentan asentamientos humanos, lo que implica que exista este tipo de iluminación durante las noches. Esta situación hace que las tortugas que llegan a desovar en las playas puedan sufrir desorientación, retrasando su regreso al mar. En los meses de muestreo se detectó la desorientación de las hembras que podría deberse a la iluminación artificial. Las tortugas golfinas que anidaron cerca de casas con iluminación artificial no regresaban al mar inmediatamente tras el desove, sino que avanzaban hacia la fuente de luz. En este sentido, Deem et al. (2007) y Rondón et al. (2009) reportaron que tortugas laúd sufrieron cierta desorientación por este factor, lo que hizo que presentaran cambios en su comportamiento de anidación. Esta situación también puede influir en el establecimiento de las diatomeas como epibiontes, considerando que las tortugas al desorientarse llegan a la laguna costera en lugar de llegar al mar, por lo que probablemente permanezcan el tiempo suficiente en este lugar para que las algas se adhieran y posteriormente se establezcan por los beneficios que el caparazón de las tortugas les brinda.
Conclusiones
El caparazón de las tortugas golfinas Lepidochelys olivacea presenta las condiciones adecuadas para que las diatomeas se establezcan, ya que sus hábitos de alimentación y desplazamiento influyen directa o indirectamente para que estas algas se adhieran.
Los lugares de alimentación y anidación de Lepidochelys olivacea son un factor importante en el establecimiento de las microalgas, debido a que se han encontrado especies de diatomeas de distribución tanto salobre como dulceacuícola, lo cual sugiere que las tortugas tienden a alimentarse en zonas con pastos marinos donde las diatomeas se adhieren a sus cuerpos o permanecen cerca de los lugares donde las aguas continentales llegan al mar en el proceso de desove. Para las diatomeas es más fácil establecerse sobre las tortugas debido a su forma de vida perifítica y a las estructuras que desarrollan para adherirse a los sustratos como son los cojines o pedículos mucilaginosos.
La escasa presencia de diatomeas centrales puede deberse a su forma de vida holoplanctónica o meroplanctónica, por lo que se considera que las tres especies registradas estuvieron de manera incidental.
Las especies de diatomeas reportadas en este trabajo son un nuevo registro de organismos epibiontes de la tortuga golfina Lepidochelys olivácea, ya que ninguna ha sido reportada por otros autores.
Trabajos de este tipo generan información relevante sobre la diversidad biológica de las microalgas y su relación con otros organismos.











 text new page (beta)
text new page (beta)



