Introducción
El aumento de la población en los últimos años ha originado el incremento en la demanda de productos alimenticios, sobre todo de origen agrícola, que da como resultado en muchos de los casos la sobreexplotación de los cultivos. De este modo impacta de manera negativa en los suelos que son destinados para este uso (Abdulra'uf & Tan, 2015). Una de las características de los suelos agrícolas es que poseen los nutrientes necesarios para hacer crecer los plantíos, pero una producción desmedida (sin rotación de cultivo, ni descanso del suelo agrícola) provoca la incorporación de plagas que merman la producción (Labriére, Locatelli, Laumonier, Freycon & Bernoux, 2015). Para erradicar las plagas de los cultivos, el ser humano ha recurrido al empleo de sustancias químicas denominadas como plaguicidas. La función general es penetrar en el organismo de la plaga y hacer daño al sistema nervioso o digestivo, provocándole la muerte; esto puede ocurrir también en el ser humano al ser expuesto a dichas sustancias (Pano-Farias, Ceballos-Magaña, González, Jurado & Muñiz-Valencia, 2015).
Los plaguicidas tienen la característica de penetrar en las diferentes capas del suelo; de esta forma, se incorporan en los diferentes sistemas acuíferos como ríos, por lo cual son transportados a lugares lejanos de donde se realizaron las aplicaciones (Durovic, Gajic Umiljendic, Cupac & Ignjatovic, 2010). Los plaguicidas no únicamente se presentan en las zonas rurales dedicadas a la agricultura, sino que también es altamente probable encontrarlos en otros sitios debido a que se transportan a través de las escorrentías de cultivos cercanos o por un mal procesamiento en las plantas de tratamiento de aguas residuales agua o aire. En este sentido, se han encontrado plaguicidas en agua superficial y en los sedimentos de ríos (Agarwal, Prajapati, Singh, Raza & Thakur, 2015; Sun & Lee, 2003).
La presencia de estos compuestos en el suelo representa un innegable riesgo a la salud debido al contacto con el ser humano. Entre los efectos adversos que pueden ocasionar están la genotoxicidad, inhibición de actividad acetilcolinesterasa, toxicidad a nivel hepático y renal (Montico & Di Leo, 2015). Los plaguicidas organoclorados son compuestos químicos cuyas propiedades de bioacumulación, actividad tóxica y fuentes de exposición los clasifican como contaminantes ambientales. Las propiedades lipofílicas y de resistencia a las reacciones metabólicas de degradación propician que estos compuestos se transporten a través de la cadena alimenticia y se biomagnifiquen en concentraciones altas a través de la misma (Waliszewski et al., 2015). Debido a estos efectos, es necesario el desarrollo de métodos analíticos para la detección y cuantificación de plaguicidas, implementando procesos de extracción de corta duración. En este sentido, con el objetivo de tener altas recuperaciones de los plaguicidas, algunos de los tratamientos de muestra implementados son la extracción en fase sólida (SPE, por sus siglas en inglés) (Cazorla-Reyes, Fernández-Moreno, Romero-González, Garrido Frenich & Martínez-Vidal, 2011; Durovic et al., 2010; Robles-Molina, Lara-Ortega, Gilbert-López, García-Reyes & Molina-Díaz, 2014; Yang et al., 2011) y la microextracción en fase sólida (SPME, por sus siglas en inglés) (Abdulra'uf & Tan, 2015; Farina, Abdullah, Bibi & Khalik, 2017; Wongklom & Intaraprasert, 2012; Xu et al., 2016). Estas técnicas se pueden aplicar (previo pretratamiento) para concentrar selectivamente los compuestos de interés en muestras de suelo agrícola. Una vez realizado el tratamiento de muestra, las muestras normalmente son analizadas por cromatografía de gases cuando los analitos son volátiles o cromatografía de líquidos si son no volátiles.
En este trabajo se presenta el desarrollo y validación de un método analítico para la determinación de plaguicidas (carbamatos y organoclorados) usando la SPE para el tratamiento de muestra y la cromatografía de líquidos de alta eficiencia (HPLC, por sus siglas en inglés) acoplada a un detector de arreglo de diodos (DAD) para muestras de suelo agrícola. El método fue validado de acuerdo con guías de validación internacionales, evaluando la selectividad, la linealidad, los límites de detección (LD) y cuantificación (LC) y la exactitud. Además, se calculó el efecto matriz de la muestra en la determinación de los plaguicidas bajo estudio. Este método presenta una metodología alternativa para la determinación de dos familias de plaguicidas ampliamente usados en campos agrícolas. Finalmente, el método propuesto se aplicó a muestras de suelo, obteniéndo resultados aceptables debido a que el efecto de la matriz (EM) es clasificado como bajo.
Materiales y Métodos
Se empleó una mezcla de estándares de plaguicidas que contenía carbofuran (CB), diuron (DI), profam (PR), dicloran (DC), clorpropham (CH) y tetradifón (TE) con una pureza del 98%, que fueron adquiridos en Sigma-Aldrich (Madrid, España). Agua ultra pura con resistividad de 18.2 MΩ/cm fue obtenida del sistema de agua Mili Q de Millipore (Bedford, MA, EUA). Acetonitrilo (AcN) y metanol grado HPLC (98% pureza) fueron adquiridos en Sigma-Aldrich (Madrid, España). Se prepararon disoluciones estándares de 500 mg/L para cada uno de los plaguicidas en metanol y se almacenaron a 4 °C en un frasco ámbar hasta su uso posterior. Las mezclas de trabajo con todos los estándares fueron preparadas semanalmente en las concentraciones requeridas (0.5 mg/kg, 1.0 mg/kg, 2.0 mg/kg, 4.0 mg/kg y 5.0 mg/kg).
Para la SPE se empleó el cartucho Finisterre C18 (200 mg, 3 mL). La columna cromatográfica Tracer Excel 120 C18 ODSA (150 mm × 4 mm, 5 µm) utilizada para la separación fue adquirida en TeknoKroma (Madrid, España). También se usaron membranas de nylon y filtros de jeringa con tamaño de poro de 0.45 µm para el filtrado de la fase móvil y extractos finales de muestra obtenidos de TeknoKroma (Madrid, España).
Se empleó un baño de ultrasonido marca PSelecta (Barcelona, España). La preconcentración de la muestra se llevó a cabo en una cámara de vacío con 12 entradas para cartuchos de SPE (Madrid, España) acoplado a una bomba de vacío modelo Eyela A-1000S. El sistema cromatográfico empleado fue el HPLC modelo 1525 de la marca Waters, volumen de inyección de 20 µL, con horno para columna y acoplado a un DAD, modelo 2996 (Milford, MA, EUA).
La adquisición de los datos fue realizada con el software Empower (Service Pack A) de la marca Waters (Madrid, España). Los análisis quimiométricos se realizaron con el paquete estadístico STATISTICA versión 8.0 Copyright© StatSoft Inc. 1984-2007 (Tulsa, OK, EUA).
Análisis por HPLC-DAD
El análisis se llevó acabo en una columna cromatográfica Tracer Excel 120 ODSA (150 mm × 4 mm, 5 µm) a una temperatura de columna de 25 °C, inyectando un volumen de 10 µL, un caudal de fase móvil de 1.0 mL/min, el cual estuvo constituido en una mezcla de Acetonitrilo, y agua Milli Q. La separación cromatográfica se efectuó en modo gradiente, se inició con 35% de AcN e inmediatamente se incrementó a 51.5% en 11 min. Posteriormente, se elevó de 51.5% a 90% en 4 min y, finalmente, se regresó a la condición inicial de 35% en 5 min. La identificación y cuantificación se realizó a la longitud de onda de 280 nm. El tiempo total de análisis fue de 18 min.
Toma y tratamiento de muestra de suelo
Las muestras de suelo agrícola fueron recolectadas en cultivos orgánicos de localidades cercanas a Sevilla, España. Se obtuvieron a una profundidad de 20 cm a 40 cm de la superficie con un peso aproximado de 2 kg; posteriormente, se almacenaron en bolsas herméticas con el objetivo de mantenerlos frescos y ser transportados en contenedores hasta el laboratorio. Una vez en el laboratorio, se procedió a retirar la humedad, por lo que se colocaron en papel filtro de carácter común y fueron colocados en mesas de laboratorio por dos noches continuas a temperatura ambiente. Después del secado, las muestras se molieron y se tamizaron con malla de 2 mm, se colocaron en bolsas herméticas y fueron almacenados con un peso de 500 g y en un lugar seco a temperatura ambiente para su posterior análisis.
A la muestra de suelo se le aplicó una lixiviación, que consistió en someter a ultrasonido por 30 minutos 4 g de suelo con 10 mL de metanol y 10 mL agua milli Q. Después, se filtró la disolución resultante a través de filtros de membrana con un tamaño de poro de 0.45 µm y fueron recuperados en viales de 20 mL.
Se empleó la técnica de SPE utilizando el cartucho Finisterre C18. Para favorecer la retención de los analitos en el cartucho, el sobrenadante filtrado (aproximadamente 18 mL) se diluyó a 150 mL con agua milli Q para llevar el porcentaje de metanol al 6%. El extracto se hizo pasar a través del cartucho a un flujo de 3 mL/min el cual fue previamente acondicionado con metanol (3 mL) y, enseguida, con agua mili Q (6 mL). Pasada la muestra, se secó al vacío durante 5 min. Finalmente, los plaguicidas retenidos por el material absorbente se eluyeron con 3 mL de metanol. Este extracto final fue inyectado en el HPLC-DAD de acuerdo con las condiciones de análisis.
Muestras de suelo añadidas y efecto matriz
Para la obtención de muestras de suelo añadidas se añadió la concentración requerida, se mezcló y se dejó reposar por 24 h. Una vez pasado este tiempo, se aplicó la preparación de muestra descrita en las secciones Toma y Tratamiento de muestra de suelo y se analizaron como se describe en la sección Análisis por HPLC-DAD.
El suelo agrícola se considera una matriz compleja; por lo tanto, aparecerán interferencias durante su análisis. Con el fin de observar este comportamiento, es necesario efectuar un estudio sobre el EM. Este procedimiento consiste en comparar las pendientes del calibrado con disolvente (calibrado externo) y el calibrado en la muestra (Giacinti, Raynaud, Capblancq & Simon, 2016; Walorczyk, 2014) (ecuación 1). Entre más cercano a 100% sea el valor obtenido, implica menos EM; si el valor es menor a 100%, implica una supresión de respuesta; y si el valor es mayor a 100%, implica un aumento de respuesta.
Ecuación 1. Efecto matriz.
Validación del método
Parte fundamental del desarrollo de métodos analíticos es su validación. Con este objetivo, se evaluó la selectividad, la linealidad, los LD y LC (Eurachem, 1998) y la exactitud del método (The Commission of the European Communities, 2002). La selectividad del método se evaluó mediante inspección visual, comparando los cromatogramas de: a) solución patrón, b) la muestra blanco de suelo y c) la muestra de suelo añadida con los plaguicidas bajo estudio. La linealidad se evaluó por medio de curvas de calibración añadidas a la matriz a cinco niveles de concentración (0.5 mg/kg, 1.0 mg/kg, 2.0 mg/kg, 4.0 mg/kg y 5.0 mg/kg) por triplicado. Para este propósito, las muestras de suelo libres de plaguicidas se añadieron de 0.5 mg/kg - 5.0 mg/kg, siguiendo el protocolo descrito en la sección Muestras de suelo añadidas. La curva de calibración añadida a la matriz se construyó trazando el área del pico de cada plaguicida (eje y) frente a la concentración (eje x). Los LD y LC se evaluaron mediante la ecuación 2. La exactitud del método se calculó como recuperación de los plaguicidas en tres concentraciones diferentes (n = 18). Los valores de recuperación se obtuvieron usando la ecuación 3. Una vez validado el método, se puede evaluar su aplicación a otras matrices realizando una evaluación del efecto matriz.
Ecuación 2. Límite de detección (LD) y de cuantificación (LC), donde X es 3 (para LD) o 10 (para LC), Sblanco es la desviación estándar de la señal en blanco y Yblanco es el valor medio de señal en blanco
Ecuación 3. Porcentaje de recuperación (%R).
Resultados y Discusión
Optimización de la separación y detección
Para la optimización de la separación cromatográfica de los seis plaguicidas estudiados (Figura 1) se realizó una serie de experimentos con: la columna FINISTERRE C18 a 25 °C, una fase móvil binaria agua AcN: Agua Milli Q a 1.0 mL/min, con un volumen de inyección de 10 µL de una mezcla de plaguicidas en concentración de 25 mg/L y una detección a longitud de onda de 280 nm. Esta optimización consistió en ensayar distintos gradientes de concentración de las fases binarias antes mencionadas hasta conseguir la mejor resolución entre picos y menor tiempo de análisis. Finalmente, el gradiente de la separación fue de tipo segmentado y como se explica a continuación: Se inició con 35% de AcN y se aumentó a 51.5% en 11 minutos; posteriormente, se aumentó hasta 90% de AcN en cuatro minutos y, finalmente, se regresó a la condición inicial de 35% de AcN en cinco minutos. En la Figura 2 se muestra la separación conseguida de los plaguicidas bajo estudio.
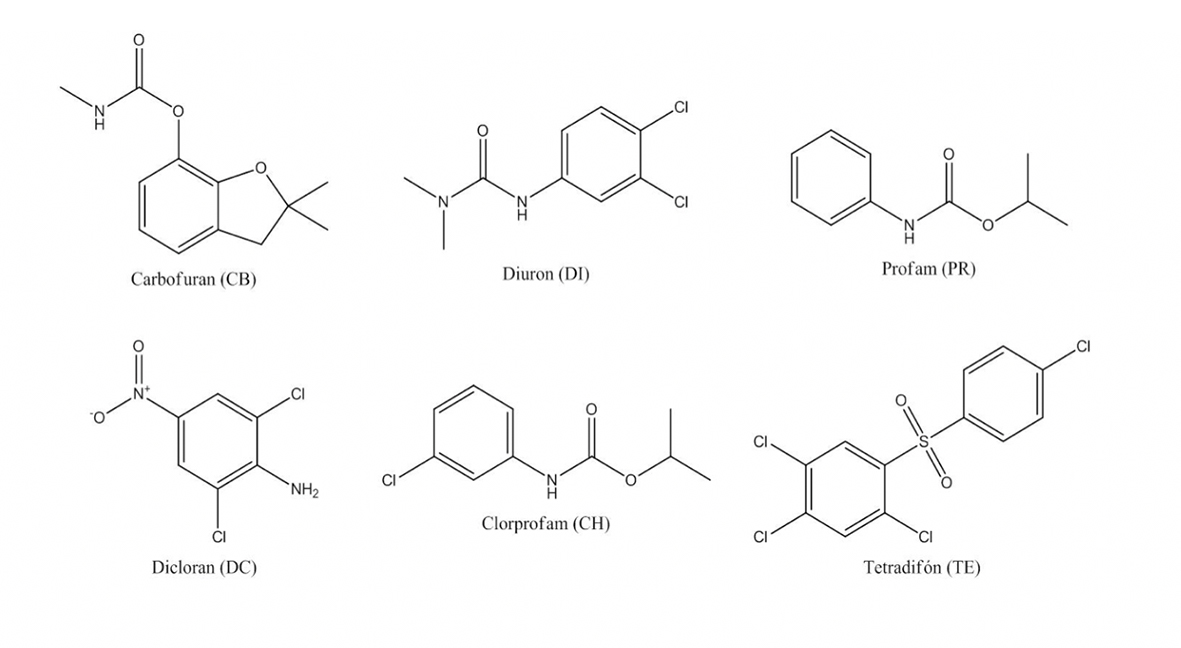
Fuente: Elaboración propia.
Figura 1 Nombre común, estructura y abreviación de los plaguicidas empleados.
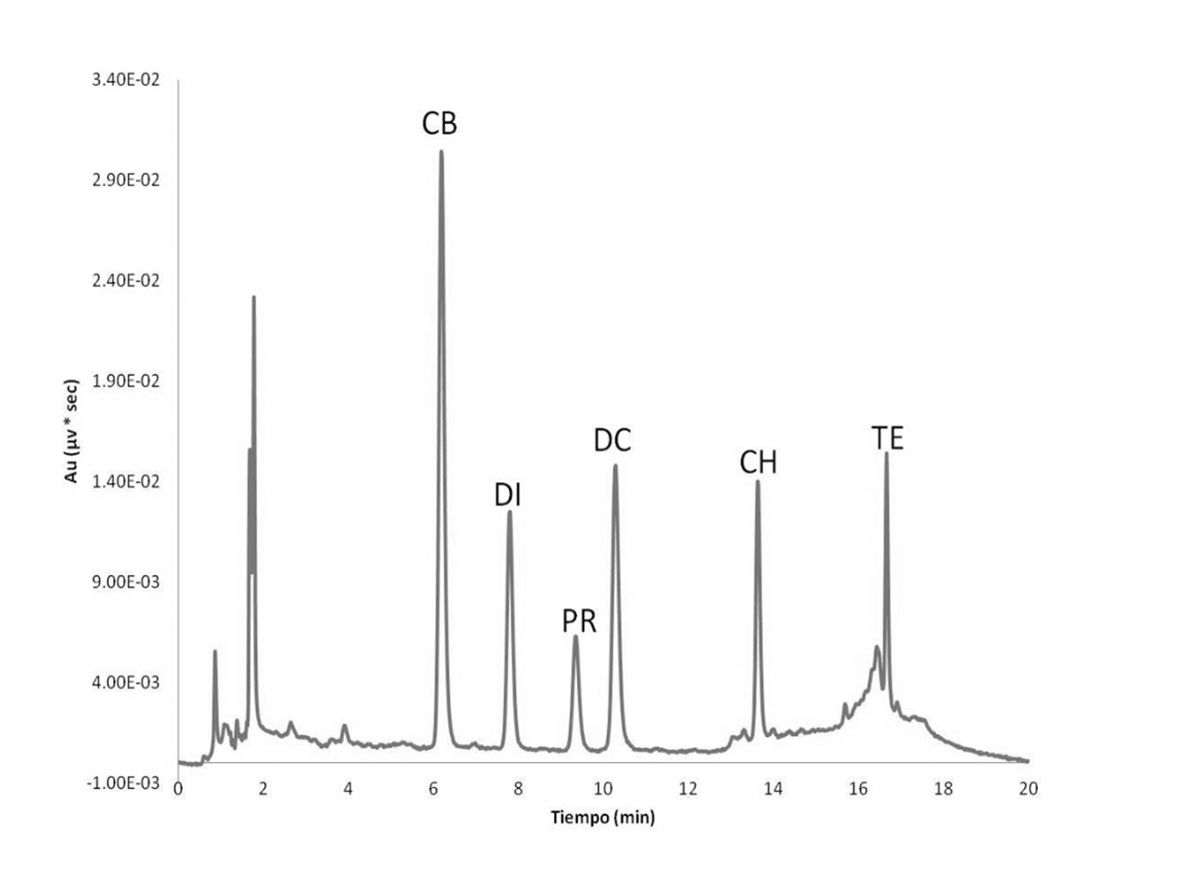
Fuente: Elaboración propia.
Figura 2 Cromatograma de la separación de plaguicidas a detección de 280 nm.
Optimización del pretratamiento de muestra de suelo
Se realizó la optimización del pretratamiento de la muestra, empleándose un diseño de experimentos factorial fraccionado, el cual se constituyó con cuatro factores a dos niveles. Los factores seleccionados fueron aquellos considerados que afectan en la extracción: el peso de la muestra (g), el volumen de extracción (mL), el porcentaje de metanol (%) y el tiempo de sonicación (min). Para cada factor se propuso un valor mínimo y un valor máximo de operación y se midió la respuesta para cada compuesto, siendo este el valor del área debajo de la curva perteneciente a cada plaguicida. En la Tabla 1 se muestra la matriz de trabajo con las combinaciones entre los factores y sus niveles.
Tabla 1 Matriz del diseño de experimento para las condiciones de lixiviación de suelo.
| Experimento | Matriz de trabajo | |||
| Muestra (g) | Vol extracción (mL) | Metanol (%) | Sonicación (min) | |
| 1 | 2 | 10 | 50 | 15 |
| 2 | 4 | 10 | 50 | 30 |
| 3 | 2 | 20 | 50 | 30 |
| 4 | 4 | 20 | 50 | 15 |
| 5 | 2 | 10 | 75 | 30 |
| 6 | 4 | 10 | 75 | 15 |
| 7 | 2 | 20 | 75 | 15 |
| 8 | 4 | 20 | 75 | 30 |
Fuente: Elaboración propia.
Después de haber realizado los experimentos, se obtuvieron las áreas de cada uno de los plaguicidas y se realizó el tratamiento estadístico con el software STATISTICA, obteniéndose los gráficos de superficies de respuesta en términos de la deseabilidad (D). En la Figura 3 se muestran los gráficos de superficies de respuesta en los cuales se grafica el factor de D vs. dos factores. A partir de estas superficies de respuesta, se definieron los valores óptimos para cada factor: el peso de la muestra de 2 g, el volumen de extrayente a 20 mL, la proporción de porcentaje de metanol con 75% y el tiempo de sonicación a 15 min.
En Tabla 2 se muestran los coeficientes de ajuste entre la ecuación de deseabilidad D=α 0 +α 1 X+α 2 Y así como también los valores de las variables del diseño. También se realizó un análisis de Pareto para determinar qué factor influye más en los resultados. De este análisis, se puede concluir que el factor que más influye en los resultados es el volumen del extrayente, seguido del porcentaje de metanol, luego el tiempo de sonicación y el peso de la muestra. En estos diagramas se grafica el efecto estándar estimado de cada variable y se marca una línea vertical en donde estaría situado el valor de p = 0.05; en caso de que una variable sobrepase esta línea, entonces se considera que tiene un efecto significativo. De todos los datos, solo el TE y la variable %MeOH superaron p = 0.05.
Tabla 2 Coeficientes de ajuste entre la D y los valores de las variables del diseño según la función D = a 0 + a 1 X+ a 2 Y, en el caso de la optimización de la preparación de muestra.
| Variable X | Variable Y | a0 | a1 | a2 |
| Peso de muestra | % Metanol | 0.2383 | -0.0811 | 0.0113 |
| Vol. extracción | % Metanol | -0.4878 | 0.0281 | 0.0114 |
| Vol. extracción | t. Sonicación | 0.6435 | 0.0283 | -0.0188 |
| % Metanol | t. Sonicación | 0.3575 | 0.0113 | -0.0186 |
| t. Sonicación | Peso de muestra | 1.3714 | -0.0187 | -0.0816 |
| Peso de muestra | Vol. extracción | 0.5263 | -0.0813 | 0.0281 |
Donde Vol: Volumen, %: Porcentaje y t: tiempo
Fuente: Elaboración propia.
Optimización de la extracción por cartucho de SPE en suelo
Posteriormente a la optimización del pretratamiento de la muestra, se optimizó la extracción de los plaguicidas mediante SPE. Se aplicó un diseño de experimento factorial fraccionado a dos niveles y con cuatro factores. Se consideraron factores que afectaban el proceso de SPE, como es el caudal de muestra (mL/min) a través del cartucho de SPE, las condiciones del cartucho (húmedo o seco), el volumen de elución (mL) y el tipo de elución de metanol (gravedad o vacío); para cada factor se propuso un valor mínimo y un valor máximo de operación. La matriz de experimentos en la Tabla 3 muestra la combinación de factores con sus respectivos niveles para cada uno de los experimentos.
Tabla 3 Matriz del diseño de experimento para la optimización de la extracción por SPE en suelo.
| Experimento | Matriz de trabajo | |||
| Caudal muestra (mL/min) | Condiciones del cartucho | Volumen elución (mL) | Tipo de elución | |
| 1 | 1.5 | Húmedo | 3 | Gravedad |
| 2 | 3 | Húmedo | 3 | Vacío |
| 3 | 1.5 | Seco | 3 | Vacío |
| 4 | 3 | Seco | 3 | Gravedad |
| 5 | 1.5 | Húmedo | 5 | Vacío |
| 6 | 3 | Húmedo | 5 | Gravedad |
| 7 | 1.5 | Seco | 5 | Gravedad |
| 8 | 3 | Seco | 5 | Vacío |
Fuente: Elaboración propia.
Se obtuvo el área de pico de cada plaguicida como la respuesta para cada experimento. Las respuestas se sometieron a un análisis estadístico en términos de la D mediante el software STATISTICA para generar las gráficas de superficie de respuesta. En la Figura 4, los gráficos de superficies muestran la D vs. combinaciones de respuestas dos factores. Las condiciones óptimas para la SPE fueron: caudal de la muestra en 3 mL/min, cartucho para su extracción es mejor seco, volumen de elución de 3 mL de metanol y tipo de elución por efecto de la gravedad (1 mL/min). En la Tabla 4 se muestran los coeficientes de ajuste entre la ecuación de deseabilidad D=α 0 +α 1 X+α 2 Y, así como también los valores de las variables del diseño. También se realizó un análisis de Pareto para determinar qué factor influye más en los resultados. De este análisis, se puede concluir que el factor que más influye en los resultados es el volumen de elución, seguido del caudal de muestra, en menor grado las condiciones del cartucho (húmedo o seco), y el que menos influye es el tipo de elución. En ninguno de los casos se superó p = 0.05.
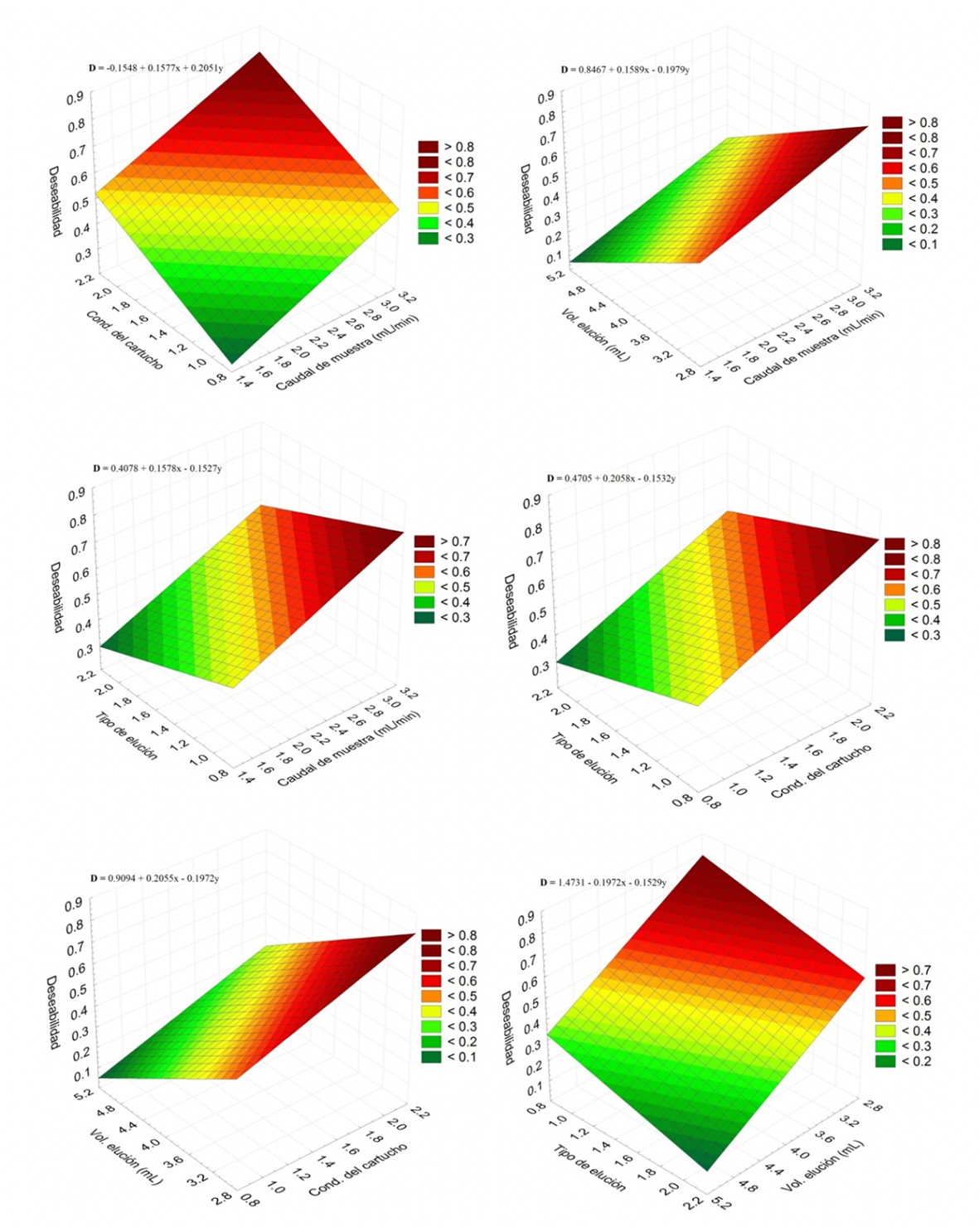
Fuente: Elaboración propia.
Figura 4 Superficie de respuesta de la D (eje Z) vs. los cuatro factores (ejes X e Y) para optimización de la extracción por cartucho de SPE.
Tabla 4 Coeficientes de ajuste entre la D y los valores de las variables del diseño según la función D=a0 + a1·X+ a2·Y, en el caso de la optimización del SPE.
| Variable X | Variable Y | a0 | a1 | a2 |
| Caudal de muestra | Cond. del cartucho | -0.1548 | 0.1577 | 0.2051 |
| Caudal de muestra | Vol elución | 0.8467 | 0.1589 | -0.1979 |
| Caudal de muestra | Tipo de elución | 0.4078 | 0.1578 | -0.1527 |
| Cond. del cartucho | Tipo de elución | 0.4705 | 0.2058 | -0.1532 |
| Cond. del cartucho | Vol elución | 0.9094 | 0.2055 | -0.1972 |
| Vol elución | Tipo de elución | 1.4731 | -0.1972 | -0.1529 |
Donde Vol: Volumen, Cond: condiciones
Fuente: Elaboración propia.
Efecto matriz del suelo
El efecto matriz (EM) fue calculado aplicando la ecuación 1 ya descrita en la metodología. Para ambas calibraciones se analizaron las siguientes concentraciones 0.5 mg/kg, 1.0 mg/kg, 2.0 mg/kg, 4.0 mg/kg y 5.0 mg/kg. En la Tabla 5 se muestran los datos de EM en las muestras de suelo. Entre más lejano a 100% sea el valor obtenido de la ecuación, es necesaria la aplicación de calibración con adición patrón para corregir el error asociado al efecto matriz. Se puede observar que únicamente el TE no mostró mayor efecto matriz (EM = 96.9 %). Sin embargo, el resto de los plaguicidas sí mostraron un efecto matriz importante, esto implica que es mandatorio hacer una calibración tipo adición patrón para compensar dicho efecto matriz en las determinaciones.
Validación del método
La selectividad del método se evaluó mediante inspección visual, comparando los cromatogramas de disolución patrón (Figura 2), la muestra de suelo en blanco (Figura 5a) y los cromatogramas de muestra de suelo con plaguicidas añadidos a 5 mg/kg (Figura 5b). Como puede verse en estas figuras, no se detectan interferencias que afecten a la determinación de los compuestos bajo estudio en muestras de suelo. Además, se llevó a cabo un proceso de detección e identificación basado en los tiempos de retención y mediante el DAD utilizado (Logan, 1994). Los tiempos de retención para CB, DI, PR, DC, CH y TE bajo las condiciones asociadas con la Figura 1 fueron 6.1 min, 7.7 min, 9.3 min, 10.2 min, 13.6 min y 16.6 min, respectivamente, y sus desviaciones estándar relativas (RSD) (n = 6) fueron inferiores al 2.5% para cada uno. El espectro ultravioleta-visible (UV-Vis) de cada pico en el cromatograma se almacenó y, posteriormente, se comparó con los previamente obtenidos de los estándares. Los espectros se normalizaron y se superpusieron. Las impurezas fueron investigadas adicionalmente, mostrando los espectros obtenidos en diferentes puntos a través del pico. Derivado de los resultados, se puede concluir que el método propuesto es adecuado para el análisis.
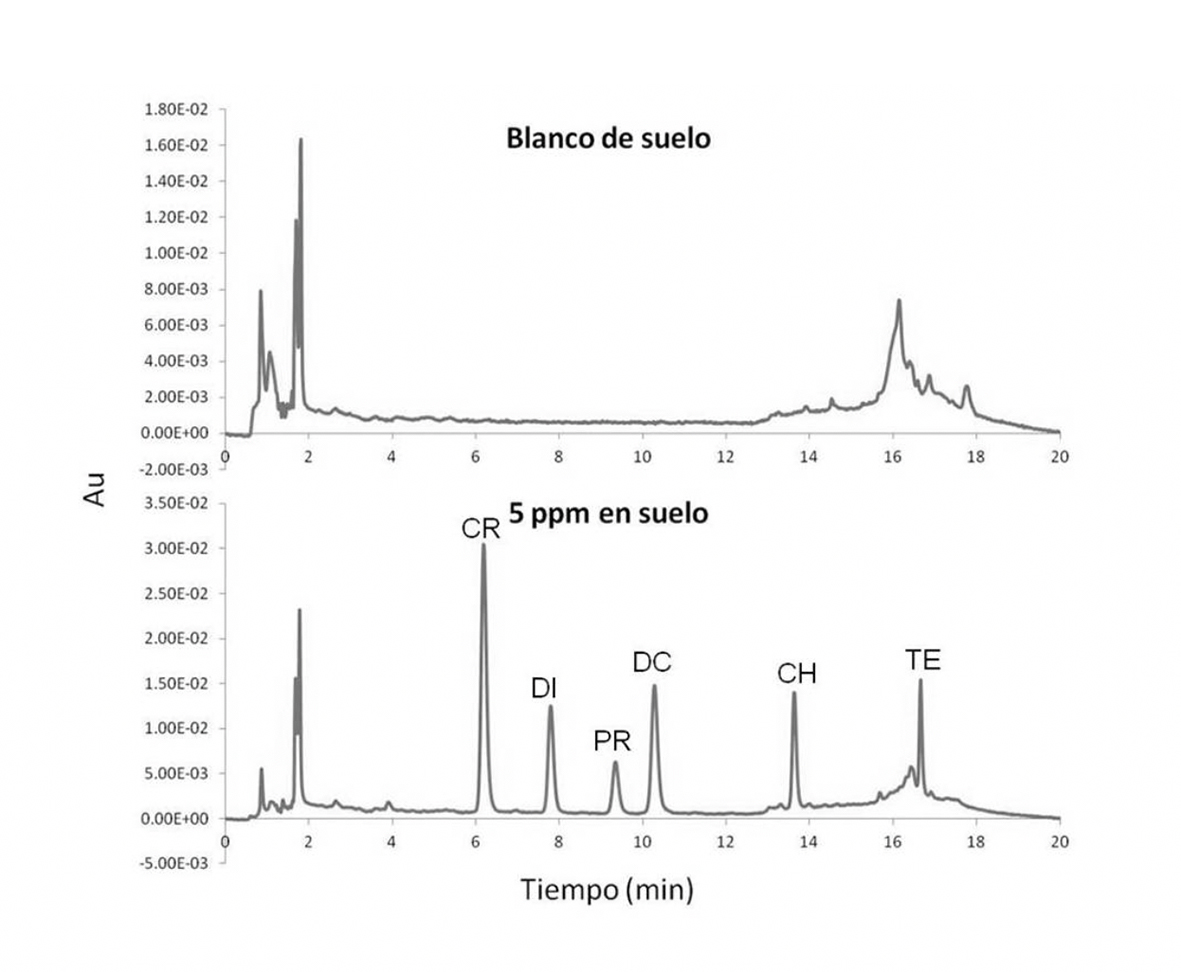
Fuente: Elaboración propia.
Figura 5 Cromatogramas HPLC-DAD de a) muestras blanco de suelo y b) muestras de suelo añadidas a 5 mg/kg.
La linealidad se evaluó por medio de plaguicidas añadidos a la matriz a cinco niveles de concentración por triplicado. Para este propósito, se construyeron las curvas de calibración, añadiendo de 0.5 mg/kg - 5 mg/kg de plaguicidas a muestras de suelo, tal y como se describe en la sección Muestras de suelo añadidas. Los resultados se analizaron representando el área bajo el pico como respuesta contra la concentración. En la Tabla 6 se muestran los coeficientes de correlación lineal (r), la pendiente y la ordenada para cada analito bajo estudio.
Tabla 6 Resultados de linealidad, LD y LC y recuperación en muestras de suelo.
| Plag | Linealidad (y = mx + b) | LD (mg/kg) (%CV) |
LC (mg/kg) (%CV) |
Recuperación (%) (%CV) mg/kg |
||||
| m | b | r | 1 | 2 | 4 | |||
| CB | 16 328 | -13 | 0.997 | 1.4 | 4.6 | 97 (15) | 109 (12) | 103 (6) |
| DI | 6596 | 694 | 0.997 | 1.6 | 5.4 | 103 (8) | 106 (6) | 105 (6) |
| PR | 2652 | 139 | 0.991 | 1.3 | 4.3 | 90 (13) | 112 (11) | 101 (8) |
| DC | 10 112 | -477 | 0.993 | 1.6 | 5.2 | 91 (16) | 113 (15) | 102 (15) |
| CH | 5807 | -100 | 0.997 | 1.8 | 6.0 | 95 (7) | 112 (6) | 104 (4) |
| TE | 5266 | 139 | 0.993 | 1.5 | 3.3 | 121 (9) | 86 (9) | 104 (5) |
m: Pendiente, b: ordenada, r: coeficiente de correlación lineal, LD: Límite de detección, LC: límite de cuantificación, %CV: porcentaje de coeficiente de variación.
Fuente: Elaboración propia.
Para calcular el LD y LC se utilizó la ecuación descrita anteriormente y se analizaron 18 muestras blanco de muestras de suelo en la ventana de tiempo en la que se esperan los plaguicidas. Como se muestra en la tabla 6, los LD y LC estuvieron en el rango de 1.3 mg/kg - 1.8 mg/kg y 3.3 mg/kg - 6.0 mg/kg, respectivamente. Los límites reportados con técnicas cromatográficas acopladas a detectores más específicos y selectivos (por ejemplo., detector de captura de electrones -ECD-, detector de nitrógeno-fosforo -NPD-, espectrometría de masas -MSD-, etc) están en el orden de cientos de µg/kg. Estas técnicas tienen la desventaja de ser costosas en su operación y mantenimiento y, por lo tanto, no se encuentran fácilmente en todos los laboratorios. Sin embargo, la técnica HPLC-DAD es relativamente barata y se encuentra más fácilmente en los laboratorios analíticos. Cabe resaltar que los límites reportados en este trabajo están dentro de lo esperado, comparados con los encontrados en la literatura.
La exactitud del método se calculó como recuperación de los plaguicidas en tres concentraciones diferentes (n = 18). Los niveles de fortificación bajos, medios y altos fueron 1 mg/kg, 2 mg/kg y 4 mg/kg, respectivamente. Los valores de recuperación se obtuvieron usando la ecuación (% R = concentración encontrada / concentración añadida × 100). Como puede verse en la tabla 6, la recuperación obtenida fue de 86% a 121%. Estos valores se consideran aceptables para este parámetro de acuerdo con la guía de validación 2002/657/CE de la Comisión Europea.
Aplicación del método
El método desarrollado se aplicó a muestras de suelo. Para determinar su aplicabilidad, se realizó un estudio de efecto matriz como el descrito anteriormente. Los resultados en la Tabla 7 indican que hay un efecto matriz bajo. Por lo tanto, el método se puede considerar aplicable a muestras de suelo.
Conclusiones
Se desarrolló un método analítico utilizando el sistema HPLC-DAD para el análisis simultáneo de plaguicidas (CB, DI, PR, DC, CH y TE). La separación cromatográfica se logró empleando la columna Tracer Excel 120 ODSA a 25 °C y fase móvil binaria de Acetonitrilol: Agua en gradiente a 1.0 mL/min. Bajo estas condiciones, los seis plaguicidas evaluados se separaron a línea base en alrededor de 17 min. La separación fue aplicada a muestras de suelo. Con este objetivo, se optimizó el pretratamiento y la extracción en fase sólida (SPE) para ambas optimizaciones se aplicó un diseño de experimentos factorial fraccionado mediante un programa estadístico. Las condiciones óptimas fueron definidas en base a las gráficas de superficies de respuesta de la D vs. combinaciones de respuestas dos factores. Una vez optimizado, el método se validó de acuerdo con normas internacionales, evaluándose la selectividad, linealidad, límite de detección y cuantificación, así como exactitud. Finalmente, el método se aplicó a muestras de suelo, obteniéndose bajo efecto matriz. Considerando estas características, el método podría ser aplicado en otros laboratorios para determinación de estos contaminantes en matrices de suelo. También puede ser un de punto de partida para ser modificado y aplicado a otro tipo de muestras y/o un mayor número de analitos.











 text new page (beta)
text new page (beta)



