INTRODUCCIÓN
En la industria minero metalúrgica la producción de grandes cantidades de residuos genera un grave impacto ambiental (Reuter et al. 2004). Las escorias son uno de estos residuos, cuya composición depende tanto del mineral del que se extrae el metal como de las temperaturas utilizadas en el proceso (Ros-Latienda y Fernández-Carrasquilla 2013). Dichas escorias están compuestas principalmente por silicatos, metales y óxidos de calcio, manganeso, hierro y magnesio (Fu-Shen y Hideaki 2005, Oh et al. 2012). Actualmente estos residuos no tienen uso ni mercado, pero se han comenzado a utilizar como relleno en construcción de viviendas, edificios y carreteras; no obstante, existen restricciones legales que limitan su uso en este sector (Guo et al. 2018). Debido a que estos residuos se generan en grandes cantidades (alrededor de 220 a 370 kg/ton de mineral procesado) (Mercado-Borrayo et al. 2018) y a que son estables en un amplio intervalo de temperatura, pueden ser materiales ideales para el tratamiento de agua (Ali et al. 2012), siempre que se demuestre que no liberan nuevos contaminantes al ambiente.
El tratamiento de aguas contaminadas con arsénico es uno de los retos más importantes (Briones y Razo 2008). Este metaloide existe en distintas formas químicas, con diferentes propiedades físicas y químicas y toxicidades (Ronkart et al. 2007). En el agua el arsénico se encuentra principalmente como As (V) (arsenato) y As (III) (arsenito) (Jain et al. 1999). El arsenato prevalece en ambientes oxidantes y el arsenito en condiciones reductoras; sin embargo, debido a la lenta cinética de transformación redox, se han encontrado simultáneamente ambas especies en condiciones comprendidas entre 200 y 500 mV y pH alcalino (Masscheleyn et al. 1991). Ambas son consideradas carcinogénicas, pero el arsenito es más tóxico, soluble, móvil y difícil de remover o inmovilizar (Raven et al. 1998, Naidu et al. 2006, Zhang et al. 2014, Folens et al. 2016). El arsenito en disolución acuosa es estable como H3AsO3 en un intervalo de pH de 0 a 9. Debido a su ausencia de carga, es poco probable que forme compuestos con calcio o con otros elementos (Fu-Shen y Hideaki 2005). Algunas de las técnicas más utilizadas en su remoción son: flotación (Matis et al. 1997), precipitación (Harper y Kingham 1992), electrocoagulación (Mohora et al. 2012), filtración (Wickramasinghe et al. 2004) e intercambio iónico (An et al. 2011); no obstante, estas técnicas son usualmente caras y tienen mejores rendimientos para remover As (V), de manera que para remover As (III) se requiere una oxidación previa (Genc-Fuhrman et al. 2004, Boddu et al. 2008, Chakraborty et al. 2014, Rahman et al. 2014).
La adsorción es una técnica mediante la cual se controla la movilidad del contaminante (Raven et al. 1998). Debido a su elevada eficiencia y fácil operación, es una de las más utilizadas en la remoción de As (III) (Folens et al. 2016). Se han estudiado diferentes materiales para este fin, como lodo rojo (Genc-Fuhrman et al. 2004), carbón activado (Lorenzen et al. 1995) y arcillas (Frost y Griffin 1977). Se ha demostrado la importancia de encontrar adsorbentes eficientes, de fácil acceso y de bajo costo. Recientemente se han utilizado óxidos de hierro (Pillai et al. 2020), nanocompuestos magnéticos (Ramos et al. 2018) y oxihidróxidos amorfos de hierro (Zhang et al. 2019, Rawat y Maiti 2021). Se ha demostrado que estos materiales tienen la capacidad de remover al arsenito sin liberar contaminantes por lixiviación en un intervalo de pH desde 2.5 hasta 12.5 (Fu-Shen y Hideaki 2005, Guo et al. 2007, Rahman y Yanful 2010, Qi y Pichler 2014). La eficiencia de los oxihidróxidos de hierro como adsorbentes de arsenito se basa en el contenido de hierro, ya que éste forma complejos con el metaloide (Atmatzidis et al. 2020). Se ha reportado que las escorias metalúrgicas con alto contenido de hierro tienen la capacidad de retener arsenito acuoso en su superficie (Fu-Shen y Hideaki 2005, Oh et al. 2012, Shi et al. 2017); sin embargo, poco se ha informado sobre el mecanismo de retención.
En algunas zonas mineras como Matehuala (Ruiz-Huerta et al. 2017), Taxco, (Romero et al. 2011) y Zimapán (Armienta et al. 1997), en México, se han encontrado concentraciones de hasta 1 mg/L de arsénico en agua, lo cual puede causar daños a la salud (Chappell et al. 200, Mohammed et al. 2015, Carlín et al. 2016). La finalidad de este trabajo es proponer el uso de materiales generados como residuos de estas mismas zonas minero metalúrgicas para la remoción de arsénico, solucionando al mismo tiempo un problema de contaminación de agua y de gestión de residuos. Además, se plantea el objetivo de elucidar el mecanismo de retención de As (III) presente en aguas contaminadas artificialmente, evaluando cinco escorias metalúrgicas con diferentes propiedades físicas (área superficial y diámetro de poro), composición mineralógica y química.
MATERIALES Y MÉTODOS
Residuos metalúrgicos
Se eligieron cinco escorias con posibilidades de retener As (III) por su estructura porosa y elevado contenido de hierro: escoria de la industria del acero de Coahuila, México (A1); escorias de la industria del acero de distintas plantas localizadas en la Ciudad de México (C1 y N1); escoria de la industria del plomo de San Luis Potosí, México (M1), y escoria de la industria del hierro de Michoacán, México (M2).
Análisis de laboratorio
Cuantificación de As (III)
El As (III) fue determinado por polarografía diferencial de pulsos (PDP) usando HCl 1 M como electrolito de soporte (Myers y Osteryoung 1973). Se trazó una curva de calibración por triplicado para relacionar el área bajo los tres picos obtenidos con la concentración de As (III) desde 0 hasta 10 mg/L. Se realizaron pruebas en el laboratorio y se determinó que las mejores condiciones de trabajo fueron las siguientes: potencial de inicio -0.2 V vs. Ag/AgCl, dirección de barrido (-), velocidad de barrido 10 mV/s, tiempo de goteo 1 s y amplitud de pulso 50 mV.
Caracterización física
El área superficial y el diámetro de poro fueron determinados por la metodología BET en un equipo de fisisorción de nitrógeno marca Bel (Japón) modelo MINI sorp II (Venegas et al. 2007) en el Instituto de Investigaciones en Materiales de la Universidad Nacional Autónoma de México (UNAM). Las escorias fueron activadas con un flujo de N2 a 200 ºC y 10-2 kPa por 24 h (Somlai et al. 2008, Tang et al. 2015, Shi et al. 2016). Finalmente se determinó el área superficial de las escorias por adsorción de N2 a 77 K.
La carga superficial de las escorias en suspensión acuosa se determinó con un equipo marca Zeta-meter, modelo 3.0+ suspendiendo 50 mg de la escoria en 40 mL de agua destilada. El pH se ajustó entre 3 y 11 con HCl o NaOH 0.1 M. Cada medición se realizó por triplicado.
Caracterización química
La composición de las escorias fue determinada por triplicado por fluorescencia de rayos X (FRX) con un equipo portátil marca Nitton, modelo XL3t Ultran en el Instituto de Geología de la UNAM.
Para determinar si estas escorias liberan algún contaminante al ambiente, se realizaron pruebas de lixiviación con agua al pH natural que imponen las escorias (aproximadamente 9), a pH neutro (7) y al pH mínimo, que por norma pueden tener los efluentes industriales (pH = 5) (SEMARNAT 1998). Estas lixiviaciones se realizaron con base en el método ASTM D3987-12 (ASTM 2020). Posteriormente se llevó a cabo la determinación de elementos por espectrometría de emisión atómica (ICP-OES) usando el método EPA 6010D (US-EPA 2018) en un equipo marca Agilent Technologies, modelo 5100 en la Facultad de Química de la UNAM.
Caracterización mineralógica
Las fases cristalinas presentes en las escorias fueron evaluadas por duplicado por difracción de rayos X (DRX) en un equipo marca Siemens, modelo D5000 en el Instituto de Geología de la UNAM.
Los análisis por espectroscopía infrarroja (IR) se realizaron por triplicado con un equipo marca Perkin Elmer, modelo Spectrum 2000 Explorer en la Facultad de Química de la UNAM. Se utilizó la técnica de pastilla de KBr y las lecturas se hicieron en un intervalo de 400 a 4000 cm-1.
Remoción de As (III)
Se prepararon sintéticamente muestras de agua contaminadas a partir de una disolución estándar de As (III) de 1000 mg/L preparada a partir de As2O3 (Sigma Aldrich) de grado reactivo, el cual fue disuelto en 25 mL de NaOH al 20 %, seguido de una neutralización con HCl 1 M (Cordos et al. 2015). Las pruebas de remoción de As (III) se realizaron con las cinco escorias al pH natural que impone el material (aproximadamente nueve) usando un diseño de experimentos 2k, cuya utilidad radica en que permite conocer la forma en que distintas variables afectan al fenómeno en estudio, lo cual se logra con pocos experimentos (Kavak 2009, Bingol et al. 2010). Las variables estudiadas y sus respectivos niveles bajos y altos fueron: cantidad de escoria (50-250 mg), concentración inicial de As (III) (3-10 mg/L) y tiempo de agitación (15-60 min). La cantidad de escoria correspondiente se mezcló con 20 mL de agua destilada y la cantidad de As (III) necesaria para la concentración deseada. La muestra se agitó por el tiempo indicado en el diseño de experimentos y posteriormente se filtró. A la fase líquida remanente se le agregaron 5 mL de HCl 5 M y el As (III) se cuantificó por PDP. En el diseño de experimentos se realizaron réplicas genuinas, obteniéndose un total de 80 experimentos.
Para corroborar que el As (III) no se oxida a As (V) (especie no electroactiva) ni se pierde en el proceso, se prepararon blancos adicionados que se agitaron por 1 h en condiciones de atmósfera abierta, simulando así condiciones ambientales reales. En ningún caso se observó que la concentración de As (III) disminuyera.
Análisis por DRX y espectroscopía IR de la escoria antes y después de fijar arsénico
Para estos estudios se agregó la alícuota correspondiente de una disolución estándar de As (III) de 1000 mg/L a una suspensión de 250 mg de la escoria que presentó mayores porcentajes de remoción (C1) en 20 mL de agua destilada, para tener así 200 mg/L del contaminante. La mezcla se agitó durante una hora, se filtró y el sólido con el arsénico retenido se analizó por DRX y espectroscopía IR para identificar cambios en las fases cristalinas o en las vibraciones de los grupos funcionales.
Cinética de adsorción
Para realizar los estudios cinéticos y obtener las isotermas de adsorción se pesaron 250 mg de la escoria C1, los cuales se mezclaron con 20 mL de agua destilada y la alícuota necesaria para obtener concentraciones de arsénico de 3, 5, 10 y 15 mg/L, ya que se buscó emular condiciones extremas similares a las que se podrían obtener en situaciones reales, en las que se han reportado concentraciones de As (III) de hasta 20 mg/L (Ongley et al. 2001, Armienta et al. 1997, Carrillo y Drever 1998a). Las muestras se agitaron por tiempos de 1 y 60 min; se filtraron y a la disolución remanente posterior a la fijación de arsénico se le agregaron 5 mL de HCl 5 M (electrolito soporte) para analizarse por PDP. Para todas las muestras se prepararon réplicas genuinas incluyendo blancos.
RESULTADOS Y DISCUSIÓN
Análisis de laboratorio
Cuantificación de arsénico
En la figura 1 se muestran los polarogramas obtenidos para el As (III), donde pueden observarse tres señales, una en -0.48, otra en -0.68 y la tercera en -0.88 V vs Ag/AgCl. Estas señales son características de la reducción de As3+ a As0, de As0 a As3- y otra debida a fenómenos de adsorción (Myers y Osteryoung 1973). Se trazaron por triplicado curvas de calibración para establecer el intervalo de concentraciones en el cual el área bajo la curva que abarca las tres señales observadas es proporcional a la concentración de arsénico. Estas curvas de calibración siempre tuvieron coeficientes de regresión lineal superiores a 0.98 y se muestran en la figura 1.
Caracterización física
El área superficial de las escorias está comprendida entre 1.6 y 10 m2/g (Cuadro I), la cual es considerablemente menor que la de la mayoría de los adsorbentes comerciales como el carbón activado (800-1200 m2/g) (Cho et al. 1979), las zeolitas (100-900 m2/g) (Yates 1968) o el gel de sílica (300- 750 m2/g) (Christy 2008). Sin embargo, éste no es el único factor que determina la capacidad de un material para remover algún contaminante (Li et al. 2010). El diámetro de poro detectado mide entre 6.5 y 16.8 nm (Cuadro I), dato que clasifica a las escorias como materiales mesoporosos (Mercado 2013). El radio termoquímico de las especies de As (III) es de 0.48 nm para H2AsO3 - y H3AsO3 (Mercado 2013), menor que el diámetro de poro de las escorias, lo que hace posible la difusión de arsénico a los sitios activos al interior del material, incrementando así el porcentaje de remoción y disminuyendo el tiempo necesario para que la sorción ocurra (Xu et al. 2013).
CUADRO I CARACTERÍSTICAS FÍSICAS DE LAS ESCORIAS.
| Escoria | Área superficial (m2/g) | Diámetro de poro (nm) | Punto de carga cero (pH) |
| A1 | 9.40 | 8.93 | 5.2 |
| C1 | 5.53 | 7.57 | 5.5 |
| M1 | 10.08 | 6.56 | 5.5 |
| M2 | 1.60 | 16.86 | 5.8 |
| N1 | 2.57 | 16.09 | 4.5 |
A1: escoria de la industria del acero de Coahuila, México; C1 y N1: escorias de la industria del acero en la Ciudad de México; M1: escoria de la industria del plomo de San Luis Potosí, México, y M2: escoria de la industria del hierro de Michoacán.
En el cuadro I se muestra que todas las escorias tienen un punto de carga cero muy cercano a 5.5, excepto N1, cuyo punto de carga cero es 4.5. Cuando las escorias se suspenden en agua, el pH resultante es cercano a 9, valor de pH en que la carga superficial promedio de los materiales es negativa. Cabe señalar que el resultado del punto de carga cero corresponde a la mineralogía predominante, pero existe la posibilidad de que en los sitios con presencia de hierro la carga superficial sea distinta. Por otra parte, un pH de 9 es cercano al primer pKa del H3AsO3 (9.2), por lo que, en disolución, el As (III) existe casi en la misma proporción como H3AsO3 y H2AsO3 -.
Se ha reportado que la atracción electrostática no es un factor determinante en el proceso de fijación del arsénico por formación de complejos con los oxihidróxidos de hierro (Manning y Goldberg 1997, Fu-Shen y Hideaki 2005, Guo et al. 2007, Rahman y Yanful 2010, Qi y Pichler 2014, Zhang et al. 2014). Se han obtenido diagramas de distribución de especies para algunos oxihidróxidos de hierro eficientes en la remoción de As (III), y a pH mayor a 9 estos materiales también tienen carga superficial neutra o negativa, al igual que las escorias metalúrgicas. Además, se ha demostrado que los porcentajes de remoción de As (III) son independientes del pH del medio en un intervalo de 2.5-12.5 (Su y Puls 2001, Farrell y Chaudhary 2013).
Caracterización química
Los principales elementos determinados por FRX presentes en las escorias son: calcio, hierro, silicio, manganeso, aluminio y magnesio (Cuadro II). Estos elementos están presentes en muchos de los adsorbentes comerciales más utilizados (Grace et al. 2016). A1 y N1 contienen mayoritariamente calcio, mientras que C1 y M1 contienen silicio y M2 principalmente hierro. Esta técnica solamente indica la proporción en la que se encuentran estos elementos, pero no su especie química. Conocer la mineralogía es particularmente importante para saber si los elementos presentes en la escoria están disponibles para reaccionar o no (Ros-Latienda y Fernández-Carrasquilla 2013).
CUADRO II CARACTERIZACIÓN QUÍMICA DE LAS ESCORIAS METALÚRGICAS.
| Técnica | Masa (%) | A1 | C1 | M1 | M2 | N1 |
| Fluorescencia de rayos X (concentraciones totales) | MgO | 7.7 | 3.6 | ND | 8.17 | 4.4 |
| Al2O3 | 11.4 | 13 | 5.5 | 8.5 | 4.5 | |
| SiO2 | 34.8 | 50.1 | 36.8 | 15.8 | 14 | |
| CaO | 40.2 | 3.8 | 22.7 | 22.9 | 44.4 | |
| Fe2O3 | 1.4 | 24.2 | 27.5 | 42.8 | 24.7 | |
| Elemento (mg/L) | A1 | C1 | M1 | M2 | N1 | |
| Espectrometría de emisión atómica (concentraciones lixiviables) | Ag | ND | ND | ND | ND | ND |
| Al | 21.3 | 8.12 | 6.44 | 91 | 57.5 | |
| As | 0.71 | ND | 1.8 | ND | ND | |
| B | 0.84 | 0.84 | 0.28 | 1.82 | 7.84 | |
| Ba | 1.12 | 0.42 | 1.68 | 1.26 | 92 | |
| Cd | ND | 0.15 | 0.14 | ND | ND | |
| Cr | 0.27 | 0.29 | 0.29 | 0.26 | 0.26 | |
| Fe | 1.54 | 0.98 | 9.8 | ND | 1.26 | |
| Mg | 7 | 38 | 13.5 | 2.5 | 3 | |
| Mn | 0.14 | 0.42 | 12.5 | ND | ND | |
| Pb | 0.55 | 0.46 | 0.38 | 0.5 | 0.02 | |
| Si | 130 | 67 | 53 | 101 | 11 |
A1: escoria de la industria del acero de Coahuila, México; C1 y N1: escorias de la industria del acero en la Ciudad de México; M1: escoria de la industria del plomo de San Luis Potosí, México; M2: escoria de la industria del hierro de Michoacán; ND: no detectado.
Como resultado del análisis por DRX, en el cuadro III se muestra que las escorias M1 y M2 están compuestas principalmente por minerales de fosfato y M2 tiene también minerales de calcio. Por FRX se concluye que A1 y N1 contienen principalmente calcio. Cuando la remoción de arsenito ocurre vía formación de complejos o interacción con el hierro, los materiales con altos contenidos de calcio o fosfato no son la mejor opción para realizar el proceso, ya que estas especies compiten con el As (III) al formar un complejo monodentado de esfera interna con los hidróxidos de hierro (Su y Puls 2001). A partir de esta información se puede predecir si una escoria es un material viable para el tratamiento de aguas contaminadas con arsénico.
CUADRO III FASES MINERALÓGICAS PRESENTES EN LAS ESCORIAS.
| Escoria | Fase mineralógica |
| A1 | Akermanita |
| C1 | SiO2 Fe0.4Mg0.6O |
| M1 | Na2.67K1.33Zn4(PO4)4 |
| M2 | (MgO)0.725(MnO)0.275 Na2Co2Cr(PO4)3 (Ca0.97Zn0.03)2Al0.63Zn0.37)(Si0.69Al0.31)2O7 |
| N1 | Na4Ca4(Si6O18) Ca2MgSi2O7 Ca0.34Sr2.66 (Al2O6) Fe3O4 |
A1: escoria de la industria del acero de Coahuila, México; C1 y N1: escorias de la industria del acero en la Ciudad de México; M1: escoria de la industria del plomo de San Luis Potosí, México; M2: escoria de la industria del hierro de Michoacán; ND: no detectado.
La figura 2 y el cuadro II muestran los elementos lixiviables de las escorias en agua. Aunque se realizaron las pruebas a pH de 9, 7 y 5, sólo se indican las concentraciones más altas obtenidas para cada metal/metaloide. Las columnas de color verde muestran los límites máximos permisibles establecidos por la norma vigente (SEMARNAT 2006). Ninguno de los límites máximos permisibles es superado por las concentraciones de los metales lixiviados. Se puede concluir que las cinco escorias metalúrgicas usadas en este trabajo no son materiales peligrosos en el intervalo de pH de 5 a 9.

Fig. 2 Concentración (mg/L) de los principales contaminantes presentes en los lixiviados de escorias a pH 5, 7 y 9 (sólo se muestran las concentraciones más altas obtenidas). Límites de detección (mg/L): As, 0.04; Cd, 0.06; Ag, 0.06; Pb, 0.05; Se, 0.06; Cr, 0.05. A1 (azul oscuro): escoria de la industria del acero de Coahuila, México; C1 (anaranjado) y N1 (azul claro): escorias de la industria del acero en la Ciudad de México; M1 (gris): escoria de la industria del plomo de San Luis Potosí, México; M2 (ocre): escoria de la industria del hierro de Michoacán.
Caracterización mineralógica
En el cuadro III se muestran las fases cristalinas y los minerales identificados en cada una de las cinco escorias. C1 y N1 son principalmente amorfas (Fig. 3). Generalmente los materiales amorfos funcionan mejor como adsorbentes (Gupta et al. 2003), por lo tanto, se esperan resultados prometedores con estas dos escorias.
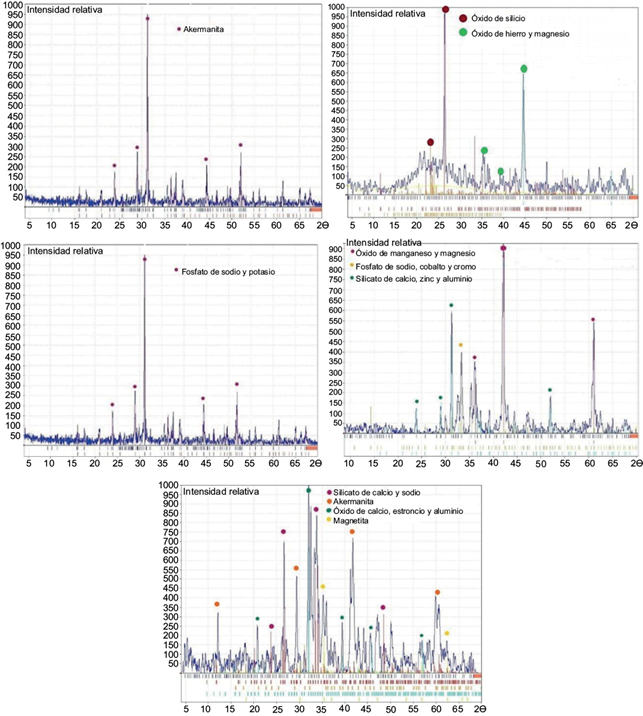
Fig. 3 Difractogramas de las escorias A1, C1, M1, M2 y N1 (interpretación realizada con la base de datos Match!). A1: escoria de la industria del acero de Coahuila, México; C1 y N1: escorias de la industria del acero en la Ciudad de México; M1: escoria de la industria del plomo de San Luis Potosí, México; M2: escoria de la industria del hierro de Michoacán; ND: no detectado.
La mayoría de las fases cristalinas presentes en estos materiales son óxidos, silicatos, fosfatos, carbonatos o sulfatos. C1 es la única escoria con una fase mineralógica relacionada con el Fe como Fe0.4Mg0.6O. Esta fase puede ser importante ya que, de acuerdo con diversos autores como Manning et al. (1998), Jain et al. (1999), Banerjee et al. (2008), Kanematsu et al. (2013) y Mercado-Borrayo et al. (2018), los óxidos, hidróxidos y oxihidróxidos de hierro tienen características que promueven la fijación de arsénico sobre sí mismos. Se sabe que cuando la remoción de As ocurre por este mecanismo de formación de complejos con hierro, la presencia de sulfatos, fosfatos, calcio y magnesio es indeseable (Kanematsu et al. 2013, Xu et al. 2013).
En la figura 4 se muestran los espectros de IR de las cinco escorias. La banda presente en todas las escorias en aproximadamente 3400 cm-1 podría corresponder a los enlaces OH de los oxihidróxidos de hierro (Lee et al. 2018, Ghanbariasad et al. 2019). La escoria C1 presenta esta banda con mayor intensidad, lo que podría suponer una mayor concentración de grupos OH en el material. Las escorias A1, M1, M2 y C1 presentan una banda intensa cerca la banda de 1020 cm-1, característica de SiO2. N1 también presenta esta banda, pero con intensidad media. A1, M1, M2 y N1 tienen dos bandas de intensidad media a fuerte en 1450 y 850 cm-1 atribuidas a CaO. Las bandas cercanas a 480 y 780 cm-1 pertenecen a las vibraciones de Fe2O3 (Manrique et al. 2015). Estas bandas son visibles en la escoria C1 con intensidad media.

Fig. 4 Espectroscopía infrarroja de las escorias A1, C1, M1, M2 y N1. A1: escoria de la industria del acero de Coahuila, México; C1 y N1: escorias de la industria del acero en la Ciudad de México; M1: escoria de la industria del plomo de San Luis Potosí, México; M2: escoria de la industria del hierro de Michoacán; ND: no detectado.
En resumen, debido a la afinidad del arsenito por el hierro y a que cuatro de las cinco escorias tienen hierro en su composición en grandes cantidades, las escorias C1, M1, M2 y N1 podrían funcionar como adsorbentes de arsenito; sin embargo, también debemos considerar que el calcio y los fosfatos compiten con el arsenito.
Remoción de As (III)
En la figura 5 se muestra la influencia de las variables sobre el porcentaje de remoción del contaminante. Modificar el tiempo de agitación de 15 a 60 min solamente aumenta el rendimiento de remoción en un 5 %, siendo así la variable que menos influye en el proceso. Aumentar la cantidad de escoria o la concentración inicial de As (III) (en un intervalo de 3 a 10 mg/L) aumenta el porcentaje de remoción en un 25 %, aproximadamente. Cabe mencionar que, a mayor cantidad inicial de contaminante, mayor probabilidad de que éste encuentre un sitio activo en la escoria. Finalmente, la variable más significativa es la escoria que se utiliza. Se puede observar que C1 es el mejor material, con más del 90 % de remoción (por lo tanto, la discusión de resultados se basa en esta escoria), en tanto que el porcentaje de remoción de las otras cuatro escorias se encuentra alrededor del 20 %. Se atribuye la afinidad de la escoria C1 por el arsenito al elevado contenido de hierro, mientras que el bajo rendimiento del resto de las escorias se atribuye a su alta concentración de calcio y fosfatos.

Fig. 5 Efecto de diferentes variables en la remoción de As (III) obtenidos del diseño de experimentos 2k. A1: escoria de la industria del acero de Coahuila, México; C1 y N1: escorias de la industria del acero en la Ciudad de México; M1: escoria de la industria del plomo de San Luis Potosí, México; M2: escoria de la industria del hierro de Michoacán; ND: no detectado.
Análisis por DRX y espectroscopía IR de la escoria antes y después de fijar As
Se realizaron análisis de DRX de la escoria C1 después de fijar 200 mg/L de As (III). En la figura 6 se muestra el difractograma obtenido de la escoria C1 antes y después de remover As (III). La principal diferencia es que el pico en 45 (escala 2Ɵ) asignado a una fase de Fe0.4Mg0.6O desaparece, lo cual puede deberse a que la fase se modifica en presencia de As o que aparece alguna fase amorfa nueva (Shen et al. 2004).
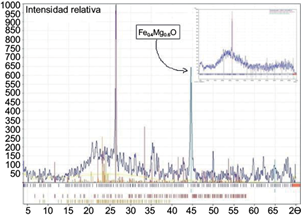
Fig. 6 Difracción de rayos X de la escoria C1 y en la esquina superior derecha y DRX de la escoria C1 con 200 mg/L de As (III). El pico de la fase Fe0.4Mg0.6O desaparece después de remover arsenito. C1: escoria de la industria del acero en la Ciudad de México.
Los modelos vibracionales característicos de estiramiento de los grupos funcionales presentes en las escorias pueden alterarse cuando interaccionan con otras especies; por ello, se analizaron por espectroscopía IR muestras de C1 antes y después de remover 200 mg/L de As (III) (Fig. 7). Con base en la relación de intensidades, se observa que la intensidad de las bandas en 780 y 480 cm-1 (características de las vibraciones del Fe2O3) disminuye después de haber fijado As (III), lo cual indica que hubo interacción entre el arsenito y el hierro del material. Se han reportado en la literatura complejos de esfera interna entre arsenito y oxihidróxidos de hierro a través de enlaces covalentes (Grossl et al. 1997, Otte et al. 2013, Qi y Pichler 2014).
Cinética de adsorción
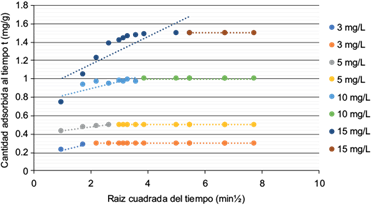
En la figura 8 se presenta la capacidad de adsorción de la escoria (qt) como función del tiempo para distintas concentraciones iniciales de As (III). Se observa que la capacidad de adsorción (mg As (III)/g escoria) aumenta con la concentración inicial y el equilibrio se alcanza después de aproximadamente 10 min de agitación para todas las concentraciones.
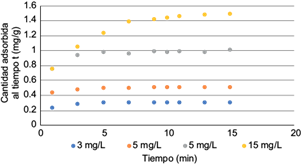
Fig. 8 Cinética de adsorción C1. Gráfico de la cantidad de contaminante adsorbida al tiempo t (mg As (III)/g C1) vs. T (min). C1: escoria de la industria del acero en la Ciudad de México.
Según lo reportado por Murillo et al. (2011) y Vasco y Betancurt (2014), para obtener información acerca de la interacción adsorbato-adsorbente como la capacidad de adsorción del material, los modelos más comunes para procesar los datos son los que se explican a continuación.
Modelo de Lagergren
Considera a la transferencia de masa como el paso controlador del proceso y es descrito por la ecuación 1:
A partir de la integración de esta ecuación en los límites q = 0, t = 0 y q = q e , t = t, se obtiene:
donde k 1 es la constante de velocidad de adsorción de Lagergren (min-1); q t es la cantidad de contaminante adsorbido por masa de adsorbente (mg/g) a un tiempo t, y q e es la cantidad de contaminante adsorbido en el equilibrio (Murillo et al. 2011).
Cuando el valor de R2 es cercano a 1, el modelo tendrá buena concordancia con los datos; sin embargo, es aún más importante que el modelo prediga el valor de q e . En el cuadro IV y la figura 9 se muestra el ajuste al modelo de pseudoprimer orden o de Lagergren. Las concentraciones de 5 y 15 mg/L tienen un coeficiente de determinación (R²) ≈ 1 y se muestran las ecuaciones de la curva para cada concentración. Si q e teórica es 10pendiente, se observa en el que, a pesar de que R² ≈ 1, el modelo no predice el valor experimental de q e , por lo tanto, se concluye que el modelo de pseudoprimer orden no describe el proceso de remoción de As (III) (Cuadro IV).
CUADRO IV CINÉTICA DE ADSORCIÓN. AJUSTE AL MODELO DE PSEUDOPRIMER ORDEN.
| As (III) mg/L | q e experimental (mg/g) | q e teórica (mg/g) | R2 |
| 3 | 0.3 | 0.149 | 1 |
| 5 | 0.5 | 0.794 | 0.991 |
| 10 | 0.98 | 0.092 | 0.494 |
| 15 | 1.48 | 0.12 | 0.989 |
q e : cantidad de contaminante adsorbido por masa de adsorbente.
Modelo de Ho o pseudosegundo orden
Representa la quimisorción y la formación de una monocapa en la superficie. Se utiliza normalmente para describir el comportamiento de las reacciones químicas entre suelo y metales, y se asocia con mecanismos en que la adsorción tiene lugar en más de un sitio activo del adsorbente (Murillo et al. 2011):
donde k 2 es la constante de velocidad de pseudosegundo orden (g/mg/min). Al integrar la ecuación 3 se obtiene:
En la figura 10 se presenta el ajuste al modelo de pseudosegundo orden, donde la pendiente de cada recta representa 1/q e . Todas las rectas obtenidas tienen un coeficiente de regresión lineal muy cercano o igual a 1. Nuevamente se comparan los valores teóricos y experimentales de q e en el cuadro V, donde es claro que el modelo pr
edice correctamente el fenómeno. Por lo tanto, la remoción de As (III) por la escoria C1 ocurre por quimisorción, formando una monocapa en la superficie de la escoria.

Fig. 10 Cinética de adsorción C1. Gráfico de ajuste al Modelo de Ho o pseudosegundo orden. C1: escoria de la industria del acero en la Ciudad de México.
CUADRO V CINÉTICA DE ADSORCIÓN. AJUSTE AL MODELO DE Ho (PSEUDOSEGUNDO ORDEN).
| As (III) (mg/L) | q e experimental (mg/g) | q e teórica (mg/g) | R2 | k 2 (g/mg/min) |
| 3 | 0.3 | 0.3 | 1.000 | 39.39 |
| 5 | 0.5 | 0.5 | 1.000 | 29.22 |
| 10 | 0.98 | 1 | 1.000 | 3.88 |
| 15 | 1.48 | 1.53 | 0.999 | 0.82 |
q e : cantidad de contaminante adsorbido por masa de adsorbente; k 2 : constante de velocidad de pseudosegundo orden.
Mientras que la pendiente de cada recta provee información sobre q e , la ordenada al origen representa:
De esta manera podemos calcular k 2 , que representa la constante de velocidad de pseudosegundo orden (g/mg/min). Los resultados se muestran en el cuadro V. Esta constante de velocidad es mayor a menor concentración inicial de As (III); es decir, la remoción ocurre en menor tiempo si hay menos cantidad de contaminante. Esto se debe a que al incrementarse la concentración de arsenito, la competencia por los sitios activos del material también aumenta.
Difusión intrapartícula
Propone que la difusión del adsorbato tiene lugar en el interior del adsorbente a través de la estructura interna porosa del material. La ecuación que representa este modelo es:
donde k 1 (mg/g/min1/2) es la constante de velocidad para cada fase del proceso, en tanto que Ci está dada por la ordenada al origen y permite estimar el espesor de la capa formada durante la adsorción (Vasco y Betancurt 2014). Si la relación entre q t y t 1/2 es lineal, se puede concluir que la difusión intrapartícula está ocurriendo. Las gráficas pueden analizarse por secciones: la primera etapa describe una adsorción instantánea en la parte externa del material; en la segunda etapa el contaminante viaja a través de los poros del adsorbente y, finalmente, la tercera etapa, que no siempre es detectada, representa el momento en que la difusión comienza a disminuir debido a la baja concentración de adsorbato.
En la figura 11 se muestran los resultados obtenidos para el modelo de difusión intrapartícula, pudiéndose concluir que el fenómeno ocurre en la escoria C1. Se observan dos pendientes para cada concentración, es decir, el arsénico se fija de manera inmediata en la superficie del material, pero también penetra gradualmente.
Isotermas de adsorción
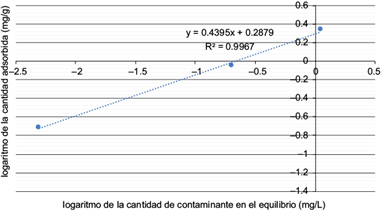
Para conocer la cantidad de contaminante que puede interaccionar con una cantidad de escoria se realizaron isotermas de adsorción, cuyos resultados se evaluaron con los modelos más utilizados en el estudio de remoción de contaminantes como son el Freundlich y el Langmuir (Rivas et al. 2014). Los datos experimentales sólo se ajustan al modelo de Freundlich.
Este modelo, descrito por la ecuación 7, se utiliza para describir la adsorción en sitios heterogéneos, es decir, que el calor de adsorción varía de un sitio a otro.
donde k f es una constante relacionada con la capacidad de adsorción del adsorbente, q es la cantidad de contaminante adsorbida por masa de adsorbente (mg/g), C es la concentración de contaminante en el equilibrio expresada en mg/L y n es una constante relacionada con la capacidad de adsorción del material, cuyos valores son siempre mayores a 1 (un valor entre 2 y 10 es característico de un buen adsorbente) (Rivas et al. 2014).
En la figura 12 se muestra el ajuste de los datos al modelo de Freundlich. Se observa una línea con coeficiente de regresión lineal de 0.997, lo que demuestra que el modelo predice el fenómeno. C1 tiene sitios heterogéneos donde ocurre la fijación de As (III), en tanto que n está dada por el inverso de la pendiente y es 2.28 mg/g, pudiendo compararse con algunas capacidades de adsorbentes emergentes como quitosano (2.32 mg/g) (Gupta et al. 2009), cáscara de almendra (1.33) mg/g (de Gisi et al. 2016), escoria modificada con hierro (3.1) mg/g (Fu-Shen y Hideaki 2005) y nanopartículas de hierro (3.5 mg/g) (Lakshmipathiraj et al. 2006), entre otros. Algunas ventajas del uso de escorias son que no requieren de un tratamiento previo a su uso, que están presentes físicamente en zonas mineras en las cuales la contaminación por arsénico suele ser recurrente y, principalmente, que son materiales considerados residuos, con lo cual se soluciona no sólo un problema de contaminación ambiental sino también de desecho de residuos.
CONCLUSIONES
Las cinco escorias metalúrgicas provenientes de la industria del acero, plomo y hierro analizadas en este trabajo no liberan contaminantes lixiviables al ambiente en un intervalo de pH de 5 a 9 y mostraron capacidad de remover As (III) en disolución acuosa con rendimientos de remoción entre 20 y 97 %. Este porcentaje de remoción depende principalmente de la composición de la escoria.
C1 es la escoria con mejores resultados. Se identificó este material como amorfo, poroso, con un elevado contenido de hierro y ausencia de calcio y fosfatos. La estructura porosa facilita la difusión del As (III) al interior del material, fenómeno que se confirmó mediante la aplicación del modelo de difusión intrapartícula. Por espectroscopía IR se determinó que la intensidad de las bandas cercanas a 480 y 780 cm-1 disminuye cuando la escoria tiene arsenito adsorbido y por DRX se observó que el pico relacionado con Fe0.4Mg0.6O desaparece después de la fijación del As (III). A partir de estas dos evidencias se concluye que el óxido de hierro es el responsable de la fijación del arsenito. La comprobación de que las escorias con mayores porcentajes de calcio y fosfatos en su composición son las que menos remueven arsénico, confirman que el responsable de la fijación es el hierro, ya que cuando hay calcio y fosfatos presentes, éstos forman un complejo monodentado de esfera interna con los hidróxidos de hierro, compitiendo así con el arsénico. Con esta información se infiere que las escorias mesoporosas, con elevado contenido de hierro y baja concentración de fosfato y calcio, pueden remover exitosamente arsenito en disolución acuosa.
La capacidad de adsorción de la escoria C1 es de 2.28 mg/g y es comparable con varios adsorbentes generados a partir de materiales de desecho, los cuales no sólo aportan un avance sustancial en el tratamiento de aguas, sino que también resuelven un problema de gestión de residuos (de Gisi et al. 2016). La principal ventaja de las escorias frente a otros adsorbentes emergentes es el hecho de que no necesitan tratamiento previo a su uso, además de ser residuos generados en las zonas minero metalúrgicas, siendo éstas, lugares en que la contaminación por arsénico es un problema recurrente.
A través de la cinética de adsorción se determinó que el arsenito se remueve por quimisorción, es decir, se forman enlaces covalentes entre el contaminante y los sitios heterogéneos de las escorias.











 text new page (beta)
text new page (beta)