INTRODUCCIÓN
Argentina es el principal exportador mundial de aceite y harina de soja y el tercer proveedor mundial de la oleaginosa en grano (FAO 2013). La superficie total cultivada con soja creció alrededor del 50 % en los últimos 30 años, ocupando la mitad del área sembrada del país (GEA 2013).
Sumado a este incremento de las superficies cultivadas de soja en detrimento de otros cultivos y de la producción láctea, en las últimas décadas se ha provocado un crecimiento notable de los volúmenes de plaguicidas empleados, especialmente del herbicida glifosato (Vila-Aiub et al. 2008, Di Fiori et al. 2012).
Uno de los problemas del uso de plaguicidas es el posible impacto sobre las poblaciones humanas expuestas directa o indirectamente a la acción de estos agentes tóxicos. Los plaguicidas, al igual que muchas otras sustancias químicas, son potenciales generadores de daño genético. En esa dirección, existe suficiente evidencia basada en consideraciones mecanísticas para afirmar que los agentes genotóxicos son potencialmente cancerígenos, y se ha establecido una correlación positiva entre individuos expuestos a estas sustancias, ya sea de forma ocupacional o accidental, y el incremento del riesgo de padecer cáncer (De Marini et al. 1989, IARC 1991, Solans y Hernández 2000, Bolognesi 2003).
Todas las poblaciones tienen, en mayor o menor grado, riesgo de exposición a plaguicidas, ya sean los de uso agrícola, los que se utilizan en otro ámbito e incluso mediante residuos químicos en los alimentos (Sailaja et al. 2006). De aquí la importancia de evaluar el potencial genotóxico de estas sustancias a través de biomarcadores como aberraciones cromosómicas, micronúcleos, intercambio de cromátidas hermanas o el ensayo cometa (Aiassa et al. 2012).
El ensayo cometa es un método sencillo, rápido y de alta sensibilidad para detectar niveles bajos de daño al ADN en células individuales. En la última década ha sido un método para evaluar a nivel de ADN, con aplicaciones en epidemiología molecular y monitoreo humano, comprobación de genotoxicidad, ecotoxicología, así como en la investigación básica de daño y reparación del ADN (Collins et al. 2004).
Asimismo, el efecto tóxico en la mayoría de los plaguicidas es causado mediante mecanismos de estrés oxidante, produciéndose la alteración del estado de reducción oxidación (redox), según Astiz et al. (2009).
El glifosato es el principio activo de Roundup®, el herbicida de amplio espectro post-emergencia más empleado en todo el mundo. En la Argentina se utilizan casi 200 millones de L de distintas formulaciones de glifosato sobre unas 19 millones de hectáreas por año, principalmente asociadas al cultivo de soja transgénica (Paganelli et al. 2010). La preocupación en gran parte de la comunidad científica en la actualidad, se centra en los efectos que la exposición al glifosato, y fundamentalmente a cualquiera de sus formulaciones comerciales pudiera tener en la salud animal y humana a largo plazo, incluyendo el potencial genotóxico de este plaguicida. En este sentido, los resultados obtenidos por el grupo de Robert Bellé, demuestran que Roundup® y otras formulaciones comerciales conteniendo glifosato podrían representar un riesgo a largo plazo debido a su capacidad de producir una disfunción de la división celular, retrasando la activación del complejo ciclina B/CDK1. Los autores sostienen que estas alteraciones en el control del ciclo celular llevan a una inestabilidad genómica que podría resultar en el desarrollo de una neoplasia a partir de la célula afectada (Marc et al. 2002, 2003 y 2004). Asimismo, la capacidad del herbicida glifosato de interactuar con el material genético ha sido reportada por una gran cantidad de investigadores en todo el mundo en diversos diseños experimentales, in vivo e in vitro (Rank et al. 1993, Bolognesi et al. 1997, Benachour et al. 2007, Lioi et al. 1998, Monroy et al. 2005, Mañas et al. 2006, Paz-y-Miño et al. 2007, Mañas et al. 2009a, Mañas et al. 2009b). Es importante resaltar que el potencial de una sustancia para inducir el desarrollo neoplásico podría relacionarse a la capacidad de la misma para actuar sobre el material genético en forma adversa, es decir a su genotoxicidad (Albertini et al. 2008).
Si bien algunos autores reportan alteraciones en el balance oxidante causadas por la exposición a glifosato o alguna de sus formulaciones comerciales (Astiz et al. 2009, Beuret et al. 2005, El-Shenawy 2009), existen pocas investigaciones sobre la relación entre exposición a glifosato y generación de estrés oxidante, y mucho menos la participación de la injuria oxidante en la génesis del daño genético.
En este estudio se evaluó el potencial genotóxico de una formulación comercial de glifosato (glifosato II-Atanor®, glifosato 43.8 %) por medio del ensayo cometa, y se determinó la concentración de especies reactivas al ácido tiobarbitúrico (TBARS), para cuantificar la peroxidación lipídica, proceso que ocurre bajo condiciones de estrés oxidante.
MATERIALES Y MÉTODOS
Ensayo cometa en leucocitos humanos
Obtención de las muestras de sangre
Se obtuvo sangre periférica de tres donadores sanos de 24, 27 y 30 años, no fumadores, sin exposición laboral a agroquímicos, sin tratamiento médico, ni exposición a rayos X en los últimos nueve meses, previo consentimiento informado, el cual fue aprobado por el Comité de Ética del Instituto Multidisciplinario de Biología Celular de la ciudad de La Plata y de la Universidad Nacional de Río Cuarto (Exp. 03/13), en el marco del proyecto Código 18/ C377, Resol Rec. 852/ 11. La extracción la realizó un profesional habilitado (bioquímica), mediante punción venosa con una jeringa estéril heparinizada.
Exposición de la sangre a glifosato II (Atanor®)
Con base en las concentraciones utilizadas por Mañas et al. (2009a, b) para glifosato puro, se realizaron ensayos previos para determinar la citotoxicidad y viabilidad de los leucocitos. Se decidió utilizar tres concentraciones finales de glifosato en formulación comercial (glifosato II Atanor®): 37.5, 75 y 112.5 µg/mL en amortiguador de fosfato salino (PBS, por sus siglas en inglés) como disolvente. En dichas formulaciones comerciales la viabilidad determinada mediante coloración con azul tripano (Freshney 2000), fue mayor a 95 %. Las concentraciones varían entre 56 y 170 veces menos que las recomendadas para pulverizaciones aéreas por la empresa que produce el herbicida.
Cada muestra de sangre se fraccionó en cinco tubos estériles de vidrio en un volumen de 2 mL. Posteriormente, a cada tubo se añadieron las concentraciones seleccionadas: 37.5, 75 y 112.5 µg/mL de la formulación comercial en PBS. Se utilizó PBS como testigo negativo. Como testigo positivo se empleó una solución de peróxido de hidrógeno 20 µM. Los tubos se incubaron en estufa a 37 ºC durante 4 horas con agitador orbital.
Aislamiento de leucocitos de sangre periférica humana
Transcurrida la incubación, se separó el plasma mediante centrifugación para realizar el ensayo de TBARS, y se procedió a aislar leucocitos del paquete globular mediante la lisis de los eritrocitos según Brendler-Shwaab et al. (1994) con algunas modificaciones. Una vez logrado el aislamiento de los leucocitos se cuantificó la viabilidad celular mediante el ensayo de coloración con Azul de Tripano (Freshney, 2000).
Ensayo cometa
El ensayo fue realizado siguiendo el protocolo descripto por Singh et al. (1988) con algunas modificaciones. Se mezclaron 250 µL de agarosa de bajo punto de fusión (Promega) con 50 µL de la solución de leucocitos, cuya concentración fue de 3×106 células/mL aproximadamente. De esa mezcla se colocaron 65 µL en un portaobjetos previamente embebido con 200 µL de agarosa de punto de fusión normal (Biodynamics). Los portaobjetos se colocaron cuidadosamente en jarras Coplin conteniendo solución de lisis y se llevaron a 4 ºC en heladera al menos durante una hora. Posteriormente se procedió a transferir los portaobjetos a una cubeta de electroforesis, que contenía una solución alcalina fría a pH 13 y se los dejó 20 min aproximadamente. A continuación, se llevó a cabo la corrida electroforética durante 30 min a 30 V y 250 mA utilizando la misma solución. Luego, se neutralizaron los portaobjetos, procedimiento realizado tres veces con intervalos de 5 min. Por último, los portaobjetos se colorearon con 40 µL de bromuro de etidio a una concentración de 20 μ g/mL y de inmediato se analizaron al microscopio óptico de fluorescencia. Todas las muestras se procesaron por duplicado, preparando por lo tanto dos réplicas por cada tratamiento.
Análisis de imágenes
Un total de 100 células se observaron al microscopio óptico de fluorescencia con un aumento de 400x. En oscuridad, se tomaron fotografías de cada una de las células y las imágenes obtenidas fueron analizadas mediante el programa Comet Score 1.5®. El parámetro elegido para evaluar el daño al ADN fue el momento de la cola. Los cometas sin núcleo detectable o “nubes” no fueron considerados en el análisis. Los resultados se transfirieron automáticamente a una planilla Excel con el parámetro seleccionado (Mañas et al. 2009a, b).
Evaluación del estrés oxidante mediante la cuantificación de sustancias reactivas al ácido tiobarbitúrico (TBARS)
Se procedió a determinar las sustancias reactivas al ácido tiobarbitúrico mediante el método descrito por Buege y Aust (1978), modificado por Marcinčák et al. (2003) en plasma de sangre periférica humana. Éste se obtuvo luego de la primera centrifugación de la sangre expuesta a los distintos tratamientos para la realización del ensayo cometa (previo al aislamiento de linfocitos) y se conservó a -20 ºC hasta la cuantificación de TBARS.
Se utilizó malondialdehído (MDA) como sustancia de referencia, obtenida a partir de la hidrólisis de 400 µL de 1,2,3,3-tetrametoxipropano (TMP, Cicarelli), luego de su incubación con 216 µL de HCl (1 M, Merck) en un tubo a baño María durante 30 min a 37 ºC. A partir de esa mezcla se realizaron las diluciones apropiadas hasta obtener las concentraciones de 1.83, 3.66, 7.32, 14.63, 29.67 y 58.54 nmol/mL, adecuadas para realizar la curva de calibración necesaria para efectuar los cálculos de las concentraciones de MDA de cada uno de los plasmas.
Se colocaron 500 µL de ácido tricloroacético (TCA, Cicarelli) al 15 % en 15 tubos, cinco para cada donador. A continuación, se añadió 20 µL de agua destilada y 500 µL de ácido tiobarbitúrico (TBA, Cicarelli) al 0.375 %. Luego, se mezclaron 250 µL de plasma con 250 µL de agua destilada y se los colocó en la solución anteriormente preparada. Se incubó a 90 ºC durante 30 min y se acomodaron en un congelador a -20 ºC durante 10 min. Posteriormente, se agregaron 1800 µL de butanol bajo una campana de extracción de gases e inmediatamente se centrifugó durante 10 min a 3500 rpm. Finalmente se realizaron las lecturas por triplicado en el espectrofotómetro a 510, 532 y 560 nm. Se aplicó la siguiente fórmula con objeto de disminuir la interferencia provocada por diversos hemopigmentos como la hemoglobina (de Sousa Sá et al. 2013): MDA532 = 1.22 [(A532) - (0.56)(A510) + (0.44)(A560)]. Los niveles de lipoperoxidación se expresan como nmol de MDA/mL de plasma.
Análisis estadístico
El supuesto de normalidad fue evaluado mediante la prueba de Kolmogorov-Smirnov. Para los datos que siguieran una distribución normal, se realizó un análisis de la varianza con el fin de evaluar las diferencias entre los distintos tratamientos, seguido de la prueba de comparaciones múltiples de Dunnett. En el caso de que los datos no siguieran una distribución normal, se procedió a realizar la prueba de Kruskal-Wallis y la prueba a posteriori de Dunn para comparaciones múltiples no paramétricas. El coeficiente de Pearson se utilizó para determinar la relación existente entre los distintos parámetros analizados. Se emplearon los programas Prism 3.0 (Prism 1997) y Statgraphics Plus 5.1 (Statgraphics 1992).
RESULTADOS
En la cuadro I se resumen los valores obtenidos mediante el ensayo cometa para el parámetro seleccionado (momento de la cola) como medida de daño inducido en el ADN. Todas las concentraciones de glifosato en formulación comercial produjeron un aumento estadísticamente significativo del momento de la cola respecto al testigo negativo (Fig. 1).
CUADRO I ENSAYO COMETA: MOMENTO DE LA COLA PARA TRES CONCENTRACIONES DE LA FORMULACIÓN COMERCIAL GLIFOSATO II (ATANOR®)
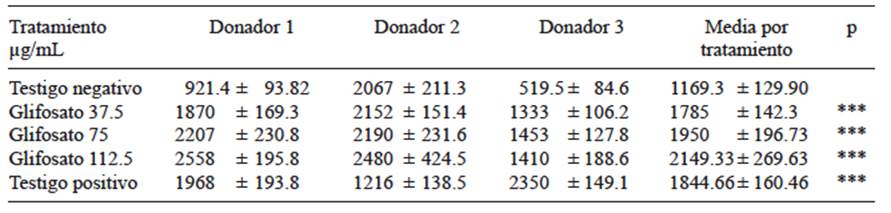
Valores expresados como promedio ± error estándar. *** = p ˂ 0.001. Prueba de Dunn luego de realizar una prueba de Kruskal-Wallis para datos no paramétricos

Fig. 1 Niveles alcanzados de daño al ADN en células sanguíneas humanas expuestas a distintas concentraciones de glifosato. TN = testigo negativo, G1= 37.5 μg/mL de glifosato, G2 = 75 μg/mL de glifosato, G3 = 112.5 μg/ mL de glifosato II (Atanor®). TP = testigo positivo (20 μM de H2O2), *** = p ≤ 0.001, Prueba de Dunn, luego de realizar una prueba de Kruskal-Wallis
Se observó una correlación positiva entre el momento de la cola y las distintas concentraciones de glifosato, con un r = 0.9342 y p = 0.043 para el coeficiente de correlación de Pearson (Fig. 2).

Fig. 2 Relación concentración unidades arbitrarias de daño al ADN tras exposición a distintas concentraciones (μg/mL) de la formulación comercial de glifosato II (Atanor®). Coeficiente de correlación r = 0.9342, p = 0.0329, prueba de Pearson.
En la figura 3 se presentan los valores correspondientes a la determinación de sustancias reactivas al ácido tiobarbitúrico (TBARS) en plasma de sangre periférica humana expuesta a glifosato.

Fig. 3 Niveles de malondialdehído/mL en plasma de sangre periférica humana expuesta a glifosato II (Atanor®) durante 4 horas. TN = Testigo negativo, G1 = 37.5 μg/ mL, G2 = 75 μg/mL y G3 = 112.5 μg/ mL de la formulación comercial. TP = testigo positivo (20 μM de H2O2). Prueba de Dunnett luego de realizar un análisis de la varianza (p > 0.05)
Las diferencias halladas no fueron estadísticamente significativas acorde al resultado obtenido mediante un análisis de la varianza. Sin embargo, hay una tendencia al incremento de los valores en correspondencia con el aumento de la concentración de glifosato II (Atanor®) (r = 0.99), p < 0.001; prueba de Pearson), como puede observarse en la figura 4.

Fig. 4 Relación entre las concentraciones de malondialdehído cuantificadas mediante el ensayo de sustancias reactivas al ácido tiobarbitúrico y las concentraciones de glifosato II (Atanor®). Coeficiente de correlación r = 0.99 (p < 0.001, Prueba de Pearson)
Por último, se encontró una correlación r = 0.9590 entre el daño al ADN cuantificado mediante el ensayo cometa y la evaluación del estado redox mediante TBARS (Pearson, p < 0.05; Fig. 5).
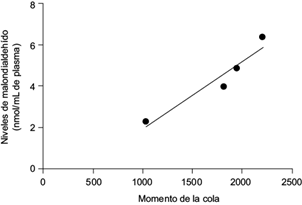
Fig. 5 Relación entre los niveles de malondialdehído cuantificadas mediante el ensayo de sustancias reactivas al ácido tiobarbitúrico y el daño al ADN expresado como el momento de la cola por el ensayo cometa en sangre periférica humana tras la exposición a tres concentraciones de glifosato II (Atanor®). Coeficiente de correlación r = 0.9590, p < 0.05, prueba de Pearson
DISCUSIÓN
La relevancia del estudio de las formulaciones comerciales radica en que el ingrediente activo puede tener un efecto aditivo e incluso sinérgico al interactuar con coadyuvantes y demás sustancias químicas que forman parte de la solución que se comercializa (Marc et al. 2002, 2004, Dimitrov et al. 2006, Šiviková y Dianovskỳ 2006).
Son pocos los trabajos publicados en los que se han realizado ensayos de genotoxicidad in vitro en leucocitos de sangre periférica humana. Lioi et al. (1998) evaluaron el efecto de varios pesticidas incluyendo el glifosato como principio activo, mediante los ensayos de aberraciones cromosómicas e intercambio de cromátidas hermanas. Estos autores encontraron que concentraciones de 8, 5, 17 y 51 µM son capaces de aumentar significativamente el porcentaje de aberraciones y la frecuencia de intercambios. A su vez, estudiaron la actividad de la enzima G6PD, que se observó aumentada tras la aplicación de las concentraciones de glifosato anteriormente mencionadas. Mladinic et al. (2009) realizaron estudios de genotoxicidad y estrés oxidante del glifosato puro en concentraciones que oscilaron entre 0.5 y 580 µg/mL, tanto con la adición de activación metabólica como sin ésta. Cuantificaron la lipoperoxidación mediante TBARS y la capacidad total antioxidante (TAC). Además utilizaron el ensayo cometa y analizaron la inestabilidad nuclear y cromosómica mediante FISH. Hallaron que sólo la dosis más alta fue capaz de incrementar estadísticamente todos los parámetros estudiados en las distintas técnicas. A diferencia de lo encontrado por estos autores, en este trabajo se observó un aumento en la fragmentación del ADN (mediante el ensayo cometa) y un incremento de la lipoperoxidación, con concentraciones entre 5 y 15 veces menores, lo que demuestra nuevamente la controversia de los resultados en torno a la genotoxicidad de este plaguicida y en la determinación del estado anterior al oxidante.
Monroy et al. (2005) evaluaron el potencial genotóxico del glifosato puro en líneas celulares humanas (HT1080 y GM38) mediante el ensayo cometa y hallaron que concentraciones de 4.5 a 6.5 mM incrementan significativamente el daño en el ADN, mientras que una solución 4 mM de este compuesto no provocó aumento significativo respecto al testigo negativo. Los resultados encontrados en este trabajo difieren con el anterior ya que se observó que concentraciones aproximadamente 10 veces menores a la más baja (0.22, 0.44 y 0.66 mM) produjeron daños significativos en el ADN. Mañas et al. (2009a, b) utilizaron una línea celular de laringocarcinoma humano (Hep-2) para estudiar la genotoxicidad del glifosato puro y su principal metabolito, el ácido amino metil fosfónico (AMPA) a concentraciones de 3 a 7.5 mM y de 2.5 a 7.5 mM, respectivamente, y encontraron evidencia para afirmar que todas las concentraciones evaluadas mediante el ensayo cometa produjeron un aumento significativo del daño en el material genético (excepto 2.5 mM de AMPA, cuyo incremento no fue significativo respecto al testigo negativo). En este trabajo se utilizaron concentraciones de hasta 10 veces inferiores, lo que concuerda con lo realizado previamente por estos autores.
La empresa Atanor® recomienda el uso de su formulación comercial glifosato II en volúmenes que oscilan entre 2 y 6 L/ha, de acuerdo con el tipo de maleza que el agricultor desee combatir. La concentración de glifosato del producto comercial que se utilizó en este trabajo es de 210 mM, aproximadamente. La dilución que se debe realizar de este compuesto depende del tipo de aplicación que se lleve a cabo. En caso de que estas sean aéreas, la empresa recomienda el uso de 15 a 30 L finales, por lo que la concentración de glifosato II Atanor® que es pulverizado ronda los 37.33 mM, una concentración que es entre 56 y 170 veces superior a las distintas dosis evaluadas en este trabajo.
De acuerdo con los resultados obtenidos, se halló una correlación entre el aumento de la lipoperoxidación y la fragmentación de ADN medida como el momento de la cola, por lo que estimamos que el estrés oxidante podría ser uno de los principales factores que estarían alterando el funcionamiento normal de las células, entendiéndose a este proceso como la principal consecuencia de una exposición a glifosato.
Marc et al. (2002, 2004) llevaron a cabo estudios en embriones de erizo de mar (Sphaerechinus granularis) que determinaron que Roundup® es capaz de provocar una disfunción en el ciclo celular al retrasar la unión ciclina B/CDK1 e incluso inhibir la síntesis de esta ciclina, resaltando la importancia de las formulaciones comerciales al concluir que los ingredientes activos y los coadyuvantes actuarían de manera sinérgica. A su vez, cabe resaltar que los reguladores del ciclo celular son universales, lo que aumenta la relevancia del estudio realizado por estos autores. Una posible explicación a lo que se observó en la investigación que aquí se reporta es que la formulación comercial que se estudió podría estar actuando del mismo modo que Roundup® en embriones de erizo de mar, es decir, inhibiendo la unión ciclina B/CDK1 necesaria para el progreso del ciclo celular. Una desregulación de las proteínas involucradas en este proceso podría llevar a una inestabilidad genómica que a su vez, podría provocar los efectos observados mediante el ensayo cometa en el presente trabajo.
Si bien hasta hace algunos años se cuestionó la genotoxicidad potencial del herbicida glifosato, fundamentalmente desde sectores involucrados con la producción de alimentos, o por supuesto desde la propia industria, en la actualidad existe suficiente evidencia que demuestra que este herbicida no es tan inocuo como inicialmente se señaló. De hecho, a comienzos del año 2015, la IARC clasificó al glifosato en la categoría 2A (“probablemente carcinógeno para el ser humano”), reconociendo que existe una “fuerte” evidencia de la capacidad genotóxica del herbicida glifosato. Si bien aún no está completamente dilucidado, una de las posibles causas del daño genético causado por la exposición a glifosato, podría ser el estrés oxidante, tal y como lo sugieren los resultados hallados en el presente trabajo.











 text new page (beta)
text new page (beta)


