INTRODUCCIÓN
Los hidrocarburos aromáticos policíclicos (HAP) son un grupo de compuestos químicos orgánicos no polares e hidrofóbicos, de dos o más anillos bencénicos fusionados. Son contaminantes del aire, producidos por la combustión incompleta de la materia orgánica, también se pueden encontrar en el suelo así como en el agua. Los HAP que contienen hasta cuatro anillos son conocidos como HAP livianos y los que contienen más de cuatro son los HAP pesados. Los HAP pesados son más estables y tóxicos que los HAP livianos (Wenzl et al. 2006). Las emisiones vehiculares han sido reconocidas como la fuente antrópica más importante de HAP en el aire urbano, por lo que su impacto en la salud y en el ambiente son temas muy estudiados en la actualidad (Lim et al. 2007, Douglas et al. 2011). La identificación de mutágenos en partículas del aire urbano confirmó la contribución de los HAP a la actividad mutagénica y condujo al descubrimiento de los nitroarenos, compuestos nitro aromáticos altamente mutagénicos en el escape del diésel (Schuetzle y Lewtas 1986, Lewtas 1988). Debido a sus conocidas propiedades carcinogénicas y mutagénicas, los efectos ambientales de los HAP son ampliamente estudiados (Li et al. 2006, Tan et al. 2009). El material particulado (MP) respirable compuesto por partículas de un diámetro aerodinámico menor de 10 µm (PM10) y de 2.5 µm (PM2.5) ha sido asociado con un incremento en la incidencia de las enfermedades pulmonares, cardiovasculares y cáncer (Brunekreef y Holgate 2002, Pope et al. 2002). Las partículas finas PM2.5 pueden penetrar las regiones más profundas de los pulmones como los bronquiolos, los alvéolos y causar efectos adversos para la salud, incluyendo enfermedades cardiopulmonares y cáncer de pulmón (Slezakova et al. 2011). El efecto del MP en el organismo depende de su composición química, un alto contenido de HAP incrementa la genotoxicidad del MP con la formación preferencial de aductos de HAP-ADN (Sevastyanova et al. 2008).
Los HAP pueden inducir toxicidad en organismos al interferir con la función de la membrana celular y los sistemas de acoplamiento de enzimas, los metabolitos de HAP se pueden unir al ADN y causar interrupciones bioquímicas y daño celular (De Kok et al. 2006, Kosmehl et al. 2008). La presencia de otros compuestos incluidas la o-quinonas (Cho et al. 2004, Jakober et al. 2007, Chung et al. 2008) o los metales de transición (Donaldson et al. 2003, De Kok et al. 2006, Geiser y Kreyling 2010) pueden conducir a la formación de especies reactivas de oxígeno (ROS, por sus siglas en ingles) y a la posterior inducción del estrés oxidativo (Hanzalova et al. 2010).
La exposición al MP puede resultar en la inflamación de los pulmones y la formación de macrófagos alveolares que conducen a la generación de radicales libres y a aumentar el estrés oxidativo (Li et al. 1997). El ataque de las ROS sobre la molécula de ADN produce un número de bases oxidadas (Cooke et al. 2003), siendo la 8-oxodesoxiguanosina (8-oxodG) la más estudiada ya que es una base altamente mutagénica, su presencia en el ADN resulta en la transversión guanina citosina-timina adenina (GC-TA). La peroxidación lipídica afecta la estructura y la actividad de las proteínas de membrana, también promueve la formación de compuestos intermedios que propagan el estrés oxidativo (Montuschi et al. 2004). En estudios para evaluar los efectos potenciales de los contaminantes atmosféricos en la salud, se emplea el bioensayo de mutagenicidad y el más conocido es el mutagénico de Ames que utiliza cepas de Salmonella typhimurium (Ames et al. 1975).
El objetivo de esta investigación fue determinar la mutagenicidad del aire de Villa del Rosario usando el bioensayo de Ames con las cepas de Salmonella typhimurium TA98 y TA100 y la identificación de HAP, mediante cromatografía de gases con detector de ionización de llama (FID, por sus siglas en inglés), asociados con partículas finas PM2.5 colectadas en la sede de la Universidad de Pamplona ubicada en un sitio urbano de Villa del Rosario, Colombia.
MATERIALES Y MÉTODOS
Muestreo
Se realizó el monitoreo de la fracción respirable PM2.5 con el equipo Partisol-2025 (Plus Air Sampler USEPA, Reference Designated PM2.5 Method RFDS-0498-118 in acordance with 40CFR Parts 3), ubicado en la sede de la Universidad de Pamplona en Villa del Rosario (coordenadas 7º50′2″N 72º28′27″O) en la autopista internacional que comunica la ciudad de Cúcuta (Colombia) con la ciudad fronteriza de San Antonio (Venezuela). Este sector presenta un gran flujo de vehículos de transporte público, particular y de carga pesada que funcionan con gasolina y diésel. Los monitoreos de PM2.5 se realizaron con filtros Pallflex de micro cuarzo de 47 mm, en el mes de agosto de 2013, en muestreos de 24 h cada tres días, el volumen de aire obtenido fue de 24 m3, los filtros se guardaron en bolsas plásticas con cierre hermético y se mantuvieron refrigerados.
Tratamiento químico de los filtros. Extracción por ultrasonido
La extracción de la materia orgánica de los filtros de PM2.5 se realizó por ultrasonido en un baño ultrasónico (Branson 1510, modelo 1510R-MT) usando como solvente el diclorometano. Los filtros provenientes del monitoreo de PM2.5 se sumergieron en un vaso de precipitados con 20 mL de diclorometano durante 15 min a temperatura ambiente. Esta extracción se repitió nueve veces hasta completar 200 mL del solvente.
Concentración de la materia orgánica
Una vez obtenido el extracto, se concentró en un evaporador rotatorio de vacío, marca Heidolph modelo Laborota 400-1, a una temperatura de 25 ºC y 150 rpm hasta alcanzar un volumen aproximado de 10 mL, para obtener el extracto global. Posteriormente el extracto global se transfirió a viales que se sellaron y se mantuvieron en refrigeración y en la oscuridad hasta su análisis.
Fraccionamiento del extracto global
El fraccionamiento de la materia orgánica presente en el extracto global se realizó por medio de cromatografía de columna empaquetada con 10 g de sílica gel (Yang et al. 2010), previamente activada a 200 ºC durante 8 días. El extracto global se disolvió en 10 mL de N-hexano y se adicionó a la columna. La columna fue eluída sucesivamente con 200 mL de N-hexano para obtener la fracción 1: con 200 mL de la mezcla N-hexano-diclorometano (3:1 v/v), obteniéndose así la fracción 2 y la fracción 3 con 200 mL de diclorometano. Cada fracción obtenida se concentró y se obtuvieron 10 mL, de los cuales 5 mL se destinaron para los análisis cromatográficos y los otros 5 mL se disolvieron en dimetilsulfóxido (DMSO) para los ensayos biológicos.
Identificación de hidrocarburos aromáticos policíclicos (HAP)
Para identificar los HAP presentes en la materia orgánica del PM2.5 del aire de Villa del Rosario (extracto global y las tres fracciones), se utilizó un cromatógrafo de gases marca Agilent Technologies 6890A Plus Series II Hewlet-Packard Plus con detector FID. La columna utilizada fue Restek Rxi-17 Sil, 30 m de longitud, 0.25 mm de diámetro, 0.25 μm de diámetro interno (silarileno similar a 50 % fenil/50 % dimetil polisiloxano). Para la identificación de los HAP se utilizó el patrón de 18 hidrocarburos de Restek (catálogo # 31841 EPA Método 8310 PAH Mixture). La identificación cualitativa de los HAP presentes en el extracto global se realizó de acuerdo con las siguientes condiciones: temperatura del inyector 250 ºC, detector FID a 320 ºC, mezcla (mL/min), aire 400 - H2 30 -N2 45. Se inyectó 1 µL, modo sin división. Condiciones del horno con una temperatura inicial 65 ºC por 0.5 min que se incrementa de la siguiente manera: 15 ºC/min hasta 200 ºC, 4 ºC/min hasta 330 ºC durante 15 min. Tiempo de análisis por muestra 53.33 min. Gas de arrastre helio, flujo 20 mL/min.
Detección de la actividad mutagénica
El efecto mutagénico de los extractos del PM2.5 del aire de Villa del Rosario, se determinó por medio del bioensayo de Ames, a través del protocolo descrito por Maron y Ames (Mortelmans y Zeiger 2000).
En esta prueba el indicativo de la mutación está dado por la reversión his- a his+, las revertantes se identifican porque crecen en medio mínimo sin histidina. Se trabajó con las cepas de Salmonella typhimurium TA98 y TA100. El bioensayo de Ames se realizó por triplicado con las cepas TA98 y TA100 para el extracto global y las diferentes fracciones de la materia orgánica (FT, F1, F2 y F3). Con cada muestra se trataron 10a bacterias y se utilizaron testigos positivos y negativos. Para el testigo positivo se utilizó 4-nitroquinolina N-óxido (4-NQO). Como testigo negativo se usó DMSO al 12 %. Para realizar los análisis mutagénicos se evaluaron tres concentraciones de MP (50 µg, 100 µg y 150 µg). Para verificar la reproducibilidad de los resultados se realizaron tres experimentos independientes, cada uno por duplicado. Para clasificar los extractos o las fracciones como mutagénicos o no, se calculó el índice de mutagenicidad (IM). IM = RI/RE, RI: revertantes inducidas por el tratamiento, RE: revertantes espontáneas (inducidas por el testigo negativo). El IM indica las veces que es superada la mutagenicidad del testigo negativo, para calcularlo se tomaron en cuenta los criterios de Flückiger-Isler y Kamber (2012), que establecen que ensayos en los que se obtenga un IM entre 2 y 3, indica que la sustancia probada tiene una mutagenicidad débil y que sustancias con resultados mayores a 3, tienen una mutagenicidad alta.
Respecto al análisis estadístico se utilizó la prueba de Dunnett para determinar el nivel de significancia entre el tratamiento y el testigo. Las diferencias de las medias se consideraron significativas con una p < 0.05.
RESULTADOS Y DISCUSIÓN
Para la identificación de los diferentes HAP presentes en el extracto global y las fracciones del PM2.5 de Villa del Rosario extraídos con diclorometano, se tomó como referencia el cromatograma de la muestra patrón de Restek de 18 HAP (EPA, Method 8310 PAH Mix) como se muestra en la figura 1. En este cromatograma los compuestos presentes en la muestra patrón son: 1) naftaleno, 2) 1-metilnaftaleno, 3) 2-metilnaftaleno, 4) cenaftileno, 5) acenafteno, 6) fluoreno, 7) fenantreno, 8) antraceno, 9) fluoranteno, 10) pireno, 11) benzo[a]antraceno,12) criseno, 13) benzo[b]fluoranteno, 14) benzo[k]fluoranteno, 15) benzo[a]pireno, 16) indeno(1,2,3-cd)pireno, 17) dibenzo[a,h]antraceno, 18.) benzo[ghi]perileno.
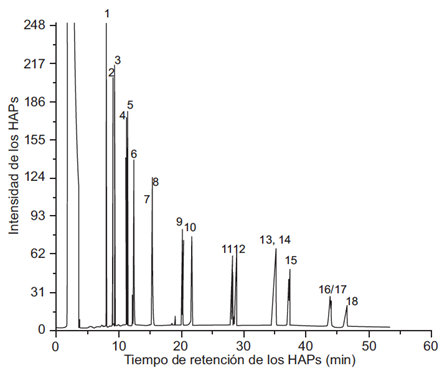
Fig. 1 Cromatograma correspondiente a la muestra patrón de hidrocarburos aromáticos policíclicos (HAPs)
En las figuras 2, 3, 4 y 5 se muestran los cromatogramas del extracto global y de las fracciones 1, 2 y 3 respectivamente del PM2.5 del aire de Villa del Rosario.
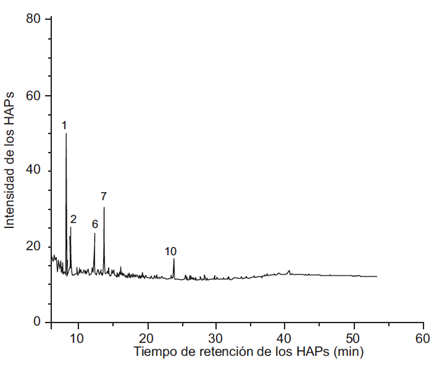
Fig. 2 Cromatograma del extracto global del PM2.5 del aire de Villa de Rosario extraída con diclorometano. Se observan los siguientes hidrocarburos aromáticos policíclicos (HAP): pico 1, naftaleno, pico 2,1-metilnaftaleno, pico 6, fluoreno, pico, 7 fenantreno y pico, 10, pireno
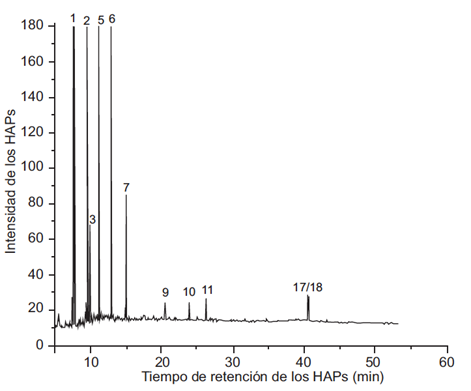
Fig. 3 Cromatograma correspondiente a los hidrocarburos aromáticos policíclicos (HAP) encontrados en la fracción 1 de las muestras de PM2.5 del aire de Villa del Rosario: pico 1, naftaleno; pico 2, 1-metilnaftaleno; pico 3, 2-metilnaftaleno; pico 5, acenafteno; pico 6, fluoreno; pico 7, fenantreno; pico 9, fluoranteno; pico 10, pireno; pico 11, benzo[a]antraceno; picos 17/18, dibenzo[ah]antraceno/benzo[g,i,h]perileno
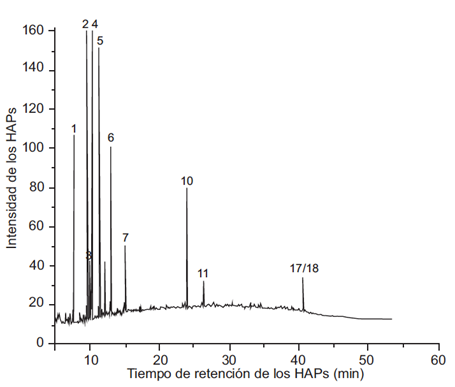
Fig. 4 Cromatograma de la fracción 2 del PM2.5 del aire de Villa del Rosario en el que se observa los siguientes hidrocarburos aromáticos policíclicos (HAP): pico 1, naftaleno: pico 2, 1-metilnaftaleno; pico 3, 2-metilnaftaleno; pico 4,-acenaftileno; pico 5, acenafteno; pico 6, fluoreno; pico 7, fenantreno; pico 9, fluoranteno; pico 10, pireno; pico 11, benzo[a]antraceno; picos17/18, dibenzo[a,h]antraceno /benzo[g,i,h]perileno
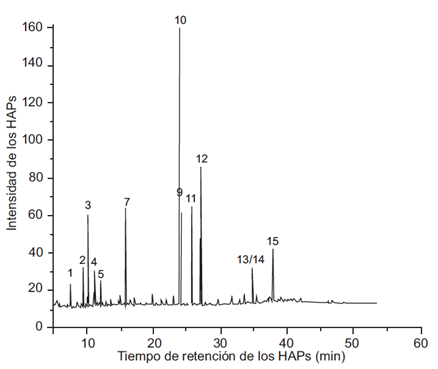
Fig. 5 Cromatograma de la fracción 3 de las muestras del PM2.5 del aire de Villa del Rosario en el que se identifica a los siguientes hidrocarburos aromáticos policíclicos (HAP): pico 1, naftaleno; pico 2, 1-metilnaftaleno; pico 3, 2-metilnaftaleno; pico 4, acenaftileno; pico 5, acenafteno; pico 7, fenantreno; pico 10, pireno; pico 11, benzo[a]antraceno; pico 12, criseno; picos 13/14, benzo[b]fluoranteno/ benzo[k]fluoranteno; 15, benzo[a]pireno
En el cuadro I se muestran los HAP extraídos con diclorometano (DCM), encontrados en el extracto global, así como en las tres fracciones del PM2.5 del aire de Villa del Rosario
Cuadro I Hidrocarburos aromáticos policíclicos encontrados en el aire de Villa del Rosario
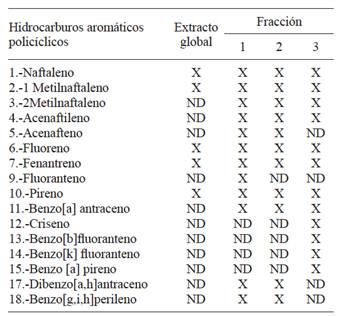
X Detectado
ND = No detectado
El papel de la contaminación del aire en el cáncer humano ha sido reportado en diferentes investigaciones (Samet 2004, Næss et al. 2007). Estudios relacionados con el origen de las partículas finas (PM2.5) en EUA y en otros centros urbanos demostraron que los vehículos de motor diésel y los de gasolina son una de las principales fuentes de material particulado (Schauer et al. 1996, Watson y Chow 2001, Barakat 2002, Maykut et al. 2003). Estudios de fraccionamiento del material particulado orgánico (PM2.5) del aire, han identificado HAP mutagénicos y carcinogénicos, que pueden causar daño oxidativo al ADN y conducir a efectos negativos tanto cardiovasculares como reproductivos (Lewtas 2007). Los HAP han sido identificados como carcinógenos en humanos por la Agencia Internacional para la Investigación del Cáncer (IARC, por sus siglas en inglés, 1984, 2010). La actividad cancerígena depende de la estructura del HAP, siendo más importante para moléculas de 4, 5, 6 ó 7 anillos. Además, las estructuras angulares están relacionadas con una mayor actividad cancerígena frente a las que presentan una estructura lineal y más condensada (Umbuzeiro et al. 2008, Dong y Lee 2009). La IARC, clasifica al benzo[a]pireno (BaP) como cancerígeno en humanos (IARC 1987). Por lo tanto, la presencia de BaP en el aire puede aumentar los riesgos carcinogénicos para el ser humano tras la exposición al aire contaminado. Los HAP suelen considerarse un indicador de emisiones de tráfico vehicular (Guo et al. 2003). Los HAP producidos por la combustión de combustibles orgánicos son considerados como mutágenos (IARC 1989). De acuerdo con la IARC, los HAP en el aire de Villa del Rosario que son cancerígenos potenciales en humanos son: el criseno, benzo(a) antraceno, la mezcla de benzo(b,k)fluorantenos y como probable el dibenzo[a,h]antraceno. El fenantreno hallado en el aire de Villa del Rosario es característico de las emisiones del tráfico vehicular (Ravindra et al. 2006). El benzo(gih)perileno se ha asociado con emisiones vehiculares (Dichut et al. 2000).
Los tipos de órganos más comunes afectados por el cáncer y que están asociados con la exposición de gases de escape del diésel son el pulmón, la vejiga y el tejido linfático (Lipsett y Campleman 1999). Ciertos HAP como el fenantreno, el pireno y el fluoranteno, se han relacionado con enfermedades respiratorias crónicas como el asma, la bronquitis severa y el cáncer de pulmón (Taguchi et al. 2007, Valavanidis et al. 2008, Aubier 2009). Los HAP con 3 y 4 anillos aromáticos fusionados están típicamente asociados con las emisiones de los vehículos diésel (Guo et al. 2003). En el aire de Villa del Rosario los HAP relacionados con las emisiones diésel son: fluoreno, fenantreno, pireno y benzo(a)antraceno. Cabe mencionar que los HAP hallados en las muestras del aire (PM2.5) de Villa del Rosario, provienen exclusivamente de la combustión de las fuentes móviles que circulan con diésel y gasolina (Mi et al. 2000, Mi et al. 2001). Además, la IARC (2014), clasifica las emisiones de los vehículos que funcionan con diésel, como cancerígeno para los seres humanos.
En la figura 6 se observan las revertantes inducidas por el extracto global en las cepas TA98 y TA100 de Salmonella typhimurium. Las cepas de esta especie permiten identificar el tipo de mutación que está involucrada, ya que cada cepa es específica para una mutación. La TA98 (His D3052) detecta mutación por desplazamiento del marco de lectura y la TA100 (His G46) detecta mutaciones por sustitución de bases. De acuerdo con los resultados nos podemos dar cuenta que aunque existen en el extracto de aire los dos tipos de mutágenos, los compuestos que inducen mutación por desplazamiento del marco de lectura superan en 1.6 veces a los compuestos que inducen mutación por sustitución de bases. Es de notar, que a medida que aumentamos la dosis hay un incremento también en la respuesta mutagénica.
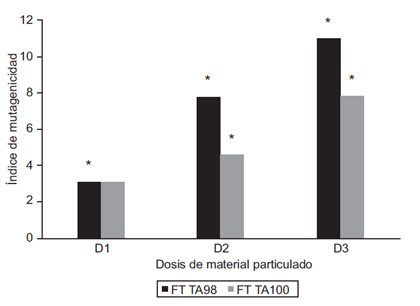
Fig. 6 Índice de mutagenicidad inducido por el extracto global de PM2.5 del aire de Villa del Rosario. D1: dosis 1 (50 µg), D2: dosis 2 (100 µg), D3: dosis 3 (150 µg). FT: fracción total. TA98 y TA100 cepas de Salmonella typhimurium. * Diferencia estadísticamente significativa comparada con el testigo negativo con p < 0.05
En la figura 7 se muestra el índice de mutagenicidad (IM) inducido por las diferentes fracciones del PM2.5 del aire de Villa del Rosario en las cepas TA98 y TA100 de Salmonella typhimurium. Si este índice es mayor o igual a 2, se considera una respuesta mutagénica positiva, lo que significa que en la muestra analizada existen compuestos químicos que están alterando el genoma de las bacterias analizadas. Como se observa en la figura 7, la fracción 3 (F3), es la que presenta mayor mutagenicidad. La razón de mutagenicidad es mayor en la cepa TA98, indicándonos que los compuestos presentes en esta muestra inducen principalmente mutación por pérdida o ganancia de bases. Los resultados observados se pueden atribuir a agentes mutagénicos presentes en el material particulado que pueden alterar el marco de lectura u originar sustitución de bases. Dichos agentes pueden ser derivados nitroaromáticos, HPA, metales y agentes cancerígenos amino (Kawanaka et al. 2008, Ianistcki et al. 2009). Gran parte de la actividad mutagénica encontrada en este estudio podría ser debida a dinitropirenos, compuestos que no requieren activación metabólica y lesionan el ADN originando pérdida o ganancia de bases (Kawanaka et al. 2008). Estos resultados son similares a los encontrados en las muestras de PM2.5 del aire de la ciudad de Pamplona Norte de Santander (Meléndez et al. 2012).
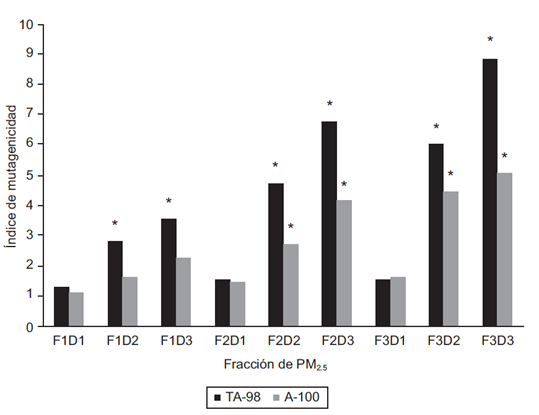
Fig. 7 Índice de mutagenicidad inducido fracciones de PM2.5 el aire de Villa del Rosario. TA98 y TA100 cepas de Salmonella typhimurium. F1: Fracción 1 (eluida con n-hexano), F2: Fracción 2 (eluida con n-hexano/DCM (3:1) (v/v)), F3: Fracción 3 (eluida con DCM), D1: Dosis 1 (50 µg), D2: Dosis 2 (100 µg), D3: Dosis 3 (150 µg), * Diferencia estadísticamente significativa comparada con el testigo negativo con p < 0.05
La mutagenicidad de las partículas diésel ha sido investigada por algunos autores (Singh et al. 2004, Seung-Min y Chung 2006, Riger et al. 2011) y se ha demostrado que inducen mutagenicidad en ausencia de enzimas microsomales (Taga et al. 2005, Lingzhi et al. 2007). Se ha descubierto que una gama más amplia de compuestos aromáticos policíclicos encontrados en las emisiones de combustión de diésel y en la contaminación del aire son a la vez mutagénicos y carcinogénicos como los nitroarenos, entre los que se incluyen a las lactonas del nitropireno y nitrofenantreno y a la 3-nitrobenzantrona que es un potente mutágeno encontrado en las partículas de diésel. (Enya et al. 1997). Se ha informado que la 3-nitrobenzantrona es un mutágeno potente en el ensayo de mutagénesis bacteriana de Ames, que induce tumores en roedores (Arlt 2005, Nagy et al. 2005)
Los resultados positivos indican, con base en las condiciones de la prueba de Ames que las muestras del material particulado PM2.5 del aire de Villa del Rosario inducen mutaciones por sustitución y por pérdida o ganancia de bases, originadas por compuestos que no requieren de la activación metabólica y que son generados fundamentalmente por la combustión vehicular. Lo anterior podría constituir un factor de riesgo para la población expuesta.











 text new page (beta)
text new page (beta)


