Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista internacional de contaminación ambiental
Print version ISSN 0188-4999
Rev. Int. Contam. Ambient vol.28 n.2 Ciudad de México May. 2012
Artículos
Obtención de azúcares fermentables mediante hidrólisis ácida de Beta vulgaris L.
Fermentable sugar production throug acid hydrolysis of Beta vulgaris L.
Donaji JIMÉNEZ ISLAS1, Arturo ABREU CORONA1, Víctor E. LÓPEZ Y LÓPEZ2, Alejandro TELLEZ JURADO1 y Jorge N. GRACIDA RODRÍGUEZ1*
1 Departamento de Biotecnología, Universidad Politécnica de Pachuca, Ex–Hacienda de Santa Bárbara, Carretera Pachuca–Cd. Sahagún Km. 20, Zempoala Hidalgo, México. *Autor responsable; gracidaj@netscape.net.
2 Centro de Investigación en Biotecnología Aplicada, Ex–Hacienda San Juan Molino Carretera Estatal Tecuexcomac–Tepetitla Km 1.5, Tlaxcala, México.
Recibido enero 2011,
aceptado octubre 2011
RESUMEN
Con el propósito de incrementar la cantidad de azúcares que beneficie el rendimiento de etanol en la fermentación, se realizó la hidrólisis de Beta vulgaris L. con H2SO4. Se evaluó el efecto que tienen los parámetros: agitación, concentración de ácido, masa y temperatura sobre el grado de hidrólisis del sustrato. La masa se probó en el intervalo de 5 hasta 40 g y la agitación de 100 a 250 rpm. La temperatura y el tiempo de reacción fueron evaluados en el intervalo de 30 a 90 °C y de 2 a 6 h, respectivamente. El tamaño de partícula probado fue de 0.5 mm y para todos los casos el volumen de reacción de 50 mL. A una velocidad de 150 rpm se tuvo mayor efecto de hidrólisis. Mediante comparación de medias se determinó que las concentraciones superiores a 0.5 N de H2SO4 no tienen efecto significativo (p<0.05) sobre la liberación de azúcares totales. Con 10 g de sustrato en los medios de reacción se obtuvo el mayor rendimiento de hidrólisis. La temperatura de 90 °C proporcionó la mayor hidrólisis, y con 50 °C la cantidad de azúcares totales fue 3 g/L menor a la generada en 90 °C. Las mejores condiciones del diseño del experimento fueron; 40 °C, 150 rpm y 10 g de sustrato. El incremento en el tiempo de reacción indicó que se lleva a cabo la degradación de hemicelulosa dentro de la matriz del sustrato y se generan regiones amorfas que promueven la disponibilidad de la celulosa.
Palabras clave: azúcares simples, betabel, bioetanol, pretratamiento.
ABSTRACT
With the purpose of increasing the amount of sugars that benefit the yield of ethanol in fermentation, it was performed hydrolysis of Beta vulgaris L. with H2SO4. The following parameters were used to evaluate the degree of hydrolysis of substrate: stirring, acid concentration, mass, and temperature. The mass was tested in the range of 5 to 40 g and stirring from 100 to 250 rpm. The temperature and reaction time were evaluated in the range of 30 to 90 °C and 2 to 6 h, respectively. The tested particle size was 0.5 mm and a reaction volume of 50 mL was used for all cases. The rate of 150 rpm had a better effect over hydrolysis. By comparison of means it was determined that concentrations higher than 0.5 N of H2SO4 showed no significant effect (p<0.05) on the release of total sugars. The highest yield of hydrolysis was obtained with 10 g of substrate in the reaction medium. The temperature of 90 °C provided the highest hydrolysis and at 50 °C the amount of total sugars was 3 g/L lower than that generated with 90 °C. The best pretreatment conditions were: 40 °C, 150 rpm and 10 g of substrate. The increase in the reaction time indicates that hemicellulose degradation occurs inside the matrix of substrate and that amorphous regions are generated, promoting cellulose availability.
Key words: simple sugars, red beet (Beta vulgaris L), bioethanol, pretreatment.
INTRODUCCIÓN
La creciente demanda de energía en el mundo ha generado el consumo acelerado de los combustibles petroquímicos, agotamiento de las reservas petroleras y problemas de contaminación asociados a su combustión. En este sentido, surgen formas de energía alterna: eólica, solar, hidrógeno y biogás; los líquidos como el biodiesel y el bioetanol (García 2008). El etanol es producido por síntesis química a partir del etileno y por vía biológica a partir de la fermentación de los azúcares; su principal aplicación es en la industria de las bebidas alcohólicas y en últimas décadas se plantearon tecnologías para usarlo como aditivo o sustituto de las gasolinas. Dicha aplicación permite reducir el volumen de los oxigenantes como el metil–terbutil éter (MTBE) y el CO2, gas de efecto invernadero (Sánchez y Cardona 2008).
Además de los azúcares contenidos en jugos de frutos, en caña de azúcar y remolachas, se puede utilizar la biomasa celulósica como otra fuente de carbono; sin embargo, la principal limitante para aprovechar la biomasa es la disponibilidad de los compuestos fermentables en la etapa de obtención de etanol, por esta razón es necesario incorporar pretratamientos mecánicos y de hidrólisis que modifiquen la estructura de la biomasa. La mayoría de la glucosa en la lignocelulosa está localizada dentro de los polímeros cristalinos de la celulosa. La hemicelulosa también los contiene pero en forma de copolímeros conformados por glucosa, xilosa y otros. Sin embargo, la lignina que es el tercer componente mayoritario en la lignocelulosa dificulta los procesos de hidrólisis al estar integrado por un polímero aromático complejo (Binder y Raines 2010). Por lo anterior es necesario incorporar tratamientos de hidrólisis que disminuyan la formación de compuestos inhibitorios que afecten el proceso de fermentación. Otra posibilidad es incorporar materiales con menor contenido de lignina y favorecer de esta manera la hidrólisis. Los materiales que cumplen con este fin son las remolachas, que tienen un menor contenido de lignina (Chakiath et al. 2009) y se puede aprovechar el jugo y el bagazo celulósico. El uso de remolachas presenta ventajas durante su cultivo como alta productividad, tolerancia a variaciones climáticas, bajo consumo de agua y fertilizantes. Comparado con caña de azúcar, requiere de 30–45 % menos agua y fertilizante (Kumar et al. 2006, Balat et al. 2008). Entre los estudios realizados con remolacha azucarera se puede mencionar los realizados con remolacha forrajera (Beta vulgaris var. Monorosa), con un rendimiento de etanol de 9.13 % (v/v) empleando la cepa de Sacharomyces cerevisiae NRRL Y–2034 (Gibbons y Westby 1986). Otro trabajo reportado es con pulpa de Beta vulgaris, tratada con amonio y posterior hidrólisis enzimática, donde se mostró el efecto sobre la celulosa (Foster et al. 2001). Amin y Khalaf Allah (1992) reportaron el uso de Beta vulgaris, la cual fue fermentada con Zymomonas mobilis ATCC 39670, con rendimiento teórico de etanol de 95 %. Por otro lado, el betabel (Beta vulgaris spp.) es una remolacha, empleada como la principal fuente de betalainas y es uno de los productos más utilizados a nivel industrial debido a su alto contenido de betacianinas (Soriano–Santos et al. 2007). Sin embargo, no se ha empleado en la obtención de etanol y es un material disponible en el territorio mexicano. De igual modo, se podrían tener beneficios adicionales por ser una fuente diversa de azúcares que podrían ser fermentados hasta etanol. En este último paso, los organismos que tradicionalmente se usan son: Zymomonas mobilis, Saccharomyces cerevisiae, Pichia stipitis y otros (Brethauer y Wyman 2010). Las condiciones de hidrólisis que favorecen la disponibilidad de azúcares fermentables mediante el cambio de propiedades de la lignocelulosa son la temperatura, la agitación, la concentración del sustrato y el pH. Cada uno de estos factores debe ser evaluado debido a que determinan el porcentaje de azúcar disponible en el proceso fermentativo y beneficiarán el rendimiento neto de etanol. Algunos parámetros estudiados en el proceso de hidrólisis han sido la temperatura y el pH. Entre los ácidos estudiados se encuentra el ácido clorhídrico, el acético y el sulfúrico, siendo este último el que presenta ventajas en el proceso de hidrólisis (Pedersen et al. 2010). En tanto, la combinación del tratamiento químico y el hidrotérmico ha buscado favorecer la velocidad de reacción de la hidrólisis de lignocelulosa (Taherzadeh y Karimi 2008, Pedersen et al. 2010). Es por estos antecedentes que en la hidrólisis del betabel se deben valorar los factores (pH, temperatura, hidrólisis, agitación y tiempo de reacción) asociados a la ruptura de los enlaces de los polímeros de carbohidratos y evitar la formación de subproductos que afecten la fermentación mediante inhibición (furfural e hidroximetilfurfural, principalmente). Por lo anterior, el presente trabajo tiene como propósito generar azúcares a partir de la evaluación de agitación, temperatura, tiempo de reacción, concentración del ácido y del sustrato que promueva la liberación de azúcares totales durante el proceso de hidrólisis de Beta vulgaris L.
MATERIALES Y MÉTODOS
Se utilizó betabel (Beta vulgaris L.) proveniente de distintos sitios de cultivo (Pachuca, Puebla y Tlaxcala, todos ubicados en México). El material fue lavado con detergente comercial y agua directamente del grifo. De los especímenes usados las hojas fueron desechadas, la raíz (cuerpo carnoso) fue pelada y picada en cubos de tamaño menor a 5 mm. Para cada lote de Beta vulgaris L., se cuantificó el peso seco de las muestras por triplicado mediante el secado de 10 g de Beta vulgaris L. a 70 °C durante 24 h (Fernandes et al. 2008).
La hidrólisis ácida se llevó a cabo en matraces Erlenmeyer de 125 mL, los cuales contenían 10 g de betabel picado y 50 mL de H2SO4 en concentraciones de 0, 0.05, 0.5, 1, 2 y 3 N. Los matraces fueron incubados a 30 °C a 150 rpm en un agitador orbital (Excella E24, New Brunswick). Después de 24 y 48 h de reacción se cuantificaron los azúcares totales (Dubois et al. 1956) además se realizaron algunas pruebas para identificación de xilosa mediante el analizador bioquímico YSI (2700 select).
Para la valoración del efecto de la cantidad de sustrato sobre la hidrólisis se utilizaron matraces de 125 mL con 50 mL de H2SO4; la cantidad de masa de la muestra picada adicionada a cada matraz fue de 5, 10, 20, 30 y 40 g. El volumen de reacción varió con el incremento en la masa, sin embargo se consideró en los cálculos de rendimiento. Dicho rendimiento fue determinado mediante la cuantificación del peso seco para cada experimento (Fernandes et al. 2008). Al final de cada experimento se determinó la cantidad de azúcares totales mediante el método del fenol–sulfúrico (Dubois et al. 1956).
Para determinar el efecto de la agitación se usaron matraces bafleados de 250 mL con 50 mL de H2SO4, la velocidad de agitación fue evaluada a 0, 100, 150, 200 y 250 rpm en un agitador orbital (Excella E24, New Brunswick) a 30 °C. Se establecieron testigos para las diferentes velocidades de agitación. Para este fin, se empleó agua para verificar el efecto de agitación (sin interacción del ácido). En una segunda serie de experimentos, se llevó a cabo la evaluación del efecto combinado de agitación y concentración del ácido. La temperatura fue de 30 °C y 10 g de masa del sustrato con la finalidad de establecer condiciones con menor consumo de energía por concepto de agitación. Se tomaron muestras a 0.5, 1 y 1.5 horas de reacción y finalmente se cuantificó la concentración de azúcares totales.
El efecto de temperatura fue evaluado en matraces de 250 mL con 50 mL de H2SO4 y testigos con 50 mL de agua. Se usó un termobaño en el cual se evaluó la temperatura de 50, 70 y 90 °C. Los matraces no fueron agitados para evitar la interferencia de la agitación sobre la hidrólisis y valorar únicamente el efecto de la temperatura. Se usaron10 g de masa para cada matraz y se cuantificó la concentración de azúcares totales.
Finalmente, fue diseñado un experimento con los siguientes factores y niveles: tiempo de 2, 4 y 6 h; concentración del ácido sulfúrico de 0.1, 0.3 y 0.5 N; temperatura de 30, 40 y 50 °C. La cantidad de masa usada fue de 10 g de sustrato. El porcentaje de hidrólisis fue determinado con la cuantificación de azúcares totales. Se utilizó el programa SigmaPlot 10.0 para la generación de superficies de respuesta de los factores y sus niveles respectivos.
Los azúcares liberados durante el proceso de hidrólisis fueron cuantificados como carbohidratos totales mediante la técnica modificada de fenol–sulfúrico, la cual consiste en adicionar en un tubo de ensayo: 1 mL de muestra (libre de sólidos suspendidos), seguido de 600 µL de solución de fenol al 5 % (p/v) y 3.6 mL de H2SO4 concentrado (>98 %), homogeneizar y enfriar a temperatura ambiente durante 30 minutos. Transcurrido el tiempo se leyeron las muestras a 490 nm empleando celdas de cuarzo en un espectrómetro UV (Termoscience, Biomate 3). Finalmente, la curva estándar se preparó con glucosa en concentraciones de 10 a 100 µg/mL y se trató con el mismo procedimiento que la solución problema. Para la identificación de azúcares se usó en algunas muestras un analizador bioquímico (YSI 2700 Select).
Se usó el paquete estadístico SPSS statistics y se estableció para todos los análisis la significancia p< 0.05. Se realizaron análisis de varianza (ANOVA), comparaciones múltiples (Tukey HSD, Duncan) y análisis multivariante (MANOVA).
RESULTADOS Y DISCUSIÓN
Efecto de la concentración de ácido sulfúrico en la hidrólisis
Los resultados del efecto de la concentración de ácido (incluido el testigo) se determinaron mediante comparaciones entre grupos (Dunnett) y se determinó que existe efecto significativo (p<0.05) entre el control (sin ácido en el medio de reacción) y todos los tratamientos donde se incorpora el ácido como catalizador de la hidrólisis. Además, la concentración de 0.05 N tiene diferencias significativas (Duncan, p<0.05) con las concentraciones de 0.5, 1, 2 y 3 N. Por este resultado, las mejores condiciones ácidas para la hidrólisis son las inferiores a 0.5 N, debido a que no se incrementó la concentración de azúcares a concentraciones superiores, lo que se muestra en la figura 1. Se ha reportado que hidrólisis con condiciones diluidas de ácido, la fracción de hemicelulosa es despolimerizada a baja temperatura (Chandel et al. 2007). Esto podría estar sucediendo en nuestro tratamiento debido a que en los hidrolizados se encontró xilosa, componente reportado en la despolimerización de la hemicelulosa junto con xilano (Lu y Mosier 2008).

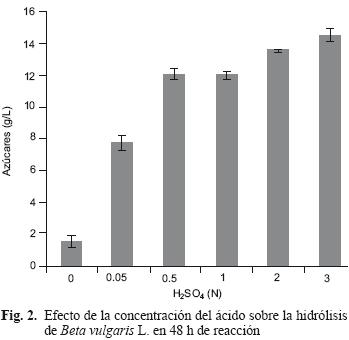
A las 48 horas de reacción, existe diferencia significativa (Dunnett, p<0.05) entre el testigo y el resto de los tratamientos donde se valoró las concentraciones del ácido, además a concentraciones de 0.5 y 1 N no se apreciaron efectos y coincide con la información del análisis realizado a 24 h de reacción. En concentraciones de 2 y 3 N sí se tiene efecto del tratamiento (Fig. 2); esto puede ser debido a que la extensión en el tiempo de reacción favorece el ataque del ácido hacia la hemicelulosa dentro de la matriz del sustrato y se generen regiones amorfas que facilitan el proceso de hidrólisis con el paso del tiempo. Romero et al. (2010) encontraron durante la hidrólisis de los residuos de árboles de olivo un proceso secuencial que inicia con la solubilización de la hemicelulosa seguida de la celulosa. Hosseini et al. (2009) propusieron un modelo en el que consideran las siguientes etapas durante el pretratamiento: i) la difusión del agua dentro de las partículas de la madera, ii) la reacción de hidrólisis sobre la hemicelulosa, iii) la difusión de los azúcares solubles (productos de la reacción) hacia fuera de las partículas de madera en medio acuoso. Los mecanismos citados pueden estar relacionados en los tratamientos de este trabajo al comparar los experimentos de los controles en las figuras 1 y 2, sin embargo la incorporación del ácido en conjunto con la extensión del tiempo de reacción favorecieron el tratamiento de hidrólisis al permitir la difusión del ácido a través del sustrato y la transferencia de masa (azúcares) del producto de la hidrólisis hacia el medio acuoso. En sustrato similar, Chamy et al. (2004) reportaron en pulpa de remolacha azucarera las condiciones de hidrólisis; la concentración del ácido sulfúrico de 0.72 N, 2 horas de reacción y agitación de 400 rpm. Cabe destacar que el tiempo de reacción en dicho reporte es menor al obtenido en nuestros experimentos, sin embargo se invierte más energía en temperatura (80 °C) y agitación (400 rpm). Para la concentración del ácido, las mejores condiciones de hidrólisis son a 0.5 N, Chamy et al. (2004) reportan 0.72 N, condiciones más ácidas que las usadas en este trabajo. Aparentemente el mejor resultado es con H2SO4 a 3 N y 48 h, sin embargo, la ganancia de azúcares totales es solo de 2 g/L sobre la misma condición ácida evaluada a 24 h.
Efecto del sustrato
Al evaluar la masa, el volumen de reacción varió debido a la incorporación del sustrato, para lo anterior se realizó el ajuste para los cálculos de rendimiento. En la figura 3 se aprecia el efecto de la masa en cada uno de los tratamientos. Se puede observar la liberación de azúcares totales cuantificada en g/L y el porcentaje de hidrólisis (%).
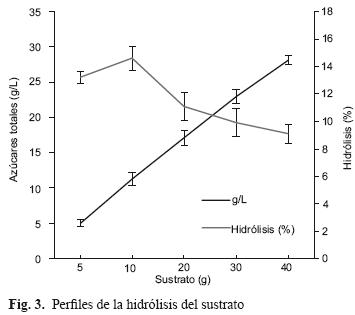
En todos los tratamientos el ANOVA mostró diferencias significativas (p<0.05) para los azúcares liberados (g/L) y fue confirmado mediante la prueba de comparaciones múltiples (Tukey HSD). Aunque el incremento en la masa de sustrato mostró favorecer los azúcares liberados (hasta 27 g/L), este no es un parámetro real para decidir el mejor rendimiento y es necesario realizar el análisis en función del porcentaje de hidrólisis.
Para el porcentaje de hidrólisis, el análisis estadístico mostró diferencias significativas entre dos grupos de medias; la de los tratamientos de 5 a 10 g con respecto a los superiores. De estos resultados, seleccionamos 10 g de masa de sustrato al considerar el máximo porcentaje de hidrólisis (28 %), el cual corresponde a una relación sólido líquido (S/L) de 15. El incremento en el porcentaje de azúcares totales por efecto de la adición de masa durante los experimentos fue el resultado de la interacción del ácido sobre el sustrato, sin embargo se encontró un límite de concentración del ácido para incrementar el porcentaje de hidrólisis, debido a que posiblemente no logró acceder a una mayor área dentro de la matriz del sustrato o el tamaño de los azúcares es mayor para ser incorporados al medio de reacción. Herrera et al. (2003) reportaron que durante la difusión de los productos de reacción, algunos oligómeros grandes no pueden pasar la matriz del sustrato y se quedan retenidos en ella.
Algunos reportes han mostrado que los tamaños de partícula influyen en la hidrólisis; en fibras de las que se obtiene el aceite de palma, el tamaño de partícula óptimo para la liberación de xilosa en presencia de ácido sulfúrico fue > 0.4 mm (Abdul Aziz et al. 2002). Con cascarilla de arroz, el proceso de conversión de xilosa a xilitol involucró un tratamiento de hidrólisis en el que las condiciones ácidas y diámetro de partícula de 5 a 8 mm presentaron el mayor contenido de azúcares reductores (Herazo et al. 2009). Nigam (1994) reportó con remolacha azucarera la hidrólisis y la fermentación de pulpa de remolacha en la cual se evaluó el tamaño de partícula de 1–1.2 mm. En este trabajo, la disminución del tamaño de partícula a 5 mm incrementó la velocidad de hidrólisis, lo anterior debido al incremento en el área superficial y el progresivo ataque del ácido hacia las partículas (matriz) del sustrato.
Efecto de la agitación sobre la hidrólisis de Beta vulgaris L.
Al evaluar la agitación, el porcentaje de hidrólisis indicó que existen diferencias significativas (p<0.05) entre los tratamientos. Se realizó la comparación de medias en el que se encontró que entre 0, 100 y 150 rpm no existe efecto del tratamiento; posterior a 150 rpm, 200 y 250 rpm existen diferencias. Debido a que se tienen dos perfiles en la agitación se buscó el punto de inflexión y se determinó que la agitación de 150 rpm o inferior tiene mejor resultado en la obtención de azúcares totales (Fig. 4). Chamy et al. (2004) reportaron como la mejor velocidad de agitación para la liberación de azúcares 400 rpm. En las pruebas realizadas a velocidades de agitación entre 250 y 400 rpm (datos no incluidos) no se encontró dicho efecto y la inversión de energía por el incremento de la agitación no benefició el proceso global de hidrólisis.
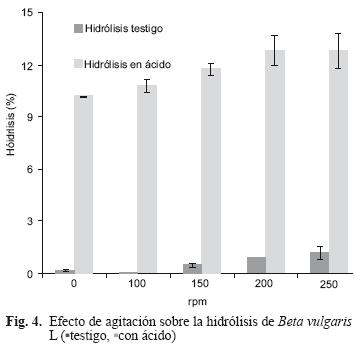
En los tratamientos donde se evaluó el efecto de la agitación se encontró efecto en la liberación de azúcares sobre cada uno de los testigos. Sin embargo, durante la hidrólisis de los tratamientos en los que se valoró la agitación en medio ácido a 0, 100 y 150 rpm no se observaron efectos, por tal motivo, se planteó valorar sistemas con agitación y sin agitación (Fig. 5). En los experimentos realizados con tiempo de reacción de 0.5 h sí hubo diferencia entre los sistemas agitados y no agitados. Pero con el incremento del tiempo de reacción la diferencia entre los tratamientos se reduce hasta casi ser nula. Con base en este último experimento, se puede prescindir de la agitación y ahorrar energía por este concepto.

En este experimento (con y sin agitación, Fig. 5), se cuantificó mayor contenido de masa seca, lo que incrementó la hidrólisis en todos los tratamientos cerca de 2 veces más el contenido inicial encontrado en los experimentos mostrados en la figura 4, pero sin afectar el comparativo debido a que se realizó con un mismo lote para cada prueba.
Efecto de la temperatura
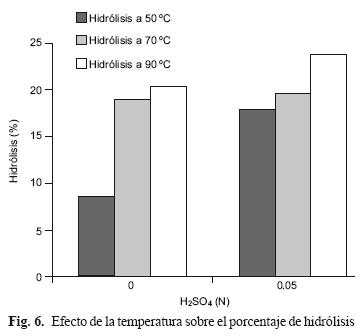
Con los experimentos realizados a diferentes temperaturas (90 °C y 50 °C, en ausencia de ácido) se obtuvieron rendimientos de 18.85 y 8.4 %, respectivamente. Entre ambas temperaturas existió una diferencia de 10.45 %, lo que evidencia el efecto de la temperatura sobre la hidrólisis. Valorando el efecto combinado de las mismas temperaturas y la incorporación de ácido en la reacción, se observó que existe efecto sobre la ganancia de hidrólisis. En los experimentos realizados a 50 °C, en los que se incorporó ácido en el medio de reacción, se incrementó el porcentaje de hidrólisis de 8.4 a 19.5 %, que corresponde a 57 % con respecto al testigo (Fig. 6). Este resultado se usó para determinar que 50 °C se usaría como la temperatura de hidrólisis adecuada para este sustrato, aunque se reduce en el proceso 3 g/L de azúcares totales, justificándose en la inversión de energía. Romero et al. (2010) encontraron durante la valoración del efecto de la temperatura que es a 90 °C cuando se tiene una mejor hidrólisis al comparar con lo obtenido a temperaturas inferiores (60, 70 y 80 °C). En este caso la tendencia es la misma, sin embargo manejar los tratamientos a menor temperatura en combinación con los factores tiempo, masa y concentración del ácido puede redituar en mejor hidrólisis.
A partir del diseño de experimentos, se valoró el efecto de la temperatura, el tiempo de reacción y la concentración del ácido sobre la cantidad de azúcares liberados. Con el incremento de la temperatura de 30 a 40 °C el porcentaje de hidrólisis pasó de 22 a 26.5 % (Fig. 7). Para los ensayos realizados a 30 °C se consideraron como las mejores condiciones para la hidrólisis: concentración de 0.1 N de ácido y tiempo de reacción de 4 y 6 h. Para los ensayos realizados a 40 °C las mejores condiciones de hidrólisis se tuvieron a 6 h y concentración de ácido sulfúrico de 0.5 N, condiciones ácidas superiores que a 30 °C pero con mayor rendimiento de hidrólisis.
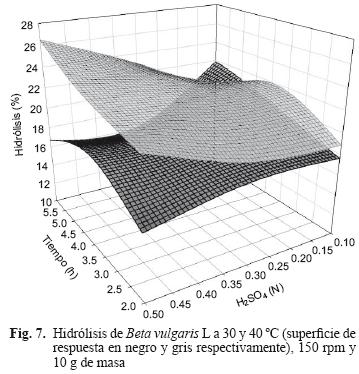
El análisis estadístico mostró que a 30 °C y tiempo de reacción de 2 y 4 h se tiene efecto significativo del tratamiento; y con 6 h de reacción se tiene efecto similar al de 4 h. El análisis entre grupos arrojó que las interacciones de ácido–tiempo–temperatura tienen mayor efecto significativo en los tratamientos realizados a 30 °C sobre los generados a 40 y 50 °C (Figs. 7 y 8). Es probable que lo anterior se deba al poco tiempo de reacción y la escasa área superficial para el ataque del ácido. En los resultados mostrados en la figura 8, se puede apreciar la interacción de los factores (curvatura) concentración del ácido y tiempo de reacción, sin embargo la temperatura de 50 °C tuvo concentración similar de azúcar con respecto a 40 °C. Se observa un mínimo de 16 (0.1–0.15 N) y un máximo de 24 % (0.47–0.5 N).

En este tratamiento se puede observar que los parámetros de agitación, tiempo, concentración del ácido y concentración del sustrato tienen efecto sobre el rendimiento neto de la hidrólisis y puede ser comparado con los tratamientos individuales las experiencias previas al establecimiento de las condiciones de hidrólisis (Excepto a los de la figura 5, donde la concentración de la masa fue superior).
Las condiciones de hidrólisis propuestas buscan reducir el consumo energético por agitación y temperatura, además de disminuir los compuestos inhibitorios generados a condiciones extremas de hidrólisis, aunados a la cantidad de reactivo para neutralizar antes de fermentar. Por otro lado, Beta vulgaris L. es un candidato propicio para ser considerado como sustrato alterno a los materiales lignocelulósicos como pajas y bagazos, donde su complejidad estructural dificulta los procesos de hidrólisis y disminuye el rendimiento de azúcares simples y por lo tanto el rendimiento neto de etanol.
CONCLUSIONES
El pretratamiento con ácido sulfúrico a concentraciones superiores a 0.5 N no tiene efectos significativos (p< 0.05) sobre el proceso de liberación de azúcares. En la agitación, velocidades inferiores a 150 rpm no tienen efecto sobre la hidrólisis. La relación sólido:líquido de 1:15 y temperatura de 40 °C generaron el mayor rendimiento de hidrólisis.
El tiempo de reacción es un parámetro ponderante sobre la hidrólisis y se deben establecer experimentos bajo condiciones ácidas diluidas y menor inversión de energía por la incorporación de temperatura y agitación en el proceso. Bajo estas condiciones no se encontraron compuestos inhibitorios como los fenólicos, lo que beneficiará el proceso de fermentación.
AGRADECIMIENTOS
Al fondo Fomix–Hidalgo 2008–98068, a la beca proporcionada al alumno Donaji Jiménez Islas.
REFERENCIAS
Abdul Aziz A., Das K., Husin M. y Mokhtar A. (2002). Effect of physical and chemical pre–treatments on xylose and glucose production from oil palm press fibre. J. Oil Palm. Res. 14, 10–17. [ Links ]
Amin G. y Khalaf Allah A. M. (1992). By–products formed during direct conversion of sugar beets to ethanol by Zymomonas mobilis in conventional submerged and solid–state fermentations. Biotechnol. Let. 14, 1187–1192. [ Links ]
Balat M., Balat H. y Öz C. (2008). Progress in bioethanol processing. Prog. Energy Combust. Sci. 34, 551–573. [ Links ]
Binder J. B. y Raines R. T. (2010). Fermentable sugars by chemical hydrolysis of biomass. PNAS 107, 4516–4521. [ Links ]
Brethauer S. y Wyman C. E. (2010). Review: Continuous hydrolysis and fermentation for cellulosic ethanol production. Bioresour. Technol. 101, 4862–4874. [ Links ]
Chakiath C., Lyons M. J., Kozak R. E. y Craig S. L. (2009). Thermal stabilization of Erwinia chrysanthemi pectin methylesterase A for application in a sugar beet pulp biorefienry. Appl. Environ. Microbiol. 75, 7343–7349. [ Links ]
Chamy R., Illanes A., Aroca G. y Nuñez L. (1994). Acid hydrolysis of sugar beet pulp as pretreatment for fermentation. Bioresour. Technol. 50, 149–152. [ Links ]
Chandel A. K., ES C., Rudravaram R., Narasu M. L., Rao L. V. y Ravindra P. (2007). Economics and environmental impact of bioethanol production technologies: an appraisal. Biotechnol. Mol. Biol. Rev. 2, 14–32. [ Links ]
Dubois M., Gilles K. A., Hamilton J. K., Rebers P.A. y Smith F. (1956). Colorimetric method for determination of sugars and related substances. Anal. Chem. 28, 350–356. [ Links ]
Fernandes S., Murray P. G. y Touhy M. G. (2008). Enzyme systems from the thermophilic fungus Talaromyces emersonii for sugar beet bioconversion. Bioresources. 3, 898–909. [ Links ]
Foster B. L., Dale B. E. y Doran–Peterson B. (2001). Enzymatic hydrolysis of ammonia–treated sugar beet pulp. Appl. Biochem. Biotechnol. 91–93, 269–282. [ Links ]
Gibbons W. R. y Westby C. A. (1986). Effects of inoculums size on solid–phase fermentation of fodder beets for fuel ethanol production. Appl. Environ. Microbiol. 52, 960–962. [ Links ]
García M. C. (2008). Producción de biodiesel mediante fermentación en estado sólido de compuestos lignocelulósicos derivados del bagazo de remolacha. Corpoica 9, 66–72. [ Links ]
Herazo I. C., Ruiz D. y Arrazola G. S. (2009). Bioconversión de xilosa a xilitol por Candida guilliermondii empleando cascarilla de arroz (Oriza sativa). Temas Agrarios 14, 1–18. [ Links ]
Herrera A., Téllez–Luis S. J., Ramírez J. A. y Vázquez M. (2003). Production of xylose from sorghum straw using hydrochloric acid. J. Cereal Sci. 37, 267–274. [ Links ]
Hosseini S. A. y Shah N. (2009).Multiscale modeling of biomass pretreatment for biofuels production. Chem. Eng. Res. Des. 87, 1251–1260. [ Links ]
Kumar L. N. V., Dhavala P., Goswami A., Maithel S. (2006). Liquid biofuels in South Asia: resources and technologies. ABDR 8, 31–49. [ Links ]
Lu Y. y Mosier N.S. (2008). Kinetic modeling analysis of maleic acid–catalyzed hemicellulose hydrolysis in corn stover. Biotechnol Bioeng. 101, 1170–1181. [ Links ]
Nigam P. (1994). Processing of sugar beet pulp in simultaneous saccharification and fermentation for the production. Process Biochem. 29, 331–336. [ Links ]
Pedersen M., Viksø–Nielsen A. y Meyer A. S. (2010). Monosaccharide yields and lignin removal from wheat straw in response to catalyst type and pH during mild thermal pretreatment. Process Biochem. 45, 1181–1186. [ Links ]
Romero I., Ruiz E., Castro E. y Moya M. (2010). Acid hydrolysis of olive tree biomass. Chem. Eng. Res. Des. 88, 633–640. [ Links ]
Sánchez Ó. J. y Cardona C. A. (2008). Trends in biotechnological production of fuel etanol from different feedstocks. Bioresour. Technol. 99, 5270–5295. [ Links ]
Soriano S. J., Franco Z. M. E., Pelayo Z. C., Armella V. M. A., Yáñez L.M.L. y Guerrero L. I. (2007). Caracterización parcial del pigmento rojo del fruto de la jiotilla"(Escontriachiotilla[Weber] Briton& Rose). AMIDIQ. 6, 19–25. [ Links ]
Taherzadeh M. y Karimi K. (2008). Pretreatment of lignocellulosic wastes to improve ethanol and biogas production: A review. Int. J. Mol. Sci. 9, 1621–1651. [ Links ]














