Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista internacional de contaminación ambiental
Print version ISSN 0188-4999
Rev. Int. Contam. Ambient vol.26 n.2 Ciudad de México May. 2010
Artículos
Competencia por sustrato durante el desarrollo de biomasa sulfatorreductora a partir de un lodo metanogénico en un reactor UASB
Competition for substrate during the development of sulfate–reducing biomass from a methanogenic granular sludge in a UASB reactor
Marisol GALLEGOS–GARCÍA, Lourdes B. CELIS y Elías RAZO–FLORES
División de Ciencias Ambientales, Instituto Potosino de Investigación Científica y Tecnológica. Camino a la Presa San José 2055, Col. Lomas 4a. Sección, CP 78216, San Luis Potosí, S.L.P., México. mgg@ipicyt.edu.mx
Recibido noviembre 2008
Aceptado agosto 2009
RESUMEN
En este trabajo se estudió la competencia entre microorganismos metanogénicos y sulfatorreductores utilizando un reactor anaerobio de lecho de lodo granular con flujo ascendente (UASB) a escala laboratorio, el cual fue usado para el enriquecimiento de biomasa sulfatorreductora a partir de un lodo granular de origen metanogénico. El reactor se alimentó con una mezcla de etanol y acetato, la carga orgánica se incrementó de 0.5 a 2 g de demanda química de oxígeno (DQO)/L–d a pH de 7.0. El consumo de DQO fue mayor a 90 % y la alcalinidad producida por la oxidación del sustrato incrementó el pH en el efluente hasta 8.0. A partir de los 50 días de operación, el reactor se alimentó con lactato y sulfato para promover la sulfatorreducción. La carga orgánica se aumentó de 1 a 3 g DQO/L–d con una relación DQO/Sulfato de 0.67 a un tiempo de retención hidráulico de un día. A los 194 días de operación del reactor el máximo consumo de DQO y sulfato obtenido fue de 94 y 22 %, respectivamente. La concentración total del sulfuro alcanzada fue de 310 mg S2–/L y la actividad sulfatorreductora de la biomasa fue de 0.29 g DQO–H2S/g SSV–d, lo que mostró el desarrollo de biomasa sulfatorreductora. La actividad metanogénica que se obtuvo fue de 0.35 g DQO–CH4/g SSV–d, estos resultados mostraron que los organismos metanogénicos no fueron desplazados por las bacterias sulfatorreductoras, coexistiendo ambos tipos de microorganismos en el lodo granular anaerobio al final de la operación del reactor.
Palabras clave: lodo granular, metanogénesis, sulfatorreducción, reactor UASB.
ABSTRACT
In this work the competition between methanogenic and sulfate –reducing microorganisms was studied using a laboratory scale up–flow anaerobic sludge blanket reactor (UASB), which was used for the enrichment of sulfate–reducing biomass from a methanogenic granular sludge. The reactor was fed with a mixture of ethanol and acetate and the organic loading rate was increased from 0.5 to 2 g chemical oxygen demand (COD)/L–d at pH of 7.0. The COD consumed was greater than 90 % and the alkalinity produced by the oxidation of the substrate increased the pH in the effluent up to 8.0. After 50 days of operation, the reactor was fed with lactate and sulfate to promote sulfate–reduction. The organic loading rate was increased from 1 to 3 g COD/L–d with a COD/sulfate ratio of 0.67 at a hydraulic retention time of one day. At 194 days of reactor operation, the maximum consumption of COD and sulfate obtained was 94 and 22%, respectively. Total sulfide concentration reached 310 mg S2–/L and the sulfate–reducing activity of the biomass was 0.29 g COD–H2S/g VSS–d, which demonstrated the development of sulfate reducing biomass. The methanogenic activity obtained was 0.35 g COD–CH4/g VSS–d, these results indicated that the methanogenic organisms were not displaced by the sulfate reducing bacteria, and both types of microorganisms coexisted in the anaerobic granular sludge at the end of reactor operation.
Key words: granular sludge, methanogenesis, sulfate reduction, UASB reactor.
INTRODUCCIÓN
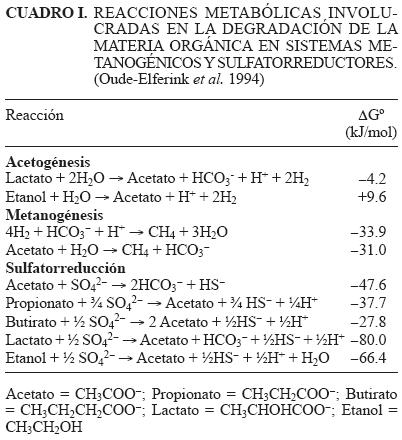
Actualmente existe una gran variedad de industrias que generan compuestos que son resistentes a la biodegradación y por lo tanto persisten en el ambiente. En especial, la industria petroquímica así como las productoras de papel, aceites comestibles y fibras sintéticas, generan aguas residuales que contienen altas concentraciones de sulfatos (SO42–) y de materia orgánica (Omil et al. 1997). Este tipo de efluentes pueden ser tóxicos para muchos microorganismos y son una fuente potencial de contaminación para los cuerpos de agua superficial y subterránea. Debido a esta problemática se han desarrollado procesos biológicos de sulfatorreducción para el tratamiento de estos efluentes, generalmente se efectúan en reactores anaerobios de lecho de lodo granular de flujo ascendente (UASB, por sus siglas en Inglés) (Lens et al. 2002). Los procesos anaerobios pueden ser extremadamente eficientes debido a su bajo consumo de energía y menor producción de lodo en comparación con los procesos aerobios. En forma general, la aplicación de un proceso de digestión anaerobia a efluentes ricos en sulfato produce la coexistencia de bacterias sulfatorreductoras (BSR) con microorganismos metanogénicos, que establecen una competencia por el sustrato orgánico disponible, especialmente por los compuestos más comunes como son el acetato, el hidrógeno y los ácidos grasos de cadena corta (Widdel 1998). El resultado de esta competencia determinará los productos finales de ambos procesos de mineralización que pueden ser sulfuro de hidrógeno (H2S), metano (CH4) o ambos. En los casos extremos en que predomine una de las dos poblaciones se tendrá un sistema totalmente metanogénico o bien un sistema totalmente sulfatorreductor (Omil et al. 1997). Las reacciones involucradas en la degradación de la materia orgánica por los metanógenos y BSR se muestran en el cuadro I (Oude–Elferink etal. 1994).
Actualmente el proceso de sulfatorreducción está adquiriendo un gran interés debido a su posible aplicación para el tratamiento de aguas contaminadas con metales pesados en reactores sulfatorreductores, en los que la eliminación conjunta del sulfato y los metales produce sulfuros metálicos como precipitados insolubles y la metanogénesis estaría parcial o totalmente inhibida (Omil et al. 1997). Para favorecer el predominio de las BSR en un lodo anaerobio es importante considerar la relación estequiométrica DQO/SO42–, que es un parámetro de control importante en el tratamiento anaerobio de ese tipo de aguas residuales. A una relación estequiométrica de 0.67 (g/g) teóricamente toda la materia orgánica es oxidada vía sulfatorreducción, ya que se requieren 64 g de DQO para reducir 96 g de SO42– y en teoría se podría operar en condiciones completamente sulfatorreductoras (Daretal. 2008).
La competencia por el sustrato está determinada por las bases termodinámicas y cinéticas de la sulfatorreducción, metanogénesis y acetogénesis. Estas bases predicen que las BSR pueden predominar sobre los organismos metanogénicos y los acetogénicos (Rinzema y Lettinga 1988). Sin embargo, se ha encontrado que la competencia entre las BSR y los organismos metanogénicos también es influenciada por otros factores tales como la duración de la competencia, el tipo de lodo, las propiedades de inmovilización de las bacterias, la concentración de materia orgánica, la concentración del sulfato, el pH en el reactor y la temperatura (Oude–Elferink et al. 1994, Lens et al. 2000).
El objetivo de este trabajo fue desarrollar una biomasa sulfatorreductora a partir de un lodo metanogénico en un reactor UASB y estudiar la competencia entre los organismos metanogénicos y las BSR durante la operación del reactor. Adicionalmente se comparó la evolución de las actividades específicas metanogénica (AM) y sulfatorreductora (ASR) con diferentes tipos de sustratos.
MATERIALES Y MÉTODOS
Reactor UASB
Se utilizó un reactor UASB de vidrio de fondo cónico de 1.07 L de volumen, un diámetro interno de 5.4 cm y una relación altura diámetro de 10.5. Para alimentar el reactor se utilizó una bomba peristáltica, el flujo de alimentación fue de 1 mL/min. El biogás producido diariamente se midió mediante un dispositivo de desplazamiento de líquido con contador integrado.
Inóculo
El reactor UASB se inoculó con lodo granular metanogénico proveniente de un reactor UASB, a escala industrial, de la planta de tratamiento de efluentes de una industria cervecera. El lodo estuvo almacenado a 4 °C antes de inocularse en el reactor. El lodo granular contenía 0.07 g de sólidos suspendidos volátiles (SSV) por gramo de lodo en base húmeda.
Se inocularon aproximadamente 530 mL de lodo en el reactor para tener una concentración de 20 g SSV/L. El lodo granular se caracterizó mediante ensayos de AM y ASR.
Medio mineral basal
El reactor UASB se alimentó con medio mineral basal con la siguiente composición (g/L): NH4Cl (0.3), CaCl2•2H2O (0.015), KH2PO4 (0.2), MgSO4•7H2O (0.12), KCl (0.25), extracto de levadura (0.02) (Visser et al. 1993) y 1 mL de solución de elementos traza que consta de (g/L): FeCl2•4H2O (1.5), MnCl2•4H2O (0.1), EDTA (0.5), H3BO3 2(0.062), ZnCl2 (0.07), NaMoO4•2H2O (0.036), AlCl3•6H2O (0.04), NiCl3•6H2O (0.024), CoCl2•6H2O (0.07), CuCl2•2H2O (0.02), HCl36 % (1 mL), Na2SeO3 (0.1) y resazurina (0.5) (Zehnder et al. 1980). Al medio mineral basal se le adicionó una mezcla de acetato–etanol–lactato (donadores de electrones) a diferentes proporciones con base en DQO, tal como se muestra en el cuadro II y se adicionó sulfato de sodio como aceptor de electrones.
Medio basal usado en las actividades específicas metanogénicas y sulfatorreductoras
El medio mineral utilizado en las pruebas de AM es el reportado por Visser et al. (1993). Para las pruebas de ASR el medio mineral se preparó idéntico al anterior con la excepción de la adición de elementos traza para evitar la precipitación del sulfuro biogénico en forma de sulfuros metálicos, la relación DQO/ SO42– fue de 0.67.
Condiciones de operación del reactor UASB
Inicialmente el reactor UASB se operó en lote durante 7 días con el fin de activar la biomasa previamente refrigerada y posteriormente en continuo bajo ocho diferentes periodos (A–H). Al inicio el reactor se operó en condiciones de metanogénesis (días 1 a 49) y a partir del día 50 en condiciones de sulfatorreducción (días 50 a 250), tal como se muestra en el cuadro II. El desempeño del reactor se evaluó mediante la eficiencia de remoción de DQO y sulfato y la producción de sulfuro. El porcentaje de DQO usado por las BSR (% DQObsr) y el porcentaje de DQO usado por los organismos metanogénicos (% DQObm) se calculó a partir de las Ec. (1) y (2) mostradas en el cuadro III. El reactor se operó en continuo durante 250 días a temperatura ambiente entre 25–30 °C.

Determinación de las actividades específicas
La actividad específica es un parámetro biológico importante, el cual proporciona información acerca del desempeño microbiano y las propiedades metabólicas de la biomasa. La ASR y AM del lodo se cuantificó al inicio (0 días) y a los 194 días de la operación del reactor. Los análisis de actividad sulfatorreductora se realizaron en botellas serológicas de 120 mL que contenían 1.5 g SSV/L de lodo granular y 115 mL de medio basal, sin solución de elementos traza. Se usaron diferentes sustratos orgánicos como etanol, acetato, propionato o lactato (2 g DQO/L) y sulfato de sodio como aceptor de electrones a una relación DQO/SO42– de 0.67; el pH se ajustó a 7.0 con NaHCO3. Las botellas se sellaron con tapones de hule y arillos de aluminio. Las botellas se incubaron y agitaron a 30 °C y 100 rpm. Los experimentos se realizaron por triplicado, como control se utilizaron botellas serológicas con la misma concentración de SSV y medio de cultivo pero sin sustrato ni SO42–. El control se utilizó para corregir la producción de sulfuro endógeno. La concentración de sulfuro se cuantificó por el método de Cord–Ruwisch (1985) y la actividad se calculó a partir de la pendiente obtenida al graficar la concentración de sulfuro contra el tiempo, expresada como DQO, y la cantidad de SSV en la botella, ver Ec. (3) en el cuadro III.
El análisis de la AM se efectuó en botellas serológicas de 120 mL; cada botella contenía 80 mL de medio y 1.5 g SSV/L de lodo granular; como sustrato se utilizó etanol o acetato (2 g DQO/L), el pH se ajustó a 7 con NaHCO3. Los experimentos se realizaron por triplicado y como control se utilizaron botellas serológicas con la misma concentración de SSV, medio de cultivo pero sin sustrato. El control se utilizó para corregir la producción de metano endógena. La producción de metano se cuantificó por el desplazamiento de líquido de una solución de NaOH al 3 %. La actividad se calculó de la pendiente obtenida al graficar el volumen de metano acumulado con respecto al tiempo y a la cantidad de SSV en la botella, ver Ec. (4) en el cuadro III.
Métodos analíticos
Se tomaron muestras del afluente y del efluente cada tercer día y éstas se filtraron con una membrana de 0.45 µm. La DQO fue determinada por el método de reflujo cerrado de acuerdo con el método estándar (APHA 1998). La alcalinidad total se cuantificó por titulación con HCl 0.1M a un pH de 4.3 (APHA 1998). El pH de las muestras líquidas se determinó con un electrodo de pH (Orion modelo 8256). El sulfuro se analizó por el método yodométrico (APHA 1998) y el sulfuro disuelto total fue analizado por espectrofotometría por el método descrito por Cord–Ruwisch (1985). El sulfato se analizó por espectrofotometría usando el método turbidimétrico con BaCl2 (APHA 1998). Los sólidos suspendidos volátiles, fijos y totales (SSV, SSF, SST, respectivamente) se analizaron de acuerdo con el método estándar (APHA 1998).
RESULTADOS Y DISCUSIÓN
Desempeño del reactor UASB
El desempeño del reactor UASB con respecto al tiempo de operación se presenta en la figura 1 y las eficiencias de remoción se resumen en el cuadro IV. Durante los primeros 7 días de operación del reactor (periodo A) se aplicó una carga orgánica de 0.5 g DQO/L–d con etanol como sustrato, para activar el lodo que había estado en refrigeración. Durante los periodos A–C se observó que la eficiencia de remoción de DQOalcanzó valores superiores a 90 %, lo cual indicó que casi toda la materia orgánica alimentada fue removida. El aumento del pH y de la alcalinidad dentro del reactor se debió a la producción de bicarbonato a partir de la oxidación del acetato (Cuadro I), lo que ayudó a incrementar la capacidad amortiguadora del sistema.
Una vez que el reactor operó bajo condiciones metanogénicas por 50 días en continuo, se procedió a enriquecer la población de BSR presente en el lodo granular mediante la operación del reactor UASB bajo condiciones de sulfatorreducción, las condiciones de operación se resumen en el cuadro II. Durante los periodos D y E se observó que las condiciones impuestas al sistema tales como el cambio de sustrato, la adición de sulfato y la producción de sulfuro, afectaron la actividad del lodo ya que la remoción de DQOdisminuyó a 78 %. La eficiencia de conversión de sulfato (ECS) alcanzó un valor de 19 % y la concentración de sulfuro disuelto sólo fue de 95 mg/L, debido a que las BSR se encontraban en proceso de enriquecimiento (Fig.2).
A partir de los 92 días, el sistema se recuperó paulatinamente hasta alcanzar una eficiencia de remoción de DQOsuperior a 90 %, a los 210 días de operación. El pH y la alcalinidad en el efluente aumentaron hasta 8 y 4000 mg CaCO3/L, respectivamente. La producción de sulfuro en el sistema se incrementó alcanzando concentraciones de 310 mg/L y una ECS de 21 % al final de la operación del reactor, lo que indicó un enriquecimiento de BSR en el lodo granular y, consecuentemente, un aumento en la actividad sulfatorreductora debido a las condiciones impuestas al sistema tales como la relación DQO/SO42–, tiempo de operación del reactor y el sustrato utilizado en la alimentación (Visser et al. 1992, Hulshoff Pol et al. 1998).
Competencia entre los organismos metanogénicos y BSR
En la figura 3 se muestra la velocidad de consumo de DQOpor los organismos metanogénicos y BSR durante los diferentes periodos de operación del reactor. La velocidad de consumo de la DQO por las BSR durante los periodos D y E fue de 0.16 y 0.24 g DQO/L–d, respectivamente; el consumo de DQOpor los organismos metanogénicos para los mismos periodos fue de 0.69 y 0.94 g DQO/L–d, respectivamente. La participación de las BSR en el consumo de DQOaumentó lentamente a partir de los 92 días, este aumento se observó después de la adición de etanol como sustrato. Al cabo de 167 días de operación del reactor, la velocidad de consumo de DQOpor las BSR se incrementó de 0.36 a 0.62 g DQO/L–d hasta el final de la operación, y el consumo de la DQOpor los organismos metanogénicos aumentó de 1.77 a 2.2 g DQO/L–d.
El incremento en la velocidad de consumo de la DQO por las BSR indicó que parte del flujo de electrones se empezaba a desviar hacia las BSR, lo que sugiere un aumento en número de los microorganismos (20 % de DQO consumida por las BSR). Este aumento pudo deberse al sustrato utilizado en la alimentación, ya que el lactato y el etanol son sustratos preferentemente usados por las BSR (Kaksonen et al. 2003), a partir de los cuales obtienen mayor energía libre de Gibbs (Cuadro I). El consumo de la DQOpor los metanógenos fue hasta de 70 % al final de la operación del reactor bajo condiciones sulfatorreductoras, esto quiere decir que en el reactor sustratos como acetato, hidrógeno y CO2 estuvieron presentes. Lo que indicó la existencia de especies metabólicas que oxidan incompletamente el sustrato hasta acetato. Esto pudo deberse a que en el lodo granular pueden estar presentes BSR que oxidan completamente el sustrato hasta CO2, y de igual manera BSR que oxidan incompletamente el sustrato hasta acetato (Madigan y Martinko, 2006). También puede ser atribuido a la presencia de organismos acetogénicos que fermentan el etanol y el lactato hasta acetato (Cuadro I) (Oude–Elferink et al. 1994). El acetato producido es consumido por los organismos metano–génicos evitando que sean desplazados por las BSR. Estos resultados indicaron que fue posible el desarrollo de las BSR en el reactor, ya que la degradación de la DQO, ya sea por los microorganismos metanogénicos o sulfatorreductores, determinará el tipo de metabolismo predominante. Por otro lado, la concentración del sulfato juega un papel importante en la competencia por el sustrato ya que la ASR podría llegar a estar limitada por el aceptor de electrones, en caso de que existiera una baja concentración de sulfato (Visser et al. 1996).
Actividad especifica con diferentes sustratos
En el cuadro V se muestran los resultados de la AM y ASR realizadas con diferentes sustratos usando lodo granular tomado del reactor UASB a los días de operación 0 y 194. Los resultados obtenidos de la actividad metanogénica al inicio de la operación del reactor mostraron que la mayor actividad metanogénica se obtuvo con la mezcla etanol–acetato (0.54 g DQO–CH4/g SSV–d), el valor obtenido se encuentra dentro de lo reportado en la literatura, que está alrededor de 0.45 g DQO–CH4/g SSV–d para una actividad metanogénica acetoclástica (Omil et al. 1997). De igual forma la actividad obtenida sólo con acetato fue similar al valor reportado en la literatura. Mientras que el etanol primero es consumido por la asociación sintrófica de otras especies metabólicas que fermentan el etanol a acetato, hidrógeno y CO2, los cuales son consumidos por los organismos metanogénicos (Stahl et al. 2006).
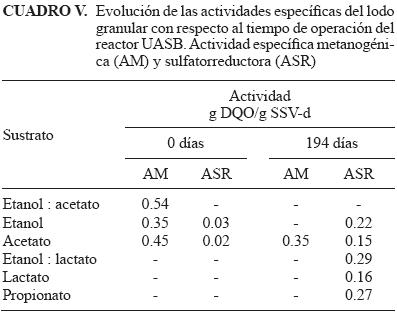
Los valores de la ASR en los ensayos con acetato y etanol logrados con el lodo granular al día 0 mostraron que existía muy poca actividad de las BSR con ambos sustratos (Cuadro V), ya que otros autores reportan valores de 0.45 y 2.1 g DQO–H2S/g SSV–d a partir de ácidos grasos volátiles (acetato, propionato, butirato) como sustrato (Visser etal. 1993, Omil etal. 1996). A diferencia de los organismos metanogénicos, las BSR obtienen 40 % más energía libre de Gibbs a partir de la degradación de etanol que de acetato (Cuadro I).
En las pruebas de actividad efectuadas con lodo obtenido del reactor a los 194 días de operación y usando acetato como sustrato (Cuadro V), se observa un aumento en la actividad de las BSR que oxidan completamente el sustrato a CO2 y una ligera disminución en la actividad de los organismos metanogénicos con respecto a la prueba inicial. Sin embargo, aunque la AM disminuyó, la existencia de especies metabólicas de oxidación incompleta del sustrato hasta acetato favorecieron la permanencia de los organismos metanogénicos manteniéndolos activos durante la operación del reactor. Visser et al. (1993) y Omil etal. (1997), reportaron la conversión completa del acetato por los organismos metanogénicos en presencia de concentraciones altas de sulfato.
Los resultados de las pruebas de laASRmuestran que se obtuvo el valor más alto de actividad con la combinación de etanol y lactato. En términos de energía y producción de biomasa, el lactato y el etanol son donadores de electrones superiores a otros (Cuadro I), ya que son sustratos que pueden enriquecer selectivamente a la población de BSR (Widdel 1988, Kalyuzhnyi et al. 1997, Kaksonen et al. 2004). Al utilizar el etanol y el lactato en forma independiente se observó que la actividad con lactato fue menor a la del etanol, esto tal vez debido a que al final de la operación del reactor sólo se adicionaba etanol.
Finalmente, el segundo sustrato con el que se obtuvo una mayor actividad de las BSR fue el propionato (Cuadro V), lo cual indica que la biomasa sulfatorreductora también fue capaz de usar otro intermediario clave de la degradación anaerobia. De igual manera Visser et al. (1993) y Omil et al. (1997), lograron obtener una mayor actividad sulfatorreductora con propionato (1.7 y 0.73 g DQO–H2S/g SSV–d, respectivamente) que con acetato y butirato, durante el desarrollo de biomasa sulfatorreductora en un reactor UASB inoculado con un lodo granular de origen metanogénico. Widdel (1988) reportó que en sistemas sulfidogénicos, la oxidación del propionato puede ser por asociaciones sintróficas entre bacterias acetogénicas y sulfatorreductoras hidrogenotróficas o directamente por BSR. Estos resultados indican que es posible utilizar diferentes sustratos para desarrollar BSR. Sin embargo, los valores de actividad que se obtengan con los diferentes sustratos dependerán de los diferentes grupos bacterianos que se encuentren en el lodo granular.
Aunque se logró aumentar la actividad de las BSR en el reactor UASB, los organismos metanogénicos no fueron desplazados por completo coexistiendo ambos tipos de microorganismos en el lodo granular al final de la operación del reactor. Esto indicó que se necesitan más de 250 días para que las BSR que oxidan el acetato hasta CO2 aumenten en número y puedan competir con los organismos metanogénicos que usan acetato y con los organismos acetogénicos que usan etanol y lactato convirtiéndose en la especie predominante. Visser et al. (1993) y Omil et al. (1997) estudiaron la competencia a largo plazo entre los organismos metanogénicos y las BSR en reactores UASB, con acetato como sustrato y sulfato en exceso, con lo que demostraron que se requieren más de 180 y 500 días, respectivamente, para que las BSR utilizadoras de acetato desplacen a los organismos metanogénicos. En el mismo trabajo de Omil et al. (1997) se observó la importancia de la relación DQO/ SO42– y del tipo de lodo inoculado, ya que se usó un lodo granular con bajo número de BSR utilizadoras de acetato, por lo que se requirieron más de 50 días para que se detectara degradación de acetato por sulfatorreducción (23 %) auna relación DQO/SO42– de 2. Los mismos autores observaron que la remoción de acetato por las BSR aumentó gradualmente tras elevar la concentración de sulfato y disminuir la relación DQO/SO42– a 0.6 a los 520 días de operación del reactor UASB.
Por otro lado Harada et al. (1994) estudiaron la competencia entre las BSR y los organismos metanogénicos con desechos complejos como sustratos a diferentes concentraciones de sulfato, concluyeron que las BSR únicamente serían predominantes después de un largo periodo de operación del reactor (180 días). Diversos autores, reportan que la competencia entre los organismos metanogénicos y las BSR no sólo podría deberse a la relación DQO/SO42– y los tiempos largos de operación del reactor, sino a otros tipos de factores como son: a) la temperatura, b) el pH, c) el tipo de lodo inoculado, d) la duración del experimento, e) la concentración de la materia orgánica y del sulfato, f) el tipo de sustrato, g) los tiempos de residencia celular, h) las propiedades cinéticas y termodinámicas de crecimiento y i) las constantes de afinidad por el sustrato (Visser et al. 1993, Oude– Elferink et al. 1994, Lens et al. 2000).
CONCLUSIONES
En este trabajo se demostró que las condiciones de operación impuestas al reactor UASB durante 250 días permitieron el desarrollo de BSR, lo cual se reflejó en los valores de la ASR obtenida con los diferentes sustratos y la producción de sulfuro en el reactor UASB. La relación DQO/SO42– y los diferentes tipos de sustratos fueron determinantes para el desarrollo de las BSR. Sin embargo, el desarrollo de la sulfatorreducción fue gradual y hasta el día 250 predominó el proceso metanogénico, coexistiendo ambos tipos de microorganismos. De tal forma que bajo las condiciones impuestas en este experimento, las BSR requieren más tiempo para desplazar a los microorganismos metanogénicos u otras especies metabólicas presentes para poder obtener un sistema completamente sulfatorreductor. Los valores de las pruebas de ASR al final de la operación, demostraron que es factible utilizar diferentes sustratos para desarrollar BSR, debido a que en un lodo granular existen diversos grupos bacterianos afines a diferentes sustratos. Finalmente se puede concluir que es posible el desarrollo de una biomasa con actividad sulfatorreductora y la producción de sulfuro durante el tratamiento anaerobio en un reactor UASB a partir de un lodo metanogénico.
AGRADECIMIENTOS
Este trabajo fue financiado por el proyecto SEP–CONACyT–46506.
REFERENCIAS
APHA (1998). Standard Methods for the Examination of Water and Wastewater. 20a. edición. Washington, D.C., EUA. [ Links ]
Cord–Ruwisch R. (1985). A quick method for the determination of dissolved and precipitated sulfides in cultures of sulfate–reducing bacteria. J. Microbiol. Methods 4, 33–36. [ Links ]
Dar S.A., Kleerebezem R., Stams A.J.M., Kuenen J.G. y Muyzer G. (2008). Competition and coexistence of sulfate–reducing bacteria, acetogens and methanogens in a lab–scale anaerobic bioreactor as affected by changing substrate to sulfate ratio. Environ. Biotechnol. 78, 1045–1055. [ Links ]
Harada H., Uemura S. y Momonoi K. (1994). Interaction between sulfate reducing bacteria and methane–producing bacteria in UASB reactors fed with low strength wastes containing different levels of sulfate. Water Res. 28, 355–367. [ Links ]
Hulshoff Pol L.W., Lens P., Stams A.J.M. y Lettinga G. (1998). Anaerobic treatment of sulphate–rich waste–waters. Biodegradation. 9, 213–224. [ Links ]
Kaksonen H., Riekkola–Vanhanen y Puhakka J. (2003). Optimization of metal sulphide precipitation in fluidized–bed treatment of acidic wastewater. Water Res 37, 255–266. [ Links ]
Kaksonen H., Plumb J., Franzmann D. y Puhakka J. (2004). Simple organic electron donors support diverse sulfate–reducing communities in fluidized–bed reactors treating acidic metal– and sulfate–containing wastewater. FEMS Microbiol. Ecol. 47, 279–289. [ Links ]
Kalyuzhnyi S., Fragoso C. y Rodríguez J. (1997). Biological sulfate reduction in a UASB reactor fed with ethanol as the electron donor. Microbiol. 66, 562–567. [ Links ]
Lens P., Omil F., Lema J.M. y Hulshoff Pol L.W. (2000). Biological treatment of organic sulfate–rich wastewaters. En: Environmental Technologies to treat sulfur Pollution. (P. Lens y L. Hulshoff Pol, Ed.) IWA Publishing, London. 7, 153–173. [ Links ]
Lens P., Vallero M., Esposito G. y Zandvoort M. (2002). Perspectives of sulfate reducing bioreactors in environmental biotechnology. Rev Environ Sci Biotechnol. 43,311–325. [ Links ]
Madigan M.T. y Martinko J.M. (2006). Brock Biology of Microorganisms. 11a. Edición, Pearson Prentice Hall. New Jersey. [ Links ]
Omil F., Lens P., Hulshoff Pol L. y Lettinga G. (1996). Effect of upward velocity and sulphide concentration on volatile fatty acid degradation in a sulphidogenic granular sludge reactor. Process Biochem. 31, 699–710. [ Links ]
Omil F., Visser A., Hulshoff Pol L. y Lettinga G. (1997). Desarrollo de biomasa sulfurogénica durante el tratamiento anaerobio de aguas con alto contenido de sulfato en reactores anaerobios de lodos granulares. Revista Afinidad, Tomo LIV. 353–471. [ Links ]
Oude Elferink S.J. W.H., Visser A., Hulsoff Pol. L. y Stams A.J.M. (1994). Sulfate reduction in methanogenic bioreactors. FEMS Microbiol. Rev. 15, 119–136. [ Links ]
Rinzema A. y Lettinga G. (1988). Anaerobic treatment of sulphate–containing wastewater. En: Biotreatment Systems (D.L. Wise Ed.), CRC Press, Boca Ratón, Florida. pp.65–109. [ Links ]
Stahl D.A., Hullar M y Davidson S. (2006). The structure and function of microbial communities. En: The prokaryotes: Symbiotic associations, biotechnology, applied microbiology (M. Dworkin, S. Falkow, E. Rosenberg, K. H. Schleifer, E. Stackebrandt, Ed.). Springer, Vol. 1, pp. 299–322. [ Links ]
Visser A., Gao Y. y Lettinga G. (1992). The anaerobic treatment of a synthetic sulfate containing wastewater under thermophilic (55 °C) conditions. Water Sci. Technol. 25, 193–202. [ Links ]
Visser A., Beeksma I., Van der Zee F., Stams A.J.M. y Lettinga G. (1993). Anaerobic degradation of volatile fatty acids at different sulphate concentrations. Appl. Microbiol. Biotechnol. 40, 549–556. [ Links ]
Visser A., Hulshoff Pol L. y Lettinga G. (1996). Competition of methanogenic and sulfidogenic bacteria. Water Sci. Technol. 33, 99–110. [ Links ]
Widdel F. (1988). Microbiology and ecology of sulfate reducing bacteria. En: Biology of anaerobic microorganisms (A.J.B. Zehnder Ed.), Wiley–Interscience, New York, pp. 469–585. [ Links ]
Zehnder A.J.B., Huser B.A., Brock T.D. y Wuhrmann K. (1980). Characterization of an acetate–decarboxylating, non–hydrogen oxidizing methane bacterium. Arch Microbiol. 124, 1–11. [ Links ]














