Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de cardiología
Print version ISSN 0188-2198
Rev. Mex. Cardiol vol.25 n.3 México Jun./Sep. 2014
Caso clínico
Cierre percutáneo de fístula arteriovenosa pulmonar en una adolescente. Reporte de un caso
Transcatheter closure of pulmonary arteriovenous fistula in adolescent. Case report
Lucelli Yáñez-Gutiérrez,* Horacio Márquez-González,* Diana López-Gallegos,* Carmen E Cerrud-Sánchez,* Ángel E Domínguez-Díaz,* Moisés Jiménez-Santos,** Jaime A Santiago-Hernández,*** Homero A Ramírez-Reyes,*** Felipe David-Gómez,* Carlos Riera-Kinkel****
* Servicio de Cardiopatías Congénitas.
** Servicio de Tomografía.
*** Servicio de Cardiología Intervencionista.
**** Servicio de Cirugía Cardiotorácica.
Hospital de Cardiología, Centro Médico Nacional "Siglo XXI".
Dirección para correspondencia:
Horacio Márquez González
Avenida Cuauhtémoc Núm. 330,
Col. Doctores, 06720, Del. Cuauhtémoc, México, D.F.
Tel: 56276900 ext: 2254
E-mail: horaciomarquez84@hotmail.com
RESUMEN
Las fístulas arteriovenosas, también llamadas malformaciones arteriovenosas pulmonares (MAVP), corresponden a un reducido grupo de patologías vasculares que en un 85% se originan de la comunicación de una arteria aferente con una vena eferente. Las congénitas son las menos frecuentes. Se presenta el caso de una adolescente de 13 años, asintomática, con soplo continuo y saturación periférica de 88%. Mediante estudios de imagen se corrobora la presencia de una fistula arteriovenosa a nivel pulmonar, que es cerrada por intervencionismo con dispositivo oclusor. Una vez tratado el defecto, la evolución de la paciente es satisfactoria. Conclusiones: Mediante el caso se abordan las herramientas clínicas y diagnósticas de las MAVP, así como las indicaciones de los modos terapéuticos.
Palabras clave: Fístula arteriovenosa pulmonar, cateterismo, cierre percutáneo.
ABSTRACT
Arteriovenous fistulas also called pulmonary arteriovenous malformations (PAVM) are a small group of vascular pathologies in 85% originate from the communication afferent efferent artery to a vein. Congenital are less frequent. The case of a 13-year-old asymptomatic continuous murmur and peripheral saturation of 88% is presented. By imaging the presence of an arteriovenous fistula in the lung, which is closed by intervention with occluder device is corroborated. Once treated the defect, the evolution of the patient is satisfactory. Conclusions: Using the case of clinical and diagnostic tools MAVP addresses, and the particulars of the therapeutic modes.
Key words: Pulmonary arteriovenous fistula, catheterization, percutaneous closure.
INTRODUCCIÓN
Las fístulas arteriovenosas, también llamadas malformaciones arteriovenosas pulmonares (MAVP), corresponden a un reducido grupo de patologías vasculares que se originan de la comunicación de una arteria aferente con una vena eferente en un 85% de los casos.1
Su etiología es congénita en 90% y casi el 85% de éstas se asocia con el síndrome Osler-Weber-Rendu (telangiectasia hemorrágica hereditaria).2,3 El resto -10% aproximadamente- suele ser secundario a trauma torácico, cirugía de tórax, cirrosis, cáncer, estenosis mitral, infecciones, amiloidosis y embarazo, entre otras.4-6
Más de la mitad de los pacientes cursan asintomáticos, cerca del 40% tienen manifestaciones neurológicas7 (eventos cerebrovasculares, cefaleas y crisis convulsivas) y sólo el 10% refiere disnea y cianosis.8 Las comorbilidades se presentan en 60% de los pacientes y cuando éstas no son tratadas, la mortalidad puede ascender del 26 al 50%.
Debido a su baja frecuencia -1 en 5,000 a 10,000 pacientes9- el diagnóstico de esta entidad representa un reto diagnóstico para el médico; por tanto, el reporte de casos clínicos facilita el conocimiento de los síntomas y signos que se presentan en la práctica diaria, lo que puede facilitar el diagnóstico y tratamiento oportunos.
REPORTE DE CASO
Asistimos en el servicio de Cardiopatías Congénitas a una adolescente de 13 años, asintomática, soplo continuo dorsal, suave, segundo ruido normal, sin visceromegalias, sin acropaquias, saturación periférica de 88%. En la radiografía de tórax se demostró una imagen hiperdensa parahiliar izquierda (Figura 1).

El ecocardiograma transtorácico mostró dilatación de ventrículo izquierdo con función sistólica y diastólica conservada; no se observaron defectos septales interatriales, ni interventriculares. La presión de arteria pulmonar fue de 30 mmHg y el arco aórtico izquierdo sin patología.
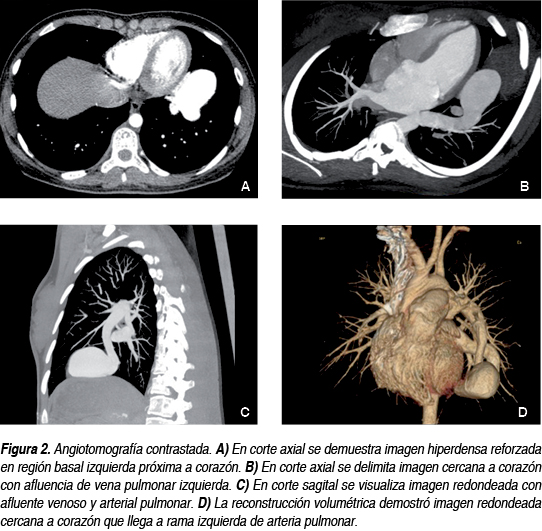
Se realizó angiotomografía que demostró en corte axial imagen redondeada parahiliar izquierda que realza intensamente en forma precoz. Las reconstrucciones coronal y sagital mostraron imagen compatible con fístula arteriovenosa con afluente arterial, aneurisma venoso interpuesto y drenaje venoso a vena pulmonar izquierda (Figura 2).
El cateterismo cardiaco confirmó la presencia de cortocircuito a nivel pulmonar con Qp/Qs de 2.3, y mediante angiografía selectiva de la fístula se demostró la malformación vascular. Se decidió embolización con dispositivo oclusor Amplatzer Vascular Plug (Figuras 3 y 4) debido al diámetro del afluente arterial. A las dos horas del procedimiento hubo incremento de la saturación a 95% y a las 24 horas la paciente fue dada de alta. A seis meses del procedimiento se mantiene asintomática y con saturación periférica del 95%.


DISCUSIÓN
Embriológicamente las venas pulmonares derivan del plexo endodérmico, mientras que las arterias se originan del sexto arco aórtico. La teoría de las MAVP de origen congénito se justifica en una incompleta formación de los septos vasculares entre la circulación arterial y venosa. Una diferencia de las malformaciones arteriovenosas sistémicas se basa en que usualmente se nutren por una sola arteria sin existencia de colaterales.10 Lo más frecuente es que presenten una localización periférica en los lóbulos inferiores pulmonares.11
Las manifestaciones clínicas van de la mano con la historia natural de la enfermedad: inicialmente, cuando el corto circuito es de izquierda a derecha, por lo general, no existen manifestaciones clínicas en esta etapa; posteriormente al incrementar la presión en el lecho venoso, la mezcla sanguínea se realiza de derecha a izquierda presentando desaturación y cuando la presión parcial de oxígeno es menor de 80 mmHg, se presenta cianosis central y periférica; si ésta es crónica, se manifiestan cambios morfológicos como los dedos en palillo de tambor. En una fase más avanzada, los mecanismos compensadores originan policitemia y dilatación de los lechos venosos, sobre todo en la vasculatura pulmonar. Entonces, algún evento de estrés o traumatismo puede mostrar una ruptura manifiesta en hemoptisis o epistaxis y eventos cerebrovasculares o abscesos cerebrales de manera secundaria a la hiperviscosidad.12
Para el abordaje diagnóstico pueden emplearse:
• Radiografía de tórax: las alteraciones radiológicas pueden identificarse en el 98%. Las imágenes ovales entre 1 a 5 cm de diámetro o redondeadas en el tercio inferior de los lóbulos o unido a los vasos hiliares son las más frecuentes.13 Presenta una sensibilidad del 92% y especificidad del 83%.14
• La prueba de hiperoxia: se trata de una prueba funcional que evalúa si existe paso de sangre procedente del corazón derecho hacia las cavidades izquierdas sin pasar por el filtro pulmonar. Se somete al paciente a inspiración de oxígeno por 15 a 20 minutos y se compara la saturación inicial (SaO2) y la presión parcial de oxígeno (PaO2). Lo normal es que la fracción de la mezcla sea menor al 5% (normal SaO2 > 96%, PaO2 > 85%).15
• Ecocardiografía contrastada: la administración de microburbujas en un paciente sin defectos arteriovenosos muestra una limpieza del medio de contraste de la aurícula derecha a la izquierda en un ciclo; cuando existen las MAVP, se presenta un retardo entre 3 a 5 ciclos cardiacos (9 a 15 segundos).16
• Tomografía de alta resolución: brinda información estructural fidedigna sobre el número de conexiones y el calibre de las mismas y ofrece cortes en tercera dimensión. Es útil en el postquirúrgico para determinar el número y el sitio de lesiones residuales.17
• Resonancia magnética nuclear: no está reportado que tenga mayores ventajas que la tomografía. La exactitud de esta prueba se ve limitada por el artefacto respiratorio.18
• Arteriografía: es el estándar de oro para el diagnóstico de las MAVP, la información que ofrece es una correcta anatomía (calibre, ubicación y número de lesiones) y funcionalidad (dirección del flujo y velocidad) tanto en el proceso diagnóstico como para evaluar la eficacia terapéutica de la oclusión.19
TRATAMIENTO
Las indicaciones para el tratamiento son:20,21
• Lesiones de más de 3 mm de diámetroEl caso que se presenta con fines didácticos muestra la evolución habitual en pacientes mayores. Las imágenes muestran claramente el defecto vascular y la mejoría con la intervención quirúrgica.• Relación de flujos Qp/Qs > 1.5 por incremento del gasto pulmonar
• Antecedentes de evento cerebrovascular embólico
• Hemoptisis masiva
• Cianosis y deterioro de la clase funcional
Los defectos pueden corregirse de dos maneras:
• Quirúrgicamente: de forma tradicional se realizan de esta manera, ahora se limita a defectos grandes que involucren grandes segmentos pulmonares, ya que al ser un abordaje invasivo, las complicaciones postquirúrgicas son mayores y desafortunadamente no se garantiza el cierre total cuando son múltiples.22
• Percutánea: se garantiza el cierre por aplicación de dispositivos oclusores de diversos tamaños según el defecto, así se prefiere usar coils para defectos pequeños y plugs vasculares de diferentes tamaños según el tamaño de la fístula, lo cual garantiza el cierre inmediato hasta en el 97% de los casos, aunque se han reportado cierres progresivos en tres meses.23 El porcentaje de recidivas es menor al 5%.24
CONCLUSIONES
• Las MAVP congénitas son la forma menos frecuentes de presentación.• La presentación clínica habitualmente depende de la edad.
• Los estudios de gabinete son la mejor herramienta diagnóstica.
• El tratamiento actual recomendado es el intervencionismo.
REFERENCIAS
1. Gregorio MA, Maynar M, D'Angostino H et al. Malformaciones arteriovenosas pulmonares diagnóstico y tratamiento endovascular. Invervencionismo. 2007; 7: 68-76. [ Links ]
2. White RI Jr, Pollak JS, Wirth JA. Pulmonary arteriovenous malformations: diagnosis and transcatheter embolotherapy. J Vasc Interv Radiol. 1996; 7: 787-804. [ Links ]
3. Cottin V, Chinet T, Lavole' A et al. Pulmonary arteriovenous malformations in hereditary hemorrhagic telangiectasia: a series of 126 patients. Medicine. 2007; 86: 1-17. [ Links ]
4. Esplin MS, Varner MW. Progression of pulmonary arteriovenous malformation during pregnancy. Obstet Gynecol Surv. 1997; 52: 248-253. [ Links ]
5. Hoffman R, Robins R. Evolving pulmonary nodule: multiple pulmonary arteriovenous fistulas. AJR Am J Roentgenol. 1974; 120: 861-864. [ Links ]
6. Moore BP. Pulmonary arteriovenous fistulas. Thorax. 1969; 24: 381. [ Links ]
7. Hodgson CH, Kaye RL. Pulmonary arteriovenous fistula and hereditary telangiectasia. Dis Chest. 1963; 43: 449-455. [ Links ]
8. Swanson K, Prakash U, Stanson A. pulmonary arteriovenous fistulas. Mayo Clinic experience 1982-1997. Mayo Clin Proc. 1999; 74: 671-680. [ Links ]
9. Carette MF, Nedelcu C, Tassart M, Grange JD, Wislez M, Khalil A. Imaging of hereditary hemorrhagic telangiectasia. Cardiovasc Intervent Radiol. 2009; 32: 745-757. [ Links ]
10. Swischuck JL, Castañeda F, Smosuse B, Fox P, Brady T. Embolization of pulmonary arteriovenous malformations. Sem Intervent Radiol. 2000; 17: 171-183. [ Links ]
11. Iqbal M, Rossoff LJ, Steinberg HN et al. Pulmonary arteriovenous malformations: A clinical review. Postgrad Med J. 2000; 76: 390-394. [ Links ]
12. Robin E, Laman D, Horn B, Theodore J. Platypnea related to orthodeoxia caused by true vascular lung shunts. N Engl J Med. 1976; 17: 941-943. [ Links ]
13. Sluiter-Eringa H, Orie NGM, Slutier HJ. Pulmonary arteriovenous fistula: diagnosis and prognosis in non-complaint patients. Am Rev Respir Dis. 1969; 100: 177-184. [ Links ]
14. Haitjema R, Disch F, Overtoom T, Westermann C, Lamers J. Screening family members of patients with hereditary hemorrhagic telangiectasia. Am J Med. 1995; 99: 519-524. [ Links ]
15. Gossage J, Kanj G. Pulmonary arteriovenous malformations. A state of the review. Am J Respir Crit Care. 1998; 158: 643-661. [ Links ]
16. Kjeldesen A, Oxhoj H, Anderesen P, Elle B, Jacobsen J, Vase P. Pulmonary arteriovenous malformations Screening procedures and pulmonary angiography in patients with hereditary hemorrhage telangiectasia. Chest. 1999; 116: 432-439. [ Links ]
17. Brillet P, Dumont Ph, Bouziz N, Duhamel A, Laurent F, Remy J et al. Pulmonary arteriovenous malformaqtion treted with emboltherapy. Systemic collateral supply at multidetector CT angiography after2-20 year follow-up. Radiology. 2007; 242: 267-276. [ Links ]
18. Vrachliotis TG, Bis KG, Kirsch MJ, Shetty AN. Contrast-enhanced MRA in pre-embolization assessment of a pulmonary arteriovenous malformation. J Magn Reson Imaging. 1997; 7: 434-436. [ Links ]
19. Haitjema R, Disch F, Overtoom T, Westermann C, Lamers J. Screening family members of patients with hereditary hemorrhagic telangiectasia. Am J Med. 1995; 99: 519-524. [ Links ]
20. Kjeldsen AD, Oxhoj H, Andersen PE, Green A, Vase P. Prevalence of pulmonary arteriovenous malformations (PAVMs) and occurrence of neurological symptoms in patients with hereditary haemorrhagic telangiectasia (HHT). J Intern Med. 2000; 248: 255-262. [ Links ]
21. Burke CM, Safai C, Nelson DP, Raffin TA. Pulmonary arteriovenous malformations: a critical update. Am Rev Resp Dis. 1986; 134: 334 339. [ Links ]
22. Gianturco C, Anderson JH, Wallace S. Mechanical devices for arterial occlusion. AJR. 1975; 124: 428-435. [ Links ]
23. Wingen M, Gunther RW. Transcatheter embolization of pulmonary arteriovenous fistulas. Rofo Fortschr Geb Rontgenstr Neuen Bildgeb Verfahr. 2001; 173: 606-611. [ Links ]
24. Hepburn J, Dauphinee JA. Successful removal of hemangioma of the lung followed by disappearance of polycythemia. Am J Med Sci. 1942; 204: 681-685. [ Links ]
Nota
Todos los autores colaboraron en: idea original, seguimiento, búsqueda de bibliografía, redacción y aprobación de la última versión del manuscrito.
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/revmexcardiol














